È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
In vitro Digestione delle emulsioni in una singola goccia tramite scambio multifase di fluidi gastrointestinali simulati
In questo articolo
Riepilogo
Una bilancia del film superficiale a goccia pendente implementata con uno scambio multi-sottofase, soprannominato OCTOPUS, consente di imitare le condizioni digestive mediante lo scambio sequenziale di sottofase della soluzione originale di massa con fluidi gastrointestinali simulati. La digestione simulata in vitro viene monitorata registrando in situ la tensione interfacciale dello strato interfacciale digerito.
Abstract
Le emulsioni vengono attualmente utilizzate per incapsulare e fornire nutrienti e farmaci per affrontare diverse condizioni gastrointestinali come obesità, fortificazione dei nutrienti, allergie alimentari e malattie digestive. La capacità di un'emulsione di fornire la funzionalità desiderata, vale a dire, raggiungere un sito specifico all'interno del tratto gastrointestinale, inibire / ritardare la lipolisi o facilitare la digeribilità, dipende in ultima analisi dalla sua suscettibilità alla degradazione enzimatica nel tratto gastrointestinale. Nelle emulsioni olio-in-acqua, le goccioline lipidiche sono circondate da strati interfacciali, dove gli emulsionanti stabilizzano l'emulsione e proteggono il composto incapsulato. Ottenere una digeribilità su misura delle emulsioni dipende dalla loro composizione iniziale, ma richiede anche il monitoraggio dell'evoluzione di quegli strati interfacciali in quanto sono sottoposti a diverse fasi della digestione gastrointestinale. Una bilancia del film superficiale a goccia pendente implementata con uno scambio multi-sottofase consente di simulare la digestione in vitro delle emulsioni in una singola goccia acquosa immersa nell'olio applicando un modello di digestione statica personalizzato. Il transito attraverso il tratto gastrointestinale è imitato dallo scambio di sottofase della soluzione originale di goccioline bulk con mezzi artificiali, imitando le condizioni fisiologiche di ciascun compartimento / fase del tratto gastrointestinale. L'evoluzione dinamica della tensione interfacciale è registrata in situ durante l'intera digestione gastrointestinale simulata. Le proprietà meccaniche delle interfacce digerite, come l'elasticità e la viscosità dilatatoria interfacciale, vengono misurate dopo ogni fase di digestione (orale, gastrica, intestino tenue). La composizione di ciascun mezzo digestivo può essere regolata per tenere conto delle particolarità delle condizioni digestive, comprese le patologie gastrointestinali e i mezzi digestivi infantili. Vengono identificati i meccanismi interfacciali specifici che influenzano la proteolisi e la lipolisi, fornendo strumenti per modulare la digestione mediante l'ingegneria interfacciale delle emulsioni. I risultati ottenuti possono essere manipolati per la progettazione di nuove matrici alimentari con funzionalità su misura come bassa allergenicità, apporto energetico controllato e ridotta digeribilità.
Introduzione
Capire come viene digerito il grasso, che comporta la digestione dell'emulsione, è importante per progettare razionalmente prodotti con funzionalità su misura1. Il substrato per la digestione dei grassi è un'emulsione poiché il grasso viene emulsionato al consumo per azione meccanica e miscelazione con biotensioattivi nella bocca e nello stomaco. Inoltre, la maggior parte del grasso consumato dagli esseri umani è già emulsionato (come i prodotti lattiero-caseari), e nel caso di neonati o di alcuni anziani, questa è l'unica forma di consumo. Quindi, la progettazione di prodotti a base di emulsioni con profili digestivi specifici è molto importante nella nutrizione1. Inoltre, le emulsioni possono incapsulare e fornire nutrienti, farmaci o bioattivi lipofili2 per affrontare diverse condizioni gastrointestinali come obesità3, fortificazione dei nutrienti, allergie alimentari e malattie digestive. Nelle emulsioni olio-in-acqua, le goccioline lipidiche sono circondate da strati interfacciali di emulsionanti come proteine, tensioattivi, polimeri, particelle e miscele4. Il ruolo degli emulsionanti è duplice: stabilizzare l'emulsione5 e proteggere/trasportare il composto incapsulato in un sito specifico. Il raggiungimento di una digeribilità su misura delle emulsioni dipende dalla loro composizione iniziale, ma richiede anche il monitoraggio della continua evoluzione di questa interfaccia durante il transito attraverso il tratto gastrointestinale (Figura 1).
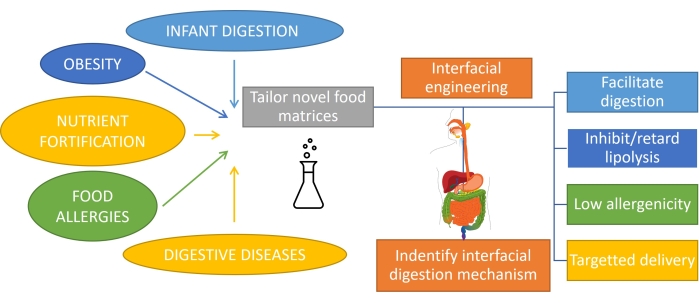
Figura 1: Applicazione dell'ingegneria interfacciale delle emulsioni per affrontare alcune delle principali condizioni gastrointestinali. Fare clic qui per visualizzare una versione ingrandita di questa figura.
La digestione lipidica è in definitiva un processo interfacciale perché richiede l'adsorbimento di lipasi (gastriche o pancreatiche) sull'interfaccia olio-acqua delle goccioline lipidiche emulsionate attraverso lo strato interfacciale per raggiungere e idrolizzare i trigliceridi contenuti nell'olio in acidi grassi liberi e monoacilgliceridi6. Questo è schematizzato nella Figura 2. La lipasi gastrica compete con la pepsina e i fosfolipidi nello stomaco per l'interfaccia olio-acqua (Figura 2, digestione gastrica). Quindi, la lipasi / colipasi pancreatica compete con tripsina / chimotripsina, fosfolipidi, sali biliari e prodotti digestivi nell'intestino tenue. Le proteasi possono alterare la copertura interfacciale, impedendo o favorendo l'adsorbimento della lipasi, mentre i sali biliari sono altamente attivi in superficie e spostano la maggior parte dell'emulsionante rimanente per promuovere l'adsorbimento della lipasi (Figura 2, digestione intestinale). Alla fine, la velocità e l'estensione della lipolisi dipendono dalle proprietà interfacciali dell'emulsione digerita iniziale / gastrica, come lo spessore, le connessioni inter / intramolecolari e le interazioni elettrostatiche e steriche. Di conseguenza, il monitoraggio dell'evoluzione dello strato interfacciale mentre viene digerito offre una piattaforma sperimentale per identificare i meccanismi interfacciali e gli eventi che influenzano l'adsorbimento della lipasi e, quindi, la digestione dei lipidi.
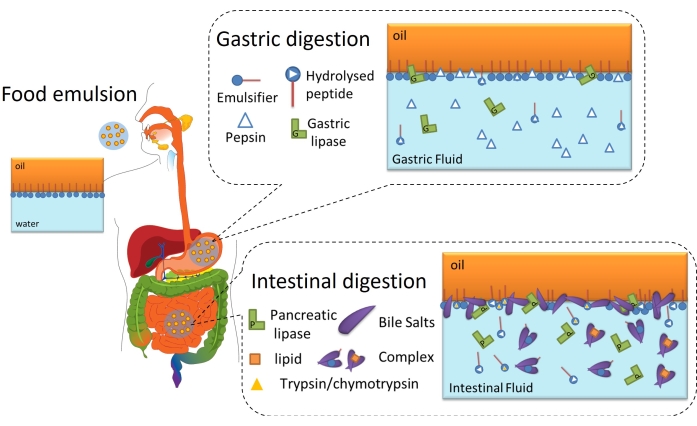
Figura 2: Diagramma schematico che illustra il ruolo delle interfacce nella digestione dei lipidi gastrointestinali. L'idrolisi della pepsina altera la composizione interfacciale nella fase gastrica, mentre la lipasi gastrica idrolizza i trigliceridi. Nell'intestino tenue, tripsina/chimotripsina idrolizzano ulteriormente il film interfacciale, mentre la lipolisi procede per adsorbimento di BS/lipasi, idrolisi dei trigliceridi e desorbimento dei prodotti lipolitici mediante solubilizzazione nelle micelle/complesso BS. Fare clic qui per visualizzare una versione ingrandita di questa figura.
L'apparecchiatura a goccia pendente dell'Università di Granada (UGR) è implementata con una tecnologia brevettata, il doppio capillare coassiale, che consente lo scambio di sottofasi della soluzione sfusa7. Il capillare, che trattiene la goccia pendente, è costituito da una disposizione di due capillari coassiali collegati in modo indipendente a ciascun canale di un doppio microiniettore. Ogni microiniettore può operare in modo indipendente, consentendo lo scambio del contenuto caduto tramite flusso passante7. Di conseguenza, lo scambio di sottofase consiste nell'iniezione simultanea della nuova soluzione con il capillare interno e nell'estrazione della soluzione sfusa con il capillare esterno utilizzando la stessa portata. Questo processo consente la sostituzione della soluzione sfusa senza disturbi dell'area interfacciale o del volume della goccia. Questa procedura è stata successivamente aggiornata a uno scambio multi-sottofase, che consente fino a otto scambi sequenziali di sottofase della soluzione di massa di goccioline8. Ciò consente la simulazione del processo digestivo in una singola goccia acquosa sospesa in mezzi lipidici scambiando sequenzialmente la soluzione bulk con mezzi artificiali che imitano i diversi compartimenti (bocca, stomaco, intestino tenue). L'intera configurazione è rappresentata nella Figura 3, inclusi i dettagli dei componenti. Le siringhe nel microiniettore sono collegate alle otto valvole vias, ciascuna collegata a un tubo di microcentrifuga contenente il fluido digestivo artificiale con i componenti descritti nella Figura 2.

Figura 3: Vista generale di OCTOPUS con tutti i componenti. La telecamera CCD, il microscopio, il microposizionatore, la cella termostabilizzata e il doppio capillare collegati indipendentemente a un doppio microiniettore con due siringhe collegate a otto valvole vias. Ogni siringa si collega con capillare, quattro provette di microcentrifuga con campione e uno scarico. Fare clic qui per visualizzare una versione ingrandita di questa figura.
La figura 4A mostra come ciascuno dei fluidi digestivi artificiali viene iniettato nella goccia pendente mediante scambio di sottofase attraverso il doppio capillare. Ogni composto digestivo descritto in Figura 2 può essere applicato simultaneamente / sequenzialmente, simulando il passaggio attraverso il tratto gastrointestinale. I fluidi digestivi artificiali contengono diversi enzimi e biotensioattivi, che alterano la tensione interfacciale dell'emulsionante iniziale, come schematizzato nella Figura 4B. Il software DINATEN (vedi Table of Materials), anch'esso sviluppato presso l'UGR, registra l'evoluzione della tensione interfacciale in tempo reale man mano che lo strato interfacciale iniziale viene digerito in vitro. Inoltre, dopo ogni fase digestiva, l'elasticità dilatatoria dello strato interfacciale viene calcolata imponendo oscillazioni periodiche di volume / area interfacciale sullo strato interfacciale stabilizzato e registrando la risposta della tensione interfacciale. Il periodo/frequenza e l'ampiezza dell'oscillazione possono essere variati, e l'elaborazione delle immagini con il software CONTACTO fornisce i parametri reologici dilatatori8.
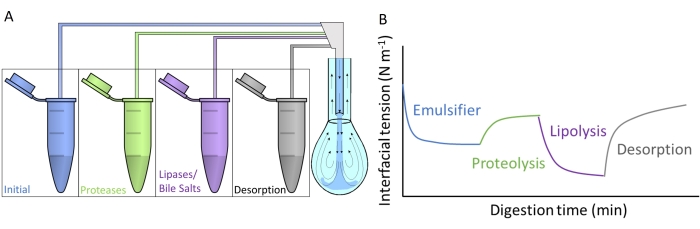
Figura 4: Esempi di profili di digestione . (A) Lo strato emulsionante iniziale è sottoposto a mezzi digestivi artificiali posti nella microcentrifuga mediante scambio sequenziale di sottofasi delle diverse soluzioni nella goccia pendente. (B) L'evoluzione generale della tensione interfacciale (asse y) dell'emulsionante iniziale in funzione del tempo (asse x) in quanto viene digerito in vitro dai vari enzimi/biotensioattivi nei mezzi artificiali. Uno scambio finale di sottofase con fluido intestinale semplice misura il desorbimento del lipide digerito mediante solubilizzazione in micelle miste. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Questo studio presenta il protocollo generale progettato per misurare la digestione in vitro degli strati interfacciali con apparecchiature pendenti per la caduta9. Lo strato interfacciale iniziale è soggetto in sequenza a condizioni che imitano il passaggio attraverso il tratto gastrointestinale, come illustrato nella Figura 2. Questi diversi mezzi digestivi vengono iniettati nella goccia del pendente mediante scambio di sottofase delle diverse soluzioni contenute nelle provette della microcentrifuga (Figura 4A). La composizione di questi mezzi può essere personalizzata in base alle condizioni gastrointestinali che verranno valutate, ovvero proteolisi/lipolisi gastrica/intestinale, consentendo di misurare gli effetti cumulativi e le sinergie10. Le condizioni sperimentali utilizzate per imitare il processo di digestione in ciascun compartimento seguono il protocollo di consenso internazionale pubblicato da INFOGEST che dettaglia il pH e le quantità di elettroliti ed enzimi11. Il dispositivo sperimentale basato sulla goccia del pendente consente di registrare la tensione interfacciale in situ durante tutto il processo di digestione simulato. La reologia dilativa dello strato interfacciale viene calcolata alla fine di ogni fase digestiva. In questo modo, ogni emulsionante offre un profilo di digestione che illustra le proprietà delle interfacce digerite, come illustrato nella Figura 4B. Ciò consente l'estrazione di conclusioni riguardanti la sua suscettibilità o resistenza alle diverse fasi del processo digestivo. In generale, i mezzi digestivi artificiali contengono pH acido/basico, elettroliti, proteasi (gastrica e intestinale), lipasi (gastrica e intestinale), sali biliari e fosfolipidi, che vengono disciolti nei rispettivi fluidi digestivi (gastrico o intestinale). La figura 4B mostra un profilo generico dell'evoluzione della tensione interfacciale di un emulsionante, prima sottoposta all'azione della proteasi, seguita dalle lipasi. In generale, la proteolisi dello strato interfacciale favorisce un aumento della tensione interfacciale dovuta al desorbimento dei peptidi idrolizzati9,12, mentre la lipolisi determina una riduzione molto marcata della tensione interfacciale dovuta all'adsorbimento di sali biliari e lipasi 13. Uno scambio finale di sottofase con il fluido intestinale esaurisce la soluzione sfusa di materiale non adsorbito / digerito e promuove il desorbimento dei composti solubili e la solubilizzazione dei lipidi digeriti nelle micelle miste. Questo è quantificato dall'aumento della tensione interfacciale registrata (Figura 4B).
In sintesi, il disegno sperimentale implementato nella goccia pendente per simulare la digestione in vitro in una singola goccia consente di misurare gli effetti cumulativi e le sinergie mentre il processo di digestione viene applicato sequenzialmente allo strato interfacciale iniziale10. La composizione di ciascun mezzo digestivo può essere facilmente sintonizzata per tenere conto delle particolarità delle condizioni digestive, comprese le patologie gastrointestinali o i mezzi digestivi infantili14. Quindi, l'identificazione dei meccanismi interfacciali che influenzano la proteolisi e la lipolisi può essere utilizzata per modulare la digestione mediante l'ingegneria interfacciale delle emulsioni. I risultati ottenuti possono essere applicati nella progettazione di nuove matrici alimentari con funzionalità su misura come bassa allergenicità, apporto energetico controllato e ridotta digeribilità 15,16,17,18,19.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Sequenza di pulizia per tutti gli oggetti in vetro utilizzati nella sperimentazione scientifica delle superfici
- Strofinare la vetreria con una soluzione detergente concentrata (vedi Tabella dei materiali) diluita in acqua (10%).
- Risciacquare abbondantemente con una sequenza di acqua di rubinetto, propanolo, acqua distillata e acqua ultrapura. Asciugare in una cabina e conservare in un armadietto chiuso fino all'uso.
2. Preparazione del campione
- Preparare mezzi digestivi artificiali secondo i protocolli standardizzati INFOGEST11,20 (vedi Tabella dei materiali). Per i dettagli, vedere la tabella 1 e includere piccoli adattamenti ai requisiti del lavoro interfacciale per prevenire la contaminazione attiva superficiale e la diluizione dei campioni (1:10)10.
- Preparare la soluzione emulsionante seguendo i passaggi seguenti.
- Preparare 0,01 L di una soluzione concentrata di (1 kg· L−1) emulsionante o una miscela di emulsionanti (vedi Tabella dei materiali) in un tampone iniziale (Tabella 1) e tenere sotto lieve agitazione durante la notte.
- Diluire a 0,1 kg· L−1 (o come richiesto) per saturare l'interfaccia; raggiungere uno pseudo plateau nella tensione interfacciale dopo 1 h di adsorbimento in un'area interfacciale costante seguendo il rapporto21 precedentemente pubblicato.
- Tenere sotto leggera agitazione per 15 minuti prima dell'uso.
- Purificare la fase oleosa.
- Preparare una miscela di olio vegetale (girasole, oliva, trioleina, ecc.) e resine metasilicate di magnesio (vedi Tabella dei materiali) in proporzione di 2:1 p/p in un grande becher. Tenere sotto lieve agitazione meccanica per almeno 3 ore.
- Centrifugare la miscela a 8.000 x g per 30 minuti a temperatura ambiente in una centrifuga commerciale (vedi Tabella dei materiali).
- Filtrare la miscela di olio sotto vuoto con un filtro a siringa (dimensione dei pori di 0,2 μm) (vedere Tabella dei materiali). Conservare in bottiglie ambrate pulite sigillate e bollite con azoto fino all'uso.
3. Taratura e pulizia dell'OCTOPUS
- Risciacquare tutti i tubi con acqua ultrapura impostando una sequenza di pulizia di entrambe le siringhe e di tutte le valvole attraverso un capillare (valvole 6/4) e all'uscita esterna (valvola 8-colore blu). A tale scopo, premere il pulsante di pulizia nella finestra di dialogo a sinistra (Figura supplementare 1A).
- Controllare la tensione superficiale7 dell'acqua a temperatura ambiente formando una goccia d'acqua e misurando in tempo reale per 5 minuti (Figura supplementare 1B, C).
- Impostare la densità differenziale aria-acqua (0,9982 kg· L−1) nella finestra di dialogo di sinistra, Figura supplementare 1B.
- Riempire la cuvetta pulita (vetro ottico) con 0,002 L di olio vegetale pulito e inserirla nel supporto della cuvetta nella cella termostatica (Figura 3).
- Impostare il termostato e consentire l'equilibrio della temperatura a 37 °C.
- Controllare la tensione interfacciale acqua-olio a temperatura ambiente7.
- Impostare la densità differenziale su olio vegetale-acqua (olio d'oliva: 0,800 kg· L−1) (figura supplementare 1C).
- Iniettare 40 μL ad una velocità di 0,5 μL·s−1 e misurare in tempo reale ogni secondo fino alla fine dell'iniezione. Si tratta di un processo dinamico semplice (figura supplementare 1B, D).
- Tracciare la tensione interfacciale in funzione del volume delle goccioline in una scheda tecnica.
- Verificare che l'intervallo di volume delle gocce fornisca un valore per la tensione interfacciale indipendente dal volume delle gocce. Tracciare l'area interfacciale in funzione del volume delle gocce.
- Programmare un processo contenente due passaggi (Figura supplementare 1B e Figura supplementare 2A) seguendo i passaggi seguenti.
- Con una siringa interna, iniettare un volume contenuto all'interno di questo intervallo di tensione interfacciale costante.
- Mantenere costante l'area interfacciale al valore selezionato al punto 3.5.4 e registrare la tensione interfacciale per 5 minuti7.
4. Programmare un processo sperimentale in DINATEN per ogni fase digestiva
NOTA: per i parametri di processo, vedere la figura supplementare 1B.
- Eseguire il controllo iniziale.
- Per la formazione di gocce, iniettare 10 μL (±5 μL) di soluzione emulsionante nel capillare (valvola 6) (Figura supplementare 2A).
- Registrare l'adsorbimento in un'area interfacciale costante 21 di 20 mm 2 (±10 mm2) per 1 ora (figura supplementare 2B).
- Registrare la reologia dilatativa8 (Figura supplementare 2C).
- Impostare l'ampiezza dell'oscillazione su 1,25 μL, periodo 10 s.
- Registrare l'adsorbimento nell'area interfacciale selezionata (punto 4.1.2) per 10 s.
- Ripetere il passaggio 4.1.3 in periodi diversi: 5 s, 20 s, 50 s e 100 s.
- Registra la digestione gastrica.
- Registrare l'adsorbimento21 nell'area interfacciale selezionata per 10 s.
- Scambio di sottofase7 con liquido nella valvola 2 (sSGF) ed enzimi gastrici (Tabella 1) (Figura supplementare 2D).
- Riempire la siringa sinistra dalla valvola 2. Iniettare 125 μL nella valvola 6-capillare con la siringa sinistra a 5 μL·s−1.
- Estrarre 125 μL dal capillare con la siringa destra a 5 μL·s−1. Scaricare la siringa destra per uscire dalla valvola 8. Ripetere i passaggi 4.2.2.1-4.2.2.2 10 volte per assicurare lo scambio completo.
- Registrare l'adsorbimento21 nell'area interfacciale selezionata al punto 4.1.2 per 1 ora (figura supplementare 2B).
- Registrare la reologia dilatativa8 (Figura supplementare 2C).
- Impostare l'ampiezza dell'oscillazione su 1,25 μL, periodo 10 s.
- Registrare l'adsorbimento dell'area interfacciale selezionata al punto 4.1.2 per 10 s. Ripetere in diversi periodi: 5 s, 20 s, 50 s, 100 s.
- Registra la digestione intestinale.
- Registrare l'adsorbimento21 nell'area interfacciale selezionata al punto 4.1.2 per 10 s (figura supplementare 2B).
- Scambio di sottofase7 con liquido nella valvola 3 (sSIF) ed enzimi intestinali/sali biliari/fosfolipidi (Tabella 1) (Figura supplementare 2D).
- Riempire la siringa sinistra dalla valvola 2. Iniettare 125 μL nella valvola 6-capillare con la siringa sinistra a 5 μL·s−1. Estrarre 125 μL dal capillare con la siringa destra a 5 μL·s−1.
- Scaricare la siringa destra per uscire dalla valvola 8. Ripetere i passaggi 4.3.2.1-4.3.2.2 10 volte per assicurare lo scambio completo.
- Registrare l'adsorbimento21 nell'area interfacciale selezionata al punto 4.1.2 per 1 ora.
- Registrare la reologia dilatativa8 (Figura supplementare 2C).
- Impostare l'ampiezza dell'oscillazione su 1,25 μL, periodo 10 s.
- Registrare l'adsorbimento nell'area interfacciale selezionata al punto 4.1.2 per 10 s.
- Ripetere in diversi periodi: 5 s, 20 s, 50 s, 100 s.
- Registrare il desorbimento seguendo i passaggi seguenti.
- Registrare l'adsorbimento21 nell'area interfacciale selezionata al punto 4.1.2 per 10 s (figura supplementare 2B).
- Scambio di sottofase7 con liquido nella valvola 5 (sSIF) (Tabella 1, Figura supplementare 2D).
- Riempire la siringa sinistra dalla valvola 5. Iniettare 125 μL nella valvola 5-capillare con la siringa sinistra a 5 μL·s−1.
- Estrarre 125 μL dal capillare con la siringa destra a 5 μL·s−1. Scaricare la siringa destra per uscire dalla valvola 8. Ripetere i passaggi 4.4.2.1-4.4.2.2 10 volte per assicurare lo scambio completo.
- Registrare l'adsorbimento21 nell'area interfacciale selezionata al punto 4.1.2 per 1 ora (figura supplementare 2B).
- Registrare la reologia dilatativa8 (Figura supplementare 2C).
- Mantenere l'ampiezza di 1,25 μL, periodo 10 s.
- Registrare l'adsorbimento nell'area interfacciale selezionata al punto 4.1.2 per 10 s.
- Ripetere il passaggio 4.4.4 in periodi diversi: 5 s, 20 s, 50 s, 100 s.
5. Impostazione dell'esperimento
- Riempire i tubi della microcentrifuga con il mezzo di digestione artificiale e collegare ciascuno di essi alla rispettiva valvola tramite il tubo corrispondente.
- Riempire il tubo nelle valvole 2-5 pulendo dalla valvola 2, dalla valvola 3, dalla valvola 4 e dalla valvola 5 fino all'uscita esterna (valvola 8) (figura supplementare 1A).
- Riempire il tubo nella valvola 1 pulendo dalla valvola 1 alla valvola 6-capillare 5 volte.
- Posizionare il capillare nella fase oleosa. Caricare la siringa sinistra con la valvola 1 (soluzione iniziale, Tabella 1).
- Avviare l'elaborazione sequenziale della fase 4.1-iniziale, della fase 4.2-gastrica, della fase 4.3-intestino e della fase 4.4-desorbimento, salvando i dati alla fine di ogni processo.
6. Calcolo dei parametri reologici dilatatori con il software di elaborazione delle immagini CONTACTO8
NOTA: Per i dettagli, vedere Maldonado-Valderrama et al.8.
- Caricare le immagini corrispondenti all'oscillazione dell'area ad una determinata frequenza e ampiezza (Figura supplementare 3A).
- Premere Reologia (Figura supplementare 3B) e ottenere i parametri dilatatori (Figura supplementare 3C).
- Copiare e incollare i risultati nel foglio di calcolo dei dati.
7. Rappresentazione dei risultati sperimentali
- Ricalcola la colonna temporale in ciascuna delle fasi del processo di digestione aggiungendo gli ultimi dati dell'ora del passaggio precedente.
- Tracciare la tensione interfacciale rispetto al tempo additivo per ciascuna delle fasi del processo di digestione utilizzato.
- Tracciare la tensione interfacciale/elasticità e viscosità finale dell'interfacciale ottenuta alla fine di ogni fase rispetto alla fase di digestione: digestione iniziale, gastrica, digestione duodenale e desorbimento.
Access restricted. Please log in or start a trial to view this content.
Risultati
Questa sezione mostra diversi esempi di profili di digestione misurati con OCTOPUS. L'aspetto generale delle corrispondenze del profilo di digestione simulato è mostrato nella Figura 4B. La tensione interfacciale è solitamente rappresentata contro il tempo nel profilo della digestione. Le diverse fasi/fasi di digestione considerate sono rappresentate in diversi colori. La prima fase forma lo strato iniziale e corrisponde alla fase di adsorbimento dell'emulsionante o della proteina/tensioat...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo articolo descrive un protocollo generalizzato per misurare la digestione in vitro degli strati interfacciali utilizzando apparecchiature per la caduta del pendente. Il protocollo può essere adattato alle esigenze specifiche dell'esperimento regolando la composizione dei tamponi digestivi, che si basano sul protocollo armonizzato INFOGEST11,20 per facilitare il confronto con la letteratura. Gli enzimi digestivi e i biotensioattivi possono essere a...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti noti o relazioni personali che potrebbero aver influenzato il lavoro riportato in questo articolo.
Riconoscimenti
Questa ricerca è stata finanziata dai progetti RTI2018-101309-B-C21 e PID2020-631-116615RAI00, finanziati da MCIN/AEI/10.13039/501100011033 e da "FESR A way of making Europe". Questo lavoro è stato (parzialmente) supportato dal Biocolloid and Fluid Physics Group (ref. PAI-FQM115) dell'Università di Granada (Spagna).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Alpha-chymotrypsin from bovine pancreas | Sigma-Aldrich | C4129 | Enzyme |
| Beta-lactoglobulin | Sigma-Aldrich | L0130 | Emulsfier |
| Bovine Serum Albumin | Sigma-Aldrich | 9048-46-8 | Emulsfier |
| CaCl2 | Sigma-Aldrich | 10043-52-4 | Electrolyte |
| Centrifuge | Kronton instruments | Centrikon T-124 | For separating oil and resins |
| Citrus pectin | Sigma-Aldrich | P9135 | Emulsfier |
| co-lipase FROM PORCINE PANCREAS | Sigma | C3028 | Enzyme |
| CONTACTO | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| DINATEN | University of Granada (UGR) | https://core.ugr.es/dinaten/, last access: 07/18/2022 | |
| Gastric lipase | Lipolytech | RGE15-1G | Enzyme |
| Human Serum Albumin | Sigma-Aldrich | 70024-90-7 | Emulsifier |
| INFOGEST | http://www.proteomics.ch/IVD/ | ||
| Lipase from porcine pancreas, type II | Sigma-Aldrich | L33126 | Enzyme |
| Magnesium metasilicate resins | Fluka | 1343-88-0 | Resins to purify oil |
| Micro 90 | International products | M-9051-04 | Cleaner |
| NaCl | Sigma | 7647-14-5 | Electrolyte |
| NaH2PO4 | Scharlau | 10049-21-5 | To prepare buffer |
| OCTOPUS | Producciones Científicas y Técnicas S.L. (Gójar, Spain) | Pendandt Drop Equipment implemented with multi subphase exchange | |
| Olive oil | Sigma-Aldrich | 1514 | oil |
| Pancreatic from porcine pancreas | Sigma | P7545-25 g | Enzyme |
| Pepsin | Sigma-Aldrich | P6887 | Enzyme |
| Pluronic F127 | Sigma | P2443 | Emulsifier |
| Pluronic F68 | Sigma | P1300 | Emulsfier |
| Sodium deoxycholate | Sigma | Bile salts | |
| Sodium glycodeoxycholate | Sigma | C9910 | Bile salts |
| Sodium taurocholate | Sigma | 86339 | Bile salts |
| Syringe Filter | Millex-DP | SLGP033R | Syringe Filter 0.22 µm pore size polyethersulfone |
| Trypsin | Sigma-Aldrich | T1426 | Enzyme |
Riferimenti
- McClements, D. J. The biophysics of digestion: Lipids. Current Opinion in Food Science. 21, 1-6 (2018).
- McClements, D. J., Li, Y. Structured emulsion-based delivery systems: Controlling the digestion and release of lipophilic food components. Advances in Colloid and Interface Science. 159 (2), 213-228 (2010).
- Corstens, M. N., et al. Food-grade micro-encapsulation systems that may induce satiety via delayed lipolysis: A review. Critical Reviews in Food Science and Nutrition. 57 (10), 2218-2244 (2017).
- Aguilera-Garrido, A., del Castillo-Santaella, T., Galisteo-González, F., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Investigating the role of hyaluronic acid in improving curcumin bioaccessibility from nanoemulsions. Food Chemistry. 351, 129301(2021).
- Rodríguez Patino, J. M., Carrera Sánchez, C., Rodríguez Niño, M. R. Implications of interfacial characteristics of food foaming agents in foam formulations. Advances in Colloid and Interface Science. 140 (2), 95-113 (2008).
- Wilde, P. J., Chu, B. S. Interfacial & colloidal aspects of lipid digestion. Advances in Colloid and Interface Science. 165 (1), 14-22 (2011).
- Cabrerizo-Vílchez, M. A., Wege, H. A., Holgado-Terriza, J. A., Neumann, A. W. Axisymmetric drop shape analysis as penetration Langmuir balance. Review of Scientific Instruments. 70 (5), 2438-2444 (1999).
- Maldonado-Valderrama, J., Muros-Cobos, J. L., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Bile salts at the air-water interface: Adsorption and desorption. Colloids and surfaces B: Biointerfaces. 120, 176-183 (2014).
- Maldonado-Valderrama, J., Terriza, J. A. H., Torcello-Gómez, A., Cabrerizo-Vílchez, M. A. In vitro digestion of interfacial protein structures. Soft Matter. 9, 1043-1053 (2013).
- Maldonado-Valderrama, J. Probing in vitro digestion at oil-water interfaces. Current Opinion in Colloid and Interface Science. 39, 51-60 (2019).
- Brodkorb, A., et al. INFOGEST static in vitro simulation of gastrointestinal food digestion. Nature Protocols. 14 (4), 991-1014 (2019).
- del Castillo-Santaella, T., Maldonado-Valderrama, J., Molina-Bolivar, J. A., Galisteo-Gonzalez, F. Effect of cross-linker glutaraldehyde on gastric digestion of emulsified albumin. Colloids and Surfaces B: Biointerfaces. 145, 899-905 (2016).
- Macierzanka, A., Torcello-Gómez, A., Jungnickel, C., Maldonado-Valderrama, J. Bile salts in digestion and transport of lipids. Advances in Colloid and Interface Science. 274, 102045(2019).
- Maldonado-Valderrama, J., Torcello-Gómez, A., del Castillo-Santaella, T., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Subphase exchange experiments with the pendant drop technique. Advances in Colloid and Interface Science. 222, 488-501 (2015).
- Bellesi, F. A., Ruiz-Henestrosa, V. M. P., Maldonado-Valderrama, J., Del Castillo Santaella, T., Pilosof, A. M. R. Comparative interfacial in vitro digestion of protein and polysaccharide oil/water films. Colloids and Surfaces B: Biointerfaces. 161, 547-554 (2018).
- Del Castillo-Santaella, T., Sanmartín, E., Cabrerizo-Vílchez, M. A., Arboleya, J. C., Maldonado-Valderrama, J. Improved digestibility of β-lactoglobulin by pulsed light processing: A dilatational and shear study. Soft Matter. 10 (48), 9702-9714 (2014).
- Infantes-Garcia, M. R., et al. In vitro gastric lipid digestion of emulsions with mixed emulsifiers: Correlation between lipolysis kinetics and interfacial characteristics. Food Hydrocolloids. 128, 107576(2022).
- del Castillo-Santaella, T., Cebrián, R., Maqueda, M., Gálvez-Ruiz, M. J., Maldonado-Valderrama, J. Assessing in vitro digestibility of food biopreservative AS-48. Food Chemistry. 246, 249-257 (2018).
- Torcello-Gómez, A., Maldonado-Valderrama, J., Jódar-Reyes, A. B., Cabrerizo-Vílchez, M. A., Martín-Rodríguez, A. Pluronic-covered oil-water interfaces under simulated duodenal conditions. Food Hydrocolloids. 34, 54-61 (2014).
- Minekus, M., et al. A standardised static in vitro digestion method suitable for food - an international consensus. Food & Function. 5 (6), 1113-1124 (2014).
- Wege, H. A., Holgado-Terriza, J. A., Cabrerizo-Vílchez, M. A. Development of a constant surface pressure penetration langmuir balance based on axisymmetric drop shape analysis. Journal of Colloid and Interface Science. 249 (2), 263-273 (2002).
- del Castillo-Santaella, T., et al. Hyaluronic acid and human/bovine serum albumin shelled nanocapsules: Interaction with mucins and in vitro digestibility of interfacial films. Food Chemistry. 383, 132330(2022).
- Aguilera-Garrido, A., et al. Applications of serum albumins in delivery systems: Differences in interfacial behaviour and interacting abilities with polysaccharides. Advances in Colloid and Interface Science. 290 (5), 102365(2021).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon