È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Progettazione di un bioreattore per migliorare l'acquisizione dei dati e modellare la produttività dei tessuti cardiaci ingegnerizzati
In questo articolo
Erratum Notice
Riepilogo
I tessuti cardiaci tridimensionali bioingegnerizzati utilizzando cardiomiociti derivati da cellule staminali sono emersi come modelli promettenti per lo studio in vitro del miocardio umano sano e malato, ricapitolando gli aspetti chiave della nicchia cardiaca nativa. Questo manoscritto descrive un protocollo per la fabbricazione e l'analisi di tessuti cardiaci ingegnerizzati ad alto contenuto generati da cardiomiociti derivati da cellule staminali pluripotenti indotte umane.
Abstract
L'insufficienza cardiaca rimane la principale causa di morte in tutto il mondo, creando un urgente bisogno di migliori modelli preclinici del cuore umano. L'ingegneria tissutale è fondamentale per la ricerca cardiologica di base; La coltura cellulare umana in vitro elimina le differenze interspecie dei modelli animali, mentre un ambiente 3D più simile a quello dei tessuti (ad esempio, con matrice extracellulare e accoppiamento eterocellulare) simula le condizioni in vivo in misura maggiore rispetto alla tradizionale coltura bidimensionale su piastre di Petri di plastica. Tuttavia, ogni sistema modello richiede attrezzature specializzate, ad esempio bioreattori progettati su misura e dispositivi di valutazione funzionale. Inoltre, questi protocolli sono spesso complicati, laboriosi e afflitti dal fallimento dei piccoli e delicati tessuti.
Questo articolo descrive un processo per la generazione di un robusto sistema modello di tessuto cardiaco ingegnerizzato umano (hECT) utilizzando cardiomiociti derivati da cellule staminali pluripotenti indotte per la misurazione longitudinale della funzione tissutale. Sei hECT con geometria a striscia lineare vengono coltivati in parallelo, con ogni hECT sospeso da una coppia di perni in polidimetilsilossano (PDMS) con rilevamento della forza collegati ai rack PDMS. Ogni post è dotato di un PDMS stable post tracker (SPoT) nero, una nuova funzionalità che migliora la facilità d'uso, la produttività, la ritenzione dei tessuti e la qualità dei dati. La forma consente un tracciamento ottico affidabile delle deflessioni dei perni, ottenendo un migliore tracciamento della forza di contrazione con tensione attiva e passiva assoluta. La geometria del cappuccio elimina il cedimento del tessuto dovuto agli hECT che scivolano dai perni e, poiché comportano una seconda fase dopo la fabbricazione del rack PDMS, gli SPoT possono essere aggiunti ai progetti basati su post-post PDMS esistenti senza modifiche sostanziali al processo di fabbricazione del bioreattore.
Il sistema viene utilizzato per dimostrare l'importanza di misurare la funzione dell'hECT a temperature fisiologiche e mostra una funzione tissutale stabile durante l'acquisizione dei dati. In sintesi, descriviamo un sistema modello all'avanguardia che riproduce le condizioni fisiologiche chiave per far progredire la biofedeltà, l'efficienza e il rigore dei tessuti cardiaci ingegnerizzati per applicazioni in vitro .
Introduzione
I modelli ingegnerizzati di tessuto cardiaco sono disponibili in una vasta gamma di geometrie e configurazioni per ricapitolare vari aspetti della nicchia cardiaca nativa che sono difficili da ottenere con la tradizionale coltura cellulare bidimensionale. Una delle configurazioni più comuni è la striscia di tessuto lineare, con ancoraggi flessibili a ciascuna estremità per indurre l'autoassemblaggio del tessuto e fornire al tessuto un precarico definito e una lettura delle forze di contrazione risultanti 1,2,3,4,5,6,7,8,9,10,11, 12,13,14,15,16,17,18,19,20,21
,22,23,24,25,26,27. La forza generata può essere determinata in modo robusto attraverso l'inseguimento ottico dell'accorciamento del tessuto e utilizzando la teoria del fascio elastico per calcolare la forza dalle deflessioni misurate e la costante elastica degli ancoraggi 1,2,3,4,5,6,7,8,9,10,11, 12,13,14,15,16,17,18,19,20,
21,22,25,26,28.
Tuttavia, l'ingegneria dei tessuti cardiaci è ancora un campo in evoluzione e permangono alcune sfide. Per ogni modello di sistema 10,29,30,31 sono necessarie attrezzature specializzate, come bioreattori su misura e dispositivi di valutazione funzionale. Le dimensioni e la complessità del microambiente di questi costrutti sono spesso limitate da un basso rendimento dovuto a protocolli ad alta intensità di lavoro, dall'elevato numero di cellule e dalla fragilità dei tessuti. Per affrontare questo problema, alcuni gruppi si sono rivolti alla fabbricazione di microtessuti contenenti solo centinaia o migliaia di cellule per facilitare saggi ad alto rendimento utili per la scoperta di farmaci. Tuttavia, questa scala ridotta complica la valutazione accurata della funzione12, elimina aspetti chiave della nicchia cardiaca nativa (come i gradienti di diffusione di nutrienti/ossigeno e l'architettura complessa36) e limita la quantità di materiale disponibile per le successive analisi molecolari e strutturali (spesso richiedendo il pooling dei tessuti). La Tabella 1 riassume alcune delle configurazioni dei modelli di strisce di tessuto lineare in letteratura 1,2,3,4,5,6,7,8,9,10,11,12,13,14,15, 16,17,18,19,20,
21,22,23,24,25,26,37,38,39,40.
| Gruppo | Cellule per tessuto | Fazzoletti per piastra | Formato piastra | Funzione di ancoraggio | Metodo di acquisizione dei dati funzionali | Bagno multimediale condiviso? | Misura funzionale- mento in situ? | ||||
| Yoshida (ECT)38 | 4 milioni | 6 | Piastra a 6 pozzetti modificata* | trasduttore di forza | Misurazione diretta della forza | No | No | ||||
| Chan (hESC-CM-ECTs)26 | 310 mila | 6 | Piatto personalizzato a 6 pozzetti | Posti PDMS | Misurazione diretta della forza | Sì | No | ||||
| Feinberg (dyn-EHT)16 | 1,5 milioni | 6 | Piatto personalizzato a 6 pozzetti | Filo PDMS | forma del tessuto | No | Sì | ||||
| RADISIC (BioWire)39, 40 | 110 mila | 8 | filo polimerico | Forma del filo | Sì | Sì | |||||
| Costa (hECT singolo)1, 2 | 1-2 milioni | 4** | Piastra Petri da 10 cm** | Posti PDMS | Deflessione ottica (tracciamento di bordi/oggetti) | Sì | Sì | ||||
| Costa (multi-hECT)3–9 | 500 k-1 milione | 6 | Piastra di Petri da 6 cm | Posti PDMS | Deflessione ottica (tracciamento di bordi/oggetti) | Sì | Sì | ||||
| Costa (multi-hECT con SPoT) | 1 milione | 6 | Piastra di Petri da 6 cm | Pali PDMS con cappucci neri | Deflessione ottica (tracciamento dell'oggetto) | Sì | Sì | ||||
| Passier (EHT)17 | 245 mila | 36 | Piastra a 12 pozzetti | Pali PDMS con cappucci neri | Deflessione ottica (tracciamento dell'oggetto) | Sì | Sì | ||||
| Vunjak-Novakovic13, 18 | 1 milione | 12 | Piastra di Petri da 6 cm | Pali PDMS con tappi | deflessione ottica (rilevamento dei bordi) | Sì | Sì | ||||
| Vunjak-Novakovic (MilliPilastro)14 | 550 mila | 6 | Piatto personalizzato a 6 pozzetti | Pali PDMS con tappi | deflessione ottica (tracciamento di oggetti); Imaging del calcio | No | Sì | ||||
| Eschenhagen (EHT)10, 19–21 | 1 milione | 12 | Piastra a 12 pozzetti | Pali PDMS con tappi | deflessione ottica (rilevamento del bordo della post-deflessione); Imaging del calcio | No | Sì | ||||
| Zandstra (CaMiRi)22 | 25-150 mila | 96 | Piastra a 96 pozzetti | Pali PDMS con ganci | deflessione ottica (rilevamento dei bordi) | No | Sì | ||||
| Murry23, 24 | 900 mila | 24 | Piastra a 24 pozzetti | Pali PDMS con tappi, magnete integrato | sensore magnetico | No | Sì | ||||
| Reich (μTUG)11, 12, 25 | indefinito | 156 | Piatto da 156 pozzetti | Pali PDMS con tappi, magnete integrato | Tracciamento ottico (perlina fluorescente) | Sì | Sì | ||||
Tabella 1: Caratteristiche di alcuni modelli di tessuto cardiaco ingegnerizzato lineare in letteratura. I modelli lineari di tessuto cardiaco ingegnerizzato variano in termini di dimensioni, produttività, design delle caratteristiche di ancoraggio e facilitazione di bagni di terreno condivisi, nonché i requisiti per un sistema di bagno muscolare separato per la caratterizzazione funzionale. * I ricercatori hanno utilizzato un sistema tissutale ingegnerizzato disponibile in commercio basato sulle dimensioni di una piastra standard a 6 pozzetti. ** Un sistema modulare in cui i bioreattori monotissutale sono ancorati a qualsiasi piastra di coltura in plastica nel numero e nella posizione desiderati.
Questo documento descrive l'ultimo protocollo per la fabbricazione del nostro modello consolidato di tessuto cardiaco lineare ingegnerizzato umano (hECT)1,2,3,4,5,6,7,8,9,15,27 e metodi per la valutazione della funzione contrattile dell'eCT. Ogni bioreattore multi-tessuto ospita fino a sei hECT in un bagno di terreno condiviso ed è composto da due pezzi "rack" realizzati con l'elastomero siliconico polidimetilsilossano (PDMS) montato su un telaio rigido in polisulfone. Ogni rack PDMS contiene sei montanti flessibili integrati con rilevamento della forza di 0,5 mm di diametro e 3,25 mm di lunghezza e, insieme, due rack forniscono sei coppie di montanti, ognuno dei quali contiene un hECT. L'inversione del bioreattore aiuta a superare qualsiasi ostacolo alla visualizzazione degli hECT dal basso dovuto alla condensazione dell'acqua dal terreno di coltura o alle distorsioni del menisco dell'interfaccia aria-liquido. Ogni contrazione di un hECT provoca la deflessione dei pali terminali integrati e la misurazione ottica del segnale di deflessione viene elaborata in un tracciato della forza rispetto al tempo che rappresenta la funzione contrattile dell'hECT 1,2,3,4,5,6,7,8,9,15,27 . Rispetto ai bioreattori monotissutali tipicamente utilizzati per tessuti di queste dimensioni, il design multi-tessuto migliora la produttività sperimentale e consente lo studio della segnalazione paracrina tra tessuti adiacenti di composizione cellulare potenzialmente diversa. Questo sistema è stato validato in studi pubblicati che descrivono applicazioni nella modellazione della malattia 4,8, nella segnalazione paracrina 6,7, nella coltura eterocellulare 5,9 e nello screening terapeutico 7,9.
In questo sistema, gli hECT sono progettati per essere lunghi circa 6 mm e con un diametro di 0,5 mm per facilitare un robusto tracciamento ottico delle misurazioni della forza con basso rumore. Inoltre, aspetti della complessità tissutale, come i gradienti di diffusione e l'organizzazione cellulare, sono bilanciati con un fabbisogno gestibile di 1 milione di cellule per tessuto. Con la tecnologia standard delle telecamere CCD, forze deboli come 1 μN (che rappresentano meno di 5 μm di post-deflessione) generano un segnale chiaro, assicurando che anche la funzione contrattile estremamente debole, come osservato con alcuni modelli di malattia hECT, possa essere misurata con precisione. Ciò facilita anche l'analisi dettagliata della curva della forza di contrazione, consentendo così l'analisi ad alto contenuto di un massimo di 16 metriche di contrattilità41, tra cui la forza sviluppata, i tassi di contrazione (+dF/dt) e di rilassamento (−dF/dt) e la variabilità della frequenza di battimento.
Questo protocollo inizia con le istruzioni per la fabbricazione dei componenti del bioreattore. Particolare attenzione è rivolta alle fasi per massimizzare la resa di hECT, ridurre la variabilità tecnica nella funzione tissutale e ottimizzare la qualità e la profondità della valutazione tissutale. La maggior parte degli studi di ingegneria tissutale cardiaca non riporta i tassi di perdita di tessuto durante la fabbricazione e i test a lungo termine, sebbene sia una sfida ben nota nel campo e riduca la produttività e l'efficienza degli studi27. I metodi di ingegneria tissutale qui descritti sono stati perfezionati nel corso degli anni per garantire la ritenzione di tutti gli hECT nella maggior parte dei bioreattori (indipendentemente da come sono fabbricati i rack PDMS). Tuttavia, anche una perdita del 5%-20% dei tessuti può influenzare significativamente la potenza statistica, in particolare negli esperimenti più piccoli limitati dal numero di cardiomiociti disponibili (ad esempio, a causa di problemi di differenziazione con alcune linee cellulari malate4 o a causa dell'alto costo dei cardiomiociti acquistati in commercio), o dalle condizioni di trattamento (ad esempio, disponibilità limitata o costo elevato di vari composti di trattamento).
Questo protocollo descrive la fabbricazione di inseguitori di pali stabili (SPoT), una nuova caratteristica dei rack PDMS, che funzionano come tappi alle estremità dei pali di rilevamento della forza che contengono gli hECT27. È stato dimostrato come la geometria del cappuccio riduca significativamente la perdita di hECT dovuta alla caduta o al distacco dei montanti, aprendo così nuove opportunità per la coltivazione di hECT con una maggiore varietà di rigidità e tensioni, che sono difficili da coltivare su pali non tappati. Inoltre, gli SPoT forniscono un oggetto ad alto contrasto per migliorare l'inseguimento ottico della contrazione hECT attraverso una forma coerente e ben definita27. Segue una descrizione della coltura di cellule staminali pluripotenti indotte umane (iPSC) e del differenziamento dei cardiomiociti sulla base dei protocolli 3,42,43 pubblicati in precedenza e una spiegazione della fabbricazione, della coltura e delle misurazioni funzionali dell'hECT.
Questo articolo affronta anche la necessità di misurare la funzione dei tessuti alla temperatura fisiologica. Il miocardio umano (tessuto sano e malato fetale e adulto), così come il tessuto cardiaco di un'ampia gamma di specie animali (tra cui ratti, gatti, topi, furetti e conigli)44,45, mostra un marcato aumento della forza di contrazione abbinata alla frequenza a temperature di 28 °C-32 °C rispetto alla temperatura fisiologica, un fenomeno noto come inotropia ipotermica45, 46. Tuttavia, gli effetti della temperatura sulla funzione del tessuto miocardico ingegnerizzato rimangono poco studiati. Molti recenti modelli di tessuto cardiaco ingegnerizzato in letteratura sono progettati per essere valutati funzionalmente a 37 °C per approssimare le condizioni fisiologiche 13,14,37. Tuttavia, per quanto ne sappiamo, gli effetti dipendenti dalla temperatura sulla forza generata dai tessuti cardiaci ingegnerizzati non sono stati studiati in modo sistematico. Questo protocollo descrive un design dell'elettrodo di stimolazione che riduce al minimo la perdita di calore durante il test, oltre a consentire l'incorporazione di un elemento riscaldante isolato nella configurazione per le misurazioni funzionali, in grado di mantenere gli hECT a temperatura fisiologica senza compromettere la sterilità27. Riportiamo quindi alcuni degli effetti osservati della temperatura sulla funzione dell'hECT, tra cui la forza sviluppata, la frequenza di battimento spontaneo, +dF/dt e −dF/dt. Nel complesso, questo documento fornisce i dettagli necessari per produrre questo sistema di bioreattore multi-tessuto con rilevamento della forza per fabbricare tessuti cardiaci ingegnerizzati dall'uomo e per valutare la loro funzione contrattile, e viene presentata una serie di dati che forniscono una base di confronto per le misurazioni a temperatura ambiente e a 37 °C27.
Protocollo
Questo protocollo utilizzava una linea iPSC de-identificata, SkiPS 31.3 (originariamente riprogrammata utilizzando fibroblasti dermici di un maschio sano di 45 anni)47, ed era, quindi, esente dall'approvazione specifica dell'Institutional Review Board, in conformità con le linee guida del comitato etico per la ricerca umana dell'istituzione. Eseguire tutta la manipolazione delle cellule e dell'hECT in condizioni asettiche in una cabina di sicurezza biologica di classe II filtrata HEPA o in un banco di lavoro a flusso laminare. Sterilizzare tutte le soluzioni non sterili mediante filtrazione attraverso un filtro da 0,22 μm e mantenere tutte le cellule e gli hECT in un incubatore a 37 °C, 95% di umidità relativa e 5% di CO2 .
1. Fabbricazione di bioreattori
- Componenti per bioreattori e fabbricazione di master cast in alluminio
NOTA: i file CAD (Computer-Aided Design) sono forniti nel file supplementare 1. Il protocollo può essere sospeso in qualsiasi punto tra questi passaggi. Si consiglia di avvalersi di un macchinista professionista per la produzione degli stampi master descritti in questa sezione, poiché sono necessarie tolleranze elevate (≤5 μm) e una finitura liscia per un'accurata geometria del perno e per un corretto montaggio a pressione dei telai in polisulfone sulle piastre di base in politetrafluoroetilene (PTFE) (con l'obiettivo di un accoppiamento aderente all'attrito, ma non troppo stretto).- Utilizzando una fresatrice a controllo numerico computerizzato (CNC), lavorare la piastra di base in PTFE secondo gli schemi nella Figura 1A. Gli hECT si formeranno nei sei pozzetti equidistanti (frecce bianche).
- Utilizzando una fresatrice CNC, lavorare il master negativo a cremagliera di polidimetilsilossano (PDMS) in alluminio secondo gli schemi della Figura 1B, con tre supporti del telaio (asterischi verdi). Praticare sei fori equidistanti (punte di freccia magenta) di 0,5 mm di diametro per creare i montanti PDMS.
- Utilizzando una fresatrice CNC, lavorare il telaio del bioreattore in polisulfone secondo gli schemi della Figura 1C. I supporti del telaio (asterischi verdi) corrispondono ai supporti del telaio visti nel getto a cremagliera (Figura 1B, asterischi verdi).
- Utilizzando una fresatrice CNC, lavorare il supporto in ghisa di alluminio in alluminio secondo gli schemi nella Figura 1D. Ogni fessura contiene un ripiano triangolare (triangolo arancione) alto 0,25 mm per fornire uno spazio morto per il flusso del PDMS attraverso i fori nei getti del rack PDMS (Figura 1B, punte di freccia magenta).
- Fusione del rack PDMS dai master negativi in alluminio
- Utilizzando una stampante 3D per modellazione a deposizione fusa termoplastica, stampare due staffe per apparecchi di fusione a rack PDMS (File supplementare 1). Utilizzare le seguenti impostazioni di stampa: un'altezza dello strato di 0,1 mm, uno spessore della parete/inferiore/superiore di 1 mm, una densità di riempimento del 90% con triangoli, una temperatura di stampa di 230 °C, una temperatura del piano di stampa di 70 °C e un bordo per l'adesione.
- Posizionare quattro fusioni master negative in alluminio nel supporto per gesso (Figura 2AI) in modo che i fori dei montanti siano allineati con lo spazio morto opposto ai ripiani triangolari (vedere la Figura 1D). Avvolgere l'apparecchio in un pezzo rettangolare di fogli di silicone di 0,5 mm di spessore (Figura 2B, frecce bianche) come guarnizione per evitare perdite del PDMS liquido e bloccarlo tra due staffe parallele stampate in 3D utilizzando un morsetto a vite.
- Aggiungere 0,5 mL di agente indurente PDMS a 5 mL di base elastomerica PDMS (rapporto 1:10, secondo le istruzioni del produttore) in un contenitore poco profondo e mescolare energicamente per 5 minuti. Degassare la miscela PDMS in una camera a vuoto e applicare un forte vuoto (0,1-1 kPa) per 20-60 minuti a temperatura ambiente o fino a quando le bolle non scompaiono.
- Versare la miscela PDMS sull'apparato di colata, riempiendo eccessivamente per garantire la copertura completa di ciascuna fessura (Figura 2AII). Se lo si desidera, aggiungere piccole perle di vetro colorate al corpo dei rack PDMS (Figura 2AII), di fronte al lato con i montanti (Figura 2B), per l'identificazione univoca di ciascun rack PDMS. Riportare l'apparecchio di colata nella camera a vuoto (assicurandosi che sia in piano orizzontalmente) e applicare un forte vuoto per almeno 12 ore. Lasciare polimerizzare il PDMS a temperatura ambiente per circa 48 ore lontano dalla polvere per consentire la completa polimerizzazione e la massima resistenza dei pali delicati. Evita di usare un forno in quanto ciò deforma i componenti stampati in 3D.
NOTA: Il protocollo può essere messo in pausa qui.
- Rimozione del rack PDMS dai master cast negativi in alluminio
- Rimuovere il clamp, le staffe e il foglio di silicone dall'apparecchio di colata. Utilizzando una lama di rasoio in acciaio inossidabile, tagliare la pellicola PDMS sopra l'apparato di fusione e i supporti del telaio e utilizzare delicatamente le dita per separare i rack PDMS dai lati del supporto per gesso. Inserire una lama di rasoio smussata in acciaio inossidabile nello spazio morto tra il gesso e il supporto del gesso e separarli (Figura 2CI, II), assicurandosi che il PDMS che riempie lo spazio morto rimanga con il supporto del gesso (poiché questo è attaccato ai montanti). Utilizzando una lama affilata in acciaio inossidabile, tagliare le pellicole PDMS rimanenti e tagliare lo spazio morto PDMS dalle punte dei perni (Figura 2C III-V).
- FASE CRITICA: Liberare il rack PDMS dal cast (Figura 2D). Partendo dal lato opposto ai montanti, utilizzare le dita per separare lentamente il rack PDMS dal getto, lavorando su lati alternati fino a quando i pali non sono liberi dai getti master.
- Ripetere il passaggio precedente fino a quando tutti i rack PDMS e tutti i montanti non sono stati liberati. Utilizzare una lama di rasoio affilata per eliminare il PDMS in eccesso dai rack. Il risultato è un rack PDMS (Figura 2E) con sei montanti intatti (punte di freccia arancioni) e perline colorate (freccia blu) per l'identificazione.
NOTA: Il protocollo può essere messo in pausa qui.
- Fabbricazione di inseguitori di pali stabili (SPoT)
- Utilizzando una stampante 3D per modellazione a deposizione fusa termoplastica, stampare i componenti dell'apparato di fusione SPoT (File supplementare 2 e Figura 3AI, II). Utilizzare le seguenti impostazioni di stampa: un'altezza dello strato di 0,1 mm, uno spessore della parete/inferiore/superiore di 1 mm, una densità di riempimento dell'80% con triangoli, una temperatura di stampa di 230 °C, una temperatura del piano di stampa di 70 °C e una falda per l'adesione.
- Assicurarsi che la pressa si adatti perfettamente ai perni stampati in 3D, nonché tra i rack PDMS e la maschera a tre punte, e verificare che i rack PDMS si adattino perfettamente ai montanti che raggiungono appena il fondo dei pozzetti senza essere piegati. Tagliare/limare la plastica se necessario.
- Aggiungere 0,5 mL di PDMS nero parte A a 0,5 mL di parte B (rapporto 1:1, secondo le istruzioni del produttore) in una piccola barca di pesatura (o in un contenitore simile piccolo e poco profondo) e mescolare accuratamente fino a ottenere un colore uniforme. Degassare il PDMS nero miscelato in una camera a vuoto sotto forte vuoto per 20 minuti. Versare il PDMS nero degassato sulla base stampata in 3D per riempire i fori e picchiettare per assicurarsi che non rimangano bolle. Raschiare via il più possibile il PDMS in eccesso dalla base.
- Agganciare il pezzo a tre punte alla base e posizionare i rack PDMS nelle scanalature della dima a tre punte (Figura 3AII, rettangolo turchese), assicurandosi che le estremità dei montanti si immergano nel PDMS nero nei pozzetti circolari (Figura 3B, C). Polimerizzare il PDMS nero a temperatura ambiente e al riparo dalla polvere per 48 ore.
NOTA: Il protocollo può essere messo in pausa qui. - Far scorrere il pezzo a tre punte, riducendo al minimo la tensione sui montanti. Utilizzare piccole pinze per raschiare via la sottile pellicola di PDMS nero che circonda ogni SPoT; quindi, inserire una pinza piegata a punta fine nel pozzetto SPoT per liberarlo dalla base stampata in 3D (Figura 3D).
- Ispezionare gli SPoT (Figura 3E) e tagliare via la pellicola PDMS nera rimanente dal processo di fusione non rimossa al punto 1.4.5 utilizzando forbici Vannas fini. Assicurarsi che i montanti finiti siano della lunghezza corretta montando i rack PDMS sul telaio in polisulfone e quindi facendolo scorrere sulla piastra di base nera (Figura 4A).
NOTA: Il protocollo può essere messo in pausa qui. - Accoppiare i rack PDMS e aggiungerli al telaio utilizzando le linguette del telaio (Figura 4A). Autoclavare in un sacchetto con una piastra di base in PTFE per un ciclo di almeno 30 minuti (<122 °C per ridurre la deformazione).
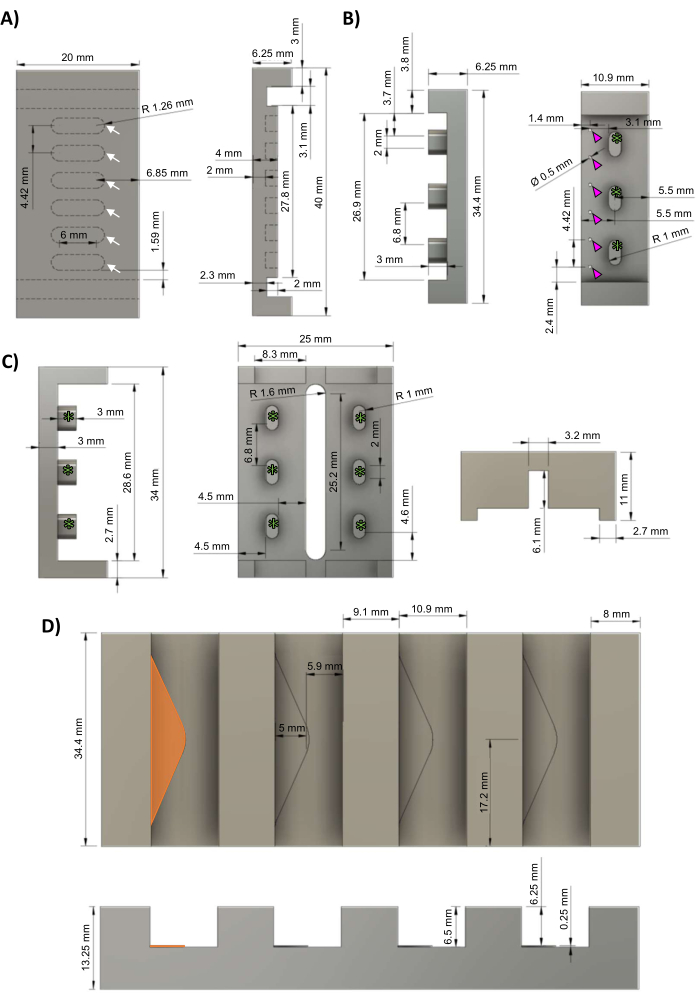
Figura 1: componenti del bioreattore hECT. (A) Vista dall'alto (a sinistra) e vista laterale (a destra) della piastra di base in PTFE con sei pozzetti equidistanti per la formazione di hECT (frecce bianche). (B) Vista laterale (a sinistra) e vista dall'alto (a destra) dei master cast negativi in alluminio per i rack PDMS con sei montanti equidistanti (punte di freccia magenta) e tre spazi vuoti per il fissaggio al telaio del bioreattore (asterischi verdi). (C) Vista laterale (sinistra) e vista inferiore (destra) dei telai in polisulfone per i rack PDMS con tre supporti per telai equidistanti (asterischi verdi) corrispondenti ai supporti per telai nel cast per rack PDMS (pannello B). (D) Vista dall'alto (dall'alto) e vista laterale (dal basso) del supporto in ghisa di alluminio con quattro slot per i getti del rack PDMS, ciascuno con un ripiano triangolare alto 0,25 mm (il ripiano più a sinistra evidenziato in arancione). Questa cifra è stata modificata da van Neste27. Abbreviazioni: hECT = tessuto cardiaco ingegnerizzato dall'uomo; Ø = diametro; PTFE = politetrafluoroetilene; PDMS = polidimetilsilossano; R = raggio. Fare clic qui per visualizzare una versione più grande di questa figura.
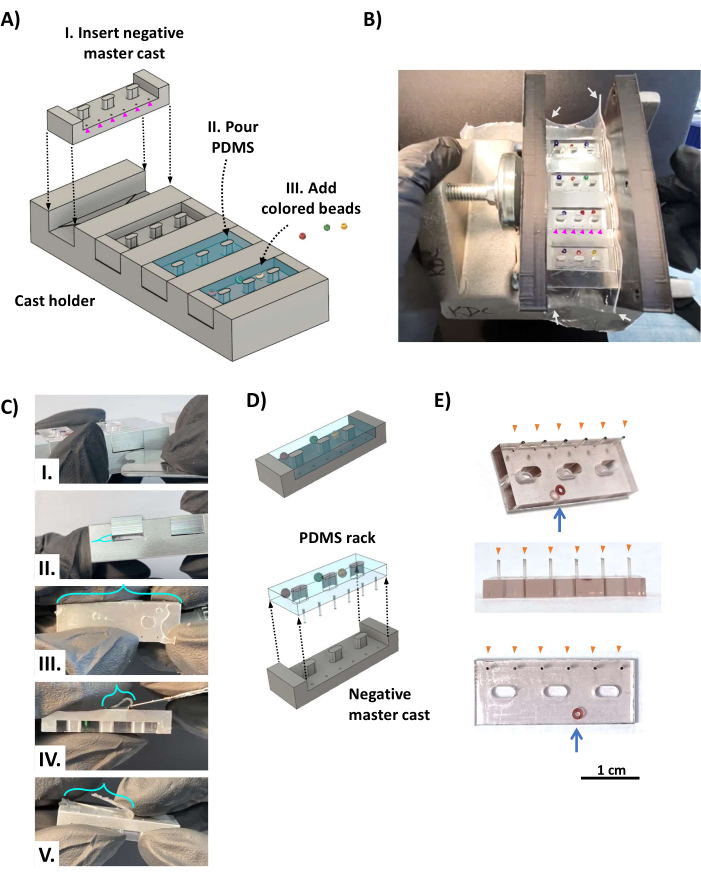
Figura 2: Fabbricazione dei rack PDMS. (A) I rendering CAD mostrano una vista obliqua dell'apparato di colata. (I) Un master cast negativo del rack PDMS viene inserito in ciascuna delle quattro fessure del supporto del cast con i fori che formano i montanti PDMS (punte di freccia magenta) posizionati sopra lo spazio morto opposto al ripiano triangolare (Figura 1D, triangolo arancione). (II) Il PDMS viene versato in ogni cavità del cast master negativo. (III) Le perline colorate vengono aggiunte al PDMS non polimerizzato come sistema di identificazione con codice colore. (B) Foto che mostra l'apparato di fusione a cremagliera PDMS assemblato, che è bloccato su entrambi i lati con due staffe stampate in 3D tenute in posizione da un morsetto a vite e avvolto con fogli di silicone di 0,5 mm di spessore (frecce bianche) per sigillare i lati bloccati. Le perline colorate sono posizionate in modo che non coprano i fori di 0,5 mm di diametro che formano i pali (punte di freccia magenta). (C) Una volta che il PDMS è indurito, il gesso viene rimosso dal supporto del gesso. (I) Una lama di rasoio smussata in acciaio inossidabile o un simile strumento metallico sottile viene inserito tra il gesso e il supporto del gesso per fare leva sul getto dal supporto del gesso (II). (III) La pellicola (staffe turchesi) formata dal PDMS che scorre attraverso i fori dei pali è attaccata alle punte dei pali e deve essere tagliata via utilizzando una lama affilata (IV,V). (D) Il rack PDMS è separato dal getto. (E) Foto che mostrano le viste oblique (in alto), laterale (al centro) e in basso (in basso) del rack PDMS con una perla di vetro incorporata nel corpo per l'identificazione (freccia blu). Le punte dei pali (punte di freccia arancioni) sono state contrassegnate con inchiostro nero. Barra della scala = 1 cm. Questa cifra è stata modificata da van Neste27. Abbreviazioni: CAD = progettazione assistita da computer; PDMS = polidimetilsilossano. Fare clic qui per visualizzare una versione più grande di questa figura.
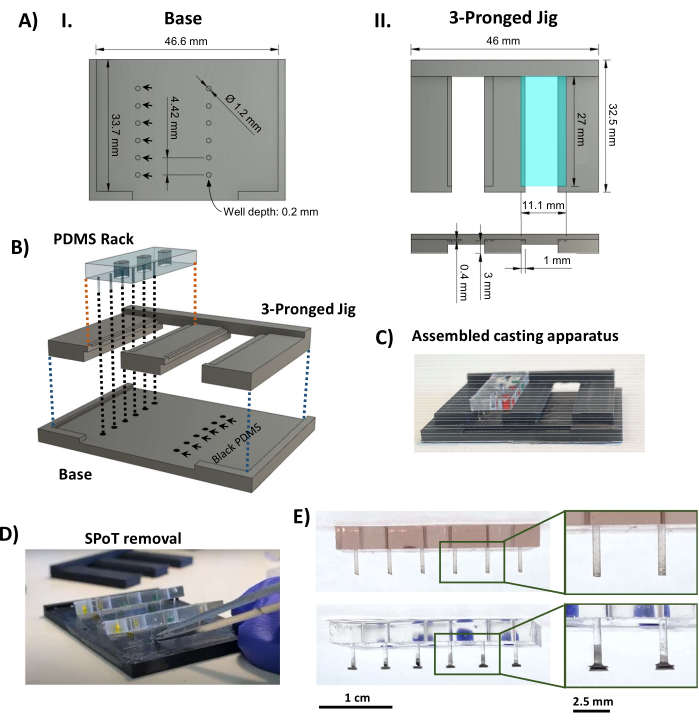
Figura 3: Fabbricazione di SPoT. (A) Rendering CAD che indicano le dimensioni chiave della base (I) e del pezzo a tre punte della maschera di colata SPoT. Le dimensioni dei moduli SPoT circolari (AI, frecce nere) sono impostate come 0,2 mm di profondità x 1,2 mm di diametro e ciascuno contiene il PDMS nero per un singolo SPoT. Il ripiano da 11,1 mm x 27 mm visibile nella vista dall'alto (AII, in alto, rettangolo turchese) è premuto di 0,4 mm (come mostrato nella vista laterale sotto) per mantenere il rack PDMS in posizione durante la polimerizzazione. (B) Rendering CAD che mostra l'assemblaggio dell'apparato di colata SPoT. (C) Una foto dell'apparecchio di fusione SPoT assemblato. (D) Dopo che il PDMS si è indurito, la maschera a tre punte viene fatta scorrere fuori da sotto i rack PDMS e gli SPoT vengono liberati dai loro pozzetti utilizzando una pinza fine. (E) Foto del rack PDMS senza (in alto) e con (in basso) SPoT. I riquadri mostrano viste ingrandite dei post. Barre di scala = 1 cm (E), 2,5 cm (immagini ingrandite in E). Questa cifra è stata modificata da van Neste27. Abbreviazioni: CAD = progettazione assistita da computer; Ø = diametro; PDMS = polidimetilsilossano; R = raggio; SPoT = tracciatore di post stabile. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Colture cellulari
- Coltivare le iPSC
NOTA: Linee cellulari diverse possono richiedere aggiustamenti della diluizione e della frequenza di passaggio e/o la titolazione degli additivi del mezzo.- Rivestire una piastra a 6 pozzetti trattata con colture cellulari con matrice di membrana basale qualificata (diluita in 1:1 Dulbecco's Modified Eagle Medium:Ham's F12 Nutrient Solution [DMEM/F12] secondo le istruzioni del produttore) e incubare la piastra a 37 °C per almeno 30 minuti. Preparare 500 mL di terreno di coltura iPSC secondo le istruzioni del produttore e aggiungere 5 mL di soluzione madre di penicillina-streptomicina (da 10.000 UI/mL a 10.000 μg/mL).
- Per far passare le iPSC, aspirare il terreno dai pozzetti e lavare ogni pozzetto una volta con 1 mL di soluzione fisiologica tamponata con fosfato (PBS). Aggiungere 1 mL di soluzione di dissociazione iPSC per pozzetto e incubare in una cappa a flusso laminare per 1 minuto.
- Aspirare la soluzione di dissociazione delle iPSC e incubare le cellule a 37 °C (senza alcun mezzo) per 5 minuti. Aggiungere 1 mL di tiazovivina 2 μM in mezzo iPSC per neutralizzare la soluzione di dissociazione iPSC.
- Utilizzare una pipetta sierologica da 2 mL per dissociare le colonie in grumi di circa 10 cellule e lavare ogni pozzetto con un ulteriore 1 mL di tiazovivina da 2 μM in terreno iPSC. Aggiungere 2 mL di sospensione cellulare a ciascun pozzetto della piastra appena rivestita con matrice di membrana basale (passaggio 2.1.1).
- Dopo 24 ore, rimuovere il terreno e aggiungere il terreno iPSC fresco (senza tiazovivacina). Somministrare le iPSC ogni 48 ore con 2 mL di terreno iPSC o ogni 72 ore con 4 mL di terreno. Riplaccare le cellule a una diluizione 1:6 per il passaggio ogni 3 giorni o quando raggiungono l'80% di confluenza.
NOTA: Diverse linee cellulari possono richiedere la regolazione della diluizione e della frequenza di passaggio.
- Differenziazione dei cardiomiociti
- Iniziare la differenziazione quando i monostrati di iPSC sono confluenti all'80%-90%.
- Preparare il terreno di differenziazione aggiungendo 10 mL di integratore di vitamina B27 senza insulina e 5 mL di soluzione madre di penicillina-streptomicina a 500 mL di terreno di trattamento Roswell Park Memorial Institute 1640 (RPMI). Preparare il terreno di mantenimento dei cardiomiociti aggiungendo 10 mL di integratore di vitamina B27 e 5 mL di soluzione madre di penicillina-streptomicina a 500 mL di RPMI 1640.
NOTA: Il terreno di differenziazione e il terreno di mantenimento dei cardiomiociti possono essere conservati a 4 °C per un massimo di 2 settimane. - Giorno 0: lavare le cellule con 1 mL di DMEM/F12 e aggiungere 2 mL di CHIR99021 da 10 μM e matrice di membrana basale diluita nel terreno di differenziazione.
- Giorno 1: Dopo 24 ore, o quando la confluenza cellulare si è ridotta al di sotto del 70%, lavare le cellule con 1 mL di DMEM/F12, aggiungere 2 mL di terreno di differenziazione e incubare per 48 ore.
- Giorni 3-4: Lavare le cellule con 1 mL di DMEM/F12 e aggiungere 2 mL di 5 μM IWR-1 nel terreno di differenziazione. Ripeti il giorno 4.
- Giorni 5-6: Lavare le cellule con 1 mL di DMEM/F12 e aggiungere 2 mL di terreno di differenziazione. Ripetere l'operazione il giorno 6.
- Giorni 7-10: Lavare le cellule con 1 mL di DMEM/F12 e aggiungere 2 mL di terreno di mantenimento per cardiomiociti. Ripetere ogni 24 ore.
- Giorni 11+: Sostituire il terreno con 4 mL di terreno di mantenimento fresco per cardiomiociti ogni 48-72 ore. Aspirare e pipettare lentamente per evitare di danneggiare i monostrati che battono vigorosamente.
3. coltura hECT
- Prelievo dei cardiomiociti
- Prelevare i monostrati di cardiomiociti per l'uso nella fabbricazione di hECT 8-60 giorni dopo l'induzione differenziale. Aspettatevi 2-5 milioni di cellule per pozzetto.
NOTA: Se le cellule non hanno iniziato a battere entro il giorno 10, è improbabile che la differenziazione abbia successo. I monostrati che battono vigorosamente spesso si staccano dopo 11-15 giorni dalla differenziazione e si compattano in tessuti densi. Si consiglia di utilizzare o riplaccare tali celle in questo momento. - Sciacquare ogni pozzetto di cardiomiociti 2 volte con 2 mL di PBS. Aggiungere 1 mL di tripsina-EDTA allo 0,25% a temperatura ambiente. Incubare a 37 °C per 5-10 minuti fino a quando le cellule appaiono arrotondate e si staccano picchiettando leggermente la piastra.
- Aggiungere 1 mL di FBS al 10% nel terreno di mantenimento dei cardiomiociti a ciascun pozzetto per neutralizzare la dissociazione. Pipettare delicatamente i monostrati utilizzando un puntale per pipette sierologiche da 5 mL e trasferirli in una provetta conica da 50 mL per rompere il pellet in grumi di 10-20 cellule.
- Miscelare la sospensione cellulare capovolgendo il tubo conico prima di trasferire 10 μL di cellule in 10 μL di blu di tripano. Conta le cellule utilizzando un contatore di cellule automatizzato o un emocitometro di vetro. Separare la sospensione cellulare in modo appropriato se non verranno utilizzate tutte le cellule o se alcune cellule sono riservate alla citometria a flusso.
NOTA: A questo punto possono essere aggiunte cellule supplementari (come i fibroblasti). - Centrifugare le cellule a 250 × g per 5 min. Aspirare immediatamente quanto più surnatante possibile senza disturbare il pellet cellulare e mantenere il ghiaccio. Lavorare rapidamente per ridurre al minimo il tempo che le cellule trascorrono nel pellet.
- Prelevare i monostrati di cardiomiociti per l'uso nella fabbricazione di hECT 8-60 giorni dopo l'induzione differenziale. Aspettatevi 2-5 milioni di cellule per pozzetto.
- fabbricazione di hECT
- Utilizzare i volumi nella Tabella 2 e regolare in base al numero di cellule nel pellet in modo che ogni hECT contenga 1 milione di cellule. Dopo ogni passaggio, mescolare pipettando lentamente per evitare la formazione di bolle.
NOTA: Eseguire i passaggi 3.2.2-3.2.3 schermati dalla luce diretta poiché alcuni componenti sono sensibili alla luce. - Preparare una soluzione di collagene di tipo 1 da 2,9 g/mL in una microprovetta da 1,7 mL aggiungendo 13,442 μL di acqua distillata, 4,4 μL di PBS 10x e 0,638 μL di NaOH 1M. Aggiungere 25,52 μL di soluzione madre di collagene 5 mg/mL e mescolare lentamente.
- Preparare la miscela di matrice extracellulare (miscela ECM dalla Tabella 2): aggiungere 5,5 μL di soluzione HEPES 0,2 N pH 9 seguiti da 5,5 μL di MEM 10x. Mescolare accuratamente fino a quando non si osserva un colore uniforme dal giallo chiaro al rosa chiaro. Trasferire 35,2 μL della soluzione di miscela ECM al pellet cellulare e aggiungere 4,4 μL di matrice di membrana basale.
- Aprire il sacchetto autoclavato con le parti del bioreattore (passaggio 1.4.7, Figura 4A). Indossando guanti sterilizzati con etanolo al 70%, rimuovere la piastra di base nera dal sacchetto dell'autoclave e riporla in un piatto da 60 mm con i pozzetti rivolti verso l'alto. Pipettare lentamente 44 μL della miscela cellulare in ciascun pozzetto per evitare l'introduzione di bolle. Se necessario, utilizzare la pipetta per rimuovere eventuali bolle che sono state introdotte dal pipettaggio o che si sono formate a causa dell'idrofobicità del PTFE. Ripristinare il volume dell'hECT in modo che la superficie del liquido sia a filo con il bordo del pozzetto (Figura 4BI).
- Indossa un nuovo paio di guanti sterilizzati e rimuovi il telaio in polisulfone con i rack PDMS dalla borsa dell'autoclave. Abbassare il telaio sulla piastra di base in modo che le estremità del telaio si inseriscano nelle scanalature alle estremità della piastra di base (Figura 4BII, III). Ispezionare il bioreattore per assicurarsi che i montanti siano tutti dritti e che il telaio non sia inclinato prima di posizionarlo in una parabola da 60 mm.
- Aggiungere 1 mL di FBS al 10% nel terreno di mantenimento dei cardiomiociti nella capsula da 60 mm (fare attenzione a non disturbare gli hECT) per aumentare l'umidità nella capsula man mano che gli hECT si solidificano. Posizionare la capsula da 60 mm senza coperchio in una capsula da 100 mm ad alto profilo (20 mm di altezza), coprire con un coperchio da 100 mm e riportare il bioreattore nell'incubatore a 37 °C, 5% di CO2 per consentire al collagene di formare un gel con le cellule in sospensione.
- Dopo 2 ore, rimuovere il piatto dall'incubatrice. Aggiungere 13 mL di FBS al 10% nel terreno di mantenimento dei cardiomiociti, inclinando la piastra per incoraggiare il fluido a fluire tra la piastra di base in PTFE e i rack PDMS.
- Ispezionare il bioreattore lateralmente per assicurarsi che non vi siano bolle d'aria intrappolate tra le superfici idrofobiche della piastra di base in PTFE e i rack PDMS e rimettere la piastra nell'incubatrice. Se c'è aria intrappolata, inclinare il bioreattore fuori dal mezzo per far rompere la bolla e abbassarlo di nuovo lentamente, oppure utilizzare una micropipetta con una punta di caricamento del gel per aspirare l'aria, facendo attenzione a non disturbare i post.
- Utilizzare i volumi nella Tabella 2 e regolare in base al numero di cellule nel pellet in modo che ogni hECT contenga 1 milione di cellule. Dopo ogni passaggio, mescolare pipettando lentamente per evitare la formazione di bolle.
- Rimozione della piastra di base
- Ispezionare la compattazione hECT attraverso la fessura del telaio. Nel corso di 24-96 ore, gli hECT si compattano e diventano più opachi (Figura 4CI-III). Una volta che c'è uno spazio visibile tra gli hECT e la parete della piastra di base (Figura 4CII), eseguire due cambi di mezzo volume per cambiare il terreno in terreno di mantenimento cardiomiocitario senza FBS. Rimuovere la piastra di base quando gli hECT sono compattati di almeno il 30% rispetto al diametro originale (Figura 4CIII). Riempire la capsula da 60 mm contenente il bioreattore con terreno di mantenimento per cardiomiociti fino a quando il liquido non è a filo con il bordo della capsula e aggiungere 14 ml in una nuova capsula da 60 mm.
- FASE CRITICA: Indossando guanti sterili, capovolgere il bioreattore nella sua capsula in modo che la piastra di base sia in alto (Figura 4BIV). Verificare la presenza di bolle d'aria intrappolate come al punto 3.2.8. Sollevare lentamente la piastra di base, mantenendola in piano (Figura 4BV).
- Se un hECT cade durante la rimozione della piastra di base ma rimane nella piastra di base, utilizzare una pinza fine curva sterile per trasferire l'hECT dalla piastra di base alla piastra da 60 mm. Utilizzare la pinza per guidare l'estremità dell'hECT al suo palo. Usa un secondo paio di pinze per tenere fermo il perno e infilalo attraverso il foro nell'hECT. Ripetere l'operazione per il secondo post, se necessario.
- Con tutti gli hECT attaccati ai montanti, trasferire il telaio con gli hECT sulla nuova parabola da 60 mm e posizionare il telaio con i montanti rivolti verso il basso (Figura 4BVI). Ispezionare il bioreattore per assicurarsi che gli hECT rimangano sui loro posti appena prossimali agli SPoT.
- Se un hECT è stato spinto dalla tensione superficiale alla base dei suoi montanti, stabilizzare il telaio con un paio di pinze sterili curve. Inserire l'altro paio di pinze attraverso la fessura nel telaio, tenendolo chiuso. Una volta che la punta della pinza è stata abbassata oltre i rack PDMS, ruotarla in modo che raggiunga il perno e utilizzare le punte chiuse per spingere delicatamente l'heFct verso l'estremità del perno finché non poggia sull'SPoT (Figura 4BVI, riquadro).
- Manutenzione hECT
- Eseguire cambi di mezzo volume con terreno di mantenimento cardiomiocitario ogni 24-48 ore (dopo 2 settimane di coltura, la frequenza può essere ridotta a due volte a settimana).
- Quando gli hECT mostrano cluster di battito spontaneo, in genere entro il giorno 3, e battito coordinato con deflessione post visibile entro il giorno 5, iniziare le misurazioni funzionali e ripetere tutte le volte che lo si desidera.
NOTA: è improbabile che gli hECT che non hanno iniziato a battere in modo coordinato entro il giorno 7 lo facciano affatto.
| Componente | Volume (μL) | |||||||
| distillato H2O | 13.442 | 2,9 mg/mL di soluzione di collagene | "Miscela ECM" | miscela finale di cellule hECT | ||||
| NaOH 1N | 0.638 | |||||||
| PBS 10x | 4.4 | |||||||
| 5 mg/mL di brodo di collagene | 25.52 | |||||||
| 0,2 N pH 9 HEPES | 5.5 | |||||||
| 10x MEM | 5.5 | |||||||
| Volume di miscela ECM da trasferire al pellet cellulare | 35.2 | |||||||
| Volume di Matrigel | 4.4 | |||||||
Tabella 2: reagenti hECT. I componenti devono essere aggiunti nell'ordine elencato e tenuti in ghiaccio.
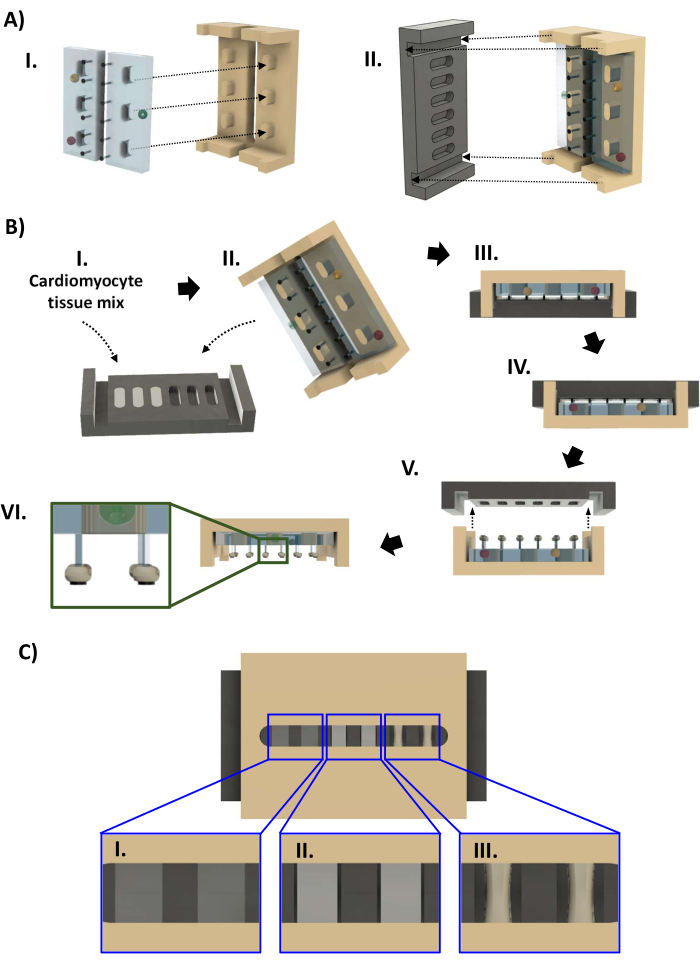
Figura 4: Assemblaggio del bioreattore e fabbricazione dell'hECT. (A) (I) Due rack PDMS (a sinistra, azzurro) montati sul telaio in polisulfone (a destra, marrone chiaro). (II) La piastra di base in PTFE (nera, a sinistra) si adatta quindi al telaio (a destra) in modo che ogni coppia di montanti si inserisca in un pozzetto della piastra di base. (B) (I) Quarantaquattro microlitri di sospensione di cardiomiociti in matrice extracellulare a base di collagene vengono aggiunti a ciascuno dei sei pozzetti della piastra di base. (II,III) Il telaio con rack PDMS viene inserito a pressione sulla piastra di base. Dopo 1-4 giorni, gli hECT possono essere rimossi dalla piastra di base. (IV) Innanzitutto, il bioreattore viene capovolto prima che (V) la piastra di base venga sollevata dal telaio. (VI) Vista laterale del bioreattore con sei hECT. Riquadro: vista ingrandita che mostra la posizione hECT sui pali rispetto agli SPoT (riquadro). (C) Rendering CAD che mostra tre livelli di compattazione hECT ([I] bassa, [II] media e [III] alta) vista attraverso la fessura nel telaio in polisulfone. Questa cifra è stata modificata da van Neste27. Abbreviazioni: CAD = progettazione assistita da computer; PDMS = polidimetilsilossano; PTFE = politetrafluoroetilene; SPoT = inseguitore di post stabile; hECT = tessuto cardiaco ingegnerizzato dall'uomo. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Apparecchiature per la stimolazione hECT
- Giacca per il palco riscaldato
- Utilizzare una macchina per il taglio laser per tagliare i componenti del rivestimento isolante acrilico da un foglio acrilico trasparente di 0,635 cm di spessore (File supplementare 3), uno ciascuno della Figura 5A-D e due ciascuno della Figura 5E, F.
- Assemblare le parti (B), (C), (D) e una delle (E) della Figura 5 e incollarle insieme utilizzando la colla acrilica come mostrato nella Figura 5GI. Fissate il pannello superiore (Figura 5GII), lasciate che la colla si solidifichi per diverse ore, quindi fate scorrere il tavolino riscaldato sul lato della giacca (Figura 5GIII).
- Una volta posizionata la giacca, utilizzare del nastro adesivo per fissare gli inserti tra le gambe del tavolino riscaldato e aggiungere il pannello frontale (Figura 5GIV) per completare l'assemblaggio (Figura 5GV).
- Fabbricazione di elettrodi in grafite
- Tagliare barre di grafite di 6,25 mm di spessore e 25 mm di larghezza con una sega a nastro in blocchi lunghi 35 mm; Quindi, tagliare ogni blocco nel senso della lunghezza in una linea curva in modo che ogni elettrodo sia alto 13-16 mm a un'estremità e 8-10 mm all'altra estremità. Praticate due fori di 0,7 mm di diametro nell'angolo superiore (Figura 6AI). Lucidare i pezzi con carta assorbente e sonicare in acqua per 20 minuti per rimuovere la polvere di grafite. Assicurarsi che gli elettrodi si incuneino tra le pareti della parabola e il bioreattore largo 25 mm per garantire una distanza costante tra gli elettrodi (Figura 6AII).
- Infilare un filo di acciaio lungo 150 mm x 0,25 mm di diametro attraverso i fori degli elettrodi e piegarlo per adattarlo al bordo del piatto da 60 mm e alle pareti del piatto da 100 mm in modo che il coperchio possa essere chiuso (Figura 6AII).
- Pulire gli elettrodi immergendoli in acqua distillata per 1-2 ore dopo ogni utilizzo per rimuovere il mezzo assorbito, lasciare asciugare per una notte, quindi sterilizzare in autoclave a 132 °C per 30 minuti. Prima di iniziare le misurazioni, posizionare un elettrodo su entrambi i lati del bioreattore (Figura 6AII). Posizionare i fili in modo che il coperchio della parabola da 100 mm possa essere chiuso e riportare il bioreattore nell'incubatore per l'equilibrio.
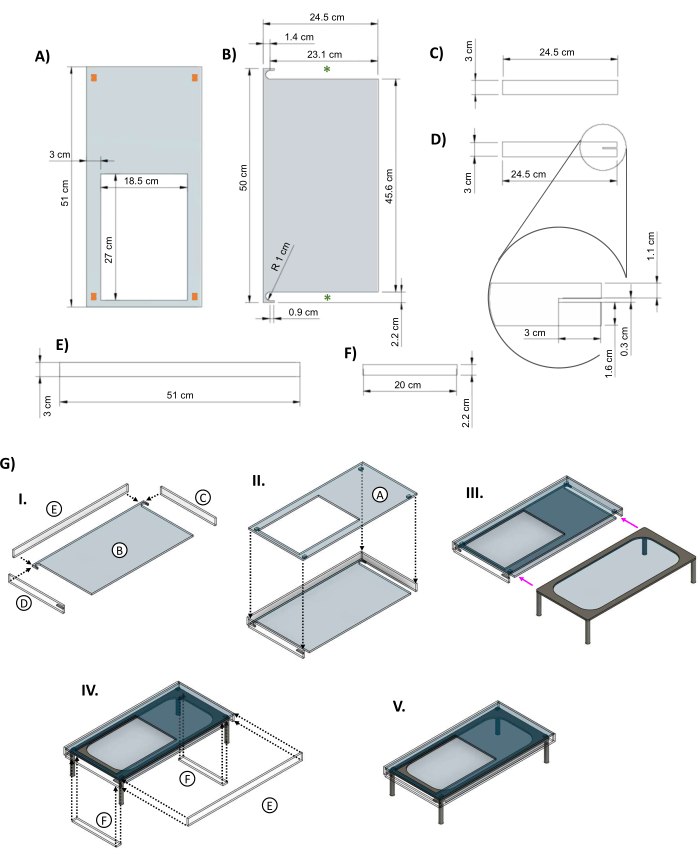
Figura 5: Rivestimento acrilico per l'isolamento del tavolino in vetro riscaldato. Immagini CAD che mostrano le dimensioni chiave dei pezzi della guaina acrilica progettata per il tavolo in vetro. (A) Il pannello superiore ha un foro di 27 cm x 18.5 cm per consentire al piatto del bioreattore di appoggiarsi sull'elemento riscaldante. I rettangoli arancioni negli angoli indicano il posizionamento suggerito di piccoli pezzi distanziatori per fornire spazio tra la parte superiore della giacca e l'elemento riscaldante. (B) La parte inferiore della giacca ha due ritagli per consentire alle gambe del tavolino riscaldato di scivolare all'interno (asterischi verdi). (C&D) Due pannelli laterali si inseriscono sotto la parte superiore. (D) Il pannello laterale sinistro include un'apertura di 3 cm x 0,3 cm (inserto) per il cavo di alimentazione del palco. (E) I pannelli lunghi si adattano alla parte anteriore e posteriore. (F) Gli inserti vengono aggiunti per riempire gli spazi vuoti una volta che il tavolo è all'interno. (G) (I) I pannelli laterali e posteriori sono fissati al pezzo inferiore, quindi (II) viene aggiunto il pannello superiore. (III) Il tavolo di vetro viene fatto scorrere nella giacca (frecce magenta). (IV) Gli inserti sono fissati tra le gambe del tavolo e lo schienale si adatta all'apertura per chiudere la scatola. (V) L'assemblaggio completo del rivestimento. Questa cifra è stata modificata da van Neste27. Abbreviazioni: CAD = progettazione assistita da computer; R = raggio; Ø = diametro. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Acquisizione dei dati di contrazione dell'hECT. (A) (I) Foto degli elettrodi tagliati da barre di grafite. Le frecce magenta indicano i fori per il fissaggio dei fili di acciaio inossidabile. Barra della scala = 1 cm. (II) Vista obliqua (sinistra) e vista dall'alto (destra) che mostra il posizionamento degli elettrodi di grafite nel bioreattore. Gli elettrodi occupano lo spazio tra il bioreattore largo 25 mm e la parete della parabola per garantire una distanza costante tra gli elettrodi. I fili sono piegati per consentire la chiusura del coperchio del piatto. (B) Foto della configurazione della stimolazione hECT all'interno del banco pulito a flusso laminare: tutte le apparecchiature sono posizionate sul tavolo di isolamento dalle vibrazioni per ridurre il rumore delle vibrazioni dal banco pulito. Il bioreattore (punta di freccia magenta) si trova sul palco riscaldato incamiciato, illuminato da una sorgente luminosa a LED dall'alto. Il microscopio da dissezione è puntato orizzontalmente su uno specchio ad angolo retto (asterisco arancione) per osservare il bioreattore dal basso ed è dotato di una telecamera CCD (a sinistra). La staffa turchese indica un bagno d'acqua per il monitoraggio continuo della temperatura per fornire un feedback al regolatore di livello riscaldato a circuito chiuso. Questa cifra è stata modificata da van Neste27. Abbreviazioni: hECT = tessuto cardiaco ingegnerizzato dall'uomo; LED = diodo a emissione luminosa. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Misure funzionali hECT
- Impostazione dell'area di lavoro di stimolazione
- Accendere il tavolino riscaldato a 39,5 °C e posizionare l'attrezzatura di stimolazione su un tavolo di isolamento dalle vibrazioni all'interno di un banco pulito a flusso laminare secondo la Figura 6B. Montare il microscopio da dissezione su un supporto a braccio e puntarlo verso uno specchio ad angolo retto (Figura 6B, asterisco arancione) situato su un martinetto da laboratorio sotto il tavolo di vetro per osservare il bioreattore dal basso. Fissare una telecamera CCD ad alta velocità al microscopio e collegarla al computer. Irradiare la configurazione con luce UV per 15 minuti per sterilizzare l'area di lavoro.
- Posizionare il bioreattore (Figura 6B, punta di freccia magenta) sul tavolino riscaldato incamiciato, illuminato dall'alto da una sorgente luminosa a LED a collo d'oca a doppia testa (i colli delle lampade a LED possono essere fissati in modo più sicuro all'unità principale rispetto alle lampade a fibre ottiche). Ridurre al minimo il rumore aggiuntivo assicurandosi che l'attrezzatura di stimolazione sul tavolo vibrante (e il tavolo stesso) non tocchi alcuna parte del banco pulito a flusso laminare.
- Aggiungere un secondo piatto da 60 mm riempito con acqua preriscaldata all'interno di un piatto da 100 mm sul tavolo riscaldato (Figura 6B, staffa turchese) e dotare di una sonda di temperatura per il monitoraggio continuo della temperatura. Regolare l'impostazione della temperatura del riscaldato stage secondo necessità per mantenere la temperatura del piatto di riferimento a 36-37 °C.
- Impostare l'ingrandimento del microscopio su 1,5x (o un altro ingrandimento desiderato con il quale un hECT può essere visualizzato nella sua interezza con una risoluzione adeguata).
- Regolazione delle impostazioni della fotocamera
- Aprire il software della fotocamera. Ridimensiona il feed video per ritagliare il più possibile il campo visivo pur visualizzando un intero hECT. In questo modo si massimizza la velocità della fotocamera.
- Impostare la velocità di acquisizione su 90 fotogrammi al secondo. Regola il tempo di esposizione e la posizione della sorgente luminosa per ottimizzare l'uniformità delle condizioni di illuminazione in tutto il campo visivo e massimizzare il contrasto degli SPoT.
- Configurazione del software di acquisizione
- Accendere lo stimolatore di impulsi quadrati e collegarlo al computer. Regolare le impostazioni per fornire impulsi bifasici con un'ampiezza di 12 V e una durata di 5 ms.
- Aprire il software di acquisizione dati, quindi aprire il file "AutomatedPostTracking3.vi" (File supplementare 4). Una volta caricato, fare clic sulla freccia bianca sul lato sinistro della barra degli strumenti per inizializzare il programma (Figura 7A).
- Calibrare il software utilizzando un emocitometro in vetro sul tavolino riscaldato. Nella barra degli strumenti (Figura 7B), fare clic sullo strumento linea per tracciare una linea attraverso 1 mm dei contrassegni dell'emocitometro (non mostrati). Nella casella Calibrazione distanza (pixel/mm) (Figura 7C), impostare la lunghezza di riferimento (mm) su 1, quindi fare clic sul pulsante Calcola .
- Misurare l'area della sezione trasversale hECT utilizzando lo strumento linea per tracciare una linea attraverso la larghezza del tessuto. Fare clic su 1 nella casella Area della sezione trasversale (mm^2) (Figura 7D) per calcolare l'area (assumendo una geometria cilindrica delle strisce di tessuto lineare, come stabilito in letteratura 1,2,3,4,5,6,7,8,9,10,11, 12,15,16,18,19,20,
21,22,23,24,25,26,37,38). Ripetere l'operazione lungo diverse parti dell'hECT e registrare i valori sotto gli altri due pulsanti della casella. Il file della tabella dei dati di output riporta la media di questi tre valori per calcolare il diametro del tessuto.
- caratterizzazione funzionale dell'hECT
- Assicurati che i suggerimenti per i post siano a fuoco. Accendere l'interruttore di soglia (Figura 7E) e regolare il dispositivo di scorrimento (Figura 7F) fino a quando gli SPoT (Figura 7G) non sono ben delimitati e non cambiano forma quando l'hECT si contrae.
- Utilizzare lo strumento rettangolo per disegnare un rettangolo attorno a uno degli SpoT (Figura 7, rettangolo verde) e fare clic sul pulsante Imposta 1 all'interno della casella Segna contorni (Figura 7H) per impostare la posizione del rettangolo attorno allo SPoT, assicurandosi che l'SPoT rimanga sempre all'interno del contorno del rettangolo. Ripeti per l'altro post e registralo nel Set 2.
- Regolare le impostazioni delle dimensioni dell'oggetto (Figura 7I) per evitare che il programma segua oggetti più piccoli. Assicurarsi che il numero di oggetti tracciati in ogni rettangolo rimanga costante. L'interfaccia (Figura 7J) mostra la distanza misurata tra gli oggetti tracciati in tempo reale. Utilizzare questo grafico per monitorare il rumore.
- Selezionare una directory in cui salvare i file (Figura 7K). Archivia i dati di giorni diversi in cartelle separate. Selezionare il numero di tessuto corrente e scrivere i commenti desiderati nella casella Commenti .
- Sotto l'intestazione Frequenza di stimolazione (Hz) (Figura 7L), indicare l'intervallo di frequenze desiderate (Min e Max) e l'intervallo desiderato per passare da Min a Max. Se si stimolano gli hECT lungo l'intero intervallo di acquisizione, testare diverse frequenze di stimolazione per trovare la frequenza più bassa alla quale viene raggiunto un rapporto stimolo:picco 1:1 e continuare ad aumentare la frequenza fino a quando tale rapporto non viene perso. Misurare la funzione spontanea scegliendo un intervallo di frequenza arbitrario (ad esempio, da 0,01 Hz a 0,01 Hz) e mantenendo disattivata l'uscita dello stimolatore a impulsi quadrati.
- Nelle caselle a destra, scegliere il tempo di impostazione desiderato (s) (un intervallo di tempo dopo che la frequenza è stata impostata ma i dati non vengono registrati) per consentire all'hECT di adattarsi alla nuova frequenza di stimolazione. Specificare il tempo di registrazione (s) e la tensione di stimolazione (V). Avviare il programma facendo clic sul pulsante Avvia programma (Figura 7M).
NOTA: I risultati vengono salvati automaticamente nella directory selezionata. Dopo ogni registrazione, si osservi che lo script visualizza la trasformata di Fourier dei dati (Figura 7N), dove i picchi corrispondono alla frequenza di battimento rilevata. - Se lo si desidera, eseguire il programma "Excitation Threshold Finding" per trovare la tensione minima richiesta per stimolare l'hECT in vista (Figura 7O). Se lo si desidera, calcolare le deflessioni massime e minime dei montanti (Figura 7P).
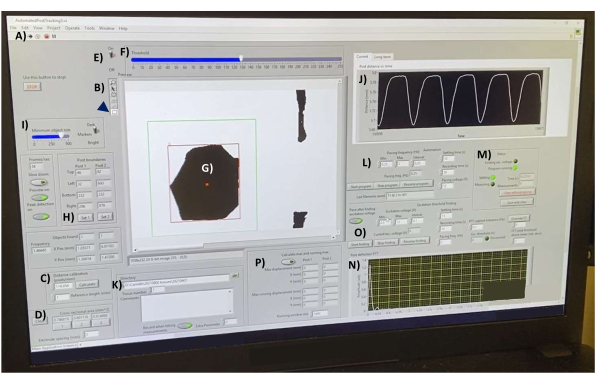
Figura 7: Interfaccia di acquisizione dati post-deflessione. (A) Pulsante per l'esecuzione del software. (B) Barra degli strumenti contenente gli strumenti linea e rettangolo rispettivamente per le misurazioni della lunghezza e la selezione degli oggetti. (C) Controlli di calibrazione della distanza. (D) Strumenti per misurare l'area della sezione trasversale hECT in tre punti diversi. (E) Interruttore di soglia e cursore (F) per convertire il feed video in immagini ad alto contrasto in tempo reale. (G) Un SPoT visibile nella finestra di anteprima. (H) Strumenti per la selezione degli SPoT. (I) Cursore per filtrare gli oggetti in base alle dimensioni. (J) Grafico che mostra la distanza misurata tra gli oggetti tracciati in tempo reale. (K) Opzioni per selezionare la directory in cui salvare i file di output. (L) Opzioni per l'impostazione dell'intervallo di frequenza, dell'intervallo di frequenza, del tempo di registrazione e dell'impostazione del tempo tra le registrazioni per il programma di post tracking (M). (N) Output grafico della trasformazione di Fourier della curva di deflessione dell'ultima registrazione salvata. (O) Programma per trovare la tensione minima richiesta per stimolare gli hECT. (P) Programma per calcolare le deflessioni massime e minime dei pali. Abbreviazioni: hECT = tessuto cardiaco ingegnerizzato dall'uomo; SPoT = tracciatore di post stabile. Fare clic qui per visualizzare una versione più grande di questa figura.
6. Misurazioni del rack PDMS
- Distanze a vuoto
- Prima della fabbricazione hECT, montare la coppia desiderata di rack PDMS su un telaio. Utilizzare l'impostazione del ritmo e il software descritti al punto 5.1 per le misurazioni funzionali. Selezionare gli SPoT fissi alle estremità dei montanti.
- Se necessario, regolare la sorgente luminosa e/o la soglia per ridurre il rumore a <2 μm. Registrare il valore y medio in tempo reale indicato nel grafico in un foglio di calcolo.
- Altezze dei pali e altezze hECT
- Dalla configurazione di stimolazione descritta al punto 5.2, rimuovere lo specchio angolato e il tavolino riscaldato. Posizionare il bioreattore direttamente sul martinetto da laboratorio per una vista laterale del bioreattore.
- Aprire il software della fotocamera. Regola il tempo di esposizione e la posizione della sorgente luminosa per ottimizzare l'uniformità delle condizioni di illuminazione in tutto il campo visivo e massimizzare la visibilità dei pali.
- Aprire il software di acquisizione dati, quindi aprire il file "PostMeasurement_PB3.vi" (File supplementare 5). Una volta caricato, fai clic sulla freccia bianca sul lato sinistro della barra degli strumenti per inizializzare il programma.
- Calibrare il software utilizzando un emocitometro in vetro. Fare clic sullo strumento linea nella barra degli strumenti verticale a sinistra della finestra di visualizzazione e tracciare una linea su 1 mm dei contrassegni dell'emocitometro. Nella casella Calibrazione distanza (pixel/mm) in basso a sinistra dello schermo, impostare la lunghezza di riferimento (mm) su 1, quindi fare clic sul pulsante Calcola .
- Sotto i campi di calibrazione, impostare il numero di tessuto desiderato (per l'identificazione) nel campo Numero di tessuto . Mettere a fuoco la fotocamera sul montante sinistro dell'hECT e selezionare Sinistra nella casella Lato palo .
- Usa lo strumento linea per disegnare una linea dalla base del palo (in alto) alla punta degli SPoT (in basso) e registra facendo clic su Misura post Ht.
- Tracciare una linea dalla base del perno al bordo più lontano dell'hECT e registrare facendo clic su Misura tessuto superiore Ht. Tracciare una linea dalla base del perno al bordo vicino dell'hECT e registrare facendo clic su Misura base tissutale Ht.
- A questo punto, ruotare il bioreattore per misurare la giusta altezza del palo. Seleziona l'opzione del post giusto per registrare le stesse misurazioni. Fare clic sul pulsante Aggiungi per compilare il foglio di calcolo con i valori misurati e calcolare automaticamente l'altezza media dell'hECT, che verrà utilizzata nel passaggio 7.
- Una volta terminata la registrazione delle altezze dei tessuti, fare clic sul pulsante Salva per salvare i valori in un file di testo.
7. Elaborazione funzionale dei dati mediante script di analisi personalizzati
- In un editor di fogli di calcolo, compila il file di riepilogo utilizzando il modello (File supplementare 6). Utilizzare i valori di lunghezza del perno e altezza media del tessuto acquisiti nei passaggi 6.2. Assicurarsi che tutti gli hECT che contengono dati nella cartella siano rappresentati nel file di riepilogo. Assegnare al file il nome "#.csv riepilogo", dove # si riferisce al numero di giorni dell'esperimento.
NOTA: I dati funzionali hECT devono essere in cartelle separate in base al giorno dell'esperimento. - Assicurarsi che la cartella contenente gli script AnalyzeLogsGUI (file supplementare 7) e la cartella con le registrazioni hECT siano entrambe aggiunte al percorso.
- Aprire il software di analisi dei dati. A sinistra della barra delle directory, fare clic sul pulsante Cerca cartella per passare alla cartella principale che contiene sia la cartella AnalyzeLogsGUI che i dati funzionali hECT. Nella barra laterale Finestra corrente , fai clic con il pulsante destro del mouse su queste cartelle per Aggiungi al percorso | Aggiungi cartelle e sottocartelle selezionate.
- Aprire il file "AnalyzeLogsGui_SC.m". Nella scheda Editor, premere il pulsante Esegui e attendere che l'interfaccia utente grafica (GUI) appaia in una nuova finestra.
- Nella casella Selezione registro (Log Selection ) (Figura 8AI), fare clic sul pulsante Seleziona directory e passare alla cartella che include i dati funzionali hECT. Selezionare l'hECT desiderato da elaborare dal menu a discesa Tessuto .
- Nella casella Input dati (Input dati) (Figura 8AII), inserire la distanza a vuoto tra i pali registrati dal punto 6.1 nel campo Distanza diastolica. Immettere 0,25 nel campo Raggio post (mm).
- Nella casella Vincoli di analisi (Figura 8AIII), scegliere le frequenze da omettere dall'analisi oppure selezionare frequenze specifiche da includere (separate da virgole). L'ora di inizio e l'ora di fine sono impostate rispettivamente su 0 e −1, per impostazione predefinita, per elaborare l'intera durata delle registrazioni. Modificare questi valori per tagliare le registrazioni, se necessario.
- Modificare i parametri del filtro (Figura 8AIV) di Ordine polinomiale e Dimensione fotogramma per modificare il livello di arrotondamento durante il processo di filtraggio e il dispositivo di scorrimento Soglia di rilevamento picco per impostare la dimensione minima del picco che verrà riconosciuta dagli script.
NOTA: lo script contiene l'opzione Rimozione punte, che ritaglia i picchi alti causati da artefatti; Tuttavia, questo non è raccomandato in quanto cambia la forma delle contrazioni. Rimuovere gli artefatti tagliando invece la registrazione (Figura 8AIII). - Utilizzare opzioni aggiuntive (Figura 8AV) per un ulteriore output dell'analisi dei dati: analisi post-deflessione per eseguire un algoritmo di rilevamento dei picchi aggiuntivo, ridimensionamento automatico dell'asse y sui grafici di zoom per regolare automaticamente gli assi sulla curva di forza di contrazione (Figura 8B), salvataggio delle curve di traccia della forza per salvare ogni valore di forza di contrazione in un file .fig e salvataggio dei dati del tempo di forza per salvare le coordinate x e y dei dati filtrati tracciati nella figura della curva di forza di contrazione.
- Fare clic su Esegui analisi per generare un file .txt contenente gli attributi della curva di forza di contrazione (file supplementare 8) mediati su un'intera registrazione.
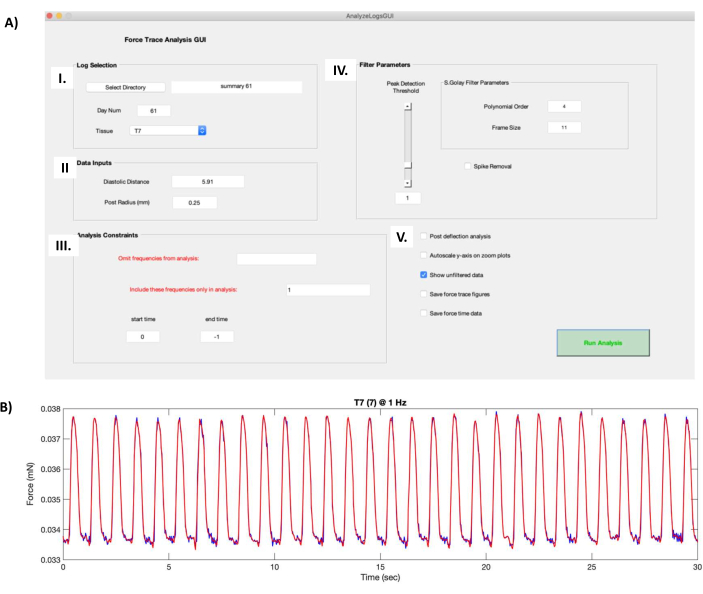
Figura 8: Calcoli della curva di forza di Twitch. (A) Eseguendo il file "AnalyzeLogsGUI.m" nel software di elaborazione dati si apre la finestra della GUI. (I) La casella Selezione registro consente all'utente di selezionare la directory per la cartella contenente i dati funzionali hECT. Il campo Num giorno viene compilato automaticamente a partire dal titolo del file di riepilogo creato nel passaggio 7.1 del protocollo. L'hECT da elaborare viene selezionato utilizzando il menu a discesa Tessuto . (II) La casella Input dati contiene informazioni sulla coppia di perni PDMS che supportano l'hECT, come la distanza a vuoto (ottenuta nel passaggio 6.1 del protocollo) e il raggio del palo (0,25 mm). (III) La casella Vincoli di analisi consente all'utente di scegliere le frequenze da omettere o da includere e tagliare le registrazioni. (IV) La casella dei parametri del filtro contiene le opzioni per scegliere come filtrare la curva di forza di contrazione grezza. L'ordine polinomiale e la dimensione del fotogramma modificano il livello di arrotondamento durante il processo di filtraggio. Il dispositivo di scorrimento Peak Detection Threshold decide la dimensione minima del picco che verrà riconosciuta dagli script. L'opzione Rimozione punte ritaglia i picchi alti causati da artefatti. (V) Le opzioni aggiuntive includono l'analisi della post-deflessione, che esegue un algoritmo di rilevamento del picco aggiuntivo, la scala automatica dell'asse y sui grafici di zoom, che agisce sulla curva di forza di contrazione, Salva curve di traccia della forza, che salva le cifre della forza di contrazione e Salva dati forza-tempo, che salva i dati della forza di contrazione tracciati. (B) Esempio della curva di forza di contrazione di una registrazione di 30 s di un hECT stimolato a 1 Hz prodotto dallo screenshot della GUI dal pannello A. La curva di forza di contrazione rossa mostra la forza filtrata prodotta dai parametri in AIV, sovrapposta alla curva di forza di contrazione grezza (curva blu scuro, appare quando è selezionata l'opzione Mostra dati non filtrati in AV ). Abbreviazioni: hECT = tessuto cardiaco ingegnerizzato dall'uomo; GUI = interfaccia utente grafica; PDMS = polidimetilsilossano. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
Seguendo il protocollo di cui sopra, i cardiomiociti sono stati generati da una linea di iPSC sana utilizzata in precedenza dal nostro gruppo 9,15 e fabbricati in hECT dopo 8-61 giorni in coltura. La Figura 9A mostra immagini rappresentative degli hECT visti dal basso, che sono stati creati senza (in alto) e con (in basso) SPoT. Le misurazioni funzionali sono state effettuate a temperatura ambiente (23 °C) e a temperatura fisiologic...
Discussione
Esistono numerosi modelli di tessuto cardiaco ingegnerizzato lineare pubblicati in letteratura, alcuni dei quali sono descritti nella Tabella 1. Alcuni modelli prevedono la misurazione diretta della forza tissutale, ma in genere richiedono il trasferimento del costrutto in un bagno muscolare separato38. La maggior parte dei modelli sono progettati con i tessuti ancorati in modo permanente ad entrambe le estremità, più comunemente ai perni PDMS ...
Divulgazioni
K.D.C. è co-fondatore e Chief Scientific Officer di Novoheart e detiene una partecipazione azionaria nella holding Medera Biopharmaceutical. Novoheart non ha contribuito al finanziamento, alla pianificazione o all'esecuzione di questo studio; tuttavia, i risultati dello studio potrebbero potenzialmente avere un impatto finanziario su Novoheart e Medera. Gli altri autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Gli autori ringraziano il Dr. Timothy Cashman per il precedente lavoro su questo metodo. Questo studio è stato sostenuto dai finanziamenti del National Institutes of Health (NIH) (R01-HL132226 e K01 HL133424) e del programma di reti internazionali di eccellenza della Fondazione Leducq (CURE-PLaN).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.25 mm diamete 304 Stainless Steel Wire | McMaster Carr | 6517K61 | |
| 0.25% trypsin-EDTA | Gibco | 25200056 | |
| 1.7 mL Microtubes | Axygen | MCT-175-C | |
| 10 cm dishes (20 mm tall) | Corning | 353003 | |
| 10 mL Serological Pipette | Drummond | 6-000-010 | |
| 10 N NaOH | Fisher Scientific | SS225-1 | dilute 1:10 in sterile distilled water |
| 10X Modified Eagle Medium | Sigma Aldrich | M0275 | |
| 20 - 200 μL Micropipette | Eppendorf | 3123000055 | |
| 200 μL MicroPipette Tips | VWR | 76322-150 | |
| 5 mL Serological Pipette | Drummond | 6-000-005 | |
| 50 mL Conical Centrifuge Tubes | Falcon | 352070 | |
| 6 cm Petri Dish | Corning | 353002 | |
| 6 Watt LED Dual Gooseneck Illuminator | AmScope | LED-6W | |
| 6-Well Plates | Corning | 353046 | |
| 90 degree angle mirror | Edmund Optics | 45-594 | |
| Acrylic bonding glue | SCIGRIP | #4 | |
| Adjustable 10 cm x 10 cm jack | Fisher Scientific | 14-673-50 | |
| Aluminum 6061 | McMaster Carr | 9008K82 | |
| A-Plan 10X Objective Lens | ZEISS | 1020-863 | |
| Autoclave Bags | Propper | 21002 | |
| B-27 supplement | ThermoFisher | 17504044 | |
| B-27 supplement (without insulin) | ThermoFisher | A1895601 | |
| Benchtop Centrifuge | Eppendorf | 5810 R | |
| Black ABS | Ultimaker | 2.85 mm wide | |
| Bovine Collagen I | Gibco | A1064401 | |
| CHIR99021 | Tocris | 4423 | |
| Class II Biosafety Cabinet | Labconco | 3430009 | |
| Clear Acrylic Sheeting | estreetplastics | 1002502436 | 6.25 mm thick |
| CNC Vertical Mill | Haas | VF-1 | |
| Conductive Graphite Bars | McMaster Carr | 1763T33 | |
| Dissection microscope | Olympus | SZ61 | |
| Dulbecco's Modified Eagle Medium/Ham's F-12 Nutrient Mix | ThermoFisher | 11330032 | |
| Ethanol | Fisher Scientific | A4094 | Dilute to 70% in water |
| EVE Automated Cell counter | NanoEntek | E1000 | |
| EVE Cell Counting Slide | NanoEntek | EVS-050 | |
| Fetal Bovine Serum | Life Technologies | 10438026 | |
| Fine Curved Forceps | Fine Science Tools | 11253-25 | |
| Forma Series II Water Jacketed CO2 Incubator | Thermo Electron Corporation | 3110 | AKA "incubator". With HEPA class 100 filter |
| Fusion360 software | Autodesk | AKA "CAD software" | |
| Glass Hemocytometer | Reichert | 1475 | 0.1 mm deep |
| HEPES | Sigma Aldrich | H3784 | |
| hESC qualified matrigel | Corning | 354277 | AKA "basement membrane matrix". Store in frozen aliquots |
| High Speed CCD Camera | PixelLINK | P7410 | |
| Inverted Microscope | Carl Zeiss Werk | Axiovert 40 CFL | 10X phase contrast objective |
| IWR-1 | Selleck Chem | S7086 | |
| LabView Software | National Instruments | 2016 | |
| Laminar flow clean bench | NuAire | NU-201-330 | necessary for hECT functional analysis |
| Laptop | AsusTek | Strix | Intel Core i& processor ,CPU 2.8GHz, 16GB RAM |
| Laser Cutting Machine | Epilog | Helix 24 | |
| Magnification headset | ExcelBlades | 70020 | Recommended for steps requiring fine manipulations |
| Matlab | Mathworks | Version 2019b or later | AKA "data analysis software" |
| Micro Vannas Scissors, 3 mm blade | WPI Instruments | 501839 | |
| Microscope Boom Stand | Olympus | SZ2-STU1 | |
| Penicillin-Streptomycin stock solution | ThermoFisher | 15140122 | 10,000 IU/ml penicillin; 10,000 μg/ml streptomycin |
| Phosphate-buffered saline without divalent cations | Sigma Aldrich | P3813 | Diluted in distilled water to 1X and 10X concentrations |
| Pipette Controller | Drummond | 4-000-100 | |
| PixelLINK Capture OEM | PixelLINK | 10.2.1.6 | AKA "Camera Software" |
| Polysulfone | McMaster Carr | 86735K73 | translucent amber color |
| Polytetrafluoroethylene (PTFE) | McMaster Carr | 8545K176 | Black, molded |
| ReLeSR | Stem Cell Technologies | 5872 | AKA "iPSC dissociation media" |
| Rosewell Park Memorial Institute 1640 Media | ThermoFisher | 11875135 | |
| Silicone Sheeting | SMI manufacturing | glossy, 0.02 in thickness, durometer 40 | |
| Size 10/0 Blue, Green, Red, and Yellow Glass Seed Beads | Michael's | color should withstand autoclaving | |
| Spatula | Fisher Scientific | 14-373 | used for mixing PDMS |
| Square Pulse Stimulator | Astro-Med / Grass Technologies | S88X | |
| Stainless Steel Razoblades | GEM | 62-0179-CTN | preferred over non-stainless steel due to lower hardness |
| Stemflex | ThermoFisher | A3349401 | AKA "iPSC culture media" |
| Sterile distilled water | ThermoFisher | 5230 | |
| Sylgard 170 - Silicone Elastomer Encapsulant Black 0.9 kg Kit | Dow | DOWSIL 170 2LB KIT | AKA black Polydimethylsiloxane (black PDMS) |
| Sylgard 184 - Silicone Elastomer Clear 1 lb Kit | Dow | DC 184 SYLGARD 0.5KG 1.1LB KIT | AKA Polydimethylsiloxane (PDMS) |
| Temperature-controlled heated stage | Okolab | H401-HG-SMU | Set height to 10 cm |
| Thermoplastic 3D printer | Ultimaker | Ultimaker 3 | |
| Thiazovivin | Selleck Chem | S1459 | |
| Trypan Blue | NanoEntek | EBT-001 | |
| Vacuum Chamber | Bel-Art Parts | F42027-0000 | |
| Variable Speed Mini Band Saw | Micro-Mark | 82203 | |
| Variable Speed Miniature Drill Press | Micro-Mark | 82959 | |
| Vibration Isolation Table | Labconco | 3618000 | |
| Weighing Boats | VWR | 10803-140 | |
| Talon Cylinder Bench Clamp | VWR | 97035-528 | AKA screw clamp |
Riferimenti
- Serrao, G. W., et al. Myocyte-depleted engineered cardiac tissues support therapeutic potential of mesenchymal stem cells. Tissue Engineering. Part A. 18 (13-14), 1322-1333 (2012).
- Turnbull, I. C., et al. Advancing functional engineered cardiac tissues toward a preclinical model of human myocardium. FASEB Journal. 28 (2), 644-654 (2014).
- Cashman, T. J., et al. Construction of defined human engineered cardiac tissues to study mechanisms of cardiac cell therapy. Journal of Visualized Experiments. (109), e53447 (2016).
- Stillitano, F., et al. Genomic correction of familial cardiomyopathy in human engineered cardiac tissues. European Heart Journal. 37 (43), 3282-3284 (2016).
- Mayourian, J., et al. Experimental and computational insight into human mesenchymal stem cell paracrine signaling and heterocellular coupling effects on cardiac contractility and arrhythmogenicity. Circulation Research. 121 (4), 411-423 (2017).
- Mayourian, J., et al. therapeutic paracrine modulation of cardiac excitation-contraction coupling. Circulation Research. 122 (1), 167-183 (2018).
- Mayourian, J., et al. Exosomal microRNA-21-5p mediates mesenchymal stem cell paracrine effects on human cardiac tissue contractility. Circulation Research. 7 (122), 933-944 (2018).
- Turnbull, I. C., et al. Cardiac tissue engineering models of inherited and acquired cardiomyopathies. Methods in Molecular Biology. 1816, 145-159 (2018).
- Murphy, J. F., et al. Adult human cardiac stem cell supplementation effectively increases contractile function and maturation in human engineered cardiac tissues. Stem Cell Research & Therapy. 10 (1), 373 (2019).
- Breckwoldt, K., et al. Differentiation of cardiomyocytes and generation of human engineered heart tissue. Nature Protocols. 12 (6), 1177-1197 (2017).
- Huang, C. Y., et al. Enhancement of human iPSC-derived cardiomyocyte maturation by chemical conditioning in a 3D environment. Journal of Molecular and Cellular Cardiology. 138, 1-11 (2020).
- Ramade, A., Legant, W. R., Picart, C., Chen, C. S., Boudou, T. Microfabrication of a platform to measure and manipulate the mechanics of engineered microtissues. Methods in Cell Biology. 121, 191-211 (2014).
- Ronaldson-Bouchard, K., et al. Engineering of human cardiac muscle electromechanically matured to an adult-like phenotype. Nature Protocols. 14 (10), 2781-2817 (2019).
- Tamargo, M. A., et al. milliPillar: A platform for the generation and real-time assessment of human engineered cardiac tissues. ACS Biomaterials Science & Engineering. 7 (11), 5215-5229 (2021).
- Ceholski, D. K., et al. CXCR4 and CXCR7 play distinct roles in cardiac lineage specification and pharmacologic β-adrenergic response. Stem Cell Research. 23, 77-86 (2017).
- Bliley, J. M., et al. Dynamic loading of human engineered heart tissue enhances contractile function and drives a desmosome-linked disease phenotype. Science Translational Medicine. 13 (603), (2021).
- Ribeiro, M. C., et al. A new versatile platform for assessment of improved cardiac performance in human-engineered heart tissues. Journal of Personalized Medicine. 12 (2), 214 (2022).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Mannhardt, I., et al. Human engineered heart tissue: Analysis of contractile force. Stem Cell Reports. 7 (1), 29-42 (2016).
- Mannhardt, I., et al. Blinded contractility analysis in hiPSC-cardiomyocytes in engineered heart tissue format: Comparison with human atrial trabeculae. Toxicological Sciences. 158 (1), 164-175 (2017).
- Saleem, U., et al. Force and calcium transients analysis in human engineered heart tissues reveals positive force-frequency relation at physiological frequency. Stem Cell Reports. 14 (2), 312-324 (2020).
- Thavandiran, N., et al. Functional arrays of human pluripotent stem cell-derived cardiac microtissues. Scientific Reports. 10 (1), 6919 (2020).
- Bielawski, K. S., Leonard, A., Bhandari, S., Murry, C. E., Sniadecki, N. J. Real-time force and frequency analysis of engineered human heart tissue derived from induced pluripotent stem cells using magnetic sensing. Tissue Engineering. Part C, Methods. 22 (10), 932-940 (2016).
- Leonard, A., et al. Afterload promotes maturation of human induced pluripotent stem cell derived cardiomyocytes in engineered heart tissues. Journal of Molecular and Cellular Cardiology. 118, 147-158 (2018).
- Bose, P., Huang, C. Y., Eyckmans, J., Chen, C. S., Reich, D. H. Fabrication and mechanical properties measurements of 3D microtissues for the study of cell-matrix interactions. Methods in Molecular Biology. 1722, 303-328 (2018).
- Zhang, W., et al. Maturation of human embryonic stem cell-derived cardiomyocytes (hESC-CMs) in 3D collagen matrix: Effects of niche cell supplementation and mechanical stimulation. Acta Biomaterialia. 49, 204-217 (2017).
- van Neste, C. Advances in bioreactor design and multi-dimensional analysis for assessing maturation phenotype of human engineered cardiac tissues. PhD thesis. Icahn School of Medicine at Mount Sinai. , (2022).
- Sala, L., et al. MUSCLEMOTION: A versatile open software tool to quantify cardiomyocyte and cardiac muscle contraction in vitro and in vivo. Circulation Research. 122 (3), e5-e16 (2018).
- Salazar, B. H., Cashion, A. T., Dennis, R. G., Birla, R. K. Development of a cyclic strain bioreactor for mechanical enhancement and assessment of bioengineered myocardial constructs. Cardiovascular Engineering and Technology. 6 (4), 533-545 (2015).
- Putame, G., et al. Application of 3D printing technology for design and manufacturing of customized components for a mechanical stretching bioreactor. Journal of Healthcare Engineering. 2019, 3957931 (2019).
- Akintewe, O. O., Roberts, E. G., Rim, N. -. G., Ferguson, M. A. H., Wong, J. Y. Design approaches to myocardial and vascular tissue engineering. Annual Review of Biomedical Engineering. 19, 389-414 (2017).
- Chen, G., et al. Phospholamban as a crucial determinant of the inotropic response of human pluripotent stem cell-derived ventricular cardiomyocytes and engineered 3-dimensional tissue constructs. Circulation. Arrhythmia and Electrophysiology. 8 (1), 193-202 (2015).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Beauchamp, P., et al. 3D co-culture of hiPSC-derived cardiomyocytes with cardiac fibroblasts improves tissue-like features of cardiac spheroids. Frontiers in Molecular Biosciences. 7, 14 (2020).
- Campostrini, G., et al. functional analysis and applications of isogenic three-dimensional self-aggregating cardiac microtissues from human pluripotent stem cells. Nature Protocols. 16 (4), 2213-2256 (2021).
- Swiatlowska, P., Iskratsch, T. Tools for studying and modulating (cardiac muscle) cell mechanics and mechanosensing across the scales. Biophysical Reviews. 13 (5), 611-623 (2021).
- Zhao, Y., et al. Engineering microenvironment for human cardiac tissue assembly in heart-on-a-chip platform. Matrix Biology. 85-86, 189-204 (2020).
- Fujiwara, Y., Deguchi, K., Miki, K., Nishimoto, T., Yoshida, Y. A method for contraction force measurement of hiPSC-derived engineered cardiac tissues. Methods in Molecular Biology. 2320, 171-180 (2021).
- Wang, E. Y., et al. Biowire model of interstitial and focal cardiac fibrosis. ACS Central Science. 5 (7), 1146-1158 (2019).
- Zhao, Y., et al. A platform for generation of chamber-specific cardiac tissues and disease modeling. Cell. 176 (4), 913-927 (2019).
- Lee, E. K., et al. Machine learning of human pluripotent stem cell-derived engineered cardiac tissue contractility for automated drug classification. Stem Cell Reports. 9 (5), 1560-1572 (2017).
- Batalov, I., Feinberg, A. W. Differentiation of cardiomyocytes from human pluripotent stem cells using monolayer culture. Biomarker Insights. 10, 71-76 (2015).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences of the United States of America. 109 (27), E1848-E1857 (2012).
- Penefsky, Z. J., Buckley, N. M., Litwak, R. S. Effect of temperature and calcium on force-frequency relationships in mammalian ventricular myocardium. Pflugers Archiv. 332 (4), 271-282 (1972).
- Bers, D. M. . Excitation-Contraction Coupling and Cardiac Contractile Force. , (2001).
- Kanaya, N., Gable, B., Wickley, P. J., Murray, P. A., Damron, D. S. Experimental conditions are important determinants of cardiac inotropic effects of propofol. Anesthesiology. 103 (5), 1026-1034 (2005).
- Galende, E., et al. Amniotic fluid cells are more efficiently reprogrammed to pluripotency than adult cells. Cellular Reprogramming. 12 (2), 117-125 (2010).
- Wacker-Gussmann, A., Strasburger, J. F., Cuneo, B. F., Wakai, R. T. Diagnosis and treatment of fetal arrhythmia. American Journal of Perinatology. 31 (7), 617-628 (2014).
- Federmann, M., Hess, O. M. Differentiation between systolic and diastolic dysfunction. European Heart Journal. 15, 2-6 (1994).
- Knight, W. E., et al. Maturation of pluripotent stem cell-derived cardiomyocytes enables modeling of human hypertrophic cardiomyopathy. Stem Cell Reports. 16 (3), 519-533 (2021).
- Ma, Z., et al. Contractile deficits in engineered cardiac microtissues as a result of MYBPC3 deficiency and mechanical overload. Nature Biomedical Engineering. 2 (12), 955-967 (2018).
- de Lange, W. J., et al. Human iPSC-engineered cardiac tissue platform faithfully models important cardiac physiology. American Journal of Physiology. Heart and Circulatory Physiology. 320 (4), H1670-H1686 (2021).
- Hiranandani, N., Varian, K. D., Monasky, M. M., Janssen, P. M. L. Frequency-dependent contractile response of isolated cardiac trabeculae under hypo-, normo-, and hyperthermic conditions. Journal of Applied Physiology. 100 (5), 1727-1732 (2006).
- Puglisi, J. L., Bassani, R. A., Bassani, J. W., Amin, J. N., Bers, D. M. Temperature and relative contributions of Ca transport systems in cardiac myocyte relaxation. The American Journal of Physiology. 270 (5), H1772-H1778 (1996).
- Puglisi, J. L., Yuan, W., Bassani, J. W., Bers, D. M. Ca(2+) influx through Ca(2+) channels in rabbit ventricular myocytes during action potential clamp: Influence of temperature. Circulation Research. 85 (6), e7-e16 (1999).
- Li, R. A., et al. Bioengineering an electro-mechanically functional miniature ventricular heart chamber from human pluripotent stem cells. Biomaterials. 163, 116-127 (2018).
- Sharma, A., et al. Biomanufacturing in low Earth orbit for regenerative medicine. Stem Cell Reports. 17 (1), 1-13 (2022).
- Strauss, D. G., Wu, W. W., Li, Z., Koerner, J., Garnett, C. Translational models and tools to reduce clinical trials and improve regulatory decision making for QTc and proarrhythmia risk (ICH E14/S7B updates). Clinical Pharmacology & Therapeutics. 109 (2), 319-333 (2021).
- Gintant, G., et al. Repolarization studies using human stem cell-derived cardiomyocytes: Validation studies and best practice recommendations. Regulatory Toxicology and Pharmacology. 117, 104756 (2020).
Erratum
Formal Correction: Erratum: Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
Posted by JoVE Editors on 1/10/2024. Citeable Link.
An erratum was issued for: Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues. The title was corrected from:
Designing a Bioreactor to Improve Data Acquisition and Model the Throughput of Engineered Cardiac Tissues
to:
Designing a Bioreactor to Improve Data Acquisition and Model Throughput of Engineered Cardiac Tissues
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon