È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento di piccoli follicoli preantrali dall'ovaio bovino utilizzando una combinazione di frammentazione, omogeneizzazione e filtrazione seriale
In questo articolo
Riepilogo
L'avanzamento dello studio della follicologenesi preantrale richiede metodi efficienti di isolamento del follicolo dalle singole ovaie. Qui viene presentato un protocollo meccanico semplificato per l'isolamento del follicolo dalle ovaie bovine utilizzando un tritatutto tissutale e un omogeneizzatore. Questo metodo consente la raccolta di un gran numero di follicoli preantrali vitali da una singola ovaia.
Abstract
Comprendere l'intero processo della follicologenesi dei mammiferi è fondamentale per migliorare le tecnologie di riproduzione assistita nel bestiame, negli esseri umani e nelle specie in via di estinzione. La ricerca è stata per lo più limitata ai follicoli antrali e ai grandi follicoli preantrali a causa della difficoltà nell'isolamento dei follicoli preantrali più piccoli, specialmente nei grandi mammiferi come le specie bovine. Questo lavoro presenta un approccio efficiente per recuperare un gran numero di piccoli follicoli preantrali da un singolo ovaio bovino. La corteccia delle singole ovaie bovine è stata tagliata in cubi da 500 μm utilizzando un trinciatutto di tessuto e omogeneizzata per 6 minuti a 9.000-11.000 giri / min utilizzando una sonda da 10 mm. I detriti di grandi dimensioni sono stati separati dall'omogenato usando un panno di formaggio, seguito da una filtrazione seriale attraverso filtri cellulari da 300 μm e 40 μm. Il contenuto trattenuto nel filtro da 40 μm è stato risciacquato in un piatto di ricerca, dove i follicoli sono stati identificati e raccolti in una goccia di mezzo. La vitalità dei follicoli raccolti è stata testata tramite colorazione blu tripano. Questo metodo consente l'isolamento di un gran numero di piccoli follicoli preantrali vitali da un singolo ovaio bovino in circa 90 minuti. È importante sottolineare che questo metodo è interamente meccanico ed evita l'uso di enzimi per dissociare il tessuto, che può danneggiare i follicoli. I follicoli ottenuti utilizzando questo protocollo possono essere utilizzati per applicazioni a valle come l'isolamento dell'RNA per RT-qPCR, l'immunolocalizzazione di proteine specifiche e la coltura in vitro .
Introduzione
I follicoli ovarici sono le unità funzionali dell'ovaio, responsabili della produzione del gamete (ovocita) e degli ormoni critici per la funzione riproduttiva e la salute generale. I follicoli primordiali si formano nell'ovaio durante lo sviluppo fetale o nel periodo neonatale a seconda della specie1 e costituiscono la riserva ovarica di una femmina. La crescita follicolare inizia con l'attivazione dei follicoli primordiali che lasciano il pool di riposo ed entrano nella fase di crescita. La follicologenesi preantrale, che comprende tutti gli stadi follicolari prima dello sviluppo dell'antro, è un processo altamente dinamico che richiede cambiamenti morfologici e metabolici sincroni nell'ovocita e nelle cellule della granulosa circostante, guidati da una stretta comunicazione tra questi due tipi di cellule 2,3. I follicoli preantrali costituiscono la maggior parte delle unità follicolari presenti nell'ovaio in un dato momento4. Lo sviluppo attraverso gli stadi preantrali della follicologenesi è stimato in diverse settimane più lungo dello sviluppo antrale 5,6, e questo tempo è necessario affinché l'ovocita e le cellule somatiche acquisiscano una maturità sufficiente per entrare nella fase finale di sviluppo (cioè la fase antrale) e prepararsi per l'ovulazione, la fecondazione e lo sviluppo embrionale 7,8,9.
Gran parte delle attuali conoscenze sulla follicologenesi preantrale ovarica proviene dai modelli murini10,11,12,13, dovuta in parte alla facilità nel recuperare un gran numero di questi follicoli da un ovaio più piccolo e meno fibroso. Sebbene le segnalazioni di isolamento di un gran numero di follicoli preantrali dalle ovaie bovine risalgano a circa 30 anni14, una comprensione più completa dei processi che regolano lo sviluppo di questi follicoli in fase iniziale è rimasta irrealizzata, in gran parte a causa della mancanza di metodi ottimizzati, efficienti e ripetibili per recuperare un numero sufficiente di follicoli preantrali vitali, in particolare nelle prime fasi dello sviluppo. Con il crescente interesse a preservare la riserva ovarica per un uso futuro nella riproduzione assistita nell'uomo, le mucche diventano un modello attraente grazie alla loro struttura ovarica più simile15. Tuttavia, l'ovaio bovino è marcatamente più ricco di collagene rispetto all'ovaio di topo16, rendendo l'isolamento meccanico utilizzando i metodi descritti per il topo molto inefficiente. Gli sforzi per espandere le tecniche di conservazione della fertilità includono la crescita completa in vitro dei follicoli preantrali allo stadio antrale, seguita dalla maturazione in vitro (IVM) degli ovociti chiusi, dalla fecondazione in vitro (IVF) e dalla produzione e trasferimento di embrioni17. Finora, l'intero processo è stato raggiunto solo nei topi18. Nei bovini, il progresso verso la crescita del follicolo in vitro è limitato a pochi rapporti con stadi follicolari variabili all'inizio della coltura, così come lunghezza variabile della coltura tra i protocolli17,19.
I metodi descritti in letteratura per il prelievo di follicoli preantrali dall'ovaio bovino hanno utilizzato principalmente tecniche meccaniche ed enzimatiche, isolate o in combinazione 2,14,17,20. Il primo rapporto di un protocollo per l'isolamento del follicolo preantrale bovino ha utilizzato un omogeneizzatore tissutale e una filtrazione seriale per elaborare le ovaie intere20. Questo studio è stato seguito da rapporti che combinano procedure meccaniche ed enzimatiche che utilizzavano la collagenasi14. Un tema ricorrente quando si utilizza la collagenasi per digerire il tessuto ovarico è il potenziale rischio di danni alla membrana basale follicolare, che può compromettere la vitalità del follicolo 14,21,22,23. Pertanto, sono state impiegate diverse combinazioni di metodi meccanici, come l'uso di un trinciatutto e pipettaggio ripetuto o di un trinciatutto combinato con omogeneizzazione20,24,25,26. Un'altra tecnica meccanica che è stata descritta utilizza aghi per sezionare i follicoli preantrali direttamente dal tessuto ovarico, che è particolarmente utile per isolare follicoli secondari più grandi (>200 μm). Tuttavia, questo processo richiede tempo, è inefficiente per isolare i follicoli preantrali più piccoli ed è dipendente dalle competenze quando viene tentato nelle ovaie bovine 19,27,28.
Sfruttando le diverse tecniche descritte in letteratura, questo protocollo mirava a ottimizzare l'isolamento dei follicoli preantrali dalle singole ovaie bovine in modo semplice, coerente ed efficiente che eviti l'incubazione in soluzioni enzimatiche. Il miglioramento dei metodi per isolare i follicoli preantrali fornirà l'opportunità di migliorare la comprensione di questo stadio della follicologenesi e consentirà lo sviluppo di sistemi di coltura efficaci per sviluppare follicoli preantrali allo stadio antrale. Le procedure dettagliate qui descritte per l'isolamento dei follicoli preantrali da un grande mammifero come la specie bovina saranno vitali per i ricercatori che mirano a studiare la follicologenesi precoce in una specie non murina che è traducibile per l'uomo.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Le ovaie bovine (Bos taurus) sono state prelevate da un mattatoio locale e trasportate al laboratorio entro 6 ore dalla raccolta. A causa del gran numero di animali lavorati nella struttura, l'età, la razza e lo stadio del ciclo di estro degli animali sono sconosciuti. Poiché in questi esperimenti non sono stati utilizzati animali vivi, non è stato richiesto un protocollo approvato per la cura e l'uso degli animali.
1. Preparazione delle attrezzature e dei reagenti
- Coprire una sezione larga 2 piedi di un banco da laboratorio con carta da banco.
- Procurarsi un manico di bisturi, una lama sterile per bisturi, un emostato, un paio di pinze da dissezione, una siringa luer-lock da 20 ml, un ago da 18 G, due becher da 200 ml, un matraccio Erlenmeyer da 500 ml, un imbuto di plastica da 104 mm di diametro, un tagliere di plastica, uno strato di garza da 22 cm2 (la garza può essere sterilizzata in autoclave prima dell'uso) per ovaio in lavorazione, un filtro cellulare da 300 μm e un filtro cellulare da 40 μm (vedi Tabella dei materiali).
- Trasferire tutte le attrezzature sulla carta da banco.
- Utilizzare l'emostatico per infilare la lama del bisturi sul manico del bisturi. Allineare la base angolata della lama all'indicatore angolato sull'impugnatura, quindi far scorrere la lama nella scanalatura dell'impugnatura.
- Posizionare l'imbuto nel pallone Erlenmeyer e coprire l'apertura dell'imbuto con la garza.
- Introdurre un tubo conico da 50 mL per ovaio da trattare in un bagno d'acqua o di perline impostato a 38,5 °C.
- Posizionare una capsula di Petri quadrata di 100 x 15 mm per ovaia in lavorazione su uno scalda vetrino impostato a 38,5 °C.
- Aggiungere 10 ml di penicillina-streptomicina (PenStrep; 10.000 U/mL di penicillina e 10.000 μg/mL di streptomicina) a 1 L di 1x soluzione salina tamponata fosfato (PBS). Riscaldare PBS + PenStrep in un bagno d'acqua o di perline impostato a 38,5 °C almeno 2 ore prima della lavorazione delle ovaie.
NOTA: la soluzione PBS + PenStrep è indispensabile per il lavaggio delle ovaie quando i follicoli isolati saranno coltivati ed è ancora raccomandata per qualsiasi esperimento a valle per mitigare la contaminazione microbica. - Per la raccolta del filtrato ovarico trattato, utilizzare Follicle Wash Medium (FWM) costituito da TCM199 con sali di Hank (vedi tabella dei materiali) contenente 3 mg/ml di albumina sierica bovina (BSA), 25 mM di tampone HEPES, 100 UI di penicillina/100 μg/mL di streptomicina, 1 mM di piruvato di sodio (NaPyr) e 100 nM di aminoacidi non essenziali (NEAA).
- Trasferire il TCM199 sterile, un flacone da 250 ml e un cilindro graduato da 100 ml in un armadio di biosicurezza (BSC). Trasferire 194 mL di TCM199 nel flacone.
- Rimuovere il becher di TCM199 dalla BSC e portare su una piastra di agitazione. Aggiungere 600 mg di BSA, 1,19 g di tampone HEPES e una barra di agitazione autoclavata al flacone e mescolare fino a quando non si scioglie.
- Una volta che il tampone BSA e HEPES si sono completamente sciolti, aggiungere 1 N idrossido di sodio (NaOH) al mezzo fino a raggiungere un pH di 7,6-7,8, misurato da un pHmetro.
- Pulire la bottiglia di mezzo, un dispositivo di filtrazione del vuoto, quattro tubi conici da 50 ml e le bottiglie di PenStrep, NaPyr e NEAA con etanolo al 70% prima di trasferirle alla BSC.
- Aggiungere 2 ml ciascuno di PenStrep (10.000 U/mL di penicillina e 10.000 μg/mL di streptomicina), 100 mM di NaPyr e 100x NEAA al flacone di TCM199 + 3 mg/mL di BSA + 25 mM HEPES. Filtrare sterile il mezzo finale e l'aliquota nei tubi conici da 50 ml. Conservare il fluido a 4 °C per un massimo di 2 settimane.
- Riscaldare un tubo conico da 50 mL di mezzo per due ovaie in un bagno di perline impostato a 38,5 °C almeno 1 ora prima della lavorazione delle ovaie.
2. Configurazione del trinciatutto
- Assicurarsi che il trituratore di tessuti (vedere la tabella dei materiali) sia collegato e acceso.
- Impostare lo spessore della fetta su 500 μm, la manopola di controllo della forza della lama su 20° e la manopola di controllo della velocità su 90° in base alle specifiche del produttore.
- Inserire una capsula di Petri in plastica da 60 mm nel portapiatti e inserire il portapiastre sul suo palco.
- Sollevare il braccio di taglio il più in alto possibile ruotando la manopola di azionamento manuale in senso orario.
- Usando una pinza, posizionare una lama di rasoio a doppio taglio (vedi Tabella dei materiali) sulla vite inserita nel braccio di taglio. Posizionare la chiusura della lama sopra la lama e fissare con la rondella e il dado. Lasciare il dado un quarto di giro sciolto.
- Ruotare la manopola di azionamento manuale fino a quando il braccio di taglio fa scattare la lama piatta sulla piastra di Petri. Stringere il dado per il resto del percorso con il cacciatore di dadi.
- Sollevare il braccio di taglio più in alto che andrà usando la manopola di azionamento manuale. Spostare la manopola di rilascio del tavolo completamente a sinistra fino a quando non si incera in posizione.
3. Preparazione delle ovaie
- Trasferire le ovaie in laboratorio a PBS + PenStrep sterili caldi (38,5 °C).
NOTA: Si raccomanda di elaborare le ovaie per l'isolamento del follicolo non appena è possibile dopo la rimozione dall'animale. In questo protocollo, le ovaie sono state lavorate entro 6 ore dalla raccolta. Le ovaie sono state trasportate dal macello al laboratorio in thermos contenenti soluzione salina sterile allo 0,9% a circa 38,5 °C. - Se possibile, selezionare ovaie piccole (≤ 4 cm x 3 cm x 3 cm) contenenti follicoli antrali piccoli (3-5 mm), follicoli antrali grandi (≥8 mm) e nessun corpo luteo prominente (Figura 1). Questi criteri sono raccomandati per garantire che una quantità minima di detriti non follicolari, come le cellule stromali e la matrice extracellulare, sia inclusa nel piatto quadrato risultante contenente follicoli isolati.
NOTA: I follicoli antrali possono essere identificati come strutture vescicolari sferiche piene di liquido sulla superficie dell'ovaio. I corpi lutei possono essere identificati come strutture rigide rosse, arancioni o gialle che sporgono dalla superficie dell'ovaio. - Utilizzare le forbici per rimuovere qualsiasi tessuto connettivo in eccesso e grasso dalle ovaie.
- Lavare le ovaie per 30 s in etanolo al 70% in un becher.
- Lavare le ovaie 3 volte per 2 minuti ciascuna in bicchieri di PBS + PenStrep caldo (38,5 °C), utilizzando PBS + PenStrep fresco per ogni lavaggio.
- Conservare le ovaie in PBS + PenStrep caldo (38,5 °C) fino al momento della lavorazione.
NOTA: La distanza tra il laboratorio e la fonte ovarica può essere variabile. Pertanto, è importante completare il protocollo in modo tempestivo per garantire il mantenimento della vitalità follicolare.
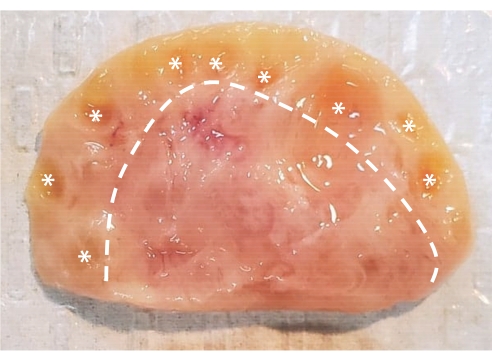
Figura 1: Anatomia dell'ovaio bovino. L'ovaio bovino è costituito da due regioni principali racchiuse in uno strato epiteliale. La corteccia, composta dal tessuto a sinistra della linea tratteggiata, contiene follicoli ovarici dallo stadio primordiale allo stadio antrale. I follicoli preantrali sono troppo piccoli per essere visti ad occhio nudo; I follicoli antrali sono contrassegnati da asterischi. Il midollo, costituito dal tessuto a destra della linea tratteggiata, contiene vasi sanguigni, vasi linfatici e nervi. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Procedura di taglio
NOTA: elaborare solo un'ovaia alla volta. Elaborare rapidamente le ovaie per evitare diminuzioni di temperatura, che possono influire sulla vitalità del follicolo.
- Trasferire un'ovaia sul tagliere sulla carta da banco (Figura 2A) e preparare il trinciatutto (Figura 2B).
- Usando una pinza e un bisturi, tagliare l'ovaio a metà e rimuovere il midollo da ciascuna metà, lasciando solo la corteccia ad uno spessore di circa 1 mm come mostrato nella Figura 2C.
- Tagliare l'ovaia a metà longitudinalmente da un sito di attacco del legamento al sito di attacco opposto.
- Tenere una metà dell'ovaio sul tagliere da lavorare e riposizionare l'altra metà dell'ovaia in PBS + PenStrep caldo (38,5 ° C).
- Con il midollo esposto rivolto verso l'alto, tagliare lungo la curvatura dell'ovaio a circa 2 mm di distanza dalla superficie dell'ovaio senza tagliare la corteccia.
- Usa la fetta lungo la curvatura dell'ovaio come guida per approfondire la fetta, seguendo ancora la curvatura dell'ovaio per separare la corteccia dal midollo.
- Sezionare e scartare qualsiasi corpora lutea dall'ovaio tagliando lungo il bordo del corpo luteo.
- Capovolgere la metà dell'ovaio in modo che l'epitelio sia rivolto verso l'alto e utilizzare il bisturi per finire di tagliare il midollo lontano dalla corteccia. Tagliare via qualsiasi tessuto connettivo bianco residuo attorno al bordo del pezzo ovarico che era collegato ai legamenti.
- Una volta rimossa la maggior parte del midollo, utilizzare il bisturi per tagliare la corteccia a circa 1 mm di spessore. Manipola il bisturi con piccoli movimenti avanti e indietro per radere via il resto del midollo.
NOTA: Il midollo è la porzione interna dell'ovaio contenente grandi vasi sanguigni. La corteccia è la porzione esterna dell'ovaio, che si trova direttamente sotto l'epitelio superficiale più esterno. La corteccia ha uno spessore di circa 1 mm nell'ovaio bovino, e quindi tagliare l'ovaio ad uno spessore di 1 mm rimuoverà il midollo.
- Tagliare la corteccia in pezzi non più grandi di 2,5 cm x 2,5 cm. Conservare i pezzi di corteccia in PBS + PenStrep caldo (38,5 ° C) fino al momento di tritare.
- Riempire un becher con almeno 50 ml di PBS + PenStrep caldo (38,5 °C) e ottenere una pipetta di trasferimento in plastica.
- Trasferire un singolo pezzo di corteccia nella capsula di Petri sul tritatutto e bagnare il tessuto con tre o quattro gocce di PBS + PenStrep caldo (38,5 °C).
- Tenere fermo il pezzo di tessuto con un paio di pinze e premere una volta il pulsante di reset per avviare il tritatutto di tessuto. Stabilizzare la piastra di Petri con una mano continuando a stabilizzare il tessuto con la pinza. Spostare la pinza a sinistra lungo il tessuto secondo necessità per evitare che la lama colpisca la pinza. Le strisce risultanti saranno lunghe circa 500 μm.
- Una volta che l'intero pezzo di corteccia è stato tagliato a strisce, utilizzare la manopola del supporto della lama per sollevare la lama dalla piastra di Petri e la pinza per rimuovere qualsiasi tessuto dalla lama.
- Ruotare il portapiastra di 90°.
- Premere una volta il pulsante di ripristino. Stabilizzare la piastra di Petri con una mano mentre si utilizza la pinza per spingere le strisce di tessuto nel percorso della lama.
- Passare la lama interamente attraverso le strisce di tessuto. Utilizzare la manopola del supporto della lama per sollevare la lama dalla piastra di Petri e la pinza per rimuovere qualsiasi tessuto dalla lama.
- Utilizzare la pipetta di trasferimento e riscaldare (38,5 °C) PBS + PenStrep per lavare il tessuto tritato (dimensione finale del tessuto: cubetti da 500 μm x 500 μm x 1 mm) in un tubo conico preriscaldato (38,5 °C) da 50 ml. Riportare il tubo conico nell'acqua o nel bagno di perline per mantenere caldo il tessuto tritato (38,5 °C).
- Utilizzare il cacciatore per rimuovere il dado dal braccio di taglio e rimuovere la rondella e la chiusura della lama. Usando una pinza, rimuovere la lama dal braccio di taglio, capovolgerla in modo che il bordo inutilizzato sia rivolto verso la capsula di Petri e riposizionarla sul braccio di taglio. Riposizionare la chiusura della lama, la rondella e il dado e reimpostare la manopola di rilascio del tavolo come descritto nei passaggi 2.5-2.7.
- Ripetere i passaggi 4.5-4.12 per tutti i restanti pezzi di corteccia dall'ovaio, sostituendo le lame con quelle nuove dopo che ogni tagliente è stato utilizzato.
- Smaltire tutte le lame usate in un contenitore di plastica con pareti rigide.
5. Procedura di omogeneizzazione
- Assicurarsi che l'unità omogeneizzatore (vedere la tabella dei materiali) sia collegata e che la velocità sia impostata sulla seconda barra (9.000-11.000 giri/min). Inserire la sonda del generatore da 10 mm nell'unità secondo le specifiche del produttore.
- Impostare un timer per 1 minuto e inserire la sonda nel tubo conico da 50 mL contenente il tessuto della corteccia tritato da un'ovaia (passo 4.11) e abbastanza PBS + PenStrep per riempire il tubo fino alla linea da 25 ml. La profondità a cui è inserita la sonda deve essere 1/3 dell'altezza del liquido misurata dal fondo della camera. Posizionare la sonda leggermente fuori centro per ridurre al minimo il vortice.
- Avviare il timer e accendere l'omogeneizzatore. Assicurarsi che la parte inferiore della sonda non tocchi il tubo e tenerlo fermo mentre l'omogeneizzatore è acceso.
- Dopo 1 minuto di omogeneizzazione, rimuovere la sonda dal tubo. Utilizzando una pinza, rimuovere il tessuto connettivo che ostruisce i fori di sfiato e lo spazio tra il coltello del rotore e il tubo del rotore. Se alcuni pezzi di corteccia sono bloccati nella sonda, rimuoverli con una pinza e rimetterli nel tubo.
- Ripetere i passaggi 5.2-5.4 in altre 5 volte per un totale di 6 minuti di omogeneizzazione.
- Posizionare il tubo con tessuto omogeneizzato nell'acqua o nel bagno di perline per mantenere il tessuto caldo (38,5 °C). Dopo aver elaborato l'ultima ovaia, smontare, pulire e asciugare immediatamente la sonda del generatore secondo le specifiche del produttore.
6. Procedura di filtrazione
- Versare il tessuto disperso nell'imbuto ricoperto di garza inserito nel matraccio di Erlenmeyer. Risciacquare il contenuto del tubo nell'imbuto usando PBS + PenStrep caldo (38,5 °C) fino a quando non rimangono frammenti di tessuto nel tubo.
- Forzare i frammenti di tessuto a passare attraverso i fori del panno ruotando la garza attorno ai frammenti di tessuto e schiacciando fino a quando tutto il liquido e il tessuto in eccesso vengono rimossi dalla garza.
- Riaprire la garza sull'imbuto, sciacquare la garza con PBS + PenStrep utilizzando una pipetta di trasferimento e spremere nuovamente eventuali frammenti di tessuto residui attraverso il panno.
- Utilizzare un emostatico per tenere il filtro cellulare da 300 μm su un becher da 200 ml. Versare il filtrato nel matraccio di Erlenmeyer attraverso il filtro cellulare. Risciacquare il contenuto del matraccio nel filtro cellulare utilizzando PBS + PenStrep caldo (38,5 °C) fino a quando non rimangono frammenti di tessuto.
- Se il filtro cellulare si intasa di tessuto, picchiettare delicatamente il filtro cellulare contro il becher per assicurarsi che tutto il liquido sia filtrato nel becher e quindi capovolgere il filtro cellulare e toccare i detriti di tessuto di grandi dimensioni sulla carta da banco. Riportare il filtro cellulare sul becher e continuare a versare il filtrato attraverso di esso. Se necessario, ripetere fino a filtrare tutti i filtrati del matraccio di Erlenmeyer.
- Utilizzare un emostatico per tenere il filtro cellulare da 40 μm su un secondo becher da 200 ml. Versare il filtrato nel primo becher da 200 ml attraverso il filtro cellulare. Risciacquare il contenuto del becher nel filtro cellulare utilizzando PBS + PenStrep caldo (38,5 °C) fino a quando non rimangono frammenti di tessuto. Non gettare il contenuto del filtro cellulare da 40 μm.
- Inserire l'ago da 18 G nella siringa da 20 ml. Riempire la siringa con FWM. Capovolgere il filtro cellulare da 40 μm su una capsula di Petri quadrata e utilizzare la siringa per lavare il contenuto del filtro cellulare nel piatto. Riempire la siringa e sciacquare il filtro cellulare secondo necessità fino a quando non rimangono frammenti di tessuto.
NOTA: In genere, 25 ml di FWM sono sufficienti per risciacquare completamente il contenuto del filtro cellulare da 40 μm.

Figura 2: Configurazione dell'area di lavoro per l'elaborazione delle ovaie e il flusso di lavoro del protocollo . (A) Configurazione del banco per tagliare le ovaie prima di tagliarle e per filtrare l'omogenato ovarico. (B) Impianto di trinciatrici e omogeneizzatori di tessuto, con supporto in polistirolo per ridurre le vibrazioni dello stadio omogeneizzatore. (C) Schema che illustra il flusso di lavoro per la lavorazione di un'ovaia intera. Le ovaie vengono rifilate del tessuto connettivo in eccesso e quindi tagliate a metà, e il midollo viene rimosso fino a quando rimane una fetta di corteccia spessa ~ 1 mm. La corteccia viene tagliata in pezzi di 2,5 cm x 2,5 cm e tritata in un trinciatutto di tessuto impostato a un intervallo di taglio di 500 μm. I pezzi vengono quindi omogeneizzati e l'omogenato viene filtrato attraverso una garza seguita dalla filtrazione attraverso filtri cellulari da 300 μm e 40 μm. Il contenuto del filtro cellulare da 40 μm viene risciacquato in una capsula di Petri quadrata, che viene ricercata per i follicoli usando uno stereomicroscopio. Creato con BioRender.com. Fare clic qui per visualizzare una versione ingrandita di questa figura.
7. Ricerca e raccolta dei follicoli
- Trasferire la capsula di Petri quadrata (punto 6.6) su uno stereoscopio con un palco riscaldato impostato a 38,5 °C. L'ingrandimento dello stereoscopio deve essere impostato tra 1,25x e 3,2x a seconda delle preferenze del ricercatore.
- Pipettare 10 μL di gocce di FWM in una capsula di Petri da 60 mm e coprire le gocce con olio minerale per evitare che si secchi. Posizionare la capsula di Petri con gocce di fluido su una piastra riscaldante impostata a 38,5 °C.
NOTA: una piastra a 4 pozzetti può essere utilizzata per raccogliere i follicoli. Aggiungere 500 μL di materiale di lavaggio in uno o due pozzetti. Posizionare sulla piastra riscaldante a 38,5 °C. - Procurarsi uno stantuffo e una punta per micropipette.
NOTA: Si raccomanda una micropipetta in vetro da 1-5 μL (vedere Tabella dei materiali) perché è meno probabile che i follicoli aderiscano alla pipetta di vetro e vadano persi quando vengono trasferiti tra le soluzioni. È anche uno strumento abbastanza piccolo da consentire micromanipolazioni più facili e precise dei follicoli. - Identificare i follicoli dalla capsula di Petri quadrata e trasferire le gocce di media (FWM) utilizzando la micropipetta. È probabile che molti follicoli siano incorporati nei detriti tissutali e possano essere recuperati utilizzando uno dei due metodi descritti di seguito.
NOTA: I follicoli sono oblunghi, piuttosto che sfere perfette, e tipicamente hanno un ovocita, che si presenta come un cerchio bianco solido in contrasti più scuri, verso il centro del follicolo (Figura 3A-C). Fare attenzione a non confondere i follicoli con gli ovociti denudati. Gli ovociti tendono ad essere sfere perfette e sono circondati da una membrana spessa e chiara (la zona pellucida). Un microscopio invertito con un ingrandimento di 10x (o superiore) può essere utilizzato per un esame più approfondito dei follicoli (Figura 3D).- Separare accuratamente i follicoli dai detriti usando la punta della micropipetta o aghi sottili (27 G).
- In alternativa, utilizzare una pipetta Pasteur di vetro con un bulbo di gomma per raccogliere e spruzzare i detriti nel piatto più volte per rimuovere i follicoli dai detriti.
- Lavora rapidamente, impiegando non più di 30 minuti, per cercare la capsula di Petri per aiutare a preservare la vitalità del follicolo.
- Posizionare un massimo di soli cinque follicoli per 10 μL di goccia, poiché una densità più elevata può aumentare la probabilità che i follicoli aderiscano insieme.
8. Test di fattibilità di esclusione del blu di Trypan
NOTA: Utilizzare il coperchio di una capsula di Petri o una piastra a 4 pozzetti per tutti i passaggi successivi, poiché i follicoli aderiscono meno alla plastica del coperchio rispetto alla plastica del piatto reale.
- Preparare PBS + 0,2% polivinilpirrolidone (PVP) sciogliendo 100 mg di PVP in 50 ml di PBS.
NOTA: PVP viene utilizzato qui per ridurre la probabilità che i follicoli si attacchino al piatto. - Utilizzare la micropipetta per trasferire tutti i follicoli (media di 40) dalle gocce di media in una goccia di 50 μL di PBS + 0,2% PVP.
- Lavare i follicoli 2 volte trasferendoli sequenzialmente su gocce fresche da 50 μL di PBS + 0,2% PVP.
- Trasferire i follicoli a una caduta di 285 μL di PBS + 0,2% PVP.
- Aggiungere 15 μL di blu tripano alla goccia di 285 μL di PBS + 0,2% PVP (concentrazione finale di 0,05% di tripano blu) e mescolare accuratamente la goccia utilizzando una punta di pipetta da 200 μL impostata su 100 μL.
NOTA: Se si utilizza la piastra a 4 pozzetti per il test di vitalità del tripano, aggiungere 475 μL di PBS + 0,2% PVP e 25 μL di blu tripano in un pozzetto. - Incubare i follicoli per 1 minuto nella goccia blu di tripano, quindi trasferire i follicoli in una goccia di 50 μL (o pozzo da 500 μL) di PBS + 0,2% PVP.
- Lavare i follicoli 3 volte secondo il passaggio 8.3 con gocce fresche da 50 μL (o 500 μL per pozzetto) di PBS + 0,2% PVP.
- Scartare tutti i follicoli che appaiono ancora blu dopo tre lavaggi in PBS + 0,2% PVP, poiché questi non sono vitali. Tutti i follicoli che non mantengono la colorazione blu dopo tre lavaggi sono vitali e possono essere utilizzati per immunofluorescenza, coltura o altre procedure (Figura 3E). Congelare i follicoli in azoto liquido e conservare a -80 °C fino a un ulteriore utilizzo, se necessario.
- Eseguire l'analisi RT-qPCR e la colorazione immunofluorescenza dei follicoli come descritto nei passaggi 9 e 10.

Figura 3: Follicoli isolati e test di esclusione del blu tripano. (A-C) I follicoli isolati sono stati ripresi attraverso uno stereomicroscopio a diversi ingrandimenti. (A) Follicoli isolati tra i detriti all'interno del piatto di ricerca iniziale. I singoli follicoli sono cerchiati in rosso. Barra della scala = 2.000 μm. (B) Follicoli isolati e detriti all'interno di una goccia di mezzo di lavaggio follicolo coperto di olio minerale. Barra di scala = 1.000 μm. (C) Follicoli isolati senza detriti ad un ingrandimento maggiore. Barra di scala = 1.000 μm. (D) Follicoli isolati ripresi utilizzando un microscopio a campo luminoso invertito. Barra della scala = 100 μm. (E) Immagini rappresentative di follicoli vitali (non colorati) e non vitali (macchie blu) ripresi utilizzando un microscopio a campo luminoso invertito e un obiettivo 20x. Barra di scala = 100 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
9. Analisi RT-qPCR
- Isolare l'RNA dai follicoli vitali (dal punto 8.8) usando un reagente di isolamento dell'RNA (vedere la Tabella dei materiali). Purificare l'RNA e trattare con DNasi utilizzando un kit di pulizia disponibile in commercio (vedere la tabella dei materiali) secondo le istruzioni del produttore.
- Eluire l'RNA con 14 μL di acqua priva di RNasi e quantificare utilizzando uno spettrofotometro. L'RNA può essere conservato a -80 °C fino alla sintesi del cDNA.
- Eseguire la sintesi del cDNA da quantità uguali di RNA estratto dai follicoli primari e secondari precoci, utilizzando un kit di sintesi del cDNA disponibile in commercio (vedi Tabella dei materiali) secondo le istruzioni del produttore. Incubare la miscela di reazione per 5 minuti a 25 °C seguita da 60 minuti a 42 °C, quindi terminare la reazione riscaldando a 70 °C per 5 minuti.
- Eseguire RT-qPCR con il cDNA sintetizzato (5 ng per reazione) e primer (Tabella 1) utilizzando un mix di reazioni disponibile in commercio (vedi Tabella dei materiali). Utilizzare condizioni di ciclo termico: 30 s a 95 °C per l'attivazione della polimerasi, seguiti da 40 cicli di amplificazione, dove ogni ciclo includeva 15 s a 95 °C per la denaturazione e 30 s a 60 °C per la ricottura/estensione. Analizzare l'RT-qPCR quantificando i valori di soglia del ciclo (Ct) e/o visualizzare i prodotti PCR utilizzando l'elettroforesi su gel di agarosio.
NOTA: L'espressione del trascritto del marcatore delle cellule granulari FSHR e del marcatore delle cellule germinali DAZL sono stati valutati in questo studio. I geni di riferimento erano H2A e ACTB. - Eseguire un'analisi della curva di fusione aumentando la temperatura da 65 °C a incrementi di 0,5 °C ogni 5 s fino a raggiungere 95 °C.
10. Analisi di immunofluorescenza
- Fissare i follicoli vitali (dal punto 8.8) per 15 minuti in una caduta di 100 μL del 4% (v/v) di paraformaldeide (PFA) a temperatura ambiente (RT), seguita da un lavaggio 3x in gocce da 100 μL di PBS + 0,1% BSA + 0,1% Tween 20.
- Bloccare i follicoli per 1 ora a RT in un tampone bloccante costituito da 1x PBS + 5% (v/v) siero normale d'asina (NDS). Dopo il blocco, incubare i follicoli per una notte a 4 °C in una caduta di 100 μL di 4 μg/mL di anticorpo CX37 anti-umano di coniglio o 4 μg/mL di isotipo IgG di coniglio (controllo negativo) diluito in tampone bloccante.
- Lavare i follicoli 3 volte in gocce da 100 μL di PBS + 0,1% BSA + 0,1% Tween 20, quindi incubarli per 1 ora a RT al buio in una goccia di 100 μL di 2 μg / mL di anticorpo secondario AlexaFluor 488 asino-anti-coniglio diluito in tampone bloccante.
- Incubare i follicoli per 5 minuti a RT al buio in una goccia di 100 μL di 1 μg/mL Hoechst 33342 diluito in tampone bloccante per marcare il DNA.
- Trasferire i follicoli su una goccia di 5 μL di supporto di montaggio (vedere Tabella dei materiali) su un vetrino da microscopio di vetro e coprire con un vetrino di copertura. Lasciare i vetrini a polimerizzare a RT durante la notte, quindi sigillare con lo smalto. Conservarli a 4 °C fino all'imaging.
- Immagina tutte le diapositive entro 48 ore dallo scivolamento del coperchio. Eseguire l'imaging utilizzando un microscopio a epifluorescenza invertita (vedi Tabella dei materiali) sotto filtri DAPI (eccitazione 380 nm ed emissione 450 nm) e FITC (eccitazione 470 nm ed emissione 525 nm).
- Fissare il tempo di esposizione per entrambi i canali. Regolare il tempo di esposizione al FITC (CX37) in base al controllo negativo dell'isotipo del coniglio. Utilizzare un obiettivo 20x e il canale DAPI impostato su 50 ms di tempo di esposizione per identificare i follicoli marcati con isotipo di coniglio.
- Immagina questi follicoli sotto il canale FITC e diminuisci il tempo di esposizione fino a quando tutto il segnale verde di fondo non viene abolito. Notare questo tempo di esposizione.
- Immagine di tutti i follicoli marcati con anticorpi CX37 utilizzando il tempo di esposizione impostato per il canale FITC isotipo e il tempo di esposizione di 50 ms per il canale DAPI.
- Elaborare l'intensità del segnale, misurata dall'area grigia media dopo la soglia, utilizzando un programma di elaborazione delle immagini del computer29 (vedere Tabella dei materiali).
- Regolare il file tiff dell'immagine DAPI per ciascun follicolo in modo che l'intero follicolo sia delineato. Utilizzare la funzione Analizza particelle del programma per selezionare l'intero follicolo come regione di interesse (ROI).
- Aprire il file tiff dell'immagine FITC per il follicolo corrispondente e sovrapporre il ROI generato dall'immagine DAPI sopra l'immagine FITC. Utilizzare la funzione Misura del programma per quantificare l'area grigia media dell'immagine FITC, che rappresenta l'intensità del segnale.
Access restricted. Please log in or start a trial to view this content.
Risultati
Panoramica e passaggi critici
Utilizzando questo protocollo, i piccoli follicoli preantrali bovini possono essere isolati in modo affidabile dalle singole ovaie in numeri sperimentalmente rilevanti. Da un totale di 30 repliche, sono stati ottenuti in media 41 follicoli per replica, con un intervallo da 11 a 135 follicoli (Figura 4A). In 14 repliche, i follicoli sono stati caratterizzati per lo stadio di sviluppo come precedentemente descritto26 mis...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il presente protocollo descrive un metodo riproducibile per recuperare i follicoli preantrali in fase iniziale, in particolare nelle fasi primarie e secondarie, dall'ovaio bovino. Questo protocollo si basa sui precedenti rapporti 20,25,30,34,35,36 e fornisce ottimizzazioni che si traducono nell'isolamento di un numero significativo di follicoli da una singola ovaia....
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo progetto è stato parzialmente finanziato dal progetto multi-stato USDA W4112 e dal premio UC Davis Jastro Shields a SM.
Gli autori vorrebbero estendere il loro apprezzamento a Central Valley Meat, Inc. per aver fornito le ovaie bovine utilizzate in tutti gli esperimenti. Gli autori ringraziano anche Olivia Silvera per l'assistenza nell'elaborazione delle ovaie e nell'isolamento del follicolo.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 5-3/4" Soda Lime Disposable Glass Pasteur Pipette | Duran Wheaton Kimble | 63A54 | Pasteur pipette that can be used to dislodge follicles from debris while searching within the petri dish |
| 16% Paraformaldehyde | Electron Microscopy Sciences | 15710 | Diluted to 4%; fixation of follicles for immunostaining |
| 20 mL Luer-lock Syringe | Fisher Scientific | Z116882-100EA | Syringe used with the 18 G needle to dislodge follicles from the 40 μm cell strainer |
| #21 Sterile Scalpel Blade | Fisher Scientific | 50-365-023 | Used to cut the ovaries and remove the medula |
| 40 μm Cell Strainer | Fisher Scientific | 22-363-547 | Used to filter the filtrate from the 300 μm cell strainer |
| 104 mm Plastic Funnel | Fisher Scientific | 10-348C | Size can vary, but ensure the cheese cloth is cut appropriately and that the ovarian homogenate will not spill over |
| 300 μm Cell Strainer | pluriSelect | 43-50300-03 | Used to filter the filtrate from the cheese cloth |
| 500 mL Erlenmeyer Flask | Fisher Scientific | FB500500 | Funnel and flask used to catch filtrate from the cheese cloth |
| Air-Tite Sterile Needles 18 G | Thermo Fisher Scientific | 14-817-151 | 18 G offers enough pressure to dislodge follicles from the 40 μm cell strainer |
| Air-Tite Sterile Needles 27 G 13 mm | Fisher Scientific | 14-817-171 | Needles that can be used to manipulate any debris in which follicles are stuck |
| BD Hoechst 33342 Solution | Fisher Scientific | BDB561908 | Fluorescent DNA stain |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A7030-100G | Component of follicle wash media |
| Cheese Cloth | Electron Microscopy Sciences | 71748-00 | First filtering step of the ovarian homogenate meant to remove large tissue debris |
| Classic Double Edge Safety Razor Blades | Wilkinson Sword | N/A | Razor blades that fit the best in the McIlwain Tissue Chopper and do not dull quickly |
| Donkey-Anti-Rabbit Secondary Antibody, Alexa Fluor 488 | Fisher Scientific | A-21206 | Secondary antibody for immunostaining |
| Eisco Latex Pipette Bulbs | Fisher Scientific | S29388 | Rubber bulb to use with Pasteur pipettes |
| HEPES Buffer | Sigma-Aldrich | H3375 | Component of follicle wash media |
| Homogenizer | VWR | 10032-336 | Homogenize the ovarian tissue to release follicles |
| ImageJ/Fiji | NIH | v2.3.1 | Software used for analysis of fluorescence-immunolocalization |
| McIlwain Tissue Chopper | Ted Pella | 10184 | Used to cut ovarian tissue small enough for homogenization |
| Microscope - Stereoscope | Olympus | SZX2-ILLT | Dissection microscope used for searching and harvesting follicles from the filtrate |
| Microscope - Inverted | Nikon | Diaphot 300 | Inverted microscope used for high magnification brightfield visualization of isolated follicles |
| Microscope - Inverted | ECHO | Revolve R4 | Inverted microscope used for high magnification brightfield and epifluorescence visualization of isolated follicles |
| Mineral Oil | Sigma-Aldrich | M8410-1L | Oil to cover the drops of follicle wash medium to prevent evaporation during searching |
| Non-essential Amino Acids (NEAA) | Gibco | 11140-050 | Component of follicle wash medium |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-001 | Reagent for immunostaining blocking buffer |
| Nunc 4-well Dishes for IVF | Thermo Fisher Scientific | 144444 | 4-well dishes for follicle isolation and washing |
| Penicillin-Streptomycin Solution 100x | Gibco | 15-140-122 | Component of follicle wash medium |
| Petri Dish 60 mm OD x 13.7 mm | Ted Pella | 10184-04 | Petri dish that fits the best in the McIlwain Tissue Chopper |
| Phosphate Buffered Saline (PBS) | Fisher Scientific | BP665-1 | Washing buffer for ovaries and follicles |
| Plastic Cutting Board | Fisher Scientific | 09-002-24A | Cutting board of sufficient size to safely cut ovaries |
| Polyvinylpyrrolidone (PVP) | Fisher Scientific | BP431-100 | Addition of PVP (0.1% w/v) to PBS prevents follicles from sticking to the plate or each other |
| ProLong Gold Antifade Mountant | Thermo Fisher Scientific | P36930 | Mounting medium for fluorescently labeled cells or tissue |
| Qiagen RNeasy Micro Kit | Qiagen | 74004 | RNA column clean-up kit |
| R | The R Foundation | v4.1.2 | Statistical analysis software |
| Rabbit-Anti-Human Cx37/GJA4 Polyclonal Antibody | Abcam | ab181701 | Cx37 primary antibody for immunostaining |
| RevertAid RT Reverse Transcription Kit | Thermo Fisher Scientific | K1691 | cDNA synthesis kit |
| Rstudio | RStudio, PBC | v2021.09.2 | Statistical analysis software |
| Sodium Hydroxide Solution (1N/Certified) | Fisher Scientific | SS266-1 | Used to increase media pH to 7.6-7.8 |
| Sodium Pyruvate (NaPyr) | Gibco | 11360-070 | Component of follicle wash medium |
| Square Petri Dish 100 mm x 15 mm | Thermo Fisher Scientific | 60872-310 | Gridded petri dishes allow for more efficient identification of follicles |
| SsoAdvanced Universal SYBR Green Supermix | BioRad | 1725271 | Mastermix for PCR reaction |
| Steritop Threaded Bottle Top Filter | Sigma-Aldrich | S2GPT02RE | Used to sterilize follicle wash medium |
| SYBR-safe DNA gel stain | Thermo Fisher Scientific | S33102 | Staining to visual PCR products on agarose gel |
| TCM199 with Hank’s Salts | Gibco | 12-350-039 | Component of follicle wash medium |
| Triton X-100 | Fisher Scientific | BP151-100 | Detergent for immunostaining permeabilization buffer |
| Trizol reagent | Thermo Fisher Scientific | 15596026 | RNA isolation reagent |
| Trypan Blue Solution, 0.4% | Gibco | 15-250-061 | Used for testing viability of isolated follicles |
| Tween 20 | Detergent for immunostaining wash buffer | ||
| Warmer Plate Universal | WTA | 20931 | Warm plate to keep follicles at 38.5 °C while searching under the microscope |
| Wiretrol II Calibrated Micropipets | Drummond | 50002-005 | Glass micropipettes to manipulate follicles |
Riferimenti
- Fortune, J. E., Yang, M. Y., Allen, J. J., Herrick, S. L. Triennial reproduction symposium: The ovarian follicular reserve in cattle: What regulates its formation and size. Journal of Animal Science. 91 (7), 3041-3050 (2013).
- Fair, T., Hulshof, S. C., Hyttel, P., Greve, T., Boland, M. Oocyte ultrastructure in bovine primordial to early tertiary follicles. Anatomy and Embryology. 195 (4), 327-336 (1997).
- Jaffe, L. A., Egbert, J. R. Regulation of mammalian oocyte meiosis by intercellular communication within the ovarian follicle. Annual Review of Physiology. 79, 237-260 (2017).
- Driancourt, M. A., Reynaud, K., Cortvrindt, R., Smitz, J. Roles of KIT and KIT LIGAND in ovarian function. Reviews of Reproduction. 5 (3), 143-152 (2000).
- Lussier, J. G., Matton, P., Dufour, J. J. Growth rates of follicles in the ovary of the cow. Journal of Reproductive Fertility. 81 (2), 301-307 (1987).
- Aerts, J. M. J., Bols, P. E. J. Ovarian follicular dynamics: a review with emphasis on the bovine species. Part I: Folliculogenesis and preantral follicle development. Reproduction in Domestic Animals. 45 (1), 171-179 (2010).
- Sugiura, K., Pendola, F. L., Eppig, J. J. Oocyte control of metabolic cooperativity between oocytes and companion granulosa cells: energy metabolism. Developmental Biology. 279 (1), 20-30 (2005).
- Eppig, J. J., Pendola, F. L., Wigglesworth, K., Pendola, J. K. Mouse oocytes regulate metabolic cooperativity between granulosa cells and oocytes: amino acid transport. Biology of Reproduction. 73 (2), 351-357 (2005).
- Sugimura, S., et al. Amphiregulin co-operates with bone morphogenetic protein 15 to increase bovine oocyte developmental competence: effects on gap junction-mediated metabolite supply. Molecular Human Reproduction. 20 (6), 499-513 (2014).
- Edson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Matzuk, M. M., Burns, K. H. Genetics of mammalian reproduction: modeling the end of the germline. Annual Review of Physiology. 74, 503-528 (2012).
- McGee, E. A., Raj, R. S. Regulators of ovarian preantral follicle development. Seminars in Reproductive Medicine. 33 (3), 179-184 (2015).
- Chen, Y., et al. The factors and pathways regulating the activation of mammalian primordial follicles in vivo. Frontiers in Cell and Developmental Biology. 8, 575706(2020).
- Figueiredo, J. R., et al. Development of a combined new mechanical and enzymatic method for the isolation of intact preantral follicles from fetal, calf and adult bovine ovaries. Theriogenology. 40 (4), 789-799 (1993).
- Sirard, M. A. The ovarian follicle of cows as a model for human. Animal Models and Human Reproduction. , 127-144 (2017).
- Parkes, W. S., et al. Hyaluronan and collagen are prominent extracellular matrix components in bovine and porcine ovaries. Genes. 12 (8), 1186(2021).
- Araújo, V. R., Gastal, M. O., Figueiredo, J. R., Gastal, E. L. In vitro culture of bovine preantral follicles: a review. Reproductive Biology and Endocrinology. 12 (1), 1-14 (2014).
- Eppig, J. J., Schroeder, A. C. Capacity of mouse oocytes from preantral follicles to undergo embryogenesis and development to live young after growth, maturation, and fertilization in vitro. Biology of Reproduction. 41 (2), 268-276 (1989).
- McLaughlin, M., Telfer, E. E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Nuttinck, F., Mermillod, P., Massip, A., Dessy, F. Characterization of in vitro growth of bovine preantral ovarian follicles: A preliminary study. Theriogenology. 39 (4), 811-821 (1993).
- Demeestere, I., et al. Effect of preantral follicle isolation technique on in-vitro follicular growth, oocyte maturation and embryo development in mice. Human Reproduction. 17 (8), 2152-2159 (2002).
- Fattahi, A., et al. Optimization of porcine ovarian follicle isolation methods for better developmental potential. Tissue Engineering Part A. 26 (13-14), 712-719 (2020).
- Nagashima, J. B., Hill, A. M., Songsasen, N. In vitro development of mechanically and enzymatically isolated cat ovarian follicles. Reproduction and Fertility. 2 (1), 35-46 (2021).
- Lucci, C. M., Rumpf, R., Figueiredo, J. R., Báo, S. N. Zebu (Bos indicus) ovarian preantral follicles: Morphological characterization and development of an efficient isolation method. Theriogenology. 57 (5), 1467-1483 (2002).
- Langbeen, A., et al. Characterization of freshly retrieved preantral follicles using a low-invasive, mechanical isolation method extended to different ruminant species. Zygote. 23 (5), 683-694 (2014).
- Candelaria, J. I., Denicol, A. C. Characterization of isolated bovine preantral follicles based on morphology, diameter and cell number. Zygote. 28 (2), 154-159 (2020).
- vanden Hurk, R., et al. Ultrastructure and viability of isolated bovine preantral follicles. Human Reproduction Update. 4 (6), 833-841 (1998).
- Paes, V. M., et al. Effect of heat stress on the survival and development of in vitro cultured bovine preantral follicles and on in vitro maturation of cumulus-oocyte complex. Theriogenology. 86 (4), 994-1003 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological image analysis. Nature Methods. 9 (7), 676-682 (2012).
- de Aguiar, L. H., Hyde, K. A., Pedroza, G. H., Denicol, A. C. Heat stress impairs in vitro development of preantral follicles of cattle. Animal Reproduction Science. 213, 106277(2020).
- Kristensen, S. G., Ebbesen, P., Andersen, C. Y. Transcriptional profiling of five isolated size-matched stages of human preantral follicles. Molecular and Cellular Endocrinology. 401, 189-201 (2015).
- Candelaria, J. I., Rabaglino, M. B., Denicol, A. C. Ovarian preantral follicles are responsive to FSH as early as the primary stage of development. Journal of Endocrinology. 247 (2), 153-168 (2020).
- Nuttinck, F., et al. Comparative immunohistochemical distribution of Connexin 37 and Connexin 43 throughout folliculogenesis in the bovine ovary. Molecular Reproduction and Development. 57 (1), 60-66 (2000).
- Itoh, T., Hoshi, H. Efficient isolation and long-term viability of bovine small preantral follicles in vitro. In Vitro Cellular and Developmental Biology-Animal. 36 (4), 235-240 (2000).
- Saha, S., Shimizu, M., Geshi, M., Izaike, Y. In vitro culture of bovine preantral follicles. Animal Reproduction Science. 63 (1-2), 27-39 (2000).
- Bus, A., et al. Preservation of connexin 43 and transzonal projections in isolated bovine pre-antral follicles before and following vitrification. Journal of Assisted Reproduction and Genetics. 38 (2), 479-492 (2021).
- Gougeon, A., Ecochard, R., Thalabard, J. C. Age-related changes of the population of human ovarian follicles: increase in the disappearance rate of non-growing and early-growing follicles in aging women. Biology of Reproduction. 50 (3), 653-663 (1994).
- Xu, D., et al. Raf-ERK1/2 signaling pathways mediate steroid hormone synthesis in bovine ovarian granulosa cells. Reproduction in Domestic Animals. 54 (5), 741-749 (2019).
- Santos, R. R., et al. Cryopreservation of ovarian tissue: an emerging technology for female germline preservation of endangered species and breeds. Animal Reproduction Science. 122 (3-4), 151-163 (2010).
- Leonel, E. C. R., Lucci, C. M., Amorim, C. A. Cryopreservation of human ovarian tissue: a review. Transfusion Medicine and Hemotherapy. 46 (3), 173-181 (2019).
- Bus, A., Langbeen, A., Martin, B., Leroy, J. I. M. R., Bols, P. E. J. Is the pre-antral ovarian follicle the 'holy grail' for female fertility preservation. Animal Reproduction Science. 207, 119-130 (2019).
- Chen, J., et al. Optimization of follicle isolation for bioengineering of human artificial ovary. Biopreservation and Biobanking. , (2021).
- Chiti, M. C., et al. A modified and tailored human follicle isolation procedure improves follicle recovery and survival. Journal of Ovarian Research. 10 (1), 1-9 (2017).
- Kristensen, S. G., Rasmussen, A., Byskov, A. G., Andersen, C. Y. Isolation of pre-antral follicles from human ovarian medulla tissue. Human Reproduction. 26 (1), 157-166 (2011).
- Oktay, K., et al. Isolation and characterization of primordial follicles from fresh and cryopreserved human ovarian tissue. Fertility and Sterility. 67 (3), 481-486 (1997).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon