È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Controllo della frazione di particelle in scaffold di particelle ricotto microporose per colture cellulari 3D
In questo articolo
Riepilogo
Ridurre al minimo la variabilità della frazione di particelle all'interno di scaffold granulari facilita la sperimentazione riproducibile. Questo lavoro descrive i metodi per generare scaffold granulari con frazioni di particelle controllate per applicazioni di ingegneria tissutale in vitro .
Abstract
I microgel sono gli elementi costitutivi degli scaffold di particelle ricotto microporose (MAP), che fungono da piattaforma sia per la coltura cellulare in vitro che per la riparazione dei tessuti in vivo . In questi scaffold granulari, la porosità innata generata dallo spazio vuoto tra i microgel consente l'infiltrazione e la migrazione cellulare. Il controllo della frazione di vuoto e della frazione di particelle è fondamentale per la progettazione dello scaffold MAP, poiché la porosità è un segnale bioattivo per le cellule. I microgel sferici possono essere generati su un dispositivo microfluidico per dimensioni e forma controllate e successivamente liofilizzati utilizzando metodi che impediscono la fratturazione della rete polimerica. Dopo la reidratazione, i microgel liofilizzati portano a frazioni di particelle controllate negli scaffold MAP. L'implementazione di questi metodi per la liofilizzazione dei microgel ha portato a studi riproducibili che mostrano l'effetto della frazione particellare sulla diffusione delle macromolecole e sulla diffusione cellulare. Il seguente protocollo coprirà la fabbricazione, la liofilizzazione e la reidratazione di microgel per il controllo della frazione di particelle negli scaffold MAP, nonché la ricottura dei microgel attraverso la reticolazione bio-ortogonale per la coltura cellulare 3D in vitro.
Introduzione
Gli scaffold di particelle ricotto microporose (MAP) sono una sottoclasse di materiali granulari in cui i blocchi di costruzione del microgel (μgel) sono interconnessi per formare un'impalcatura porosa e di massa. Con la microarchitettura unica di questi scaffold granulari, la porosità innata generata dallo spazio vuoto tra microgel sferici interconnessi supporta l'infiltrazione e la migrazione accelerata delle cellule1. Gli elementi costitutivi in microgel degli scaffold MAP possono essere fabbricati da polimeri sia sintetici che naturali con modifiche chimiche2. I metodi qui descritti evidenziano specificamente l'uso di microgel costituiti da una spina dorsale di acido ialuronico (HA) modificata con maniglie funzionali di norbornene (NB). L'impugnatura funzionale NB sul polimero HA supporta le reazioni di chimica dei clic per formare microgel e collegarli insieme per generare scaffold MAP 3,4. Sono stati impiegati numerosi schemi per collegare insieme i microgel (cioè la ricottura), come l'enzima1, laluce 5,6 e le reazioni di chimica a scatto 3,7 senza additivo. La chimica dei clic senza additivi è descritta in questo lavoro, usando la coniugazione Diels-Alder della domanda inversa di elettroni tetrazina-norbornene per interconnettere i microgel HA-NB.
Per fabbricare scaffold MAP, gli utenti generano prima i mattoni del microgel utilizzando emulsioni inverse in sistemi batch o all'interno di dispositivi microfluidici, nonché con spruzzatura elettroidrodinamica, litografia o frammentazione meccanica2. La produzione di microgel sferici HA-NB è stata ben descritta e precedentemente riportata utilizzando sia l'emulsione batch2 che le tecniche di generazione di goccioline microfluidiche 8,9,10,11. In questo lavoro, microgel sferici HA-NB sono stati generati su una piattaforma microfluidica focalizzata sul flusso per dimensioni e forma controllate, come precedentemente descritto 8,9,10. Dopo la purificazione, i microgel esistono in sospensione acquosa e devono essere concentrati per indurre uno stato di inceppamento. Quando sono bloccati, i microgel presentano proprietà di assottigliamento del taglio, che consentono loro di funzionare come materiali iniettabili che riempiono lo spazio1. Un metodo per indurre uno stato inceppato è quello di asciugare i microgel tramite liofilizzazione o liofilizzazione, quindi successivamente reidratare il prodotto essiccato in un volume controllato12. In alternativa, il tampone in eccesso può essere rimosso dal liquame di microgel tramite centrifugazione su un filtro o con rimozione manuale del tampone dal pellet di microgel mediante aspirazione o utilizzando un materiale assorbente. Tuttavia, l'uso della centrifugazione per asciugare i microgel può generare una gamma altamente variabile di frazioni di particelle e frazioni vuote quando si effettuano scaffold granulari12. Sono state descritte tecniche per la liofilizzazione dei microgel utilizzando il 70% di IPA per microgel di polietilenglicole (PEG)13, oli fluorurati per microgel di gelatina metacriloile (GelMa) 14 e etanolo al 70% per microgel HA12. Questo protocollo evidenzia i metodi per la liofilizzazione dei microgel sferici HA utilizzando il 70% di etanolo, un reagente di laboratorio standard, per mantenere le proprietà originali del microgel durante il processo di essiccazione. I microgel di HA liofilizzati possono essere pesati e reidratati a percentuali di peso definite dall'utente per controllare le frazioni finali di particelle negli scaffold MAP12.
La fase finale nella formazione dello scaffold MAP si basa sulla ricottura dei microgel per creare un'impalcatura massiccia e porosa1. Utilizzando componenti nativi della matrice extracellulare e impiegando schemi di ricottura bio-ortogonale, gli scaffold MAP fungono da piattaforma biocompatibile sia per la coltura cellulare in vitro che per la riparazione tissutale in vivo 3. Attraverso questi approcci, gli scaffold MAP possono essere fabbricati da blocchi di costruzione HA-NB con frazioni di particelle definite dall'utente per il loro impiego in applicazioni di ingegneria tissutale12. Il seguente protocollo descrive la produzione microfluidica di microgel HA-NB seguita da liofilizzazione e reidratazione per il controllo della frazione di particelle negli scaffold MAP. Infine, i passaggi per la ricottura dei microgel sono descritti utilizzando la chimica bio-ortogonale per esperimenti di coltura cellulare 3D in vitro .
Protocollo
1. Fabbricazione di dispositivi microfluidici
- Litografia morbida
NOTA: Questo protocollo descrive la fabbricazione di un dispositivo microfluidico focalizzato sul flusso progettato da de Wilson et al.9. Tuttavia, questo protocollo può essere utilizzato con qualsiasi progetto di dispositivo su un wafer SU-8. Il wafer può essere collegato a una capsula di Petri e quindi deve essere silanizzato per impedire l'aderenza del PDMS alle caratteristiche del wafer15.- Miscelare la base di elastomero di polidimetilsilossano (PDMS) con l'agente di polimerizzazione (vedere la tabella dei materiali) in rapporto 10:1. Preparare circa 100 g per coprire il wafer con ~5 mm PDMS. Versare la miscela PDMS sul wafer e degassare in un essiccatore per circa 30 minuti. Una volta che tutte le bolle sono sparite, mettere in forno a 60 °C per almeno 2 ore per polimerizzare il PDMS.
- Utilizzare un coltello per tracciare delicatamente il parametro del dispositivo senza rompere il wafer; quindi, staccare con cautela il PDMS dal wafer. Utilizzare un punzone per biopsia da 1 mm (vedere Tabella dei materiali) per creare i canali di ingresso e uscita.
NOTA: Sii delicato quando punzecchia il dispositivo microfluidico. Strappe o strappi attorno ai canali di ingresso o di uscita possono causare perdite durante la produzione di microgel. - Utilizzare del nastro adesivo per rimuovere la polvere dal dispositivo sul lato della funzione. Posizionare i dispositivi e pulire i vetrini su una piastra calda a 135 °C per almeno 15 minuti per rimuovere l'umidità.
- In una cappa aspirante, utilizzare una pistola al plasma corona (vedi Tabella dei materiali) in alto sia sui vetrini che sui dispositivi (lato esposto con caratteristica) per circa 30 secondi, quindi incollarli rapidamente insieme. Applicare delicatamente una pressione per garantire una buona tenuta tra il dispositivo e il vetrino. Posizionare i dispositivi in un forno a 60 °C durante la notte per fissare il legame.
2. Produzione microfluidica di microgel di acido ialuronico (HA) con maniglie funzionali norbornene (NB)
- Sintesi di HA-NB
NOTA: La sintesi di HA-norbornene (HA-NB) è stata adattata da Darling et al.3 utilizzando 79 kDa di HA sodico con equivalenti molari di 1:1.5:2.5 di unità di ripetizione HA a 4-(4,6-dimetossi-1,3,5-triazin-2-il)-4-metilmorfolinio cloruro (DMTMM) a 5-norbornene-2-metilammina (NMA).- Pesare i reagenti. Sciogliere l'HA a 20 mg/ml in tampone MES da 200 mM (pH ~6) agitando in un becher o in un matraccio su una piastra di agitazione. Una volta sciolto, aggiungere il DMTMM alla soluzione di HA e lasciare reagire per circa 20 minuti a temperatura ambiente. Ad esempio, è possibile utilizzare 1 g di HA + 1,09 g DMTMM + 845 μL di NMA.
- Aggiungere NMA a goccia alla soluzione HA/DMTMM. Aggiungere il parafilm all'apertura del recipiente di reazione per ridurre al minimo l'evaporazione e coprire il recipiente di reazione con un foglio. Continuare ad agitare lasciando procedere la reazione per circa 24 ore.
- Dopo 24 ore, raffreddare l'etanolo a prova di 200 (circa 10 volte il volume di reazione). Su una piastra di agitazione, trasferire la reazione goccia a goccia all'etanolo refrigerato per precipitare l'HA-NB e continuare a mescolare a 200-300 giri / min per 20 minuti.
- Trasferire la soluzione in provette coniche da 50 ml, quindi centrifugare a 5.000 x g per 10 minuti. Versare l'etanolo in eccesso per smaltirlo come rifiuto. A questo punto, il prodotto HA-NB dovrebbe essere pellet bianco nei tubi conici. Tirare il vuoto sull'HA-NB in un essiccatore per asciugare durante la notte.
- Purificare l'HA-NB utilizzando tubi di dialisi di cellulosa a peso molecolare 12-14 kDa (vedi Tabella dei materiali). Sciogliere HA-NB in soluzione 2 M NaCl e trasferirlo nel tubo di dialisi. Legare il tubo e fissarlo con morsetti, se necessario. Trasferire il tubo di dialisi riempito in un secchio con 5 L di acqua ultrapura e dializzare l'HA-NB contro l'acqua durante la notte.
- Il giorno successivo, rimuovere l'acqua e sostituirla con una soluzione di NaCl 1 M per 30 minuti. Rimuovere la soluzione di NaCl e quindi dializzare con acqua ultrapura per 3 giorni, sostituendo l'acqua ogni giorno.
- Filtrare il prodotto dializzato utilizzando un filtro sottovuoto da 0,2 μm, quindi trasferire il prodotto filtrato in tubi conici da 50 ml.
- Aggiungere azoto liquido in un contenitore criogenico e congelare i tubi HA-NB per 10 minuti. Quindi, rimuovere i tubi conici con una pinza e rimuovere rapidamente il cappuccio e coprire con un tessuto di laboratorio (vedere Tabella dei materiali). Fissare il tessuto con un elastico e trasferirlo in un contenitore o camera di liofilizzazione (vedi Tabella dei materiali) e liofilizzare. Conservare il prodotto liofilizzato a -20 °C.
ATTENZIONE: L'azoto liquido è una sostanza pericolosa. Indossare i dispositivi di protezione individuale appropriati quando si lavora con azoto liquido. - Quantificare la modifica del norbornene dissolvendo l'HA-NB a 10 mg/ml in D2O e analizzando tramite NMR protonico (Figura 1A)16.
- Per determinare la quantità di funzionalizzazione, calibrare prima il picco del solvente D2O a 4,8 PPM. Integrare il picco per i protoni metilici HA (δ2.05) e calibrare l'integrazione a 3.0. Quindi, integrare i picchi per i gruppi norbornene pendenti a δ6.33 e δ6.02 (protoni vinilici, endo). Normalizzare l'integrazione di questi picchi al numero corrispondente di protoni per determinare il grado medio di modificazione3.
- Preparazione del precursore del microgel HA-NB
- Preparare un tampone HEPES da 50 mM (pH 7,5) e filtrare sterile il tampone utilizzando un filtro sottovuoto da 0,2 μm. Utilizzando il tampone HEPES, preparare le rispettive scorte di 50 mM di fenil(2,4,6,-trimetilbenzoil)fosfinato (LAP) foto-iniziatore e agente riducente tris(2-carbossietil)fosfina (TCEP). Tenere la soluzione LAP al riparo dalla luce.
- Preparare gli altri componenti precursori del microgel preparando le rispettive scorte di 50 mM di linker di-tiolo e peptide RGD in acqua distillata sterile. Pesare HA-NB e sciogliere in tampone HEPES per preparare una scorta di 10 mg/ml.
NOTA: Diversi linker di di-tiolo potrebbero essere utilizzati per la reticolazione interna dei microgel in base alle preferenze dell'utente. Sia un linker degradabile (cioè scissabile MMP) che non degradabile (ditiotreitolo o DTT) sono stati elencati nella tabella dei materiali. Il peptide RGD è incluso nella formulazione del microgel per promuovere l'adesione cellulare negli scaffold MAP, ma questo componente potrebbe essere rimosso e sostituito con un volume uguale di tampone HEPES. - Combinare i componenti precursori con concentrazioni finali di 9,9 mM LAP, 0,9375 mM TCEP (4 tiolo/TCEP), 2,8 mM di-tiolo linker, 1 mM RGD peptide e 3,5% in peso (p/v) HA-NB aggiungendo un tampone HEPES aggiuntivo per raggiungere il volume finale desiderato. Mescolare bene il precursore usando una pipetta a spostamento positivo.
- Utilizzando una pipetta P1000, sollevare lentamente l'intera miscela. Posizionare la punta sull'estremità di una siringa da 1 mL ed espellere la punta dalla pipetta. Tirare lo stantuffo della siringa per caricare la miscela nella siringa, quindi aggiungere un filtro da 0,2 μm all'estremità della siringa e filtrare in una nuova provetta da microcentrifuga da 1,5 ml. Centrifugare la soluzione precursore filtrata per rimuovere le bolle prodotte durante il filtraggio.
- Anche in questo caso, utilizzando una pipetta P1000, tirare lentamente verso l'alto il precursore filtrato facendo attenzione a non creare bolle. Se ci sono bolle, tocca delicatamente la punta per farle rimuovere e galleggiare verso l'alto.
- Posizionare la punta sull'estremità di una siringa da 1 mL ed espellere la punta dalla pipetta. Tenere la siringa verticale e tirare lentamente lo stantuffo della siringa fino a quando l'intera soluzione precursore è nella siringa. Aggiungere un ago a punta smussata alla siringa e spingere il precursore attraverso la punta dell'ago. Avvolgere la siringa in un foglio di alluminio per tenerla lontana dalla luce.
- Preparazione della soluzione di pizzicamento del microgel
- Preparare 5% v / v Span-80 in olio minerale bianco pesante e mescolare bene. Essiccare per rimuovere le bolle. Conservare la miscela tensioattivo/olio a temperatura ambiente avvolta in un foglio. Mescolare bene e asciugare prima di ogni utilizzo.
- Utilizzare una siringa da 5 mL per aspirare la miscela olio/tensioattivo (ridurre al minimo le bolle) fino a quando la distanza tra lo stantuffo e la presa è approssimativamente uguale alla distanza della siringa precursore. Aggiungere un ago smussato alla siringa e spingere l'olio attraverso la punta dell'ago.
- Configurazione del dispositivo microfluidico
- Aggiungere un ago smussato a una siringa da 1 mL e riempire con una soluzione sintetica di trattamento idrofobico (vedere Tabella dei materiali). Far scorrere delicatamente la soluzione attraverso il dispositivo microfluidico fino a quando non si accumula ad ogni ingresso/uscita. Lasciare asciugare la soluzione nel dispositivo sul piano di lavoro per circa 30 minuti, quindi tirare il vuoto sull'uscita per rimuovere la soluzione in eccesso. Fissare il dispositivo con morsetti su un microscopio da tavolo.
- Avvolgere un tubo conico da 15 mL con un foglio e metterlo in un rack per tubi per fungere da contenitore per la raccolta del microgel. Utilizzare un supporto ad anello con un morsetto per posizionare la sonda di luce UV nell'apertura del tubo di raccolta. Utilizzare un rilevatore UV (vedere la tabella dei materiali) per misurare l'intensità UV, spostando la sonda fino a raggiungere 20 mW/cm2 . Spegnere la luce UV fino a più tardi.
- Tagliare i tubi ad una lunghezza che si estenderà dal dispositivo microfluidico al contenitore di raccolta. Su un'estremità del tubo, tagliare un angolo di 45°. Inserire delicatamente l'estremità angolata del tubo nel canale di uscita.
NOTA: Essere delicati quando si inserisce il tubo nel dispositivo microfluidico. Strappe o strappi attorno ai canali di ingresso o di uscita possono causare perdite durante la produzione di microgel. - Fissare sia la siringa precursore che quella in fase oleosa su una pompa a doppia siringa (vedere la tabella dei materiali). Tagliare altri due pezzi di tubo a una lunghezza che raggiungerà dalle punte della siringa al dispositivo microfluidico. Su un'estremità di ciascun tubo, tagliare un angolo di 45°. Fissare con cura il tubo (estremità smussata) su entrambe le punte della siringa.
- Modificare le impostazioni sulla pompa per la siringa da 1 mL e includere il volume approssimativo del precursore. Spingere lentamente la pompa in avanti fino a quando non viene applicata una pressione sufficiente agli stantuffi della siringa per spingere sia l'olio che il precursore alle estremità del tubo, rimuovendo l'aria dal sistema. Lasciare che la pressione si equalizzi 5-10 minuti prima di passare al punto 2.4.6.
- Inserire delicatamente l'estremità angolata del tubo nei canali di ingresso del dispositivo microfluidico con la soluzione precursore del microgel nell'ingresso anteriore e l'olio di pizzicamento nell'ingresso posteriore. Spostare la pompa in avanti con piccoli incrementi fino a quando il flusso inizia nel dispositivo e i microgel sferici iniziano a formarsi nella regione di focalizzazione del flusso. Avviare la pompa con una portata di 0,4 μL/min e lasciare funzionare il dispositivo fino a quando non si stabilizza. Se necessario, regolare la portata ±0,1 μL/min con piccoli incrementi per stabilizzare la produzione di microgel.
- Una volta stabilizzata la produzione di microgel, come mostrato nella Figura 1B, sostituire il tubo di raccolta con un nuovo tubo e accendere la luce UV. Controllare periodicamente la corsa per assicurarsi che la produzione di microgel sia stabile per tutta la durata della corsa.
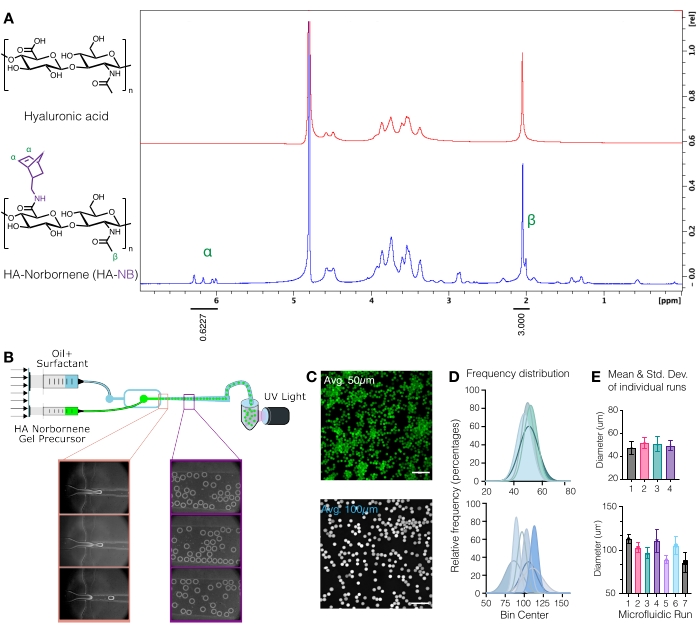
Figura 1: Produzione microfluidica di microgel di acido ialuronico (HA) con maniglie funzionali di norbornene (NB). (A) Circa il 31% delle unità di ripetizione HA sono state modificate con successo con NB, come determinato dall'analisi NMR protonica eseguita nell'ossido di deuterio. 1 Gli spostamenti NMR H dei norborneni pendenti a δ6,33 e δ6,02 (protoni vinilici, endo) e δ6,26 e δ6,23 ppm (protoni vinilici, eso) sono stati confrontati con il gruppo metilico HA δ2,05 ppm per determinare la funzionalizzazione. Ristampato da Anderson et al.12 con il permesso di Elsevier. (B) Schema del dispositivo microfluidico a focalizzazione del flusso utilizzato per generare μgel HA-NB. (C) Le proiezioni di massima intensità dalla microscopia confocale sono state utilizzate per visualizzare μgel marcati con fluorescenza (barra di scala = 500 μm). (D) Le distribuzioni di frequenza del diametro del microgel da corse indipendenti sulla configurazione microfluidica dimostrano il controllo sulla dimensione del microgel ~50 μm o ~100 μm a seconda del dispositivo utilizzato. (E) Il diametro del microgel è indicato come la media e la deviazione standard per ogni corsa indipendente. Ristampato da Wilson et al.9 con il permesso di Wiley. Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Microgel purificanti e essiccanti
- Purificazione dei microgel
- Preparare il tampone di lavaggio microgel (300 mM HEPES, 50 mM NaCl, 50 mM CaCl2) e il 2% (p/v) di soluzione tensioattiva Pluronic F-127 nel tampone di lavaggio. Sterilizzare le soluzioni utilizzando un filtro sottovuoto da 0,2 μm.
- Centrifugare la provetta di raccolta del microgel (5.000 x g) per 5 minuti. In una cappa sterile, aspirare con cura la fase di olio surnatante . Combinare μgel 1:1 con soluzione tensioattiva Pluronic F-127 al 2% e vortice per miscelare bene. Centrifugare (5.000 x g) per 5 minuti e aspirare la soluzione di lavaggio surnatante
- Aggiungere tampone di lavaggio a 4x volume di microgel e vortice per mescolare bene. Centrifugare (5.000 x g) la miscela per 5 minuti e aspirare la soluzione di lavaggio. Completare 4-8 lavaggi con il tampone di lavaggio fino a quando il tensioattivo non viene rimosso dal sistema (cioè non rimangono bolle).
- Etichettatura fluorescente dei microgel HA-NB
NOTA:La sintesi interna di una tetrazina marcata fluorescentmente si basa su due reazioni di addizione tiolo-Michael catalizzate da basi in serie che sono state ben descritte e precedentemente riportate3. Per questo lavoro, Alexa Fluor-488 è stato coniugato con tetrazina per l'etichettatura di μgel modificati con norbornene. Il prodotto liofilizzato (Alexa Flour 488-Tet) è stato sciolto in dimetilformammide a 1 mg/mL e conservato a -20 °C.- Per marcare in modo fluorescente i μgel, preparare prima una soluzione di lavoro di Alexa Fluor 488-Tet diluendo il brodo 1 mg/mL 1:14 in 1x PBS sterile. In una cappa sterile, combinare i μgel con la soluzione di lavoro (2:1 in volume).
- Utilizzare una pipetta di spostamento e mescolare bene. Incubare la miscela per 1 ora a temperatura ambiente o per una notte a 4 °C.
- Centrifugare (5.000 x g) e aspirare la soluzione colorante. Lavare i μgel due volte con 1x PBS (1:1 in volume) per rimuovere Alexa Fluor 488-Tet non reagito.
NOTA: A questo punto, i μgel marcati con fluorescenza possono essere visualizzati su un microscopio confocale per quantificare la dimensione del microgel (Figura 1C-E)9. I metodi per misurare le dimensioni del microgel sono stati accuratamente descritti da Roosa et al.17.
- Essiccazione di microgel HA-NB
- Trasferire μgel purificati (Figura 2A) in un tubo con tappo a vite criogenico utilizzando una pipetta volumetrica. Aggiungere etanolo al 70% ai μgel purificati al 50% (v/v) e mescolare bene con una pipetta di spostamento. Centrifugare per 5 minuti a 5.000 x g.
ATTENZIONE: L'etanolo è una sostanza altamente infiammabile.
NOTA: Il tubo con tappo a vite crio-sicuro può essere pesato prima di aggiungere μgel e quindi pesato nuovamente dopo la liofilizzazione per determinare la massa di μgel. Questo è raccomandato per ridurre al minimo l'errore quando si utilizzano quantità inferiori a 1 mg. Assicurarsi che la bilancia sia regolata o calibrata internamente prima dell'uso. - Aspirare il liquido surnatante e sostituirlo con etanolo al 70% (50% v/v) (Figura 2B). Mescolare bene con una pipetta di spostamento. Incubare per una notte a 4 °C.
NOTA: I microgel possono essere conservati in etanolo al 70% a 4 °C prima della liofilizzazione per la conservazione a lungo termine, se necessario. I microgel liofilizzati sono mostrati in Figura 2C. Altri mezzi di liofilizzazione possono essere utilizzati in questa fase se si desidera la formazione di criogel (Figura 2D). - Centrifugare brevemente per assicurarsi che i μgel siano sul fondo del tubo a vite. Aggiungere azoto liquido in un contenitore criogenico, quindi aggiungere il tubo di μgel al flash-freeze.
- Dopo 5-10 minuti, rimuovere il tubo di μgel con una pinza. Rimuovere rapidamente il cappuccio e coprire con un fazzoletto di qualità da laboratorio. Fissare il tessuto con un elastico e trasferirlo in un contenitore o camera di liofilizzazione.
- Caricare il campione sul liofilizzante seguendo le istruzioni del produttore. Liofilizzare a 0,066 Torr e -63 °C. Conservare i μgel liofilizzati (lyo-μgel) ben sigillati a temperatura ambiente.
NOTA: La liofilizzazione è completa quando tutto il liquido viene rimosso dal tubo e rimane un prodotto essiccato. I solventi organici possono ridurre la longevità dei dispositivi in gomma sui comuni sistemi di liofilizzazione.
- Trasferire μgel purificati (Figura 2A) in un tubo con tappo a vite criogenico utilizzando una pipetta volumetrica. Aggiungere etanolo al 70% ai μgel purificati al 50% (v/v) e mescolare bene con una pipetta di spostamento. Centrifugare per 5 minuti a 5.000 x g.
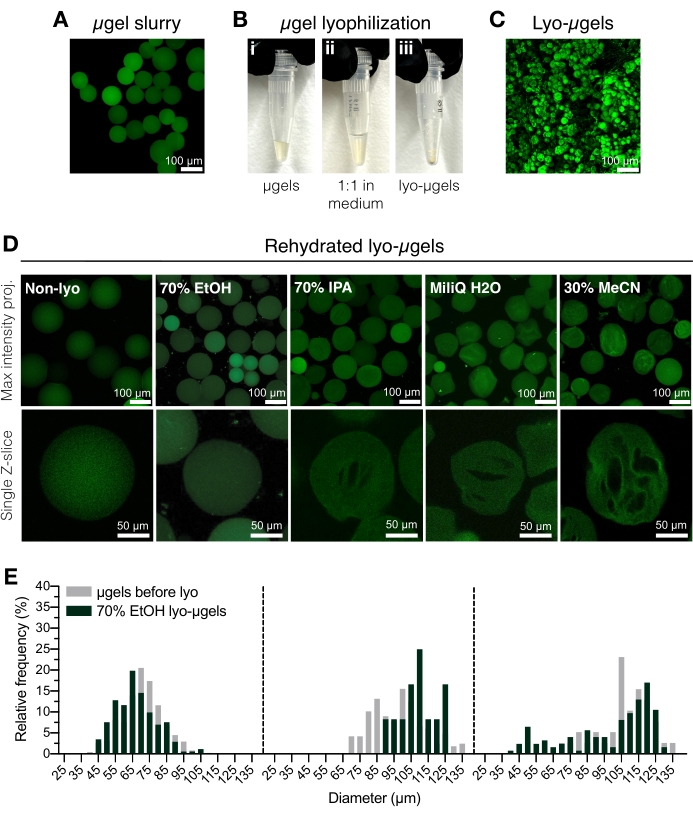
Figura 2: Essiccazione dei microgel HA-NB. (A) Proiezione di massima intensità di μgel in soluzione acquosa (barra di scala = 100 μm). (B) I μgel purificati possono essere incubati 1:1 in volume nel mezzo di liofilizzazione scelto e liofilizzati. (C) Proiezione di massima intensità di lyo-μgel essiccati (barra di scala = 100 μm). (D) I microgel vengono risospesi dopo la liofilizzazione. EtOH (70%) è raccomandato per mantenere le proprietà originali dei μgel durante tutto il processo di liofilizzazione; tuttavia, altri mezzi come l'alcol isopropilico (IPA), l'acqua e l'acetonitrile (MeCN) possono essere usati in modo intercambiabile per facilitare la formazione di criogel (barra di scala = 100 o 50 μm come notato). (E) Misura del diametro del microgel HA-NB prima (grigio) e dopo liofilizzazione (verde) in EtOH al 70% mostrato come distribuzioni di frequenza per tre popolazioni di microgel. Ristampato da Anderson et al.12 con il permesso di Elsevier. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Fabbricazione di impalcature MAP
- Sintesi del linker della tetrazina
NOTA: I linker della tetrazina possono essere usati per collegare μgel contenenti gruppi norbornenici liberi (Figura 3A). La procedura di sintesi di HA-tetrazina (HA-Tet) è stata adattata da Zhang et al.18 utilizzando 79 kDa di HA sodico con equivalenti molari di 1:1:0.25 di unità di ripetizione HA a DMTMM a tetrazina-ammina (Figura 3B) 12.- Pesare i reagenti. Sciogliere l'HA a 20 mg/ml in tampone MES da 200 mM (pH ~6) agitando in un becher o in un matraccio su una piastra di agitazione. Una volta sciolto, aggiungere il DMTMM alla soluzione di HA e lasciare reagire per circa 20 minuti a temperatura ambiente. Ad esempio, è possibile utilizzare 100 mg di HA + 72,8 mg di DMTMM + 14,14 mg di tetrazina-ammina.
- Sciogliere la tetrazina-ammina a 15 mg/ml in tampone MES da 200 mM e aggiungere goccia a goccia alla soluzione di HA/DMTMM. Fare riferimento alla Figura 3C per l'impostazione della reazione HA-Tet.
- Aggiungere il parafilm all'apertura del recipiente di reazione per ridurre al minimo l'evaporazione e coprire il recipiente di reazione con un foglio. Continuare ad agitare lasciando procedere la reazione per circa 24 ore.
- Dopo 24 ore, raffreddare l'etanolo a prova di 200 (circa 10 volte il volume di reazione). Su una piastra di agitazione, trasferire la reazione goccia per goccia all'etanolo refrigerato per precipitare l'HA-Tet (Figura 3D) e continuare a mescolare per 20 minuti.
- Trasferire la soluzione in provette coniche da 50 ml, quindi centrifugare a 5.000 x g per 10 minuti. Versare l'etanolo in eccesso per smaltirlo come rifiuto. Tirare il vuoto sull'HA-Tet in un essiccatore per asciugare durante la notte. Un esempio del prodotto essiccato in questa fase del protocollo può essere trovato nella Figura 3E.
- Purificare l'HA-Tet mediante dialisi. Sciogliere HA-Tet in soluzione di 2 M NaCl e trasferirlo in un tubo di dialisi di cellulosa con un cut-off di peso molecolare di 12-14 kDa. Trasferire il tubo di dialisi riempito in un secchio con 5 L di acqua ultrapura e dializzare l'HA-Tet contro l'acqua durante la notte.
- Il giorno successivo, rimuovere l'acqua e sostituirla con una soluzione di NaCl 1 M per 30 minuti. Rimuovere la soluzione di NaCl e quindi dializzare con acqua ultrapura per 3 giorni, sostituendo l'acqua ogni giorno.
- Filtrare il prodotto dializzato utilizzando un filtro sottovuoto da 0,2 μm, quindi trasferire il prodotto HA-Tet filtrato in tubi conici da 50 ml.
- Congelare i tubi conici in azoto liquido per 10 minuti, quindi rimuovere i tubi conici con una pinza. Rimuovere rapidamente il cappuccio e coprire con un fazzoletto di qualità da laboratorio. Fissare il tessuto con un elastico e trasferirlo in un contenitore o camera di liofilizzazione e liofilizzare. Conservare il prodotto liofilizzato (Figura 3F) a -20 °C.
- Quantificare la modifica della tetrazina dissolvendo l'HA-Tet a 10 mg/ml in D2O e analizzando tramite NMR protonico (Figura 3G)16.
- Per determinare la quantità di funzionalizzazione, calibrare prima il picco del solvente D2O a 4,8 PPM. Integrare il picco per i protoni metilici HA (δ2.05) e calibrare l'integrazione a 3.0. Quindi, integrare i picchi per i gruppi tetrazina pendenti a δ8,5 (2H) e δ7,7 (2H) (protoni aromatici). Normalizzare l'integrazione di questi picchi al numero corrispondente di protoni per determinare il grado medio di modificazione12.
- Collegamento di lyo-μgel per formare scaffold MAP per la caratterizzazione
- Preparare i componenti dello scaffold MAP (ad esempio, μgel, HA-Tet, volume di reidratazione). Pesare i lyo-μgel (Figura 4A) e ricostituire nell'84% il volume finale MAP di 1x PBS. Lasciare gonfiare i microgel per circa 20 minuti (Figura 4B,C). Il MAP wt% utilizzato per la reidratazione può essere scelto in base alla preferenza dell'utente per la frazione finale di particelle (fare riferimento alla Figura 4D, E).
- Sciogliere l'HA-Tet in 1x PBS alla concentrazione scelta (vedere NOTA sotto).
NOTA: La modifica sia della frazione di imballaggio (tramite wt% MAP) che della concentrazione di HA-Tet altererà le proprietà meccaniche dello scaffold sfuso. Ad esempio, uno scaffold MAP del 3,4% in peso reticolato con 0,02 mg/mL di HA-Tet (rapporto di ricottura di 2,6 mol Tet:mol HA-NB) genera scaffold MAP con circa 700 Pa modulo di stoccaggio di taglio12. - Utilizzare una pipetta di spostamento per combinare l'HA-Tet e i lyo-μgel e mescolare bene. A questo punto, la miscela può essere trasferita tramite pipetta di spostamento su vetrini, piastre di pozzetto o un contenitore a scelta dell'utente. Lasciare ricottura μgel a 37 °C per 25 minuti, quindi utilizzare una spatola per trasferire gli scaffold MAP su piastre riempite con 1x PBS. Conservare gli scaffold MAP in 1x PBS fino al momento della caratterizzazione.
- Calcolo della frazione di particelle dello scaffold MAP
- Per una migliore qualità dell'immagine, trasferire lo scaffold MAP su un vetrino di vetro utilizzando una spatola. Scaffold MAP di immagini su un microscopio confocale che utilizza il laser per l'eccitazione e l'emissione FITC. Image MAP scaffolds su un obiettivo 20x e ottenere uno Z-stack che attraversa 250-300 μm nella direzione Z con una dimensione del passo di 2,5 μm. Prendi nota della calibrazione μm/pixel dell'immagine.
- Importare l'immagine Z-stack nel software di analisi (vedere Tabella dei materiali). Selezionate il pulsante Aggiungi nuove superfici (Add New Surfaces ). Seleziona la casella Segmenta solo un'area di interesse, quindi seleziona il pulsante freccia blu Avanti: Regione di interesse.
- Definire una regione di interesse, tenendo traccia delle dimensioni X, Y e Z del volume analizzato. Selezionare il pulsante freccia blu Avanti: Canale sorgente.
NOTA: le dimensioni X e Y sono espresse in unità di pixel, mentre la dimensione Z rappresenta il numero di passaggi. Un'altezza Z consigliata per la regione di interesse dovrebbe includere un minimo di due μgel. - Utilizzare l'elenco a discesa Canale di origine per selezionare il canale FITC. Seleziona la casella accanto a Liscio e inserisci un dettaglio della superficie di 2,50 μm. In Soglie selezionare Intensità assoluta, quindi selezionare il pulsante freccia blu Avanti: Soglia.
- Utilizzare il valore di soglia suggerito per il canale FITC. Ruotare la proiezione 3D per valutare la qualità del rendering e regolarla in base alle esigenze. Selezionare Avanti: Classifica superfici.
NOTA: il pulsante Indietro può essere utilizzato per modificare i passaggi precedenti del processo, ad esempio la dimensione Z, in base alle esigenze. - Controllare se Numero di voxel è 10.0, quindi selezionare il pulsante verde a doppia freccia Fine: eseguire tutti i passaggi di creazione e terminare la procedura guidata.
NOTA: i parametri di rendering del volume possono essere memorizzati per l'analisi batch in modo che vengano applicate le stesse impostazioni per analizzare tutti gli scaffold. - Per esportare i dati, selezionare la scheda Statistiche e quindi la scheda Dettagliati . Utilizzare la seconda casella a discesa per selezionare la variabile Volume. Selezionare il pulsante del disco floppy Esporta statistiche su Tab Display su file e salvarle come file di foglio di calcolo (.xls) quando richiesto.
- Aprire il file e utilizzare la funzione SOMMA sul volume della colonna A per determinare il volume totale (μm3) dei μgel nella regione di interesse.
- Converti le dimensioni della regione di interesse analizzata da pixel a μm. Utilizzare la calibrazione μm/pixel dell'immagine dal punto 4.3.1 per convertire le dimensioni X e Y. Moltiplicare la dimensione Z (numero di passi) per la dimensione del passo affinché l'immagine converta la dimensione Z in μm. Calcola il volume della regione di interesse (μm3) moltiplicando le dimensioni X, Y e Z.
- Per determinare la frazione di particelle dello scaffold, dividere il volume totale dei μgel nella regione di interesse (trovato nel punto 4.3.8) per il volume della regione di interesse (trovato nel punto 4.3.9).
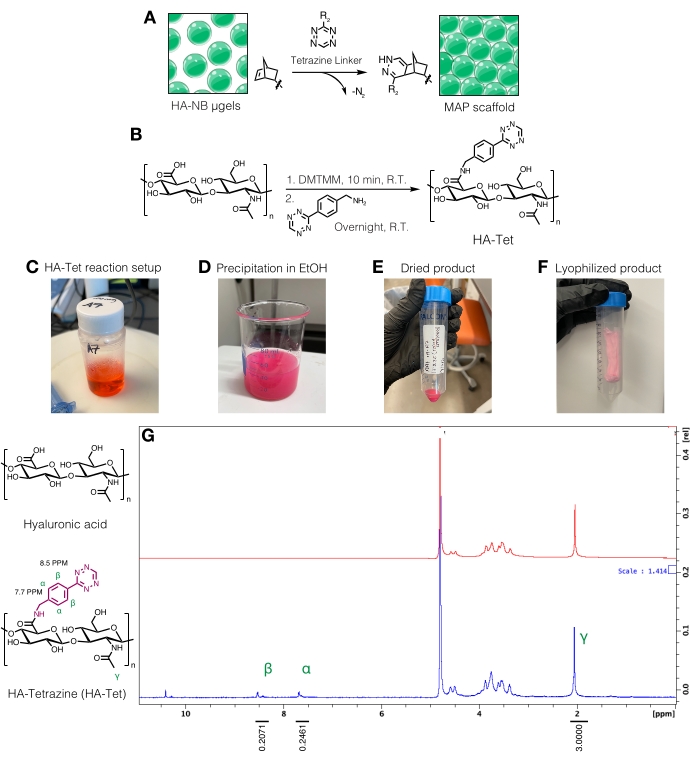
Figura 3: Sintesi del linker della tetrazina per la fabbricazione di scaffold di particelle ricotto microporose (MAP). (A) Schema dei μgel HA-NB interconnessi con un linker tetrazina per formare scaffold MAP. (B) Schema di reazione per la sintesi di HA-Tet. (C) La reazione HA-Tet è stata impostata e lasciata reagire durante la notte seguita da (D) precipitazione di HA-Tet in etanolo. (E) Una volta purificato ed essiccato, l'HA-Tet è stato reidratato e liofilizzato per produrre (F) un prodotto essiccato di colore rosa chiaro. (G) L'analisi NMR protonica mostra una modifica riuscita dell'11% delle unità ripetute HA. Ristampato da Anderson et al.12 con il permesso di Elsevier. Fare clic qui per visualizzare una versione ingrandita di questa figura.
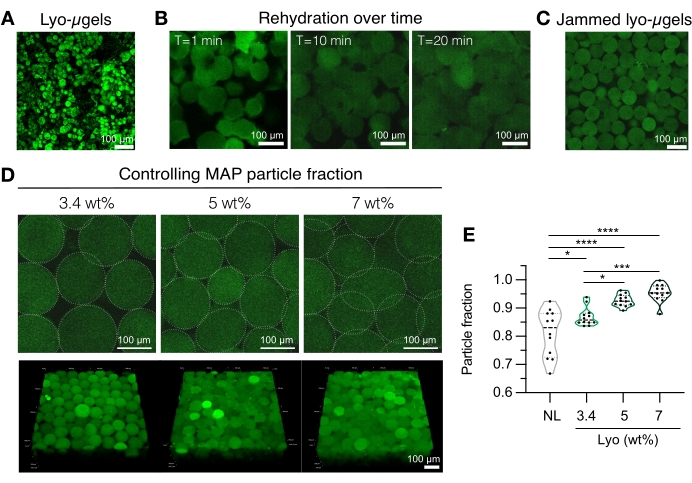
Figura 4: Reidratazione di microgel liofilizzati per la fabbricazione di scaffold MAP. (A) Proiezione di massima intensità di lyo-μgel essiccati (barra di scala = 100 μm). (B) Dopo la liofilizzazione, la reidratazione dei lyo-μgel richiede circa 20 minuti (barra della scala = 100 μm). (C) I Lyo-μgel possono essere reidratati a diverse wt% MAP per produrre μgel inceppati (barra di scala = 100 μm). (D) L'aumento del MAP in peso durante la reidratazione dei lyo-μgel altera la frazione di particelle negli scaffold MAP, come mostrato da singole fette Z di scaffold MAP e proiezioni di volume (barra di scala = 100 μm). (E) Utilizzando questi scaffold wt% MAP definiti dall'utente, è possibile ottenere frazioni di particelle uniche (NL = μgel non liofilizzati). Sui campioni è stato eseguito un ANOVA unidirezionale con Tukey HSD (n = 3), con significatività riportata a p < 0,05 (*), p < 0,01 (**), p < 0,005 (***) e p < 0,001 (****). Ristampato da Anderson et al.12 con il permesso di Elsevier. Fare clic qui per visualizzare una versione ingrandita di questa figura.
5.3D Coltura cellulare in scaffold MAP
- Preparare dispositivi di coltura cellulare
- Per creare un dispositivo di coltura cellulare personalizzato per questi esperimenti (Figura 5A-C), utilizzare una stampante 3D per stampare uno stampo negativo utilizzando il file CAD disponibile nel file di codifica supplementare 1.
NOTA: Le dimensioni del dispositivo di coltura cellulare sono le seguenti: 94,9 mm x 94,9 mm x 4,8 mm con un'altezza totale del pozzo di 2,6 mm. Il diametro dei pozzetti interni e dei pozzetti esterni è rispettivamente di 4 mm e 6 mm. - Mescolare la base di elastomero di polidimetilsilossano (PDMS) con l'agente di polimerizzazione con un rapporto di 10: 1 in massa. Versare la miscela PDMS in una grande capsula di Petri di plastica e degassare in un essiccatore per circa 30 minuti o fino a quando tutte le bolle sono scomparse.
- Una volta che tutte le bolle sono scomparse, posizionare con cura lo stampo stampato in 3D nel PDMS per ridurre al minimo la formazione di nuove bolle. Mettere in forno a 60 °C per almeno 2 ore per polimerizzare il PDMS.
- Utilizzare un coltello o una lama di rasoio per tracciare delicatamente il parametro del dispositivo di coltura, quindi rimuovere con attenzione lo stampo. Utilizzare un punzone bioptico da 4 mm per rimuovere qualsiasi PDMS dal fondo dei pozzetti. Tagliare i dispositivi per adattarli a una copertina di vetro.
NOTA: i dispositivi di coltura cellulare possono anche essere incollati a vetrini, ma i vetrini migliorano l'imaging dei campioni. - Utilizzare del nastro adesivo per rimuovere la polvere dal lato inferiore dei dispositivi di coltura. Posizionare i vetrini di vetro puliti e i dispositivi di coltura (lato inferiore verso l'alto) su una piastra calda a 135 °C per almeno 15 minuti per rimuovere l'umidità.
- In una cappa aspirante, utilizzare una pistola al plasma corona in alto sia sul coprislip di vetro che sul lato inferiore del dispositivo per 30 s, quindi incollare rapidamente le superfici trattate. Applicare delicatamente una pressione per garantire una buona tenuta tra il dispositivo di coltura e il vetrino.
- Ripetere il punto 5.1.6 per tutti i dispositivi, quindi metterli in forno a 60 °C per una notte per fissare il legame. Autoclavare i dispositivi da sterilizzare prima dell'uso in vitro.
- Per creare un dispositivo di coltura cellulare personalizzato per questi esperimenti (Figura 5A-C), utilizzare una stampante 3D per stampare uno stampo negativo utilizzando il file CAD disponibile nel file di codifica supplementare 1.
- Coltura cellulare in scaffold MAP
- Preparare i componenti dello scaffold MAP (cioè μgel, HA-Tet, volume del supporto) in base alla frazione di particelle desiderata (fare riferimento alla Figura 4D-E). Pesare i lyo-μgel in una cappa sterile e ricostituire nell'84% il volume finale di MAP dei terreni cellulari in base al MAP scelto in wt%. Lasciare gonfiare i μgel per circa 20 minuti.
NOTA: Questi metodi richiedono all'utente di pesare il prodotto lyo-microgel per la reidratazione. Per piccole masse (1 mg o meno), si consiglia di pesare prima il criotubo prima di aggiungere e liofilizzare μgel, quindi ripesare il tubo dopo la liofilizzazione per determinare la massa del prodotto per ridurre al minimo l'errore. - Sciogliere l'HA-Tet nei supporti cellulari nel 16% del volume finale del MAP.
NOTA: i seguenti passaggi per preparare le celle per la semina negli scaffold MAP possono essere modificati a seconda del tipo di cella utilizzato. In questo protocollo, le cellule mesenchimali di topo D1 sono state coltivate nel Modified Eagle Medium (DMEM) di Dulbecco integrato con l'1% di penicillina-streptomicina (pen-streptococco) e il 10% di siero bovino fetale (FBS) (vedi Tabella dei materiali). Per queste cellule devono essere seguiti protocolli standard di coltura cellulare aderente, mantenendo le colture a 37 °C e al 5% di CO2 nei vasi di coltura trattati con colture tissutali. - Una volta che le cellule mesenchimali del topo D1 hanno raggiunto il 70% -80% di confluenza, aspirare il mezzo e lavare le cellule con 1x PBS. Sollevare le cellule aggiungendo un volume sufficiente di tripsina-EDTA all'1% per coprire la superficie del vaso di coltura tissutale. Incubare a 37 °C per 1-3 minuti, quindi estinguere la tripsinizzazione aggiungendo DMEM media integrati con 1% di pen-streptococco e 10% FBS a 2 volte il volume di tripsina-EDTA.
- Centrifugare la sospensione cellulare a 100 x g per 5 minuti a temperatura ambiente per pellettare le celle. Aspirare il mezzo surnatante e risospendere le cellule in 1 mL di DMEM media integrato con 1% di pen-streptococco e 10% FBS.
- Assicurarsi che la sospensione cellulare sia ben miscelata, quindi trasferire 20 μL in una nuova provetta per microcentrifuga. Aggiungere 20 μL di soluzione di tripano blu e mescolare bene. Utilizzare 20 μL di questa miscela per contare le cellule utilizzando un emocitometro o un contatore automatico delle cellule con vetrini della camera di conteggio delle cellule.
- Trasferire il numero di cellule necessarie per la semina di 10.000 cellule/μL MAP in una nuova provetta per microcentrifuga. Centrifugare a 100 x g per 5 minuti a temperatura ambiente per pellettare le celle. Aspirare con attenzione il mezzo surnatante dal pellet cellulare senza aspirare le cellule.
- Aggiungere i μgel e il reticolante al pellet cellulare con una pipetta di spostamento. Mescolare bene con una pipetta di spostamento, quindi seminare 10 μL della miscela per pozzetto. Durante la placcatura, pipettare con un movimento circolare per distribuire uniformemente la miscela nel pozzetto.
- Lasciare ricottura dei μgel a 37 °C nell'incubatore cellulare per 25 minuti prima di aggiungere mezzi cellulari per riempire i pozzetti (~50 μL di media per pozzetto). Mantenere le colture 3D a 37 °C e cambiare i supporti in base alle esigenze. Per evitare di aspirare l'impalcatura quando si cambia il fluido, stabilizzare la punta della pipetta lungo la cresta del pozzetto superiore.
NOTA: quando si aggiunge o si rimuove liquido dai pozzetti di coltura, appoggiare l'estremità della punta della pipetta sulla sporgenza sopra l'impalcatura MAP per ridurre al minimo la possibilità di interrompere o aspirare l'impalcatura dal pozzetto. - Nei punti temporali desiderati, fissare i campioni rimuovendo il mezzo e aggiungendo 50 μL di paraformaldeide al 4% per pozzetto per 30 minuti a temperatura ambiente. Lavare i campioni 3 volte con 50 μL di 1x PBS o tampone preferito. A questo punto del protocollo, è possibile seguire metodi standard per l'immunofluorescenza o la colorazione a fluorescenza, utilizzando 50 μL per volume di lavoro.
NOTA: Questi metodi per la fissazione e la colorazione cellulare descrivono specificamente l'uso di macchie fluorescenti; tuttavia, l'immunocolorazione con coniugazioni anticorpali primarie e/o secondarie può essere eseguita anche in questi scaffold seguendo le istruzioni del produttore utilizzando 50 μL come volume di lavoro per pozzetto. - Le cellule di immagine negli scaffold MAP su un microscopio confocale utilizzano un obiettivo 20x e ottengono una pila Z che attraversa 200-250 μm nella direzione Z con una dimensione del passo di 2,5 μm. Un esempio di colorazione a fluorescenza con DAPI (colorazione nucleare diluita 1:1000 in 0,15% Triton-X in 1x PBS) e falloidina-647 (colorazione F-actina diluita 1:40 in 0,15% Triton-X in 1x PBS) è mostrato in Figura 5E, F con cellule D1 fisse coltivate in scaffold MAP per 3 giorni.
NOTA: Il trattamento al plasma delle superfici vetrate provoca un aumento dell'idrofilia, che ha dimostrato di migliorare l'adesione cellulare. Le cellule saranno probabilmente osservate diffondersi lungo il fondo dei pozzetti di coltura cellulare, ma non dovrebbero essere incluse nella conta cellulare o nella quantificazione del volume cellulare per valutare la risposta cellulare negli scaffold MAP.
- Preparare i componenti dello scaffold MAP (cioè μgel, HA-Tet, volume del supporto) in base alla frazione di particelle desiderata (fare riferimento alla Figura 4D-E). Pesare i lyo-μgel in una cappa sterile e ricostituire nell'84% il volume finale di MAP dei terreni cellulari in base al MAP scelto in wt%. Lasciare gonfiare i μgel per circa 20 minuti.
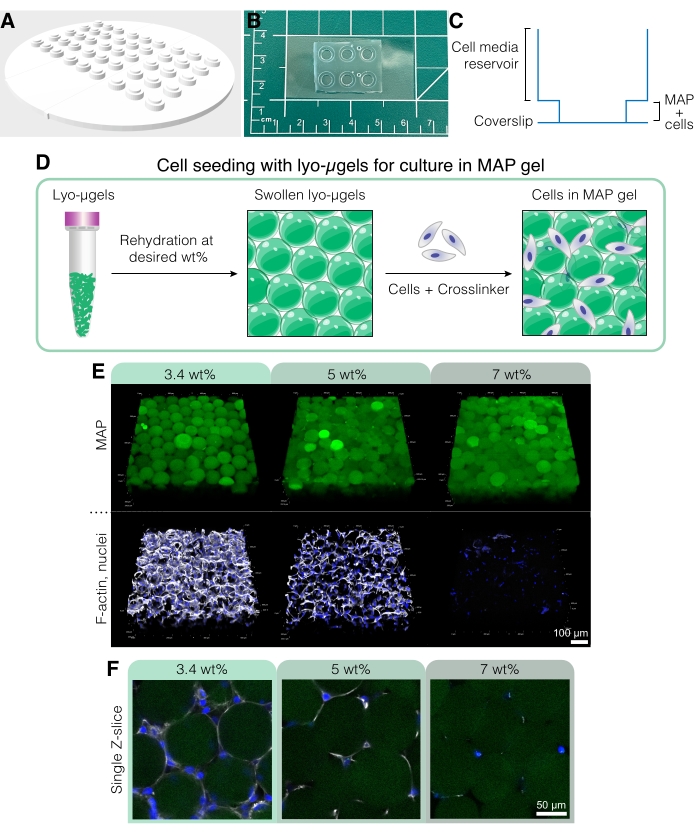
Figura 5: Coltura cellulare in scaffold MAP. (A) Lo stampo per la creazione di pozzetti di coltura cellulare può essere stampato in 3D e fuso con PDMS. L'intero stampo ha un diametro di 95 mm, i pozzetti grandi hanno un diametro di 6 mm e i piccoli pozzetti interni hanno un diametro di 4 mm. (B) Una volta colati con PDMS, i dispositivi di coltura cellulare sono legati al plasma a vetrini di copertura per migliorare le capacità di microscopia. (C) La sezione trasversale di un pozzo di coltura cellulare rappresenta il serbatoio per i mezzi cellulari (~50 μL) e un serbatoio più piccolo per la semina dello scaffold MAP con cellule (~10 μL). (D) Il processo di semina delle cellule negli scaffold MAP si basa innanzitutto sulla reidratazione dei lyo-μgel alla wt desiderata dall'utente, seguita dalla miscelazione con le cellule e il reticolante per l'interconnessione dei μgel. (E) Le celle possono essere incapsulate in scaffold MAP (verde) con MAP in wt% variabile. Le immagini rappresentative sono del giorno 5 della coltura cellulare D1 in scaffold MAP (barra di scala = 100 μm). (F) Le singole fette Z mostrano differenze nella crescita cellulare in scaffold comprendenti diversi MAP in peso (barra di scala = 50 μm). Ristampato da Anderson et al.12 con il permesso di Elsevier. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Lo scopo di questo protocollo è dimostrare la preparazione di scaffold di particelle ricotto microporose (MAP) con uno schema di reticolazione bio-ortogonale e frazioni di particelle controllate per la coltura cellulare 3D. In primo luogo, l'HA è stato modificato con gruppi pendenti norbornene da utilizzare sia nella formazione di microgel che nell'interconnessione per formare scaffold MAP. Utilizzando questi metodi, circa il 31% delle unità ripetute HA sono state modificate con successo con una maniglia funzionale no...
Discussione
È stato dimostrato che la produzione microfluidica di microgel HA-NB genera microgel con una gamma più ristretta di distribuzione dimensionale rispetto alla produzione di lotti di emulsione 3,9. I microgel descritti in questo protocollo sono stati formulati utilizzando un reticolante con scissione MMP (AC-GGRDGPQGIWGQDRCG-NH2) per supportare la degradazione del materiale. Tuttavia, i microgel HA-NB possono anche essere reticolati utilizzando un link...
Divulgazioni
ARA e TS hanno depositato un brevetto provvisorio su questa tecnologia.
Riconoscimenti
Gli autori desiderano ringraziare il National Institutes of Health, il National Institutes of Neurological Disorders and Stroke (1R01NS112940, 1R01NS079691, R01NS094599) e il National Institute of Allergy and Infectious Disease (1R01AI152568). Questo lavoro è stato eseguito in parte presso la Duke University Shared Materials Instrumentation Facility (SMIF), membro del North Carolina Research Triangle Nanotechnology Network (RTNN), che è supportato dalla National Science Foundation (numero di premio ECCS-2025064) come parte della National Nanotechnology Coordinated Infrastructure (NNCI). Gli autori desiderano ringraziare l'ex post-doc del laboratorio Dr. Lucas Schirmer e Ethan Nicklow per la loro assistenza nella generazione del dispositivo stampato in 3D per esperimenti di coltura cellulare.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309628 | |
| 5 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309646 | |
| Alexa Fluor 488 C5 maleimide | Invitrogen | A10254 | For synthesis of fluorescently-labeled tetrazine |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | For staining cell culture samples |
| Aluminum foil | VWR | 89107-726 | |
| Biopsy punch with plunger, 1.0 mm | Integra Miltex | 69031-01 | |
| Biopsy punch, 4 mm | Integra Miltex | 33-34 | |
| Blunt needle, 23 G 0.5", Non-Sterile, Capped | SAI Infusion Technologies | B23-50 | |
| Bottle-top vacuum filter, 0.22 μm | Corning | CLS430521 | |
| Calcium chloride | VWR | 1B1110 | For microgel washing buffer |
| Capillary-piston assemblies for positive-displacement pipettes, 1000 μL max. volume | Rainin | 17008609 | |
| Capillary-piston assemblies for positive-displacement pipettes, 25 μL max. volume | Rainin | 17008605 | |
| Capillary-piston assemblies for positive-displacement pipettes, 250 μL max. volume | Rainin | 17008608 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10228 | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Centrifuge tube, 15 mL | CELLTREAT | 667015B | |
| Centrifuge tube, 50 mL | CELLTREAT | 229421 | |
| Chloroform, ACS grade, Glass Bottle | Stellar Scientific | CP-C7304 | For synthesis of fluorescently-labeled tetrazine |
| Corona plasma gun, BD-10A High Frequency Generator | ETP | 11011 | |
| CryoTube Vials, Polypropylene, Internal Thread with Screw Cap | Nunc | 368632 | |
| D1 mouse mesenchymal cells | ATCC | CRL-12424 | Example cell line for culture in MAP gels |
| DAPI | Sigma-Aldrich | D9542 | For staining cell culture samples |
| Deuterium oxide, 99.9 atom% D | Sigma-Aldrich | 151882 | For NMR spectroscopy |
| Dialysis tubing, regenerated cellulose membrane, 12-14 kDa molecular weight cut-off | Spectra/Por | 132703 | For purifying HA-NB and HA-Tet |
| Diethyl ether | VWR | BDH1121-4LPC | For synthesis of fluorescently-labeled tetrazine |
| Dimethylformamide | Sigma-Aldrich | 277056 | For synthesis of fluorescently-labeled tetrazine |
| 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride (DMTMM) | TCI-Chemicals | D2919 | For modifying HA |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | Non-degradable dithiol linker (substitute for MMP-cleavable peptide) |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | D6429-500ML | For D1 cell culture |
| EMS Paraformaldehyde, Granular | VWR | 100504-162 | For making 4% PFA |
| Ethanol absolute (200 proof) | KOPTEC | 89234-850 | |
| Fetal bovine serum (FBS) | ATCC | 30-2020 | For D1 cell culture |
| Heating Plate | Kopf Instruments | HP-4M | |
| Hemacytometer with coverglass | Daigger Scientific | EF16034F | |
| 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375 | |
| Sodium hyaluronate, 79 kDa average molecular weight, produced in bacteria Streptococcus zooepidemicus, pharmaceutical grade, microbial contamination <100 CFU/g, bacterial endotoxins <0.050 IU/mg | Contipro | N/A | 79 kDa average molecular weight was used for HA-Tet synthesis, but these methods could be adapted for other molecular weights. |
| IMARIS Essentials software package | Oxford Instruments | N/A | Microscopy image analysis software |
| Infusion pump, dual syringe | Chemyx | N/A | |
| Kimwipe | Kimberly-Clark | 34120 | |
| Laboratory stand with support lab clamp | Geyer | 212100 | |
| Liquid nitrogen | Airgas | NI 180LT22 | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate | TCI-Chemicals | L0290 | |
| Lyophilizer | Labconco | N/A | Labconco FreeZone 6 plus has been discontinued, but other lab grade console freeze dryers could be used for this protocol. |
| Methyltetrazine-PEG4-maleimide | Kerafast | FCC210 | For synthesis of fluorescently-labeled tetrazine |
| 2-(4-Morpholino)ethane Sulfonic Acid (MES) | Fisher Scientific | BP300-100 | For modifying HA |
| Micro cover glass, 24 x 60 mm No. 1 | VWR | 48393-106 | |
| Microfluidic device SU8 master wafer | FlowJem | Custom design made either in-house in clean room or outsourced | |
| Mineral oil, heavy | Sigma-Aldrich | 330760 | |
| MMP-cleavable dithiol crosslinker peptide (Ac-GCRDGPQGIWGQDRCG-NH2) | GenScript | N/A | |
| 5-Norbornene-2-methylamine | TCI-Chemicals | 95-10-3 | For HA-NB synthesis |
| Packing tape | Scotch | 3M 1426 | |
| Parafilm | Bemis | PM996 | |
| PEG(thiol)2 | JenKem Technology USA | A4001-1 | For synthesis of fluorescently-labeled tetrazine |
| Penicillin-Streptomycin, 10,000 units/mL | Thermo Fisher Scientific | 15140122 | For D1 cell culture |
| Petri dish, polystyrene, disposable, Dia. x H=150 x 15 mm | Corning | 351058 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | For washing HMPs |
| Phosphate buffered saline (PBS) 1x | Gibco | 10010023 | |
| RainX water repellent glass treatment | Grainger | 465D20 | Synthetic hydrophobic treatment solution for microfluidic device treatment |
| RGD peptide (Ac-RGDSPGERCG-NH2) | GenScript | N/A | |
| Rubber bands | Staples | 112417 | |
| Sodium chloride | Chem-Impex | 30070 | For dialysis |
| Span 80 for synthesis | Sigma-Aldrich | 1338-43-8 | |
| Sylgard 184 Silicone Elastomer | Electron Microscopy Science | 4019862 | polydimethylsiloxane (PDMS) elastomer for making microfluidic devices and tissue culture devices |
| Syringe filter, Whatman Uniflo, 0.2 μm PES, 13 mm diameter | Cytvia | 09-928-066 | |
| Tetraview LCD digital microscope | Celestron | 44347 | |
| Tetrazine-amine HCl salt | Chem-Impex | 35098 | For HA-Tet synthesis |
| Triethylamine | Sigma-Aldrich | 471283 | For synthesis of fluorescently-labeled tetrazine |
| Tris(2-carboxyethyl)phosphine (TCEP) | Millipore Sigma | 51805-45-9 | |
| Triton X-100 | VWR | 97063-864 | |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| Trypsin EDTA (0.25%), Phenol red | Fisher Scientific | 25-200-056 | For lifting adherent cells to seed in MAP gels |
| Tygon ND-100-80 Non-DEHP Medical Tubing, Needle Gauge=23, Wall Thickness=0.020 in, Internal diameter = 0.020, Outer diameter = 0.060 in | Thomas Scientific | 1204G82 | |
| UV curing system controller, LX500 LED | OmniCure | 010-00369R | |
| UV curing head, LED spot UV | OmniCure | N/A | |
| UV light meter, Traceable | VWR | 61161-386 | |
| Vacuum dessicator | Bel-Art | 08-594-15C | |
| X-Acto Z Series Precision Utility Knife | Elmer's | XZ3601W |
Riferimenti
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Darling, N. J., et al. Click by click Microporous Annealed Particle (MAP) scaffolds. Advanced Healthcare Materials. 9 (10), 1901391 (2020).
- Truong, N. F., et al. Microporous annealed particle hydrogel stiffness, void space size, and adhesion properties impact cell proliferation, cell spreading, and gene transfer. Acta Biomaterialia. 94, 160-172 (2020).
- Pfaff, B. N., et al. Selective and improved photoannealing of Microporous Annealed Particle (MAP) scaffolds. ACS Biomaterials Science & Engineering. 7 (2), 422-427 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science & Engineering. 2 (11), 2034-2041 (2016).
- Caldwell, A. S., Campbell, G. T., Shekiro, K. M. T., Anseth, K. S. Clickable microgel scaffolds as platforms for 3D cell encapsulation. Advanced Healthcare Materials. 6 (15), 1700254 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194 (2022).
- Wilson, K. L., et al. Stoichiometric post modification of hydrogel microparticles dictates neural stem cell fate in microporous annealed particle scaffolds. Advanced Materials. 34 (33), 2201921 (2022).
- Muir, V. G., Qazi, T. H., Shan, J., Groll, J., Burdick, J. A. Influence of microgel fabrication technique on granular hydrogel properties. ACS Biomaterials Science & Engineering. 7 (9), 4269-4281 (2021).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3D printing applications. Advanced Science. 6 (1), 1801076 (2018).
- Anderson, A. R., Nicklow, E., Segura, T. Particle fraction as a bioactive cue in granular scaffolds. Acta Biomaterialia. 150, 111-127 (2022).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. R. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step variable height photolithography for valved multilayer microfluidic devices. Journal of Visualized Experiments. (119), e55276 (2017).
- JoVE. Nuclear Magnetic Resonance (NMR) Spectroscopy. JoVE Science Education Database. Organic Chemistry. JoVE. , (2022).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. Journal of Visualized Experiments. (184), e64119 (2022).
- Zhang, H., Dicker, K. T., Xu, X., Jia, X., Fox, J. M. Interfacial bioorthogonal crosslinking. ACS Macro Letters. 3 (8), 727-731 (2014).
- Welzel, P. B., et al. Cryogel micromechanics unraveled by atomic force microscopy-based nanoindentation. Advanced Healthcare Materials. 3 (11), 1849-1853 (2014).
- Plieva, F., Huiting, X., Galaev, I. Y., Bergenståhl, B., Mattiasson, B. Macroporous elastic polyacrylamide gels prepared at subzero temperatures: control of porous structure. Journal of Materials Chemistry. 16 (41), 4065-4073 (2006).
- Rommel, D., et al. Functionalized microgel rods interlinked into soft macroporous structures for 3D cell culture. Advanced Science. 9 (10), 2103554 (2022).
- Kurt, E., Segura, T. Nucleic acid delivery from granular hydrogels. Advanced Healthcare Materials. 11 (3), 2101867 (2021).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science & Engineering. 5 (12), 6395-6404 (2019).
- Truong, N. F., Lesher-Pérez, S. C., Kurt, E., Segura, T. Pathways governing polyethylenimine polyplex transfection in Microporous Annealed Particle scaffolds. Bioconjugate Chemistry. 30 (2), 476-486 (2019).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147 (2019).
- Li, F., et al. Cartilage tissue formation through assembly of microgels containing mesenchymal stem cells. Acta Biomaterialia. 77, 48-62 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon