È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Scaffold di idrogel granulare di gelatina metacrilico: fabbricazione di microgel ad alta produttività, liofilizzazione, assemblaggio chimico e bioprinting 3D
In questo articolo
Riepilogo
Questo articolo descrive i protocolli per la fabbricazione di microgel di gelatina metacriloile ad alta produttività utilizzando dispositivi microfluidici, la conversione di microgel in polvere risostenibile (micro-aerogel), l'assemblaggio chimico di microgel per formare scaffold di idrogel granulare e lo sviluppo di bioink granulari di idrogel con microporosità conservata per il bioprinting 3D.
Abstract
L'emergere di scaffold granulari di idrogel (GHS), fabbricati tramite l'assemblaggio di microparticelle di idrogel (HMP), ha permesso la formazione di scaffold microporosi in situ. A differenza degli idrogel sfusi convenzionali, i pori interconnessi su microscala nel GHS facilitano l'infiltrazione cellulare indipendente dalla degradazione e il trasferimento di ossigeno, nutrienti e sottoprodotti cellulari. La gelatina modificata con metacrilile (GelMA), un biopolimero (foto)chimicamente reticolabile a base di proteine contenente adesivi cellulari e porzioni biodegradabili, è stato ampiamente utilizzato come biomateriale sensibile alle cellule / istruttivo. La conversione di GelMA sfuso in GHS può aprire una pletora di opportunità per l'ingegneria e la rigenerazione dei tessuti. In questo articolo, dimostriamo le procedure di fabbricazione di microgel GelMA ad alta produttività, conversione in microgel secchi risospendibili (micro-aerogel), formazione di GHS tramite l'assemblaggio chimico di microgel e fabbricazione di bioink granulari per la bioprinting per estrusione. Mostriamo come un trattamento fisico-chimico sequenziale tramite raffreddamento e fotoreticolazione consenta la formazione di GHS meccanicamente robusto. Quando la luce è inaccessibile (ad esempio, durante l'iniezione di tessuti profondi), gli HMP GelMA reticolati singolarmente possono essere assemblati bioortogonalmente tramite reticolazione enzimatica utilizzando transglutaminasi. Infine, la bioprinting tridimensionale (3D) di GHS microporoso a bassa densità di impacchettamento HMP è dimostrata attraverso l'autoassemblaggio interfacciale di nanoparticelle caricate eterogeneamente.
Introduzione
L'assemblaggio di blocchi di costruzione HMP per formare scaffold di ingegneria tissutale ha guadagnato un'enorme attenzione negli ultimi anni1. GHS, fabbricato tramite assemblaggio HMP, ha proprietà uniche rispetto alle loro controparti sfuse, compresa la microporosità su scala cellulare proveniente dagli spazi vuoti tra i blocchi di costruzione discreti. Ulteriori proprietà, come l'iniettabilità, la modularità e la rigidità disaccoppiata dalla porosità, rendono GHS una piattaforma promettente per migliorare la riparazione e la rigenerazione dei tessuti2. Per la fabbricazione del GHS sono stati utilizzati diversi biomateriali, tra cui polimeri sintetici a base di PEG3,4 e polisaccaridi, come l'alginato5 e l'acido ialuronico 6,7. Tra i polimeri di derivazione naturale, il biopolimero a base proteica più comune per la fabbricazione di GHS è GelMA 8,9,10,11, un biomateriale reticolabile, biocompatibile, bioadesivo e biodegradabile12,13.
Gli HMP possono essere fabbricati tramite emulsificazione batch8, dispositivi microfluidici14,15 o emulsificazione a gradini9,11, miscelazione 16 o coacervazione complessa17,18. Di solito, c'è un compromesso tra il throughput di fabbricazione e la monodispersità HMP. Ad esempio, la tecnica di miscelazione produce HMP di forma irregolare e altamente polidispersi. L'emulsificazione in batch o la coacervazione complessa consente la produzione di grandi volumi di HMP sferici polidispersi. Sono stati utilizzati dispositivi microfluidici focalizzati sul flusso per fabbricare goccioline altamente monodisperse con un coefficiente di variazione del <5%, tuttavia la produttività è significativamente bassa. Nei dispositivi microfluidici a emulsificazione a gradini, i passaggi altamente parallelizzati consentono la fabbricazione ad alta produttività di HMP monodispersi19.
Gli elementi costitutivi HMP della gelatina modificata con metacrililico (GelMA) sono termoreattivi e (foto)chimicamente reticolabili, consentendo una facile fabbricazione di GHS20. Dopo il raffreddamento al di sotto della temperatura massima della soluzione critica (UCST)21 (ad esempio, a 4 °C), le goccioline contenenti una soluzione di GelMA vengono convertite in HMP fisicamente reticolati. Questi elementi costitutivi HMP vengono quindi imballati utilizzando forze esterne (ad esempio, tramite centrifugazione) per produrre sospensioni di microgel inceppate. I collegamenti interparticellari sono stabiliti tra HMP adiacenti tramite reticolazione (foto)chimica per formare GHS14 meccanicamente robusto. Una delle proprietà più importanti del GHS è la microporosità, che consente una facile penetrazione cellulare in vitro11 e una maggiore crescita tissutale in vivo22. La bioprinting tridimensionale (3D) degli HMP viene eseguita convenzionalmente utilizzando sospensioni di microgel strettamente imballate, compromettendo la microporosità23.
Abbiamo recentemente sviluppato una nuova classe di bioink granulari basati sulla nanoingegneria interfacciale dei microgel GelMA attraverso l'adsorbimento di nanoparticelle caricate eterogeneamente, seguito dall'autoassemblaggio reversibile di nanoparticelle. Questa strategia rende biostampabili in 3D i microgel a cedimento di taglio e di estrusione debolmente imballati, che preservano la porosità su microscala del GHS11 prodotto in modo additivo. Questo articolo presenta i metodi per la fabbricazione di goccioline GelMA ad alta produttività, convertendo queste goccioline in HMP fisicamente reticolati, fabbricando HMP GelMA utilizzando polvere risospendibile, formazione di GelMA GHS, preparazione di bioink granulare nanoingegnerizzato (NGB) GelMA e bioprinting 3D.
Access restricted. Please log in or start a trial to view this content.
Protocollo
NOTA: vedere la tabella dei materiali per i dettagli relativi a tutti i materiali, strumenti e reagenti utilizzati in questo protocollo.
1. Sintesi di GelMA
NOTA: la sintesi di GelMA deve essere condotta in una cappa aspirante chimica e devono essere utilizzati sempre adeguati dispositivi di protezione individuale (DPI).
- Aggiungere 200 mL di soluzione salina tamponata fosfato di Dulbecco (DPBS, 1x) in un matraccio Erlenmeyer e riscaldare la soluzione fino a 50 °C. Coprire il pallone con un foglio di alluminio per evitare l'evaporazione.
- Aggiungere 20 g di gelatina in polvere alla soluzione DPBS a 50 °C agitando a 240 giri/min fino a completa dissoluzione della polvere.
- Aggiungere 16, 2,5 o 0,5 ml di anidride metacrilica (MA) alla soluzione di gelatina goccia per goccia attraverso una pipetta Pasteur di vetro per sintetizzare GelMA con un grado alto, medio o basso di sostituzione del metacrilile, rispettivamente.
ATTENZIONE: MA è un materiale pericoloso. I DPI appropriati devono essere utilizzati quando si lavora con MA. MA è anche sensibile alla luce, quindi proteggi la reazione dalla luce avvolgendo il pallone con un foglio di alluminio. - Dopo 2 ore, aggiungere 400 mL di DPBS a 50 °C per interrompere la reazione. Lasciare continuare l'agitazione a 50 °C per 10 min.
- Versare la soluzione in un tubo a membrana per dialisi con cutoff di peso molecolare di 12-14 kDa, quindi posizionare il tubo in un becher da 5 L riempito con acqua ultrapura a 40 °C. Mescolare l'acqua a 240 giri/min e 40 °C.
- Dializzare la soluzione contro l'acqua ultrapura per 10 giorni e cambiare l'acqua 2 volte al giorno per rimuovere l'anidride metacrilato non reagita, i sottoprodotti e altre impurità.
- Dopo 10 giorni, aggiungere 400 ml di acqua ultrapura a 40 °C alla soluzione di GelMA. Agitare la soluzione a 240 giri/min per 15 min.
- Filtrare la soluzione due volte utilizzando filtri per caffè, seguiti da filtrazione sottovuoto tramite un'unità di filtrazione sottovuoto da 0,2 μm.
- Versare 25 mL della soluzione filtrata in provette da centrifuga da 50 mL e congelarle a -80 °C, posizionandole orizzontalmente.
- Dopo 2 giorni, rimuovere i tappi e coprire le provette da centrifuga con salviette da laboratorio. Utilizzare del nastro adesivo o un elastico per tenere saldamente le salviette.
- Liofilizzare la soluzione congelata di GelMA per ottenere GelMA solido bianco.
- Per condurre la spettroscopia di risonanza magnetica nucleare protonica (1 H NMR), aggiungere separatamente 30 mg di polvere di gelatina (controllo) o GelMA liofilizzato in 1mL di ossido di deuterio (D2O) e mantenere i campioni a 37 °C fino a quando la polvere di gelatina o GelMA è completamente sciolta.
- Ottenere gli spettri NMR 1H e determinare il grado di sostituzione del metacriloile integrando gli acidi aromatici e i picchi protonici di metilene lisina a spostamenti chimici di ~6,5-7,5 e ~3,0 ppm, rispettivamente. Utilizzare il picco degli acidi aromatici come riferimento e determinare il grado di sostituzione (DS) utilizzando i picchi di metilene lisina basati sull'equazione (1):
DS (%) = [1 - (Area di metilene lisina in GelMA / Area di metilene lisina in gelatina)] × 100 (1)
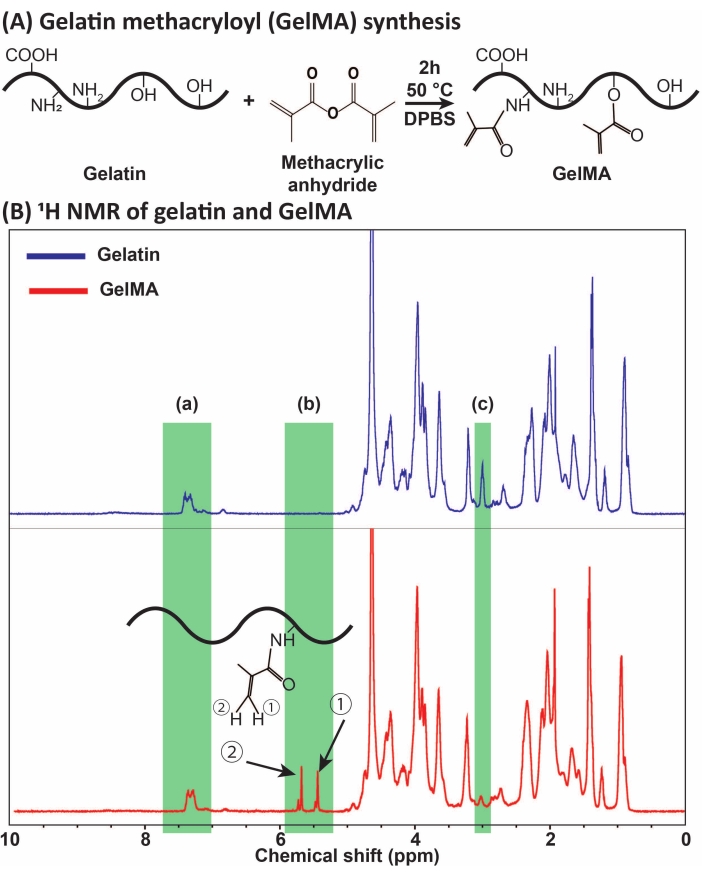
Figura 1: Sintesi e caratterizzazione del GelMA. (A) Reazione di sintesi del GelMA. La gelatina viene modificata con anidride metacrilica a 50 °C per 2 ore. (B) Gli spettri di risonanza magnetica nucleare protonica (1H NMR) della gelatina e del GelMA: (a) il picco per gli acidi aromatici, che è selezionato come riferimento per la taratura, (b) i picchi del gruppo funzionale vinilico dopo la modifica MA della gelatina e (c) il picco per le proteine della lisina. In questo esempio, il grado di sostituzione MA era 71% ± 3% (n = 3). Questa cifra è stata modificata con il permesso di Ataie et al.11 Abbreviazioni: GelMA = gelatina metacrilile; DPBS = soluzione salina tamponata fosfato di Dulbecco; MA = metacrilo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Fabbricazione di microgel GelMA ad alta produttività
- Microfabbricazione di stampi master per dispositivi
NOTA: Gli stampi master possono essere microfabbricati tramite litografia morbida utilizzando il fotoresist negativo KMPR 1000 serie19.- Disgelo KMPR 1025 e 1035 durante la notte. Evitare qualsiasi esposizione alla luce.
- Per rivestire il primo strato sul wafer, aggiungere KMPR 1025 direttamente al centro del wafer per creare un cerchio di circa 5 cm di fotoresist. Far funzionare lo spin coater a 3.000 giri/min per 30 s.
- Cuocere in forno morbido per 12 minuti su una piastra a 100 °C. Quindi, raffreddare sulla piastra di raffreddamento per 5 minuti.
- Attaccare la maschera del primo strato alla calce sodata vuota, quindi esporre il wafer rivestito alla luce UV utilizzando un allineatore per maschera per 645 mJ / cm2 di dosaggio.
- Infornate per 3 minuti su una piastra a 100 °C. Raffreddare sulla piastra di raffreddamento per 5 minuti.
Nota : non sviluppare dopo questo passaggio. Sviluppa solo una volta alla fine del processo. - Spin coat il secondo strato sul wafer usando KMPR 1035. Far funzionare lo spin coater a 1.000 giri/min per 30 s.
- Cuocere in forno per 30 minuti su una piastra a 100 °C. Raffreddare sulla piastra di raffreddamento per 5 minuti.
- Attaccare la maschera del secondo strato alla calce soda vuota e allineare la seconda maschera utilizzando l'allineatore attraverso i segnali di allineamento standard. Esporre ai raggi UV utilizzando un allineatore per maschera fino a 2.000 mJ/cm2.
- Infornate per 5 minuti su una piastra a 100 °C.
- Sviluppa per >6 minuti nello sviluppatore SU-8.
NOTA: Se il wafer sembra lattiginoso, lo sviluppo dovrebbe essere continuato per un tempo più lungo. Usa nuovi sviluppatori ogni volta e nel mezzo per un risultato migliore. - Spruzzare con isopropanolo. Assicurati che il wafer sia chiaro, senza residui lattiginosi. Asciugare accuratamente il wafer usando azoto (N2) gassoso.
- Fabbricazione di dispositivi microfluidici
- Versare 50 g di parte base di polidimetilsilossano (PDMS) in un bicchiere di plastica trasparente. Quindi, aggiungere 5 g del reticolante al bicchiere di plastica. Mescolare energicamente la base e il reticolante con una spatola fino ad ottenere una consistenza cremosa.
- Degasare sottovuoto la miscela usando un essiccatore per 20 minuti fino a quando non diventa chiaro. Versare il composto sullo stampo principale, che viene posto all'interno e fissato su una capsula di Petri.
NOTA: Assicurarsi che lo spessore (altezza) del PDMS versato sia ≤8 mm. - Inserire la capsula di Petri nell'essiccatore e degasare nuovamente la miscela PDMS per 20 minuti fino a quando tutte le bolle non vengono rimosse. Porre la piastra di Petri in forno a 70 °C per 2 ore fino a quando il PDMS non è reticolato. Togliere la piastra di Petri dal forno e lasciarla raffreddare.
- Tagliare i dispositivi dallo stampo usando un bisturi. Staccare lentamente i dispositivi dallo stampo principale. Utilizzare il punzone bioptico (diametro 1,5 mm) per praticare fori attraverso gli ingressi e l'uscita.
- Rimuovere la polvere dai dispositivi PDMS e dai vetrini utilizzando del nastro adesivo e posizionare i vetrini e i dispositivi in una camera di pulizia al plasma. Eseguire il trattamento al plasma per 45 s (a partire da quando la camera diventa viola) con pressione dell'aria inferiore a 400 mTorr. Rimuovere le guide e i dispositivi dalla camera, posizionare il dispositivo sui vetrini e applicare una leggera pressione. Mettere il dispositivo nel forno a 70 °C per 30 minuti per migliorare l'incollaggio.
- Riempire i dispositivi con tricloro(1H,1H,2H,2H-perfluoroottil)silano (F-silano, 2% v/v) nel fluido ingegnerizzato per rendere la superficie del canale fluorofila. Iniettare la soluzione di F-silano attraverso l'uscita e assicurarsi che tutti i dispositivi siano esposti. Attendere 5-10 minuti.
NOTA: F-silano deve essere preparato fresco. Inoltre, F-silano non deve essere esposto all'aria per lungo tempo. - Aspirare la soluzione di F-silano fuori dal dispositivo attraverso l'ingresso della soluzione acquosa. Lavare il dispositivo due volte utilizzando il fluido tecnico e aspirare nuovamente. Mettere il dispositivo nel forno a 70 °C per 30 minuti per far evaporare l'olio rimanente.
- Formazione di goccioline e fabbricazione di microgel GelMA
- Aggiungere 10 mg di litio fenil-2,4,6-trimetilbenzoilfosfinato (LAP) a 10 mL di DPBS per preparare una soluzione di fotoiniziatore (PI) (0,1% p/v). Proteggere la soluzione dalla luce avvolgendola in un foglio di alluminio.
- Sciogliere la quantità desiderata di GelMA nella soluzione PI e metterla nel forno a 37 °C per 1 ora fino ad ottenere una soluzione limpida. Proteggere la soluzione dalla luce avvolgendo in un foglio di alluminio.
- Per preparare la fase oleosa, produrre un 2% v / v di soluzione tensioattiva biocompatibile nel fluido tecnico.
- Inserire il tubo Tygon negli ingressi e nelle uscite del dispositivo PDMS. Inserire un ago smussato da 25 G nell'altra estremità del tubo Tygon per gli ingressi. Utilizzare la lunghezza minima possibile del tubo.
- Posizionare il dispositivo sotto il microscopio. Mantenere l'ambiente caldo (~40 °C) utilizzando un asciugacapelli e / o una stufa.
- Caricare le soluzioni acquose e oleose in siringhe separate, collegate al dispositivo. Avviare le pompe a siringa con portate di 160 e 80 μL/min rispettivamente per le fasi olio (continua) e acquosa (dispersa).
NOTA: avviare prima la fase dell'olio; Assicurati che l'olio riempia il canale, quindi avvia la fase acquosa. - Raccogliere le goccioline in un contenitore e valutarle nella camera di imaging tramite microscopia ottica.
- Posizionare le goccioline a 4 °C durante la notte proteggendole dalla luce per avviare la reticolazione fisica GelMA HMP e convertire le goccioline in microgel stabili a 4 °C.
3. Conversione di microgel in polvere risostenibile tramite la tecnologia MEtoP (microengineered emulsion-to-powder)
NOTA: È stata sviluppata la tecnologia MEtoP per convertire gli HMP a base di emulsione di olio acqua-in polvere (micro-aerogel) con proprietà preservate, come risospendibilità, forma, dimensioni e assemblaggio.
- Per implementare il MEtoP, raccogliere gli HMP fisicamente reticolati nel fluido ingegneristico utilizzando tubi di microcentrifuga termicamente resistenti o crioviali. Aprire i tappi del tubo e sigillarli con una salvietta e del nastro adesivo da laboratorio.
- Surgelare gli HMP fisicamente reticolati in azoto liquido (-196 °C) per 10 minuti.
- Trasferire i tubi congelati in uno strumento liofilizzato. Liofilizzare i tubi a bassa pressione (ad esempio, 0,06 mbar) per almeno 6 ore per ottenere polvere.
NOTA: Al termine del ciclo di liofilizzazione, rompere lentamente la pressione in modo che la polvere non venga persa. - Aggiungere 1 mL di soluzione PI raffreddata (0,1% p/v, 4 °C) alla polvere per ottenere sospensioni di microgel. Vortice per 5 s, quindi centrifugare a 3.000 × g per 15 s. Scartare il surnatante.
- Trasferire la sospensione di microgel imballata in uno stampo utilizzando una pipetta a spostamento positivo, seguita dall'esposizione alla luce UV a una lunghezza d'onda di 400 nm con un'intensità di 15 mW/cm2 per 60 s per formare GHS.

Figura 2: Preparazione della polvere di microparticelle GelMA tramite tecnologia MEtoP. (A) Immagini di polvere di GelMA ottenute dalla tecnologia MEtoP o dalla liofilizzazione convenzionale di HMP. Nella tecnologia MEtoP o nella liofilizzazione convenzionale, gli HMP sono sospesi rispettivamente in mezzi oleosi-tensioattivi o acquosi. Il fluido ingegneristico protegge la fase dispersa (HMP) dall'aggregazione e preserva le proprietà fisico-chimiche delle microparticelle di GelMA durante la liofilizzazione. (B) Illustrazione schematica di HMP essiccati preparati tramite MEtoP confrontati con HMP convenzionalmente liofilizzati in un mezzo acquoso. (C) Immagini SEM di microparticelle di GelMA essiccate preparate tramite il MEtoP rispetto alla liofilizzazione convenzionale. Barre della scala = 2 mm (a sinistra; A), 500 μm (a destra; A), 10 μm (a sinistra; C), e 200 μm (a destra; C). Questa cifra è stata modificata con il permesso di Sheikhi et al.26 Abbreviazioni: GelMA = gelatina metacrilile; DPBS = soluzione salina tamponata fosfato di Dulbecco; MEtoP = emulsione-polvere microingegnerizzata; HMP = microparticella di idrogel; SEM = microscopia elettronica a scansione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Formazione di GelMA GHS
NOTA: Questo protocollo serve per preparare 400 μL di sospensione di microgel. Per quantità maggiori, è necessario lo scale-up. Per mantenere gli HMP GelMA fisicamente reticolati, tutti i passaggi devono essere eseguiti a circa 4 °C posizionando i contenitori di microgel in un secchio per acqua ghiacciata.
- Aggiungere 400 μL di soluzione di 1H,1H-perfluoro-1-ottanolo (PFO) nel fluido tecnico (20% v/v) agli HMP GelMA fisicamente reticolati. Quindi, vortice per 5 s e centrifuga per 15 s a 300 × g.
NOTA: La soluzione di PFO nel fluido tecnico deve essere preparata fresca e conservata in un contenitore chiuso per evitare l'evaporazione. - Rimuovere la fase olio dagli HMP GelMA tramite pipettaggio.
- Aggiungere 400 μL di soluzione di PI (0,1% p/v) a 4 °C alla sospensione di microgel. Quindi, vortice per 5 s e centrifugare a 300 × g per 15 s. Scartare l'olio in seguito.
- Ripetere il passaggio precedente ma centrifugare a 3.000 × g. Rimuovere il surnatante degli HMP GelMA confezionati tramite pipettaggio.
- Trasferire gli HMP GelMA confezionati in uno stampo utilizzando una pipetta volumetrica, seguita dall'esposizione alla luce UV (lunghezza d'onda = 400 nm, intensità = 15 mW/cm2, tempo di esposizione = 60 s).
5. Bioink granulari nanoingegnerizzati (NGB) per la bioprinting 3D di GHS con microporosità conservata
- Aggiungere 100 mg di polvere di nanopiastrine a 3 ml di acqua ultrapura a 4 °C per formare una dispersione di nanoparticelle (3,33% p/v). Vortice la dispersione vigorosamente all'interno di un frigorifero a 4 °C per 15 minuti per esfoliare le nanoparticelle altrimenti aggregate. Le nanoparticelle correttamente esfoliate producono una chiara dispersione.
- Sciogliere 50 mg di LAP in 5 ml di acqua ultrapura a 4 °C per preparare una soluzione madre di PI (1% p/v).
- Aggiungere 333 μL di soluzione PI (1% p/v) alla dispersione di nanoparticelle esfoliate. Avvolgere in un foglio di alluminio per proteggere dalla luce ambientale. Vortice per 1 minuto per mescolare la dispersione di nanoparticelle e PI. Le concentrazioni finali di argilla e PI sono rispettivamente del 3% p/v e dello 0,1% p/v.
- Aggiungere PFO 20% v/v nel fluido tecnico (4 °C) agli HMP GelMA fisicamente reticolati con un rapporto di volume 1:1. Vortice accuratamente per 5 s. Quindi, centrifugare a 300 × g per 15 s ed eliminare la fase oleosa contenente il tensioattivo.
- Aggiungere la dispersione di nanoparticelle integrata con LAP (4 °C) agli HMP GelMA lavati. Vortice per 15 s, centrifugare a 3.000 × g per 15 s e scartare l'olio rimanente sul fondo e la dispersione surnatante .
- Conservare la sospensione a 4 °C proteggendola dalla luce con un foglio di alluminio per 1 giorno. Il prodotto di questo passaggio è il GelMA NGB.
- Caricare l'NGB in una siringa da 3 ml, sigillare la siringa caricata con un tappo e un parafilm e centrifugare a impulsi a 200 × g per rimuovere l'aria intrappolata. Trasferire il bioink in una cartuccia da 3 mL utilizzando un connettore Luer-Lok femmina-femmina. Centrifugare brevemente la cartuccia a 200 × g per rimuovere l'aria intrappolata. Conservare l'NGB a 4 °C in frigorifero prima dell'uso.
- Prima della preparazione del bioink carico di cellule, preparare una sospensione cellulare concentrata (ad esempio, cellule di fibroblasti murini NIH / 3T3), contenente ~ 24 milioni di cellule in 100 μL di terreno di coltura cellulare. Caricare la sospensione cellulare in una siringa da 3 ml, accoppiare la siringa caricata con NGB e la siringa caricata con cellule utilizzando un connettore Luer-Lok femmina-femmina e mescolare delicatamente le cellule e NGB spingendo avanti e indietro 40x.
- Stampare l'NGB o l'NGB carico di cellule utilizzando un bioprinter appropriato con un ugello conico standard. Caricare l'ugello nella testina di stampa da 3 ml. Mantenere la temperatura del piano di stampa al di sotto di 10 °C. Ottimizzare i parametri di stampa come velocità e contropressione prima della stampa.
- Selezionare il substrato e il tipo di ugello (siringa pneumatica da 3 mL dotata di ugello conico standard), calibrare il bioprinter utilizzando le linee guida del dispositivo, selezionare il file gcode o STL desiderato e iniziare a stampare.
NOTA: Quando si esegue il bioprinting carico di cellule, tutti i materiali e i dispositivi devono essere mantenuti sotto l'armadio di sicurezza biologica per ridurre al minimo la contaminazione. - Dopo la stampa, esporre il costrutto alla luce UV per la fotoreticolazione (lunghezza d'onda = 400 nm, intensità = 15 mW/cm2, tempo di esposizione = 60 s).
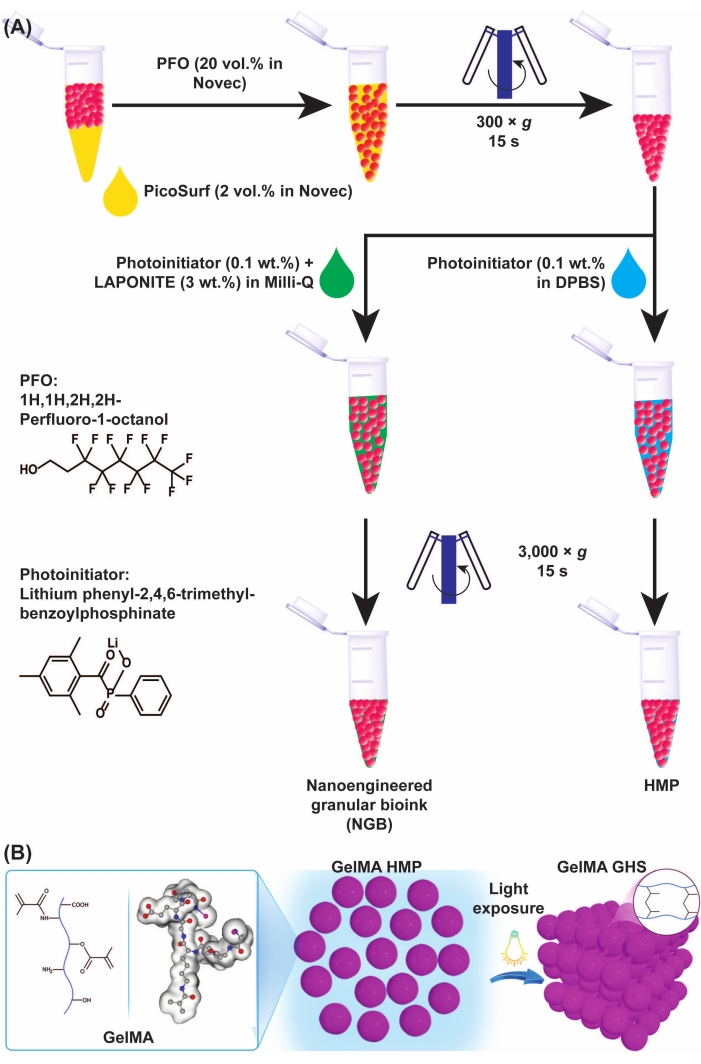
Figura 3: Schemi della formazione di microgel GelMA e GHS. (A) Schemi della separazione del microgel GelMA dall'olio e dalla preparazione di NGB. Il PFO (20% v/v nel fluido tecnico) è stato aggiunto all'emulsione di microgel-olio GelMA con un rapporto volumetrico 1:1, seguito da vortice e centrifugazione a 300 × g per 15 s. Per fabbricare GelMA GHS, la soluzione PI (LAP 0,1% p/v in DPBS) è stata aggiunta agli HMP GelMA, seguita da vortice e centrifugazione a 3.000 × g per 15 s. Per la preparazione dell'NGB, la soluzione PI (LAP 0,1% p/v in acqua ultrapura) e la dispersione nanopiastrinica (3% p/v in acqua ultrapura) sono state aggiunte alla sospensione HMP di GelMA, seguite da vortice e centrifugazione a 3.000 × g per 15 s. La Figura 3A è stata modificata con il permesso di Ataie, Z. et al.11 (B) L'esposizione di HMP GelMA confezionati alla luce rende GHS. La figura 3B è stata modificata con il permesso di Sheikhi et al.15 Abbreviazioni: GelMA = gelatina metacrilile; GHS = scaffold granulare di idrogel; NGB = bioink granulare nanoingegnerizzato; PFO = 1H,1H-perfluoro-1-ottanolo; PI = fotoiniziatore; LAP = litio fenil-2,4,6-trimetilbenzoilfosfinato; HMP = microparticella di idrogel; DPBS = soluzione salina tamponata fosfato di Dulbecco. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
GelMA è stato sintetizzato attraverso la reazione della gelatina con MA, come presentato nella Figura 1A. Adattando le condizioni di reazione, come la concentrazione di MA, sono stati ottenuti diversi gradi di sostituzione di MA. Per quantificare il grado di sostituzione MA, GelMA è stato valutato tramite spettroscopia NMR 1H (Figura 1B). I gruppi funzionali vinilici con picchi rappresentativi ai cambiamenti chimici di ~ 5-6 ppm hanno confe...
Access restricted. Please log in or start a trial to view this content.
Discussione
La gelatina e i suoi derivati sono i biomateriali a base proteica più comunemente usati per la fabbricazione di HMP. La sfida del compromesso tra produttività e monodispersità delle dimensioni delle particelle può essere superata utilizzando dispositivi microfluidici a emulsificazione graduale. Questi dispositivi sono in grado di formare più di 40 milioni di goccioline all'ora, con un coefficiente di variazione inferiore al 5%27. In questo articolo, abbiamo discusso la microfabbricazione di g...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Gli autori desiderano ringraziare T. Pond, specialista di supporto alla ricerca presso il Dipartimento di Ingegneria Chimica della Pennsylvania State University (Penn State), lo staff del Nanofabrication Lab della Penn State e il Dr. J. de Rutte di Partillion Bioscience per l'aiuto e la discussione sui processi di nanofabbricazione. A. Sheikhi riconosce il sostegno del Materials Research Institute (MRI) e del College of Engineering Materials Matter presso le sovvenzioni per le sementi a livello umano, il Convergence Center for Living Multifunctional Material Systems (LiMC2) e il Cluster of Excellence Living, Adaptive and Energy-autonomous Materials Systems (livMatS) Living Multifunctional Materials Collaborative Research Seed Grant Program e il fondo di avvio della Penn State. La ricerca riportata in questa pubblicazione è stata parzialmente supportata dal National Institute of Biomedical Imaging and Bioengineering (NIBIB) del National Institutes of Health (NIH) con il numero di premio R56EB032672.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 1H,1H-perfluoro-1-octanol | Alfa Aesar, MA, USA | B20156-18 | 98% purity |
| Biopsy punch | Integra Miltex, NY, USA | 33-31A-P/25 | 1.5 mm Biopsy Punch with Plunger System |
| Blunt needle | SANANTS | 30-002-25 | 25 G |
| Bruker Avance NEO 400 MHz | 400 MHz Bruker NEO, MA, USA | NMR device | |
| Centrifuge | Eppendorf, Germany | 5415 C | |
| Centrifuge tube | Celltreat, MA ,USA | 229423 | |
| Coffee filters | BUNN, IL, USA | 20104.0006 | BUNN 8-12 Cup Coffee Filters, 6 each, 100 ct |
| Desiccator | Thermo Scientific | 5311-0250 | Nalgene Vacuum Desiccator, PC Cover and Body, 280 mm OD |
| Deuterium oxide | Sigma, MA, USA | 151882 | |
| Dialysis membrane (12-14 kDa) | Spectrum Laboratories, NJ, USA | 08-667E | |
| Dulbecco's phosphate buffered saline (DPBS, 1x) | Sigma, MA, USA | 56064C-10L | dry powder, without calcium, without magnesium, suitable for cell culture |
| Erlenmeyer flask | Corning, NY, USA | 4980 | Corning PYREX |
| Ethanol | VWR, PA, USA | 89125-188 | Koptec 200 proof |
| External thread cryogenic vials (cryovials) | Corning, NY, USA | 430659 | |
| Freeze dryer | Labconco, MO, USA | 71042000 | Equipped with vacuum pump (Catalog# 7587000) |
| Gelatin powder | Sigma, MA, USA | G1890-5100G | Type A from porcine skin, gel strength ~300 g Bloom |
| Glass microscope slides | VWR, PA, USA | 82027-788 | |
| Hotplate | FOUR E'S SCIENTIFIC | MI0102003 | 5 inch Magnetic Hotplate Stirrer Max Temp 280 °C/536 °F |
| Kimwipes | Fischer scientific, MA, USA | 06-666 | |
| KMPR 1000 negative photoresist series | Kayaku Advanced Materials, MA, USA | 121619 | KMPR1025 and KMP1035 are included |
| LAPONITE XLG | BYK USA Inc., CT, USA | 2344265 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma, MA, USA | 900889-1G | >95% |
| Luer-Lok connector | BD, NJ, USA | BD 302995 | |
| MA/BA Gen4-Serie Mask- und Bond-Aligner | SÜSS MicroTeck, German | Nanofabrication device | |
| Methacylate anhydride | Sigma, MA, USA | 276685-100ML | contains 2,000 ppm topanol A as inhibitor, 94% |
| Milli-Q water | Millipore Corporation, MA, USA | ZRQSVR5WW | electrical resistivity ≈ 18 MΩ at 25 °C, Direct-Q 5 UV Remote Water Purification System |
| Novec 7500 engineering fluid | 3M, MN, USA | 3M ID 7100003723 | |
| Oven | VWR, PA, USA | VWR-1410 | 1410 Vacuum Oven |
| Parafilm | Fischer scientific, MA, USA | HS234526C | |
| Pasteur pipette | VWR, PA, USA | 14673-010 | |
| Petri dish | VWR, PA, USA | 25384-092 | polystyrene |
| Pico-Surf | Sphere Fluidics, UK | C022 | (5% (w/w) in Novec 7500) |
| Pipette | VWR, PA, USA | 89079-970 | |
| Pipette tips | VWR, PA, USA | 87006-060 | |
| Plasma cleaner chamber | Harrick Plasma, NY, USA | PDC-001-HP | |
| Polydimethylsiloxane | Dow Corning, MI, USA | 2065623 | SYLGARD 184 Silicone Elastomer Kit |
| Positive displacement pipette | Microman E M100E, Gilson, OH, USA | M100E | |
| Silicon wafers | UniversityWafer, MA, USA | 452/1196 | 4-inch mechanical grade |
| Spatula | VWR, PA, USA | 231-0104 | Disposable |
| SU-8 | Kayaku Advanced Materials, MA, USA | ||
| Syringe pump | Harvard Apparatus, MA, USA | 70-2001 | PHD 2000 |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Millipore Sigma, MA, USA | 448931-10G | 97% |
| Tygon tubings | Saint-globain, PA, USA | AAD04103 | |
| UV light | QUANS | Voltage: 85 V-265 V AC / Power: 20 W | |
| Vacuum filtration unit | VWR, PA, USA | 10040-460 | 0.20 µm |
| Vortex | Fischer scientific, USA | 14-955-151 | Mini Vortex Mixer |
Riferimenti
- Feng, Q., Li, D., Li, Q., Cao, X., Dong, H. Microgel assembly: Fabrication, characteristics and application in tissue engineering and regenerative medicine. Bioactive Materials. 9, 105-119 (2022).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Ding, A., et al. Jammed micro-flake hydrogel for four-dimensional living cell bioprinting. Advanced Materials. 34 (15), 2109394(2022).
- Muir, V. G., et al. Sticking together: injectable granular hydrogels with increased functionality via dynamic covalent inter-particle crosslinking. Small. 18 (36), 2201115(2022).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Molley, T. G., Hung, T., Kilian, K. A. Cell-laden gradient microgel suspensions for spatial control of differentiation during biofabrication. Advanced Healthcare Materials. , 2201122(2022).
- Zoratto, N., et al. In situ forming microporous gelatin methacryloyl hydrogel scaffolds from thermostable microgels for tissue engineering. Bioengineering and Translational. 5 (3), (2020).
- Yuan, Z., et al. In situ fused granular hydrogels with ultrastretchability, strong adhesion, and mutli-bioactivities for efficient chronic wound care. Chemical Engineering Journal. 450, 138076(2022).
- Ataie, Z., et al. Nanoengineered granular hydrogel bioinks with preserved interconnected microporosity for extrusion bioprinting. Small. 18 (37), 2202390(2022).
- Annabi, N., et al. 25th anniversary article: rational design and applications of hydrogels in regenerative medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Rajabi, N., et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering. Part A. 27 (11-12), 679-702 (2021).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A., De Rutte, J. Methods for fabricating modular hydrogels from macromolecules with orthogonal physico-chemical responsivity. U.S. Patent Application. , 17/279,283 (2021).
- Sheikhi, A., et al. Microfluidic-enabled bottom-up hydrogels from annealable naturally-derived protein microbeads. Biomaterials. 192, 560-568 (2019).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Seymour, A. J., Shin, S., Heilshorn, S. C. 3D printing of microgel scaffolds with tunable void fraction to promote cell infiltration. Advanced Healthcare Materials. 10 (18), 2100644(2021).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- de Rutte, J. M., Koh, J., Di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071(2019).
- Sheikhi, A., et al. Modular microporous hydrogels formed from microgel beads with orthogonal thermo-chemical responsivity: Microfluidic fabrication and characterization. MethodsX. 6, 1747-1752 (2019).
- Van Den Bulcke, A. I., et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules. 1 (1), 31-38 (2000).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194(2022).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3d printing applications. Advanced Science. 6 (1), 1801076(2019).
- Claaßen, C., et al. Quantification of substitution of gelatin methacryloyl: best practice and current pitfalls. Biomacromolecules. 19 (1), 42-52 (2018).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A. Methods for converting colloidal systems to resuspendable/redispersable powders that preserve the original properties of the colloids. U.S. Patent Application. , 17/425,027 (2022).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Lee, S., de Rutte, J., Dimatteo, R., Koo, D., Di Carlo, D. Scalable fabrication and use of 3d structured microparticles spatially functionalized with biomolecules. ACS Nano. 16 (1), 38-49 (2022).
- Charlet, A., Bono, F., Amstad, E. Mechanical reinforcement of granular hydrogels. Chemical Science. 13 (11), 3082-3093 (2022).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon