È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Posizionamento di elettrodi stimolanti extracranici e misurazione del flusso sanguigno cerebrale e dei campi elettrici intracranici in topi anestetizzati
In questo articolo
Riepilogo
Descriviamo un protocollo per la valutazione delle curve dose-risposta per la stimolazione extracranica in termini di misurazioni del campo elettrico cerebrale e di un rilevante biomarcatore-flusso sanguigno cerebrale. Poiché questo protocollo prevede il posizionamento invasivo di elettrodi nel cervello, è necessaria l'anestesia generale, con la respirazione spontanea preferita alla respirazione controllata.
Abstract
Il rilevamento delle risposte del flusso sanguigno cerebrale (CBF) a varie forme di attivazione neuronale è fondamentale per comprendere la funzione cerebrale dinamica e le variazioni nell'apporto di substrato al cervello. Questo documento descrive un protocollo per misurare le risposte del CBF alla stimolazione transcranica a corrente alternata (tACS). Le curve dose-risposta sono stimate sia dalla variazione del CBF che si verifica con il tACS (mA) che dal campo elettrico intracranico (mV/mm). Stimiamo il campo elettrico intracranico in base alle diverse ampiezze misurate dai microelettrodi di vetro all'interno di ciascun lato del cervello. In questo articolo, descriviamo la configurazione sperimentale, che prevede l'utilizzo di sonde laser Doppler (LD) bilaterali o di imaging laser speckle (LSI) per misurare il CBF; Di conseguenza, questa configurazione richiede l'anestesia per il posizionamento e la stabilità dell'elettrodo. Presentiamo una correlazione tra la risposta CBF e la corrente in funzione dell'età, mostrando una risposta significativamente maggiore a correnti più elevate (1,5 mA e 2,0 mA) negli animali di controllo giovani (12-14 settimane) rispetto agli animali più anziani (28-32 settimane) (differenza p < 0,005). Dimostriamo anche una significativa risposta CBF a intensità di campo elettrico <5 mV/mm, che è una considerazione importante per eventuali studi sull'uomo. Queste risposte CBF sono anche fortemente influenzate dall'uso dell'anestesia rispetto agli animali svegli, dal controllo della respirazione (cioè respirazione intubata vs. respirazione spontanea), dai fattori sistemici (cioè CO2 ) e dalla conduzione locale all'interno dei vasi sanguigni, che è mediata da periciti e cellule endoteliali. Allo stesso modo, tecniche di imaging/registrazione più dettagliate possono limitare la dimensione del campo dall'intero cervello solo a una piccola regione. Descriviamo l'uso di elettrodi extracranici per l'applicazione della stimolazione tACS, compresi i progetti di elettrodi fatti in casa e commerciali per i roditori, la misurazione simultanea del CBF e del campo elettrico intracranico utilizzando elettrodi di registrazione CC bilaterali in vetro e gli approcci di imaging. Attualmente stiamo applicando queste tecniche per implementare un formato a circuito chiuso per aumentare il CBF in modelli animali di malattia di Alzheimer e ictus.
Introduzione
La stimolazione elettrica transcranica (tES; con stimolazione sinusoidale, tACS) è un approccio comune, esterno e non invasivo alla neuromodulazione cerebrale 1,2. In precedenza, abbiamo ipotizzato che a determinate dosi, il tES (e in particolare il tACS) possa aumentare il flusso sanguigno cerebrale (CBF) nelle regioni cerebrali sottostanti3. Inoltre, può esistere una relazione dose-risposta tra la corrente esterna applicata o il campo elettrico intracranico e le risposte CBF risultanti. Tuttavia, la maggior parte dei protocolli di stimolazione clinica si è concentrata su un livello massimo di stimolazione cutanea confortevole (cioè ~ 2 mA) per periodi di tempo programmati (cioè 30-45 minuti) come protocollo di trattamento 4,5. Nei roditori, è possibile utilizzare elettrodi cerebrali extracranici invasivi applicati direttamente al cranio per studiare i campi elettrici nel cervello indotti da tES6. Pertanto, l'obiettivo di questo approccio è quello di determinare gli effetti dell'intensità del tACS a frequenze rilevanti sui cambiamenti del CBF in termini di relazione dose-risposta. Questa curva dose-risposta si basa su un biomarcatore fisiologico a breve termine - misurazioni dirette del CBF - in relazione al campo elettrico imposto al cervello3. Abbiamo precedentemente dimostrato che, ad ampiezze maggiori, tipicamente oltre la gamma di campi elettrici all'interno del cervello indotti clinicamente da tACS, esiste una correlazione quasi lineare tra il campo elettrico indotto e il CBF nella corteccia3. Tuttavia, la stimolazione a campo più piccolo (cioè un'intensità di 1-5 mV/mm) può essere più rilevante e fattibile per l'uso nell'uomo; quindi, abbiamo modificato le nostre tecniche per rilevare cambiamenti CBF più piccoli.
Questo articolo descrive un protocollo per analizzare gli effetti delle correnti sinusoidali alternate (tACS) tES a bassa intensità di campo sul CBF (cioè corrente 0,5-2,0 mA, campo elettrico 1-5 mV/mm), che può essere tollerato dai roditori svegli5. Questo protocollo prevede l'uso di un nuovo imaging a speckle laser durante la tACS, nonché di due elettrodi di vetro intracranico, per determinare sia la diffusione della tACS attiva all'interno del cervello (come monitorato dal CBF) che l'intensità del campo elettrico intracranico, che viene mostrata sia come diagramma che come una fotografia sperimentale reale (Figura 1). Ci sono molti possibili effetti fisiologici della tES all'interno del cervello, tra cui la modulazione neuronale diretta, la plasticità neurale e l'attivazione degli astrociti 7,8. Sebbene il CBF sia stato misurato con tDCS 9,10, queste misurazioni sono state lente, indirette e insufficienti per valutare la funzione dose-risposta nel cervello. Pertanto, utilizzando appropriati biomarcatori a breve termine (ad esempio, CBF, campi elettrici) e sequenze rapide on/off di tACS, possiamo ora stimare la funzione dose-risposta in modo più accurato. Inoltre, possiamo applicare diverse tecniche per misurare il CBF, tra cui sonde laser Doppler focali (LD) e imaging laser speckle (LSI) con regioni di interesse definite.
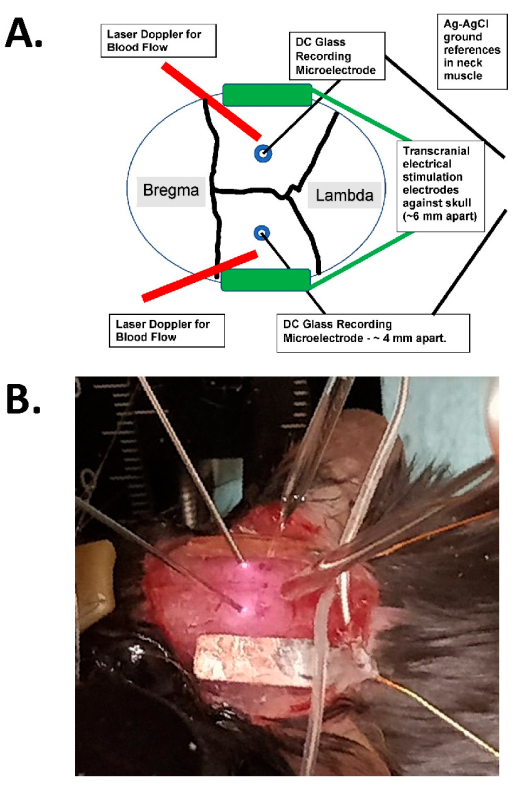
Figura 1: Diagramma di stimolazione transcranica ed esempio fotografico . (A) Schema della configurazione della stimolazione transcranica. Il diagramma mostra un cranio di topo con suture coronali e sagittali. Gli elettrodi transcranici sono posizionati lateralmente e simmetricamente sul cranio e sono montati con colla chirurgica e pasta conduttiva tra gli elettrodi e il cranio. Questi elettrodi sono collegati a un dispositivo di stimolazione a corrente costante compatibile con l'uomo, che può specificare la frequenza, l'ampiezza e la durata della stimolazione. Per la valutazione dei campi elettrici intracranici, gli elettrodi di vetro bilaterali (~2 MΩ) vengono posizionati nella corteccia cerebrale (cioè entro 1 mm dall'aspetto interno del cranio attraverso piccoli fori di bava), e questi sono sigillati con olio minerale e hanno fondi di AgCl nel muscolo del collo (mostrati come fili più grandi al centro sepolti nel tessuto sottocutaneo del collo). Questi elettrodi di vetro sono collegati a un amplificatore CC e le loro uscite vengono registrate attraverso un digitalizzatore con almeno quattro canali. Sul cranio vengono posizionate anche sonde laser Doppler bilaterali per le registrazioni. L'intero cranio viene anche ripreso con un dispositivo di imaging a speckle laser o una telecamera raffreddata ad alta risoluzione (almeno 1.024 x 1.024 pixel, profondità pixel 12-14 bit) per il rilevamento del segnale ottico intrinseco. La frequenza isosbestica dell'emoglobina viene in genere scelta (cioè 562 nm) per l'illuminazione per l'imaging del flusso sanguigno. (B) Un'immagine ravvicinata di un esperimento reale, che mostra le sonde laser Doppler bilaterali (a sinistra), i microelettrodi di registrazione intracranica (bilaterale) in vetro posizionati attraverso i fori della bava e con gli elettrodi di stimolazione tACS lateralmente. Abbreviazione: tACS = stimolazione transcranica in corrente alternata. Fare clic qui per visualizzare una versione più grande di questa figura.
Come modo per valutare i meccanismi, possiamo anche interrogare le interazioni con altri processi fisiologici che alterano il CBF, come la depolarizzazione diffusa indotta da K+ 11. Inoltre, piuttosto che sessioni programmate a orari regolari, è anche possibile sviluppare un sistema a circuito chiuso basato su biomarcatori aggiuntivi per una varietà di malattie, come è stato proposto per il trattamento dell'epilessia12 (ad esempio, dispositivi clinici Neuropace). Ad esempio, la stimolazione cerebrale a circuito chiuso per la malattia di Parkinson si basa comunemente sui potenziali di campo locale (LFP) intrinseci e anormali intrinseci a questa malattia in assenza di una quantità sufficiente di dopamina (tipicamente LFP a banda β)13.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le procedure sugli animali sono state approvate dall'Institutional Animal Care and Use Committee della Duke University o dall'autorità locale equivalente che regola la ricerca sugli animali. Vedere la Tabella dei materiali per i dettagli su tutti i materiali, gli strumenti e le attrezzature utilizzati in questo protocollo.
1. Preparazione dello strumento
- Assicurarsi che tutti gli elementi e gli strumenti chirurgici necessari siano a posto (Figura 2): soluzione detergente per il cuoio capelluto (cuscinetti imbevuti di alcol), nastro adesivo, pinze, forbici e un trapano per posizionare i piccoli fori di fresatura (0,5 mm).
- Preparare gli elettrodi di superficie extracranica per l'applicazione del cranio e assicurarsi che sia stata pulita l'eventuale colla chirurgica se sono stati utilizzati in precedenza.
- Verificare l'impedenza di questi elettrodi tACS direttamente prima di applicarli al cranio. A tale scopo, utilizzare la funzione di misurazione integrata dello stimolatore tACS con entrambi gli elettrodi posti in un bagno salino.
NOTA: L'impedenza preferita è di <5 KΩ per coppia di elettrodi per consentire il passaggio di corrente sufficiente attraverso il cranio. Il dispositivo stimolatore controlla l'impedenza prima di erogare impulsi a corrente costante e fornisce direttamente il valore.
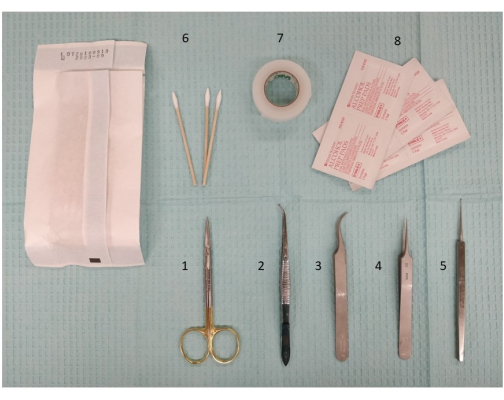
Figura 2: Una fotografia della strumentazione necessaria, compresi gli strumenti di dissezione e le forbici, per preparare la stimolazione extracranica. 1. Forbici per microdissezione, 11,5 cm; 2. Forcipe, 11,5 cm, leggera curva, seghettata; 3. Pinza Dumont #7, curva; 4. Pinza Dumont #5; 5. Micro curette, 13 cm; 6. Cotton fioc; 7. Nastro chirurgico; 8. Tamponi imbevuti di alcool. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Preparazione dell'animale per l'intervento chirurgico
NOTA: Per questi esperimenti, sono stati utilizzati 14 topi di controllo C57BL/6 di età compresa tra 12 settimane e 33 settimane, di cui cinque maschi e nove femmine.
- Anestetizzare l'animale in una camera di induzione con isoflurano al 30% di O2 a ~1,5 L/min, con ~4% inizialmente per indurre e ~1,25%-1,5% per mantenere un livello di anestesia con respirazione spontanea e sufficiente per eliminare la risposta al pizzicamento della coda.
- Trasferire l'animale al telaio stereotassico dopo l'induzione, quindi fissare la testa nel cono nasale e nelle barre auricolari per la successiva applicazione dell'elettrodo e la procedura di foro di sbavatura (Figura 1 e Figura 3).
- Collegare l'ogiva del telaio stereotassico al vaporizzatore tramite un ingresso e un'uscita per rimuovere eventuali residui di isoflurano attraverso un sistema di lavaggio (ad esempio, carbone o aspirapolvere). Assicurarsi che non vi siano perdite d'aria dal cono nasale, sia per mantenere il livello di anestesia con l'isofluorano sia per evitare perdite accidentali nell'aria ambiente (Figura 3).
- Controllare la posizione del topo nel telaio stereotassico, compresa la posizione dell'ogino nasale, per consentire la respirazione spontanea senza intubazione, nonché il recupero e lo scavenging dell'anestesia appropriati per proteggere il personale di ricerca (Figura 3).
- Posizionare le sonde per la misurazione del polso, della saturazione di ossigeno del polso (polso OX), della pressione sanguigna e della temperatura sull'animale; Assicurarsi che l'ossigenazione minima dell'impulso sia del 90% e che l'impulso sia >450/min (il limite inferiore dell'allarme è indicato come 380 impulsi/min). Registrare questi parametri durante la procedura a intervalli regolari o in modo continuo, a seconda del sistema di registrazione (Figura 3).
- Prima di iniziare la procedura, controllare il livello di sedazione dell'animale utilizzando (ad esempio) un pizzicotto del dito per controllare i riflessi. Se non c'è riflesso, il livello di sedazione è ottimale, purché l'animale mantenga la respirazione spontanea e un'adeguata ossigenazione del polso. Se c'è un riflesso, aumentare l'erogazione di isoflurano per approfondire il livello dell'anestesia, quindi ricontrollare il riflesso. Osservare e monitorare continuamente la frequenza respiratoria dell'animale e regolare di conseguenza l'apporto di isoflurano.
- Radere i peli del cuoio capelluto o rimuovere i peli con una crema depilatoria (pulire la crema residua con passaggi di tampone imbevuto di alcol).
- Applicare un unguento per gli occhi, quindi pulire asetticamente il cuoio capelluto con tre passaggi di iodio e alcol prima dell'escissione utilizzando le forbici.

Figura 3: Un'immagine dell'animale nella cornice stereotassica, con il cranio esposto e solo gli elettrodi dello stimolatore tACS in posizione (prima del posizionamento del foro di bava). Notare il dispositivo per la pressione sanguigna intorno alla coda e il pulsossimetro sulla zampa, con la lettura a sinistra. Ci sono tubi di lavaggio per l'isoflurano intorno al cono nasale. Abbreviazione: tACS = stimolazione transcranica in corrente alternata. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Procedura chirurgica: applicazione degli elettrodi stimolanti e realizzazione dei fori di sbavatura
- Per uno studio terminale, rimuovere il cuoio capelluto utilizzando forbici chirurgiche ed esporre il cranio ~ 3 mm dalla sutura lambdoidea caudalmente e ~ 3 mm frontalmente al bregma per esporre parte della sutura frontale posteriore. Asportare il cuoio capelluto per via parietale per esporre la parte iniziale del muscolo temporale su entrambi i lati (Figura 3).
- Rimuovere eventuali residui di tessuto connettivo sottocutaneo in modo che il cranio sia pulito e asciutto per l'applicazione degli elettrodi stimolanti.
- Applicare gel o pasta conduttiva sul lato degli elettrodi che saranno a contatto con il cranio e fissare gli elettrodi con supercolla chirurgica attorno al bordo nei punti intermittenti.
NOTA: Non lasciare che il gel conduttore interferisca con la supercolla chirurgica per consentire un migliore legame con la superficie del cranio. La superficie esterna degli elettrodi può anche essere isolata (dal cuoio capelluto se questo è chiuso durante un intervento chirurgico di sopravvivenza) utilizzando la supercolla chirurgica. - Utilizzare elettrodi piatti commerciali o creare elettrodi interni utilizzando un filo isolato con un diametro di 100 μm (saldato alla piastra) e una piastra di rame flessibile e isolata (su una superficie) di 1 mm x 3 mm tagliata in base alle dimensioni del cranio.
- Applicare la pasta di lidocaina sul muscolo temporale e sul cuoio capelluto su entrambi i lati senza disturbare gli elettrodi per ridurre l'attivazione del muscolo e del nervo periferico.
- Una volta che gli elettrodi di stimolazione extracranica sono posizionati a 4 mm lateralmente da ciascun lato del cranio (tra il bregma e il lambda), praticare due fori di 0,5 mm per gli elettrodi di vetro a 2 mm su ciascun lato della linea mediana, a 4 mm di distanza l'uno dall'altro, ortogonali alla sutura sagittale (Figura 1). Riempire questi fori con olio minerale sterile per impedire l'ingresso di corrente nel cranio da parte degli elettrodi extracranici.
- Se si desidera che un particolare esperimento induca la depressione di diffusione (cioè la depressione di diffusione indotta dal potassio [K+-SD]), aggiungere, sul lato destro del cranio, un terzo foro di bava di 0,5 mm ~1,5 mm rostrale alla sutura coronale e ~1 mm lateralmente alla sutura frontale posteriore. Riempire questo foro di fresa con soluzione fisiologica per una successiva applicazione di 1 M KCl per indurre K+-SD.
- Testare l'impedenza degli elettrodi stimolanti extracranici sia prima del posizionamento del foro di bava (e rispetto agli stessi elettrodi posti in un bagno salino) sia dopo il posizionamento del foro di bava per verificare che i fori di bava non interferiscano con il flusso di corrente nel cervello (cioè, assicurarsi che la resistenza sia invariata).
NOTA: La misurazione dell'impedenza è fornita direttamente dal dispositivo di stimolazione. In generale, abbiamo riscontrato che l'impedenza complessiva del sistema (cioè dagli elettrodi extracranici attraverso il percorso cranio/cervello, in genere ~ 3 KΩ) è relativamente costante indipendentemente dai fori di bava e dai microelettrodi di vetro, indicando che c'è una minima dispersione di corrente direttamente nel cervello attraverso i fori di bava. - Posizionare gli elettrodi di stimolazione transcranica cronica per la stimolazione cronica in modo simile. In questo caso, isolare la superficie esterna degli elettrodi, chiudere il cuoio capelluto e far uscire i fili isolati attraverso il cuoio capelluto o instradarli in uno stadio di testa fisso montato sul cranio.
4. Procedura fisiologica
- Inizia con gli aspetti fisiologici dell'esperimento, una volta che l'animale è completamente preparato per l'esperimento fisiologico di non sopravvivenza. Mantenere il livello di anestesia sufficiente sia per la respirazione spontanea che per adeguati livelli di polso Ox, respiratorio e polso.
- Misurare il CBF risultante dalla stimolazione extracranica con uno dei due metodi seguenti.
- Posizionare il topo sotto un dispositivo di imaging a speckle laser con o senza elettrodi di registrazione intracranica per misurare il campo elettrico intracranico durante gli episodi di stimolazione (Figura 3).
- Trasferire l'animale in una preparazione fisiologica per il posizionamento di sonde laser Doppler bilaterali ed elettrodi intracranici per misurare il campo elettrico intracranico durante gli episodi di stimolazione (Figura 1).
5. Posizionamento di laser Doppler bilaterale ed elettrodi in vetro
- Trasferire l'animale su un tavolino microscopico per l'applicazione di sonde laser Doppler bilaterali. Posizionare le sonde sulla parte superiore della superficie del cranio tra i fori bilaterali della bava e la sutura coronale (Figura 1).
- Riempire i microelettrodi di vetro tirati (~0,1 μM, impedenza 2-6 MΩ) con NaCl da 0,2 M e posizionarli utilizzando un micromanipolatore nei due fori di fresatura posti lateralmente alla sutura sagittale 3,14 (Figura 1).
NOTA: Questi fori si trovano tra i due elettrodi simmetrici di stimolazione extracranica (Figura 1). - Una volta inseriti nel cervello, assicurarsi che questi microelettrodi di vetro siano ~1 mm all'interno della corteccia cerebrale. Eseguire profili di profondità a varie profondità simmetriche. Riempire i fori della bava con olio minerale sterile per isolare questo percorso per il flusso di corrente.
6. Procedura di stimolazione e misurazione dell'intensità della stimolazione transcranica a corrente alternata (tACS) o della stimolazione transcranica a corrente continua (tDCS)
- Registrare i dati continui provenienti dalle doppie sonde laser Doppler sul cranio e dalle due uscite dei microelettrodi intracranici (registrati utilizzando un amplificatore DC con headstage) utilizzando un sistema di digitalizzazione e un software con almeno quattro canali (a una frequenza di campionamento di 1 KHz). Una volta che tutti i valori sono stati registrati su una durata basale sufficientemente stabile (cioè >10 min), testare la stimolazione extracranica.
NOTA: La Figura 4 mostra un esempio dei quattro canali con i due elettrodi di registrazione intracranica nei canali superiori e la risposta CBF nei canali inferiori. - Applicare brevi periodi di stimolazione on/off a varie ampiezze (cioè 20-30 s, 0,5-2,0 mA, nell'intervallo tollerabile) per ottenere una linea di base chiara prima e dopo la stimolazione (Figura 4). Applicare la stimolazione tra i due elettrodi tACS del cranio su entrambi i lati (Figura 1) utilizzando un dispositivo di stimolazione commerciale compatibile con l'uomo che eroga una corrente costante.
- Osservare attentamente il topo per le contrazioni muscolari o altre risposte al tACS, come un cambiamento nel polso o nella respirazione, per creare un limite superiore di tollerabilità (generalmente ~ 2 mA).
- Continuare a monitorare l'impedenza attraverso gli elettrodi con le epoche di stimolazione per assicurarsi che sia costante.
- Aggiungere una piccola quantità (2-3 μL) di 1 M KCl al foro anteriore14 per indurre eventi spontanei di K+-SD. Questi generano un'ampia risposta CBF e interazioni tra la risposta CBF indotta da K+-SD e la risposta CBF. Stimare la risposta del CBF del tACS, applicando la stimolazione del tACS sia prima che dopo l'insorgenza della SD.
- Al termine dell'esperimento, eseguire l'eutanasia attraverso un sovradosaggio di isoflurano (5%) e poi decapitare una volta cessate le respirazioni e i battiti cardiaci.
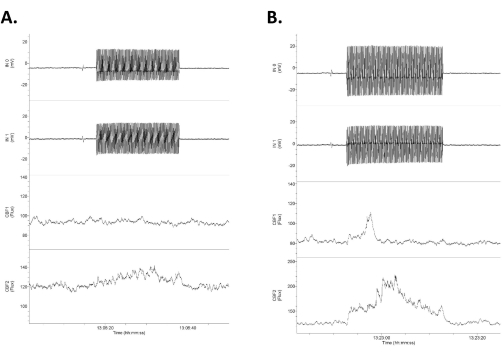
Figura 4: Dati che mostrano quattro canali di dati grezzi in risposta a tACS a bassa intensità. I dati sono disposti con le due file superiori come le registrazioni elettriche intracraniche e dirette DC (etichettate come Input 1 [IN0] e input 2 [IN1]) e le due file inferiori come le registrazioni laser Doppler bilaterali del flusso sanguigno cerebrale. Si noti che le risposte sono asimmetriche tra le tracce del flusso sanguigno elettrico e cerebrale destro (superiore) e sinistro (inferiore). (A) Una piccola risposta (aumento del 16% del flusso sanguigno) in risposta a uno stimolo di 1,2 mV/mm 20 s (0,75 mA). (B) Una risposta maggiore (aumento del 21% del flusso sanguigno) in risposta a uno stimolo di 1,4 mV/mm (1,0 mA). Abbreviazione: tACS = stimolazione transcranica in corrente alternata. Fare clic qui per visualizzare una versione più grande di questa figura.
7. Calcolo del campo elettrico
- Misurare la differenza nell'uscita dai due elettrodi intracranici utilizzando la differenza nella semionda (un ciclo) delle due onde sinusoidali registrate (le due tracce superiori nella Figura 4). Dividere questa differenza (mV) per la distanza tra i due elettrodi (mm, qui ~4 mm, ma misurata direttamente in ogni caso) per ottenere l'intensità del campo (mV/mm)3,6.
Access restricted. Please log in or start a trial to view this content.
Risultati
I risultati rappresentativi sono mostrati nella Figura 4, nella Figura 5 e nella Figura 6. La Figura 4 mostra un esempio dei quattro canali con i due elettrodi di registrazione intracranica sui canali superiori e le risposte CBF sui canali inferiori. Il tACS è simmetrico in tutto il cranio, ma generalmente la risposta del campo intracranico è leggermente asimmetrica per le correnti alternate applicate...
Access restricted. Please log in or start a trial to view this content.
Discussione
Questo protocollo si concentra sulla misurazione in vivo e anestetizzata della risposta CBF come biomarcatore per stimare la risposta cerebrale a tES14. I biomarcatori a lungo termine della risposta tES includono gli effetti istologici del trattamento, come la prevenzione o i cambiamenti nella formazione della placca amiloide (ad esempio, con la stimolazione gamma a 40 Hz in diversi modelli di AD)16,17,18,19
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo studio è stato sostenuto dalle seguenti sovvenzioni (a D.A.T.): NIA RO1 AG074999, NIA R21AG051103, VA I21RX002223 e VA I21 BX003023.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Alcohol pads | HenryShein | 112-6131 | |
| Baby mineral oil | Johnson & Johnson | ||
| BD 1 mL syringe | Becton Dikinson | REF 305699 | |
| C3 Flat Surface Electrodes | Neuronexus | ||
| C57BI mice | from NIH colonies | ||
| Copper skull electrods | In house preparation | ||
| Digidata 1440, Clampex | Axon Instruments | ||
| Dumont #5 forceps | FST | #5 | |
| Dumont #7 forceps curved | Dumont | RS-5047 | |
| Eye ointment | Major | LubiFresh P.M. NDC-0904-6488-38 | |
| Flaming/Brown micropipette puller | Sutter instrument Co. | Model P-87 | |
| Forceps 11.5 cm slight curve serrated | Roboz | RS-8254 | |
| Intramedic needle 23 G | Becton Dikinson | REF 427565 | |
| KCl 1 M | In house preparation | ||
| Laser Doppler Probes | Moor Instruments | 0.46 mm laser doppler probes | |
| Laser Speckle Imaging Device | RWD | RFLSI-ZW | |
| Micro curette 13 cm | FST | 10080-05 | |
| Micro Dissecting Scissors, 11.5 cm | Roboz | RS-5914 | |
| Mouse anesthesia fixation | Stoelting | ||
| Neuroconn-DS | Neurocare | DC-Stimulator Plus | |
| PhysioSuite Monitoring | Kent Scientific | ||
| Q-tips | Fisherbrand | 22363167 | |
| Saline 0.9% NaCl solution | Baxter | 281322 | |
| Sensicam QE | PCO Instruments | ||
| Software | Axon Instruments Clampex | ||
| Surgical glue | Covetrus | 31477 | |
| Surgical tape | 3M Transpore | T9784 |
Riferimenti
- Bestmann, S., Walsh, V. Transcranial electrical stimulation. Current Biology. 27 (23), R1258-R1262 (2017).
- Bikson, M., et al. Rigor and reproducibility in research with transcranial electrical stimulation: An NIMH-sponsored workshop. Brain Stimulation. 11 (3), 465-480 (2018).
- Turner, D. A., Degan, S., Galeffi, F., Schmidt, S., Peterchev, A. V. Rapid, dose-dependent enhancement of cerebral blood flow by transcranial AC stimulation in mouse. Brain Stimulation. 14 (1), 80-87 (2020).
- Shah, S., Chhatbar, P. Y., Feld, J. A., Feng, W. Integrating tDCS into routine inpatient rehabilitation practice to boost post-stroke recovery. Brain Stimulation. 13 (4), 953-954 (2020).
- Voroslakos, M., et al. Direct effects of transcranial electric stimulation on brain circuits in rats and humans. Nature Communications. 9 (1), 483(2018).
- Alekseichuk, I., Mantell, K., Shirinpour, S., Opitz, A. Comparative modeling of transcranial magnetic and electric stimulation in mouse, monkey, and human. Neuroimage. 194, 136-148 (2019).
- Tavakoli, A. V., Yun, K. Transcranial alternating current stimulation (tACS) mechanisms and protocols. Frontiers in Cellular Neuroscience. 11, 214(2017).
- Yavari, F., Jamil, A., Mosayebi Samani, M., Vidor, L. P., Nitsche, M. A. Basic and functional effects of transcranial electrical stimulation (tES)-An introduction. Neuroscience and Biobehavioral Reviews. 85, 81-92 (2018).
- Wachter, D., et al. Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat. Experimental Neurology. 227 (2), 322-327 (2011).
- Han, C. H., et al. Hemodynamic responses in rat brain during transcranial direct current stimulation: A functional near-infrared spectroscopy study. Biomedical Optics Express. 5 (6), 1812-1821 (2014).
- Ayata, C., Lauritzen, M. Spreading depression, spreading depolarizations, and the cerebral vasculature. Physiological Reviews. 95 (3), 953-993 (2015).
- Berenyi, A., Belluscio, M., Mao, D., Buzsaki, G. Closed-loop control of epilepsy by transcranial electrical stimulation. Science. 337 (6095), 735-737 (2012).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564(2017).
- Turner, D., A, D. S., Hoffmann, U., Galleffi, F., Colton, C. A. CVN-AD Alzheimer's mice show premature reduction in neurovascular coupling in response to spreading depression and anoxia compared to aged controls. Alzheimer's and Dementia. 17 (7), 1109-1120 (2021).
- Colton, C. A., et al. mNos2 deletion and human NOS2 replacement in Alzheimer disease models. Journal of Neuropathology and Experimental Neurology. 73 (8), 752-769 (2014).
- Castano-Prat, P., et al. Altered slow (<1 Hz) and fast (beta and gamma) neocortical oscillations in the 3xTg-AD mouse model of Alzheimer's disease under anesthesia. Neurobiology of Aging. 79, 142-151 (2019).
- Etter, G., et al. Optogenetic gamma stimulation rescues memory impairments in an Alzheimer's disease mouse model. Nature Communications. 10 (1), 5322(2019).
- Iaccarino, H. F., et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 540 (7632), 230-235 (2016).
- Martorell, A. J., et al. Multi-sensory gamma stimulation ameliorates Alzheimer's-associated pathology and improves cognition. Cell. 177 (2), 256-271 (2019).
- Dawson, J., et al. Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. Lancet. 397 (10284), 1545-1553 (2021).
- Hacker, M. L., et al. Deep brain stimulation in early-stage Parkinson disease: Five-year outcomes. Neurology. 95 (4), e393-e401 (2020).
- Duun-Henriksen, J., et al. A new era in electroencephalographic monitoring? Subscalp devices for ultra-long-term recordings. Epilepsia. 61 (9), 1805-1817 (2020).
- Haneef, Z., et al. Sub-scalp electroencephalography: A next-generation technique to study human neurophysiology. Clinical Neurophysiology. 141, 77-87 (2022).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon