È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Gastrectomia totale robotica con risparmio del vago per il trattamento della mutazione del gene CDH1
In questo articolo
Riepilogo
Questo articolo si concentra sulla gastrectomia totale robotica con risparmio del vago. Vengono discusse le tecniche e le insidie della conservazione del vago, dell'esofagodigiunostomia suturata, della formazione della sacca digiunale e della ricostruzione di Roux-en-Y con una digiunodigiunostomia con graffette.
Abstract
Il carcinoma gastrico diffuso ereditario (HDGC) causato dalla mutazione del gene CDH1 è una sindrome tumorale ereditaria che aumenta il rischio di carcinoma gastrico diffuso ed è quasi impossibile da rilevare con la gastroscopia di screening. Il trattamento preventivo raccomandato è la gastrectomia totale. La chirurgia robotica facilita l'uso di tecniche chirurgiche minimamente invasive (MIS) per le anastomosi e la conservazione del vago posteriore per ridurre potenzialmente gli esiti funzionali avversi. Un maschio asintomatico di 24 anni con la mutazione del gene CDH1 dimostrata da test genetici e una storia familiare di un fratello sottoposto a gastrectomia totale per HDGC è stato trattato con questa tecnica. Questo caso clinico video dimostra le tecniche e le insidie della chirurgia robotica in termini di posizionamento del paziente e posizionamento della porta, dissezione posteriore con conservazione del vago, esofagodigiunostomia suturata, formazione della sacca digiunale e ricostruzione Roux-en-Y con una digiunodigiunostomia con graffette. Sebbene queste tecniche siano dimostrate nel caso della gastrectomia profilattica, molte di esse possono essere applicate ad altri tipi di chirurgia benigna e bariatrica dell'intestino anteriore e generale. La chirurgia robotica può facilitare la tecnica MIS dell'intestino anteriore, come descritto in questo caso di gastrectomia totale con risparmio del vago.
Introduzione
Il carcinoma gastrico diffuso ereditario (HDGC) è caratterizzato da una mutazione genetica nel gene oncosoppressore E-caderina (CDH1), che ha un modello di trasmissione autosomica dominante1. Questa sindrome tumorale ereditaria aumenta il rischio di carcinoma gastrico diffuso e carcinoma mammario lobulare (LBC). Le attuali linee guida raccomandano di testare le mutazioni CDH1 nei pazienti con cluster familiari di HDGC e LBC, in particolare in quelli con esordio precoce (prima dei 40 anni di età)2. Secondo la più ampia casistica riportata di portatori di mutazioni CDH1, l'incidenza cumulativa nel corso della vita di cancro gastrico è del 70% (IC 95%, 59%-80%) per i maschi e del 56% (IC 95%, 44%-69%) per le femmine con questa mutazione3. Tuttavia, studi recenti hanno stimato che la penetranza del cancro gastrico con questa mutazione è compresa tra il 37% e il 42% per i maschi e tra il 25% e il 33% per le femmine1.
La sorveglianza endoscopica con biopsie è il tipo di sorveglianza raccomandato per coloro che scelgono di ritardare la gastrectomia profilattica; Tuttavia, è quasi impossibile rilevare il cancro gastrico precoce in questa coorte utilizzando la gastroscopiadi screening 2. L'esame endoscopico approfondito a luce bianca è seguito da un minimo di 30 biopsie gastriche non mirate da cinque aree separate dello stomaco. Tuttavia, questo metodo di sorveglianza ha un alto tasso di falsi negativi e rileva solo il 20%-63% dei focolai di cellule ad anello con segno occulto 4,5.
La gastrectomia totale profilattica (PTG) è il trattamento preventivo raccomandato per qualsiasi portatore patogeno o probabilmente patogeno della variante CDH1 a partire dall'età di 20 anni, ma non è raccomandato oltre i 70 anni di età 1,2. Le metastasi linfonodali perigastriche sono un reperto raro nei pazienti asintomatici, che in genere hanno cellule ad anello con castone T1a o in situ. La morbilità perioperatoria è generalmente bassa e la soddisfazione del paziente è elevata6. Sebbene la qualità complessiva della vita dopo l'intervento chirurgico sia elevata, una vagotomia troncale viene generalmente eseguita in una gastrectomia totale 7,8. La resezione del nervo vago al di sopra del livello dei rami celiaci ed epatici porta alla denervazione parasimpatica dell'albero epatobiliare e dell'intestino tenue e crasso. La diarrea post-vagotomia e la sindrome da dumping sono complicanze a lungo termine ben note dopo PTG8.
La chirurgia robotica fornisce al chirurgo una visione tridimensionale ingrandita 10x del campo chirurgico e offre un elevato grado di libertà con gli strumenti chirurgici articolati9. L'obiettivo dell'esecuzione di questa tecnica è quello di ridurre potenzialmente gli esiti funzionali avversi attraverso la conservazione del vago posteriore, che è facilitata da tecniche chirurgiche minimamente invasive (MIS).
Protocollo
Il paziente ha fornito il consenso informato per la pubblicazione di informazioni, immagini e documentazione video anonimizzati. Il professore associato Dr. Michael Talbot (co-autore) è un chirurgo del tratto gastrointestinale superiore accreditato per eseguire la gastrectomia presso il suo istituto. A causa del rischio trascurabile di questo caso clinico e protocollo, è stato esentato da una revisione etica secondo le linee guida del comitato di revisione istituzionale locale. Le applicazioni etiche per i casi clinici sono esentate secondo le linee guida del comitato di revisione istituzionale locale.
1. Posizionamento del paziente
- Posizionare il paziente nella posizione di Trendelenburg inversa dopo che è stata somministrata l'anestesia generale.
- Fissare il paziente in posizione con una pedana, una cinghia per il corpo posizionata sopra le ginocchia e cinturini per le caviglie. Abdurre (<90°) le braccia e fasciarle con la crêpe alle assi delle braccia. Posizionare una staffa per divaricatore epatico Nathanson sul tavolo operatorio, craniale rispetto alla tavola del braccio sinistro.
2. Posizionamento delle porte (Figura 1)
- Praticare un'incisione cutanea di 12 mm con l'approccio preferito dal chirurgo nella posizione medioclavicolare destra al livello dell'ombelico o al di sotto di esso. Eseguire un'entrata ottica con un cannocchiale laparoscopico da 8 mm, 0° e con una porta da 12 mm attraverso questa incisione. Si noti che la porta della fotocamera deve trovarsi a 10-20 cm dall'anatomia di destinazione.
- Sostituisci la porta con una porta robotica da 12 mm (pinzatura) con un riduttore da 12-8 mm e sostituisci il laparoscopio con un laparoscopio da 8 mm a 30°. Stabilire 15 mmHg di CO2 pneumoperitoneo con flusso di 45 mmHg.
- Praticare tre ulteriori incisioni cutanee da 8 mm nel piano transombelicale e posizionare tre porte robotiche da 8 mm. Posizionare una delle porte robotiche sull'ombelico e le altre due porte robotiche lateralmente ad esso sul lato sinistro. Assicurarsi che ci sia una distanza di >8 cm tra le porte e una distanza di 10-20 cm tra le porte e l'anatomia del bersaglio.
- Posizionare un'altra porta assistente da 12 mm (porta A) nel quadrante in alto a destra. Inserire un divaricatore Nathanson nell'epigastrio attraverso un'incisione di 5 mm e ritrarre il lobo sinistro del fegato.
- Posizionare il carrello robotizzato sopra il paziente dal lato destro del paziente, facendo attenzione a evitare la collisione con il divaricatore epatico. Agganciare prima il braccio della fotocamera utilizzando il posizionamento della porta guidata dal laser. Eseguire un'incisura mirata allo stomaco con un endoscopio robotico da 8 mm e 30° utilizzando la porta 3.
- Agganciare e ruttare le restanti porte robotiche ai bracci dello strumento, quindi inserire uno strumento bipolare a forza da 8 mm (porta 1), un sigillante per vasi (porta 2) e una pinza fenestrata ribaltabile (pentola 4). Impostare il taglio automatico monopolare e bipolare e la coagulazione forzata all'effetto 3 e controllare la configurazione del sistema.
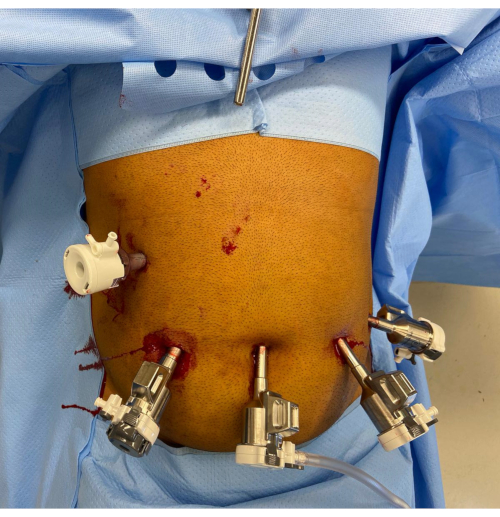
Figura 1: Posizionamento delle porte robotiche. L'impugnatura del divaricatore Nathanson è visibile nell'epigastrio. C'è una porta assistente da 12 mm nel quadrante in alto a destra. Le porte rimanenti da sinistra a destra dell'immagine sono la porta robotica da 12 mm con riduttore, la porta della fotocamera da 8 mm e due porte robotiche aggiuntive da 8 mm. Clicca qui per visualizzare una versione più grande di questa figura.
3. Dissezione che preserva il vago
- Mobilizzare la curva maggiore dello stomaco attraverso il legamento gastrocolico dall'antro al cardias e dividere in cinque o sette vasi gastrici corti lateralmente al sigillante dei vasi arcade che si estendono per includere i nodi N1. Quindi, mobilizzare il lato sinistro dello iato esofageo.
- Entrare nel legamento frenoesofageo e mobilizzare il lato sinistro dell'esofago distale. Eseguire la dissezione distale con il sigillante per vasi e continuare fino alla mobilizzazione della prima parte del duodeno. Seguire la finestra sopraduodenale attraverso la pars flaccida per completare la mobilizzazione esofagea destra, con il piano di dissezione adiacente all'esofago.
- Sezionare la prima parte del duodeno con la suturatrice robotica utilizzando una ricarica verde da 60 mm x 4,3 mm con un rinforzo a contrafforte. Dividi i vasi gastrici sinistri vicino alla parete dello stomaco usando il sigillante per vasi. Questo per garantire che il vago posteriore sia lasciato indiviso nel mesentere attorno al peduncolo gastrico sinistro.
- Ritrarre l'esofago e lo stomaco in direzione superolaterale e identificare il nervo vago posteriore. Spazza il nervo posteriormente e preservalo.
4. Sutura dell'esofagodigiunostomia con una sacca digiunale
- Ricostruzione del legamento frenoesofageo
- Eseguire la ricostruzione del legamento frenoesofageo in senso antiorario continuo dalla posizione delle 5 alle 9 utilizzando una sutura spinata 2-0 non assorbibile su un ago a punta conica da 26 mm 1/2 cerchio. Sezionare l'esofago intraaddominale con la suturatrice robotica utilizzando una ricarica verde di 60 mm x 4,3 mm. Sposta lo stomaco staccato nel quadrante in alto a destra.
- Anastomosi esofagodigiunale
- Sollevare cranialmente il grande omento per identificare la flessura duodenodigiunale e portare un'ansa digiunale di 50 cm (creando un arto biliopancreatico di 40-60 cm dopo la formazione della sacca digiunale) all'esofago.
- Sutura una sutura spinata assorbibile 3-0 lunga 23 cm su un ago a punta conica 1/2 cerchio da 26 mm come una pessia esofagodigiunale laterale a ore 3. Ritrarre lateralmente la sutura non tagliata. Creare un'esofagomia anteriore alla linea di graffette utilizzando un gancio per diatermia monopolare con una guida per sondino nasogastrico da 18Fr. Creare una digiunostomia di dimensioni uguali o leggermente inferiori come fatto per l'esofagomia .
- Sutura la parete posteriore dell'esofagodigiunostomia con la sutura spinata in modo continuo, in senso orario dalla posizione delle 3 alle 9, incorporando la linea di graffetta. Sutura la porzione anteriore utilizzando un'altra della stessa sutura per completare la sutura monostrato a tutto spessore per l'anastomosi esofagodigiunale. Posizionare alcune suture mediali oltre l'anastomosi come una pessi mediale.
- Sacchetto digiunale
- Sezionare l'ansa digiunale prossimale a 10 cm dall'anastomosi con una suturatrice robotica utilizzando una ricarica bianca di 60 mm x 2,5 mm. Creare enterostomie antimesenteriche di 10 cm prossimali e distali all'anastomosi esofagodigiunale.
- Esegui due spari della cucitrice robotica utilizzando ricariche bianche da 60 mm x 2,5 mm per creare la sacca digiunale. Assicurarsi che la seconda cottura non vada fino in fondo per incontrare l'anastomosi esofagodigiunale al fine di preservare l'afflusso di sangue alle anastomosi. Chiudere l'enterotomia digiunale in modo continuo con una sutura spinata riassorbibile 3-0.
5. Digiunodigiunostomia pinzata
- Misurare un arto alimentare di 70 cm e posizionare una sutura interrotta di seta 2-0 a questo punto e l'arto biliopancreatico distale sia per la marcatura che per la retrazione.
- Formare la digiunodigiunostomia utilizzando una tecnica di sola graffetta, come descritto nella tecnica di tripla pinzatura per bypass gastrico laparoscopico10,11. Utilizzare una ricarica bianca da 60 mm x 2,5 mm per formare l'anastomosi e chiudere l'enterotomia.
- Chiudere sia i difetti mesenterici digiunali che quelli retro-Roux utilizzando suture spinate 2-0 non assorbibili per ridurre il rischio di complicanze dovute all'ernia interna.
6. Estrazione e chiusura del campione
- Rimuovi gli strumenti, il divaricatore Nathanson e le porte sotto la visione robotica. Sganciare il carrello robotizzato dal paziente.
- Creare una mini-laparotomia di 5 cm attraverso l'estensione della porta ombelicale. Rilasciare il campione attraverso un piccolo divaricatore di protezione della ferita con O-ring. Chiudere la laparotomia nel modo consueto utilizzando suture risparmio muscolare con chiusura fasciale continua e con un rapporto sutura/lunghezza della ferita di 1:4.
Risultati
Il tempo operatorio totale è stato di 2 ore e 50 minuti e il paziente ha avuto un decorso postoperatorio insignificante. Il paziente è stato sottoposto a una dieta a base di liquidi liberi il giorno 1 dopo l'intervento chirurgico e dimesso dall'ospedale il giorno 4. Al follow-up di 1 mese e 3 mesi, il paziente stava bene e non riportava diarrea o sintomi di dumping.
Il campione è stato inviato per l'esame patologico e ha mostrato cinque aree di invasione su...
Discussione
È stato selezionato un maschio asintomatico di 24 anni con la mutazione del gene CDH1 dimostrata da test genetici e una storia familiare di un fratello sottoposto a gastrectomia totale per HDGC. L'endoscopia preoperatoria era insignificante. Il caso viene utilizzato come piattaforma per discutere le tecniche e le insidie degli aspetti chiave di esso. Ciò include il posizionamento del paziente e il posizionamento della porta, la dissezione posteriore con conservazione del vago, l'esofag...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano la Upper Gastrointestinal and Metabolic Research Foundation per aver finanziato le spese di pubblicazione della rivista. Gli autori riconoscono anche in questo caso al paziente il suo consenso alla pubblicazione delle informazioni e delle immagini anonime.
Materiali
| Name | Company | Catalog Number | Comments |
| Laparoscopic instruments | |||
| 5 mm optical entry port | Applied Medical | CFF03 | Kii Fios First entry access system. |
| Laparoscopic 5mm 0° camera | Olympus | ENDOEYE HD II | 5 mm, 0° |
| Laparoscopic needle holder | KARL STORZ | Laparoscopic needle holder | |
| Nasogastric tube | Cardinal Health | 8888264960E | 16Fr |
| Nathanson liver retractor | COOK Medical | NLRS-1001/ NLRS-1002 | Large/ Extra-large |
| Robotic instruments | |||
| 12 mm port | Intuitive Surgical | 470375 | |
| 8 mm port | Intuitive Surgical | 470380 | |
| 8 mm reducer | Intuitive Surgical | 470381 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 0° | Intuitive Surgical | 470026 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 30° | Intuitive Surgical | 470027 | |
| Force Bipolar 8 mm | Intuitive Surgical | 470405 | |
| Mega SutureCut Needle Driver | Intuitive Surgical | 470309 | |
| Monopolar hook diathermy | Intuitive Surgical | 470183 | |
| SureForm 60mm stapler | Intuitive Surgical | 480460 | |
| Tip-up fenetrated grasper 8 mm | Intuitive Surgical | 470347 | |
| Vessel Sealer Extend 8 mm | Intuitive Surgical | 480422 | |
| Stapler reloads | |||
| Seamguard buttress 60 mm | GORE | 1BSGXI60GB/12BSGXI60GB | |
| SureForm 60 mm green reload | Intuitive Surgical | 48360G | |
| SureForm 60 mm white reload | Intuitive Surgical | 48360W | |
| Sutures | |||
| 2-0 nonabsorbable barbed suture | Medtronic | VLOCN0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle |
| 3-0 absorbable barbed suture | Medtronic/ Ethicon (J&J) | VLOCM0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle (preferred), STRATAFIX (alternate). Catalogue number |
| 2-0 monocryl suture | Ethicon (J&J) | JJW3463 | Cut to 15 cm, taper point needle |
| 2-0 silk suture | Ethicon (J&J) | JJ423H | Cut to 15 cm, taper point needle |
| 1 PDS suture | Ethicon (J&J) | JJ75414 | Fascial closure |
| 3-0 monocryl suture | Ethicon (J&J) | JJY227H | Skin closure |
| Topical Skin Adhesive | Ethicon (J&J) | JJ79025 | Skin closure/ wound dressing |
| Specimen extraction | |||
| Alexis O-ring wound retractor | Applied Medical | C8402 | Medium. For specimen extraction |
| Handheld diathermy | Covidien/ Valleylab | VLE2515 | For specimen extraction |
Riferimenti
- Gamble, L. A., Heller, T., Davis, J. L. Hereditary diffuse gastric cancer syndrome and the role of CDH1: A review. JAMA Surgery. 156 (4), 387-392 (2021).
- Shenoy, S. CDH1 (E-cadherin) mutation and gastric cancer: Genetics, molecular mechanisms and guidelines for management. Cancer Management and Research. 11, 10477-10486 (2019).
- Hansford, S., et al. Hereditary diffuse gastric cancer syndrome: CDH1 mutations and beyond. JAMA Oncology. 1 (1), 23-32 (2015).
- Friedman, M., et al. Surveillance endoscopy in the management of hereditary diffuse gastric cancer syndrome. Clincal Gastroenterology and Hepatology. 19 (1), 189-191 (2021).
- van der Post, R. S., et al. Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDH1 mutation carriers. Journal of Medical Genetics. 52 (6), 361-374 (2015).
- Kaurah, P., et al. Hereditary diffuse gastric cancer: Cancer risk and the personal cost of preventive surgery. Familal Cancer. 18 (4), 429-438 (2019).
- Hejazi, R. A., Patil, H., McCallum, R. W. Dumping syndrome: Establishing criteria for diagnosis and identifying new etiolo gies. Digestive Diseases and Sciences. 55 (1), 117-123 (2010).
- Johnston, D. Operative mortality and postoperative morbidity of highly selective vagotomy. British Medical Journal. 4 (5996), 545-547 (1975).
- Nakauchi, M., et al. Robotic surgery for the upper gastrointestinal tract: Current status and future perspectives. Asian Journal of Endoscopic Surgery. 10 (4), 354-363 (2017).
- Frantzides, C. T., et al. Laparoscopic Roux-en-Y gastric bypass utilizing the triple stapling technique. Journal of the Society of Laparoendoscopic Surgeons. 10 (2), 176-179 (2006).
- Madan, A. K., Frantzides, C. T. Triple-stapling technique for jejunojejunostomy in laparoscopic gastric bypass. Archives of Surgery. 138 (9), 1029-1032 (2003).
- Forrester, J. D., et al. Surgery for hereditary diffuse gastric cancer: Long-term outcomes. Cancers. 14 (3), 728 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon