È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Imaging chimico iperspettrale non lineare multimodale mediante microscopia a scansione lineare con generazione di somma-frequenza vibrazionale
In questo articolo
Riepilogo
È stato sviluppato un quadro di imaging iperspettrale rapido e multimodale per ottenere immagini di generazione di somma e frequenza vibrazionale a banda larga (VSFG), insieme a modalità di imaging in campo chiaro, generazione di seconda armonica (SHG). A causa della risonanza della frequenza infrarossa con le vibrazioni molecolari, viene rivelata la conoscenza della morfologia strutturale e mesoscopica microscopica dei campioni consentiti dalla simmetria.
Abstract
La generazione di somma-frequenza vibrazionale (VSFG), un segnale ottico non lineare del secondo ordine, è stata tradizionalmente utilizzata per studiare le molecole alle interfacce come tecnica di spettroscopia con una risoluzione spaziale di ~100 μm. Tuttavia, la spettroscopia non è sensibile all'eterogeneità di un campione. Per studiare campioni mesoscopicamente eterogenei, noi, insieme ad altri, abbiamo spinto il limite di risoluzione della spettroscopia VSFG fino al livello di ~1 μm e abbiamo costruito il microscopio VSFG. Questa tecnica di imaging non solo è in grado di risolvere le morfologie del campione attraverso l'imaging, ma anche di registrare uno spettro VSFG a banda larga in ogni pixel delle immagini. Essendo una tecnica ottica non lineare del secondo ordine, la sua regola di selezione consente la visualizzazione di strutture autoassemblate non centrosimmetriche o chirali che si trovano comunemente in biologia, scienza dei materiali e bioingegneria, tra gli altri. In questo articolo, il pubblico sarà guidato attraverso un design di trasmissione invertita che consente l'imaging di campioni non fissi. Questo lavoro mostra anche che la microscopia VSFG può risolvere informazioni geometriche specifiche per la chimica di singoli fogli autoassemblati combinandola con un risolutore di funzioni di rete neurale. Infine, le immagini ottenute in configurazioni in campo chiaro, SHG e VSFG di vari campioni discutono brevemente le informazioni uniche rivelate dall'imaging VSFG.
Introduzione
La generazione di somma-frequenza vibrazionale (VSFG), una tecnica ottica non lineare del secondo ordine 1,2, è stata ampiamente utilizzata come strumento di spettroscopia per profilare chimicamente campioni simmetriciconsentiti 3,4,5,6,7,8,9,10,11,12,13, 14,15,16,17,18,19,20,21,22. Tradizionalmente, il VSFG è stato applicato ai sistemi interfacciali 8,9,10,11 (cioè gas-liquido, liquido-liquido, gas-solido, solido-liquido), che mancano di simmetria di inversione - un requisito per l'attività VSFG. Questa applicazione di VSFG ha fornito una vasta gamma di dettagli molecolari delle interfacce sepolte 12,13, delle configurazioni delle molecole d'acqua alle interfacce 14,15,16,17,18 e delle specie chimiche alle interfacce 19,20,21,22.
Sebbene il VSFG sia stato potente nel determinare le specie molecolari e le configurazioni alle interfacce, il suo potenziale nella misurazione delle strutture molecolari di materiali privi di centri di inversione non è stato realizzato. Ciò è in parte dovuto al fatto che i materiali potrebbero essere eterogenei nel loro ambiente chimico, nelle composizioni e nella disposizione geometrica, e uno spettrometro VSFG tradizionale ha un'ampia area di illuminazione dell'ordine di 100 μm2. Pertanto, la spettroscopia VSFG tradizionale riporta informazioni mediate dall'ensemble del campione su una tipica area di illuminazione di 100 μm2. Questa media d'insieme può portare a cancellazioni di segnale tra domini ben ordinati con orientamenti opposti e a un'errata caratterizzazione delle eterogeneità locali 15,20,23,24.
Con i progressi negli obiettivi per microscopi ad alta apertura numerica (NA), basati su riflessione (geometrie di Schwarzschild e Cassegrain), che sono quasi privi di aberrazioni cromatiche, la dimensione del fuoco dei due fasci negli esperimenti VSFG può essere ridotta da 100 μm 2 a 1-2 μm2 e in alcuni casi submicron25. Compreso questo progresso tecnologico, il nostro gruppo e altri hanno sviluppato VSFG in una piattaforma di microscopia 20,23,26,27,28,29,30,31,32,33,34,35,36. Recentemente, abbiamo implementato un layout ottico invertito e uno schema di rilevamento a banda larga37, che consente una raccolta senza soluzione di continuità di immagini multimodali (VSFG, generazione di seconda armonica (SHG) e ottica in campo chiaro). L'imaging multimodale consente una rapida ispezione dei campioni utilizzando l'imaging ottico, correlando tra loro vari tipi di immagini e localizzando le posizioni del segnale sulle immagini del campione. Con l'ottica di illuminazione acromatica e la scelta della sorgente di illuminazione laser pulsata, questa piattaforma ottica consente in futuro l'integrazione senza soluzione di continuità di tecniche aggiuntive come la microscopia a fluorescenza38 e la microscopia Raman, tra le altre.
In questa nuova disposizione, sono stati studiati campioni come le organizzazioni gerarchiche e una classe di auto-assemblaggi molecolari (MSA). Questi materiali includono il collagene e la biomimetica, in cui sia la composizione chimica che l'organizzazione geometrica sono importanti per la funzione finale del materiale. Poiché VSFG è un segnale ottico non lineare del secondo ordine, è specificamente sensibile alle disposizioni intermolecolari39,40, come la distanza intermolecolare o gli angoli di torsione, il che lo rende uno strumento ideale per rivelare sia le composizioni chimiche che le disposizioni molecolari. Questo lavoro descrive le modalità VSFG, SHG e campo chiaro dello strumento principale costituito da un laser a stato solido a cavità drogato con itterbio che pompa un amplificatore parametrico ottico (OPA), un microscopio invertito multimodale costruito in casa e un analizzatore di frequenza monocromatore accoppiato a un rivelatore bidimensionale ad accoppiamento caricato (CCD)27. Vengono fornite procedure dettagliate di costruzione e allineamento e un elenco completo delle parti della configurazione. Un'analisi approfondita di un MSA, la cui subunità molecolare fondamentale è costituita da una molecola di sodio-dodecilsolfato (SDS), un tensioattivo comune, e due molecole di β-ciclodestrina (β-CD), nota come SDS@2 β-CD, viene fornita anche come esempio per mostrare come VSFG può rivelare dettagli geometrici specifici della molecola della materia organizzata. È stato inoltre dimostrato che i dettagli geometrici chimicamente specifici dell'MSA possono essere determinati con un approccio risolutore di funzioni di rete neurale.
Protocollo
1. Microscopio VSFG a scansione lineare iperspettrale
- Sistema laser
- Utilizzare un sistema laser pulsato (vedi Tabella dei materiali) centrato a 1025 nm ± 5 nm. Il laser è impostato a 40 W, 200 kHz (200 μJ/impulso) con un'ampiezza di impulso di ~290 fs.
NOTA: L'esatta frequenza di ripetizione può variare e un laser ad alta frequenza di ripetizione generalmente funziona meglio per questo microscopio VSFG. - Guidare l'uscita del laser a semina in un amplificatore parametrico ottico (OPA) commerciale per generare un fascio nel medio infrarosso (MIR) (vedere la tabella dei materiali). Regolare il MIR sulla frequenza degli interessi (Figura 1A).
NOTA: Nel presente studio, il MIR è centrato a 3450 nm ± 85 nm (~2900 ± 72 cm-1) con una durata dell'impulso di ~290 fs e un'energia dell'impulso di ~6 μJ, che comprende parte della regione del gruppo funzionale -CHx .
- Utilizzare un sistema laser pulsato (vedi Tabella dei materiali) centrato a 1025 nm ± 5 nm. Il laser è impostato a 40 W, 200 kHz (200 μJ/impulso) con un'ampiezza di impulso di ~290 fs.
- Trave di conversione verso l'alto
- Far passare il fascio residuo di 1025 nm da OPA attraverso un etalon Fabry-Perot (vedi Tabella dei materiali) per produrre un fascio di conversione verso l'alto spettralmente ristretto con un FWHM di ~4,75 cm-1.
- Filtra spazialmente il fascio ristretto di 1025 nm con un foro stenopeico in zaffiro da 8 μm.
NOTA: Il fascio di 1025 nm può essere visualizzato utilizzando una scheda NIR. - Controllare la polarizzazione dell'impulso a 1025 nm con una piastra d'onda λ/2 (vedi Tabella dei materiali).
- Trave MIR
- Guidare il fascio MIR attraverso uno stadio di ritardo per un controllo preciso della sovrapposizione temporale.
- Controlla la polarizzazione del MIR con una piastra d'onda λ/2.
- Microscopio VSFG
- Sovrapponi spazialmente sia i fasci di conversione verso l'alto che i fasci MIR in uno specchio dicroico personalizzato (DM, Figura 1B) che è trasmissivo a MIR e riflettente a NIR (vedi Tabella dei materiali). Usa due iridi per guidare l'allineamento: uno subito dopo il DM e uno all'estremità. Utilizzare un misuratore di potenza dopo il diaframma per determinare se il MIR è centrato e utilizzare una scheda NIR per individuare le posizioni NIR.
NOTA: Dopo la sovrapposizione, il raggio NIR può essere utilizzato per guidare entrambi i raggi. - Dirigere i fasci sovrapposti in un microscopio invertito con uno scanner a fascio risonante monoassiale integrato a 325 Hz (montato su uno scanner integrato a due posizioni (I2PS), Figura 1B) (vedere la tabella dei materiali).
NOTA: Lo scanner risonante proietta una linea dei due fasci sovrapposti sull'apertura posteriore dell'obiettivo a condensatore. È montato su un cursore che consente la riconfigurazione senza soluzione di continuità tra le modalità VSFG/SHG e campo chiaro. - Focalizzare i due fasci spazialmente sovrapposti sul campione con un obiettivo Schwarzschild puramente riflettente (SO, Figura 1B,D) (vedi Tabella dei materiali).
- Raccogliere il segnale VSFG generato dal campione con un obiettivo refrattivo corretto all'infinito (RO, Figura 1B,D) (vedi Tabella dei materiali).
- Guidare il segnale VSFG in uscita collimato attraverso un polarizzatore lineare e quindi attraverso un sistema di lenti tubolari telecentriche composto da due lenti focali f = 60 mm (TL1 e TL2, Figura 1B,C) (vedi Tabella dei Materiali).
NOTA: L'immagine ingrandita dalle lenti del tubo si forma nella fessura d'ingresso del monocromatore (MC, Figura 1B,C) e i dati risolti spazialmente/frequenza vengono rilevati su un rivelatore CCD bidimensionale (CCD, Figura 1B).
- Sovrapponi spazialmente sia i fasci di conversione verso l'alto che i fasci MIR in uno specchio dicroico personalizzato (DM, Figura 1B) che è trasmissivo a MIR e riflettente a NIR (vedi Tabella dei materiali). Usa due iridi per guidare l'allineamento: uno subito dopo il DM e uno all'estremità. Utilizzare un misuratore di potenza dopo il diaframma per determinare se il MIR è centrato e utilizzare una scheda NIR per individuare le posizioni NIR.
- Modalità SHG
- Per passare all'imaging SHG, bloccare il fascio IR e ruotare il reticolo dello spettrografo a 501,5 nm per visualizzare il segnale SHG.
- Modalità campo chiaro
- Per passare all'imaging ottico in campo chiaro, accendere la sorgente di luce bianca (vedere Tabella dei materiali). Spostare il cursore integrato (I2PS, Figura 1B) per raccogliere immagini in campo chiaro nella direzione di contropropagazione, con l'obiettivo di imaging (RO) che funge da condensatore e l'obiettivo a condensatore (SO) che funge da obiettivo di imaging.
- Formare un'immagine dell'uscita collimata dell'obiettivo rifrattivo sul piano del sensore di una fotocamera RGB in campo chiaro utilizzando un sistema tubo-obiettivo disponibile in commercio (vedere la tabella dei materiali).

Figura 1: Microscopio VSFG iperspettrale multimodale. (A) Vista dall'alto della configurazione principale. Un laser a pompa da 1025 nm è stato inviato a un OPA per generare un impulso modulabile nel medio infrarosso. I 1025 nm residui sono stati spesso ristretti da un etalon (E) e filtrati spazialmente in un fascio gaussiano da un filtro spaziale (SFG). I fasci di medio infrarosso e 1025 nm sono spazialmente sovrapposti a uno specchio dicroico (DM) personalizzato e guidati attraverso il microscopio invertito (regione scatolata in A). (B) I due fasci vengono inviati a uno scanner a fascio risonante a 325 Hz montato su un cursore integrato a 2 posizioni (I2PS), consentendo la commutazione senza soluzione di continuità tra le modalità ottiche in campo chiaro e non lineari. La piattaforma del microscopio è dotata di un obiettivo Schwarzschild (SO) con correzione all'infinito basato su riflessione che funge da condensatore e di un obiettivo di imaging (RO) con correzione all'infinito basato sulla rifrazione montato su uno stadio dell'asse z di nanoposizionamento verticale (VNP). Il SO focalizza la linea di fasci in arrivo che lo scanner del fascio risonante riflette sul campione, mentre l'RO raccoglie la sezione della linea VSFG dei segnali. È importante controllare con precisione la posizione dell'asse z dell'osmosi inversa con una precisione di 1 μm per garantire che il campione sia nelle migliori condizioni focali per un imaging di alta qualità. La linea collimata del segnale VSFG viene quindi diretta verso un sistema di lenti tubolari composto da 2 lenti a vasca (TL1 e TL2), formando un'immagine ingrandita nella fessura d'ingresso del monocromatore (MC). La linea di spettri risolta in frequenza viene quindi visualizzata in modo iperspettrale su un dispositivo ad accoppiamento di carica (CCD). Dopo aver raccolto ogni linea iperspettrale, il campione viene scansionato nell'asse perpendicolare all'asse di scansione dello scanner a fascio risonante utilizzando il NP. Per raccogliere immagini in campo chiaro del campione, l'I2PS viene spostato nella posizione in campo chiaro e viene installato uno specchio che intercetta la sorgente di luce bianca (WLS). La luce viene quindi focalizzata dall'RO e ripresa dall'SO. Viene quindi formata un'immagine sul piano del sensore della fotocamera in campo chiaro (BC) nella parte superiore del microscopio invertito. (C) Vista dettagliata del percorso ottico attraverso l'area della lente del tubo nel MC e nel CCD. (D) Vista dettagliata dell'area del campione tra SO e RO. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Allineamento del microscopio iperspettrale e calibrazione spaziale dell'asse CCD verticale
- Ottimizzare approssimativamente la posizione del piano del campione (asse z del nano posizionatore) utilizzando un campione standard di ZnO (1 μm di spessore) rivestito di sputtering 15 mm x 15 mm x 0,170 mm ± vetrino coprioggetto da 0,005 mm e portandolo a fuoco in campo chiaro utilizzando la modalità di imaging in campo chiaro.
NOTA: Potrebbe essere necessario regolare la posizione z dell'RO e l'allineamento della luce bianca, se necessario. Un'immagine rappresentativa dello ZnO sul modello di vetro utilizzato per la calibrazione dell'allineamento è mostrata nella Figura 2. - Riportare l'I2PS sul braccio di illuminazione non lineare e ottimizzare l'altezza del campione per la massima intensità VSFG non risonante generata dalle regioni ZnO osservate sulla telecamera CCD.
NOTA: La posizione z dell'osmosi inversa deve essere regolata per la massima intensità. Potrebbe essere necessario ripetere i passaggi 2.1 e 2.2 alcune volte prima di raggiungere l'altezza ottimale del campione e l'osmosi inversa. - Accendi lo scanner a fascio risonante e raccogli una linea delle immagini.
- Raccogli immagini di intensità non risonante scansionando il campione perpendicolarmente alla direzione dello scanner del fascio. Prendi sezioni verticali dei dati dell'immagine e stabilisci il rapporto pixel:micron. (fare riferimento alla Figura 3 e alla relativa legenda).
NOTA: La derivata di queste sezioni di linea viene analizzata per produrre il rapporto pixel:micron dell'asse verticale CCD che verrà utilizzato per le immagini future.

Figura 2: Qualità dell'immagine rappresentativa per l'allineamento approssimativo della modalità di imaging in campo chiaro di un modello ZnO. Fare clic qui per visualizzare una versione più grande di questa figura.
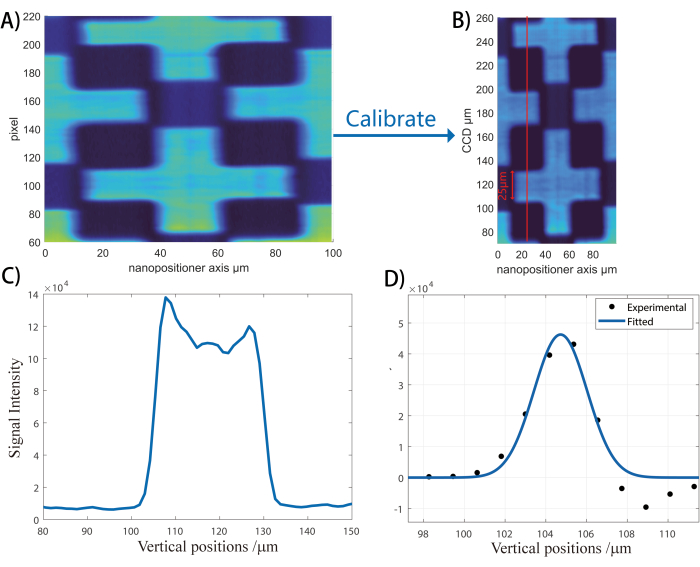
Figura 3: Flusso di lavoro di calibrazione dell'asse verticale. Questa figura illustra come convertire i pixel del CCD in dimensioni spaziali verticali nell'unità di μm. (A) Viene raccolta e ricostruita un'immagine del vetrino coprioggetto con motivo ZnO. Quindi, la distanza in pixel da uno all'altro bordo del motivo (piccola barra verticale in A). Poiché la croce del modello ZnO è progettata per avere una larghezza di 25 μm, è possibile utilizzare il rapporto tra larghezza fisica e larghezza in pixel per calcolare il rapporto dimensione fisica/pixel. Un'immagine rappresentativa calibrata sull'asse verticale è mostrata in (B). (C) Infine, viene presa una fetta verticale come indicato dalla linea rossa. (D) La derivata della fetta verticale viene presa per ottenere la risoluzione spaziale. La derivata della sezione verticale viene utilizzata per ottenere la risoluzione spaziale. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Raccolta di dati iperspettrali
- Raccogliere gli spettri di una linea verticale dei segnali VSFG sul CCD, i cui spettri sono dispersi lungo l'asse orizzontale e le posizioni spaziali sono registrate sull'asse verticale del CCD.
NOTA: In questo modo si ottiene un set di dati bidimensionale per una sezione a riga singola. - Dopo che la sezione della linea del campione è stata sottoposta a imaging iperspettrale, scansionare il campione nell'asse perpendicolare all'asse di scansione della linea utilizzando il nano-posizionatore tridimensionale (NP, Figura 1).
NOTA: Il posizionatore nano 3D è importante per un'elevata precisione e riproducibilità nell'individuazione delle regioni del campione (piano x-y) e per mettere a fuoco il campione (asse z). - Eseguire l'iterazione tra il passaggio 3.1 e il passaggio 3.2 per raccogliere un'immagine iperspettrale VSFG.
4. Analisi dei dati iperspettrali
- Spettrale i dati utilizzando il flusso di lavoro della libreria di imaging iperspettraleMatLab toolbox 41.
NOTA: L'unmixing spettrale correla le posizioni spaziali a spettri univoci. Il codice Matlab per l'analisi dei dati iperspettrali è fornito nel file supplementare 1.- Crea un ipercubo a 4 dimensioni (x = spaziale, y = spaziale, z = intensità dipendente dalla frequenza, ω = frequenza) utilizzando la funzione ipercubo nella libreria di imaging iperspettraleMatlab image processing toolbox 41.
- Identificare il numero di spettri univoci con la funzione countEndmembersHFC con un valore di probabilità di falso allarme (PFA) compreso tra 10 e 7.
- Identifica gli spettri unici utilizzando la funzione di demiscelazione spettrale di nfindr .
- Infine, utilizzando la funzione sid , associare ogni pixel a uno degli spettri univoci identificati nel passaggio precedente.
NOTA: Ulteriori metodi di dismixing e matching spettrale possono essere eseguiti con funzioni/algoritmi alternativi offerti nella MatLab Hyperspectral Imaging Library41.
- Adattare i dati di somma per ogni foglio isolato alla funzione Voigt42 (File supplementare 1).
NOTA: La funzione lorentziana rappresenta il limite della forma di linea omogenea pura, mentre la funzione gaussiana ha origine da limiti disomogenei. In realtà, i sistemi potrebbero trovarsi in una combinazione di limiti omogenei e disomogenei, che richiede una funzione di Voigt - una pratica comune per la spettroscopia in fase condensata, incluso il VSFG.
5. Analisi geometrica del campione
- Determinare la geometria dei campioni seguendo la procedura indicata nei punti 5.2-5.3. In questo studio, SDS@2 β-CD viene utilizzato come esempio. Derivare gli elementi tensoriali consentiti alla simmetria di χ(2) in base alla simmetria C7 della subunità molecolare del campione di mesofogli SDS@2 β-CD.
NOTA: La simmetria consentita χ(2) dipende dalla simmetria. Per calcolare la suscettibilità non lineare ammessa di qualsiasi simmetria, fare riferimento al riferimento43. - Applicare la rotazione di Eulero27 per mettere in relazione le misure del frame di laboratorio con il frame molecolare.
NOTA: Nel caso di SDS@2 β-CD, la sua simmetria C7 porta a otto equazioni indipendenti che mettono in relazione 8 uscite (lab frame χ(2)) e 8 ingressi (6 iperpolarizzabilità indipendenti β(2) e due angoli: Θ, l'angolo di inclinazione rispetto al piano campione di tutti i fogli e φ, la rotazione nel piano del foglio (Figura 4)). Due fogli vengono utilizzati per estrarre gli allineamenti molecolari comuni dei due fogli. Le relazioni tra φ1 e φ2 (angolo di rotazione nel piano dei due fogli) possono essere estratte dalle immagini in campo chiaro. Nell'esempio corrente, φ2 = φ1 + 60°. Si assume che tutte le unità molecolari si aggiungano allo stesso angolo, quindi Θ1 = Θ2. Ciò si traduce in 11 incognite (9 indipendenti, di cui 6 indipendenti di iperpolarizzabilità β(2), Θ 1 e φ1, e il rapporto di copertura relativo tra i fogli N e i due angoli dipendenti, che sono φ 2 e Θ2) per 16 noti (8 polarizzazioni del frame di laboratorio per foglio e due fogli). - Mettere in relazione il frame di laboratorio χ(2) e l'iperpolarizzabilità del frame molecolare β(2) con un risolutore di funzioni di rete neurale.
NOTA: una sintesi dettagliata di questo approccio è disponibile nel riferimento27.- Crea un modello di rete neurale a più livelli in Python44usando Keras composto da una struttura di 200-100-50 nodi e una funzione di attivazione tangente iperbolica.
- Creare una matrice 100000 x 11 generata in modo casuale dei valori di β(2), Θ 1, Θ 2, φ1, φ 2 e N. Calcolare il corrispondente frame di laboratorio 16 χ(2), utilizzando l'equazione determinata in 5.2 dalle rotazioni di Eulero.
- Usa i valori χ(2) calcolati (un totale di 100.000 per 16 valori) come input e impara a prevedere 11 valori (β(2), Θ 1, Θ 2, φ1, φ 2 e N) quando vengono forniti 16 valori χ(2).
- Dopo il training, usare un altro set di 1000 voci con gli input e gli output per testare il modello sottoposto a training. L'output previsto e l'output reale devono mostrare una relazione lineare con una pendenza pari a 1.
- Infine, fornire la χ(2) misurata sperimentalmente da due fogli (ogni foglio ha 8 χ(2 ) misurati) e utilizzare il modello addestrato per prevedere l'angolo di inclinazione Θ, insieme ad altre proprietà.
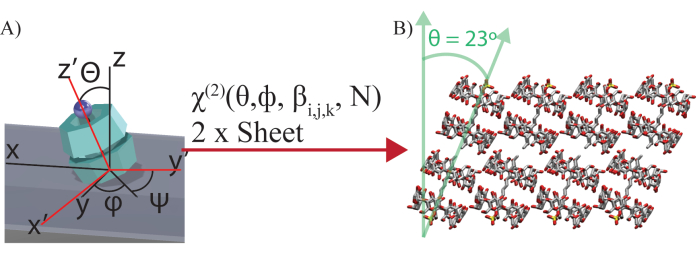
Figura 4: Illustrazione della trasformazione di Eulero. (A) Illustrazione della trasformazione di Eulero tra la suscettibilità del secondo ordine delle coordinate di laboratorio (XYZ) χ(2) e l'iperpolarizzabilità delle coordinate molecolari (xyz) βijk. La rotazione di Eulero z-y'-z'' viene eseguita sulle coordinate molecolari, dove φ è l'angolo di rotazione nel piano, θ l'angolo di inclinazione e ψ l'angolo di torsione. ψ è integrato per angoli di torsione arbitrari attorno all'asse molecolare. φ non è integrato perché tutte le molecole ruotano ad un angolo specifico rispetto al telaio del laboratorio per formare i fogli autoassemblati. N è la copertura superficiale relativa dei due fogli. (B) Visualizzazione delle subunità inclinate che formano un foglio determinato dai risultati della rete neurale. Questa cifra è stata modificata da Wagner et al.27. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
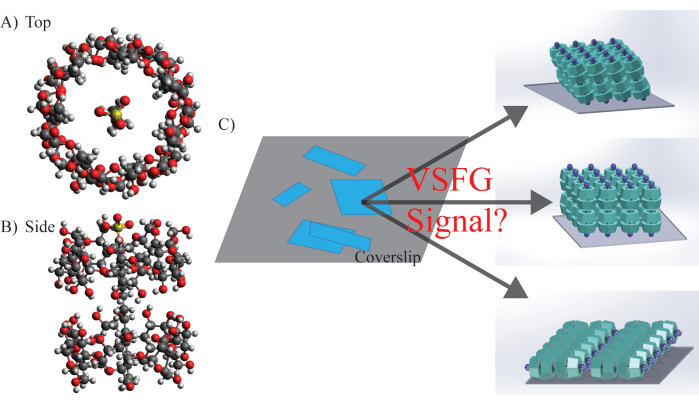
Figura 5: Struttura molecolare, morfologia e orientamento potenziale di SDS@β-CD. (A) Vista dall'alto e (B) vista laterale struttura chimica di SDS@β-CD. (C) Distribuzione rappresentativa del campione eterogeneo dei fogli a mesoscala sul piano del campione. La subunità molecolare potrebbe avere d...
Discussione
I passaggi più critici vanno da 1,42 a 1,44. È fondamentale allineare bene la lente dell'obiettivo per una risoluzione spaziale ottica. È anche importante raccogliere il segnale emesso, il relè e proiettare il raggio di scansione come una linea nelle fessure di ingresso. Allineamenti corretti garantirebbero la migliore risoluzione e il miglior rapporto segnale/rumore. Per un campione tipico, come i fogli SDS@2 β-CD da 100 μm per 100 μm, un'immagine a buona risoluzione (risoluzione ~1 μm) con un elevato rapporto s...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Lo sviluppo dello strumento è supportato dal Grant NSF CHE-1828666. ZW, JCW e WX sono supportati dal National Institutes of Health, National Institute of General Medical Sciences, Grant 1R35GM138092-01. BY è sostenuto dall'Associazione per la promozione dell'innovazione giovanile, Accademia cinese delle scienze (CAS, 2021183).
Materiali
| Name | Company | Catalog Number | Comments |
| 1x Camera Por | Thorlabs | WFA4100 | connect a camera to a microscope or optical system |
| 25.0 mm Right-Angle Prism Mirror, Protected Gold | Thorlabs | MRA25-M01 | reflect light and produce retroreflection, redirecting light back along its original path |
| 3” Universal Post Holder-5 Pack | Thorlabs | UPH3-P5 | hold and support posts of various sizes and configurations |
| 30 mm to 60 mm Cage Plate, 4 mm Thick | Thorlabs | LCP4S | convert between a 30 mm cage system and a 60 mm cage system |
| 500 mm Tall Cerna Body with Epi Arm | Thorlabs | CEA1500 | provide the function of enabling top illumination techniques in microscopy |
| 60 mm Cage Mounted Ø50.0 mm Iris | Thorlabs | LCP50S | control the amount of light passing through an optical system |
| 60 mm Cage Mounting Bracket | Thorlabs | LCP01B | mount and position a 60 mm cage system in optical setups |
| Air spaced Etalon | SLS Optics Ltd. | Customized | generate narrow-band 1030 nm light |
| Cage Plate Mounting Bracket | Thorlabs | KCB2 | hold and adjust mirrors at a precise angle |
| CCD | Andor Technologies | Newton | 2D CCD for frequency and spatial resolution |
| Collinear Optical Parametric Amplifier | Light Conversion | Orpheus-One-HP | Tunable MID light generator |
| Copper Chloride | Thermo Fischer Scientific | A16064.30 | Self-assembly component |
| Customized Dichroic Mirror | Newport | Customized | selectively reflects or transmits light based on its wavelength or polarization |
| Ext to M32 Int Adapter | Thorlabs | SM1A34 | provide compatibility and facilitating the connection between components with different thread types |
| Infinity Corrected Refractive Objective | Zeiss | 420150-9900-000 | Refractive Objective |
| Infinity Corrected Schwarzschild Objective | Pike Technologies Inc. | 891-0007 | Reflective objective |
| Laser | Carbide, Light-Conversion | C18212 | Laser source |
| M32x0.75 External to Internal RMS | Thorlabs | M32RMSS | adapt or convert the threading size or type of microscope objectives |
| M32x0.75 External to M27x0.75 Internal Engraving | Thorlabs | M32M27S | adapt or convert the threading size or type of microscope objectives |
| Manual Mid-Height Condenser Focus Module | Thorlabs | ZFM1030 | adjust the focus of an optical element |
| Monochromator | Andor Technologies | Shamrock 500i | Provides frequency resolution for each line scan |
| Motorized module with 1" Travel for Edge-Mounted Arms | Thorlabs | ZFM2020 | control the vertical positon of the imaging objective |
| Nanopositioner | Mad City Labs Inc. | MMP3 | 3D sample stage |
| Resonant Scanner | EOPC | SC-25 | 325Hz resonant beam scanner |
| RGB Color CCD Camera | Thorlabs | DCU224C | Brightfield camera, discontinued but other cameras will work just as well |
| RGB tube lens | Thorlabs | ITL200 | white light collection |
| Right Angle Kinematic Breadboard | Thorlabs | OPX2400 | incorporate a sliding mechanism with two fixed positions |
| Right Angle Kinematic Mirror Mount, 30 mm | Thorlabs | KCB1 | hold and adjust mirrors at a precise angle |
| Right Angle Kinematic Mirror Mount, 60 mm | Thorlabs | KCB2 | hold and adjust mirrors at a precise angle |
| SM2, 60 mm Cage Arm for Cerna Focusing Stage | Thorlabs | CSA2100 | securely mount and position condensers |
| Snap on Cage Cover for 60 mm Cage, 24 in Long, | Thorlabs | C60L24 | enclose and protect the components inside the cage |
| Sodium dodecyl sulfate | Thermo Fischer Scientific | J63394.AK | Self-assembly component |
| Three-Chnnale Controller and Knob Box for 1" Cerna Travel Stages | Thorlabs | MCM3001 | control ZFM2020 |
| Tube lens | Thorlabs | LA1380-AB - N-BK7 | SFG signal collection |
| Visible LED Set | Thorlabs | WFA1010 | provide illumination in imaging setup |
| Whitelight Source | Thorlabs | WFA1010 | Whitelight illumination source for brightfield imaging |
| WPH05M-1030 - Ø1/2" Zero-Order Half-Wave Plate, Ø1" Mount, 1030 nm | Thorlabs | WPH05M-1030 | alter the polarization state of light passing through it |
| WPLQ05M-3500 - Ø1/2" Mounted Low-Order Quarter-Wave Plate, 3.5 µm | Thorlabs | WPLQ05M-3500 | alter the polarization state of light passing through it |
| X axis Long Travel Steel Extended Contact Slide Stages | Optosigma | TSD-65122CUU | positioning stages that offer extended travel in the horizontal (X) direction |
| XT95 4in Rail Carrier | Thorlabs | XT95RC4 | mount and position optical components |
| X-Y Axis Translation Stage w/ 360 deg. Rotation | Thorlabs | XYR1 | precise movement and positioning of objects in two dimensions, along with the ability to rotate the platform |
| XY(1/2") Linear Translator with Central SM1 Thru Hole | Thorlabs | XYT1 | provide precise movement and positioning in two dimensions |
| Yb doped Solid State Laser | Light Conversion | CB3-40W | Seed laser |
| β-Cyclodextrin | Thermo Fischer Scientific | J63161.22 | Self-assembly component |
Riferimenti
- Zhu, X. D., Suhr, H., Shen, Y. R. Surface vibrational spectroscopy by infrared-visible sum frequency generation. Physical Review B. 35 (6), 3047-3050 (1987).
- Shen, Y. R. Surface properties probed by second-harmonic and sum-frequency generation. Nature. 337 (6207), 519-525 (1987).
- Li, Y., Shrestha, M., Luo, M., Sit, I., Song, M., Grassian, V. H., Xiong, W. Salting up of proteins at the air/water interface. Langmuir. 35 (43), 13815-13820 (2019).
- Wang, C., Li, Y., Xiong, W. Extracting molecular responses from ultrafast charge dynamics at material interfaces. Journal of Materials Chemistry C. 8 (35), 12062-12067 (2020).
- Nihonyanagi, S., Mondal, J. A., Yamaguchi, S., Tahara, T. Structure and dynamics of interfacial water studied by heterodyne-detected vibrational sum-frequency generation. Annual Review of Physical Chemistry. 64 (1), 579-603 (2013).
- Nihonyanagi, S., Yamaguchi, S., Tahara, T. Ultrafast dynamics at water interfaces studied by vibrational sum frequency generation spectroscopy. Chemical Reviews. 117 (16), 10665-10693 (2017).
- Singh, P. C., Nihonyanagi, S., Yamaguchi, S., Tahara, T. Ultrafast vibrational dynamics of water at a charged interface revealed by two-dimensional heterodyne-detected vibrational sum frequency generation. The Journal of Chemical Physics. 137 (9), 094706 (2012).
- Jubb, A. M., Hua, W., Allen, H. C. Environmental chemistry at vapor/water interfaces: insights from vibrational sum frequency generation spectroscopy. Annual Review of Physical Chemistry. 63 (1), 107-130 (2012).
- Ishiyama, T., Sato, Y., Morita, A. Interfacial structures and vibrational spectra at liquid/liquid boundaries: molecular dynamics study of water/carbon tetrachloride and water/1,2-dichloroethane interfaces. The Journal of Physical Chemistry C. 116 (40), 21439-21446 (2012).
- Sapi, A., Liu, F., Cai, X., Thompson, C. M., Wang, H., An, K., Krier, J. M., Somorjai, G. A. Comparing the catalytic oxidation of ethanol at the solid-gas and solid-liquid interfaces over size-controlled pt nanoparticles: striking differences in kinetics and mechanism. Nano Letters. 14 (11), 6727-6730 (2014).
- Chen, X., Wang, J., Sniadecki, J. J., Even, M. A., Chen, Z. Probing α-helical and β-sheet structures of peptides at solid/liquid interfaces with SFG. Langmuir. 21 (7), 2662-2664 (2015).
- Dramstad, T. A., Wu, Z., Gretz, G. M., Massari, A. M. Thin films and bulk phases conucleate at the interfaces of pentacene thin films. The Journal of Physical Chemistry C. 125 (30), 16803-16809 (2021).
- Xiang, B., Li, Y., Pham, C. H., Paesani, F., Xiong, W. Ultrafast direct electron transfer at organic semiconductor and metal interfaces. Science Advances. 3 (11), e1701508 (2017).
- Livingstone, R. A., Nagata, Y., Bonn, M., Backus, E. H. G. Two types of water at the water-surfactant interface revealed by time-resolved vibrational spectroscopy. Journal of the American Chemical Society. 137 (47), 14912-14919 (2015).
- Wagner, J. C., Hunter, K. M., Paesani, F., Xiong, W. Water capture mechanisms at zeolitic imidazolate framework interfaces. Journal of the American Chemical Society. 143 (50), 21189-21194 (2021).
- Montenegro, A., Dutta, C., Mammetkuliev, M., Shi, H., Hou, B., Bhattacharyya, D., Zhao, B., Cronin, S. B., Benderskii, A. V. Asymmetric response of interfacial water to applied electric fields. Nature. 594 (7861), 62-65 (2021).
- Nihonyanagi, S., Ishiyama, T., Lee, T., Yamaguchi, S., Bonn, M., Morita, A., Tahara, T. Unified molecular view of the air/water interface based on experimental and theoretical χ(2) spectra of an isotopically diluted water surface. Journal of the American Chemical Society. 133 (42), 16875-16880 (2011).
- Shen, Y. R., Ostroverkhov, V. Sum-frequency vibrational spectroscopy on water interfaces: polar orientation of water molecules at interfaces. Chemical Reviews. 106 (4), 1140-1154 (2006).
- Hosseinpour, S., Roeters, S. J., Bonn, M., Peukert, W., Woutersen, S., Weidner, T. Structure and dynamics of interfacial peptides and proteins from vibrational sum-frequency generation spectroscopy. Chemical Reviews. 120 (7), 3420-3465 (2020).
- Wang, H., Xiong, W. Vibrational sum-frequency generation hyperspectral microscopy for molecular self-assembled systems. Annual Review of Physical Chemistry. 72 (1), 279-306 (2021).
- Wang, H. -. F., Velarde, L., Gan, W., Fu, L. Quantitative sum-frequency generation vibrational spectroscopy of molecular surfaces and interfaces: lineshape, polarization, and orientation. Annual Review of Physical Chemistry. 66 (1), 189-216 (2015).
- Inoue, K., Ahmed, M., Nihonyanagi, S., Tahara, T. Reorientation-induced relaxation of free oh at the air/water interface revealed by ultrafast heterodyne-detected nonlinear spectroscopy. Nature Communications. 11 (1), 5344 (2020).
- Wang, H., Gao, T., Xiong, W. Self-phase-stabilized heterodyne vibrational sum frequency generation microscopy. ACS Photonics. 4 (7), 1839-1845 (2017).
- Wang, H., Xiong, W. Revealing the molecular physics of lattice self-assembly by vibrational hyperspectral imaging. Langmuir. 38 (10), 3017-3031 (2022).
- Raghunathan, V., Han, Y., Korth, O., Ge, N. -. H., Potma, E. O. Rapid vibrational imaging with sum frequency generation microscopy. Optics Letters. 36 (19), 3891 (2011).
- Wang, H., Wagner, J. C., Chen, W., Wang, C., Xiong, W. Spatially dependent h-bond dynamics at interfaces of water/biomimetic self-assembled lattice materials. Proceedings of the National Academy of Sciences. 117 (38), 23385-23392 (2020).
- Wagner, J. C., Wu, Z., Wang, H., Xiong, W. Imaging orientation of a single molecular hierarchical self-assembled sheet: the combined power of a vibrational sum frequency generation microscopy and neural network. The Journal of Physical Chemistry B. 126 (37), 7192-7201 (2022).
- Han, Y., Hsu, J., Ge, N. -. H., Potma, E. O. Polarization-sensitive sum-frequency generation microscopy of collagen fibers. The Journal of Physical Chemistry B. 119 (8), 3356-3365 (2015).
- Chung, C. -. Y., Potma, E. O. Biomolecular imaging with coherent nonlinear vibrational microscopy. Annual Review of Physical Chemistry. 64 (1), 77-99 (2013).
- Potma, E. O. Advances in vibrationally resonant sum-frequency generation microscopy. Optics in the Life Sciences Congress. , (2017).
- Han, Y., Raghunathan, V., Feng, R. R., Maekawa, H., Chung, C. -. Y. Y., Feng, Y., Potma, E. O., Ge, N. -. H. H. Mapping molecular orientation with phase sensitive vibrationally resonant sum-frequency generation microscopy. The Journal of Physical Chemistry B. 117 (20), 6149-6156 (2013).
- Hsu, J., Haninnen, A., Ge, N. -. H., Potma, E. O. Molecular imaging with sum-frequency generation microscopy. Optics in the Life Sciences. , (2015).
- Hanninen, A., Shu, M. W., Potma, E. O. Hyperspectral imaging with laser-scanning sum-frequency generation microscopy. Biomedical Optics Express. 8 (9), 4230 (2017).
- Wang, H., Chen, W., Wagner, J. C., Xiong, W. Local ordering of lattice self-assembled SDS@2β-CD materials and adsorbed water revealed by vibrational sum frequency generation microscope. The Journal of Physical Chemistry B. 123 (29), 6212-6221 (2019).
- Cimatu, K., Baldelli, S. Chemical imaging of corrosion: sum frequency generation imaging microscopy of cyanide on gold at the solid−liquid interface. Journal of the American Chemical Society. 130 (25), 8030-8037 (2008).
- Shah, S. A., Baldelli, S. Chemical imaging of surfaces with sum frequency generation vibrational spectroscopy. Accounts of Chemical Research. 53 (6), 1139-1150 (2020).
- Wagner, J. a. c. k. s. o. n. . C., Zishan, W. u., Xiong, W. Multimodal nonlinear vibrational hyperspectral imaging. ChemRxiv. , (2023).
- Yan, C., Wagner, J., Wang, C., Ren, J., Lee, C., Wan, Y., Wang, S., Xiong, W. Multi-dimensional widefield infrared-encoded spontaneous emission microscopy: distinguishing chromophores by ultrashort infrared pulses. ChemRxiv. , (2023).
- Lin, Y., Fromel, M., Guo, Y., Guest, R., Choi, J., Li, Y., Kaya, H., Pester, C. W., Kim, S. H. Elucidating interfacial chain conformation of superhydrophilic polymer brushes by vibrational sum frequency generation spectroscopy. Langmuir. 38 (48), 14704-14711 (2022).
- Choi, J., Lee, J., Makarem, M., Huang, S., Kim, S. H. Numerical simulation of vibrational sum frequency generation intensity for non-centrosymmetric domains interspersed in an amorphous matrix: a case study for cellulose in plant cell wall. The Journal of Physical Chemistry B. 126 (35), 6629-6641 (2022).
- Matlab Image Processing Toolbox Hyperspectral Imaging Library. . , .
- Armstrong, B. H. Spectrum line profiles: the Voigt function. Journal of Quantitative Spectroscopy and Radiative Transfer. 7 (1), 61-88 (1967).
- Wu, Z., Xiong, W. Neumann's principle based eigenvector approach for deriving non-vanishing tensor elements for nonlinear optics. The Journal of Chemical Physics. 157 (13), 134702 (2022).
- Chollet, F. Keras Neural Network Library. https://github.com/fchollet/keras accessed Apr 12. , (2021).
- Vicidomini, G., Bianchini, P., Diaspro, A. STED super-resolved microscopy. Nature Methods. 15 (3), 173-182 (2018).
- Xiong, W., Laaser, J. E., Mehlenbacher, R. D., Zanni, M. T. Adding a dimension to the infrared spectra of interfaces using heterodyne detected 2D sum-frequency generation (HD 2D SFG) spectroscopy. Proceedings of the National Academy of Sciences. 108 (52), 20902-20907 (2011).
- Lukas, M., Backus, E. H. G., Bonn, M., Grechko, M. Passively stabilized phase-resolved collinear sfg spectroscopy using a displaced sagnac interferometer. The Journal of Physical Chemistry A. 126 (6), 951-956 (2022).
- Ji, N., Ostroverkhov, V., Chen, C., Shen, Y. Phase-sensitive sum-frequency vibrational spectroscopy and its application to studies of interfacial alkyl chains. Journal of the American Chemical Society. 129 (33), 10056-10057 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon