È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Coltura di massa non frazionata di muscolo scheletrico di topo per ricapitolare la quiescenza di nicchie e cellule staminali
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il muscolo scheletrico comprende più tipi di cellule, comprese le cellule staminali residenti, ognuna con un contributo speciale all'omeostasi e alla rigenerazione muscolare. Qui vengono descritte la coltura 2D di cellule staminali muscolari e la nicchia delle cellule muscolari in un ambiente ex vivo che conserva molte delle caratteristiche fisiologiche, in vivo e ambientali.
Abstract
Il muscolo scheletrico è il tessuto più grande del corpo e svolge molteplici funzioni, dalla locomozione al controllo della temperatura corporea. La sua funzionalità e il recupero dagli infortuni dipendono da una moltitudine di tipi di cellule e da segnali molecolari tra le cellule muscolari centrali (miofibre, cellule staminali muscolari) e la loro nicchia. La maggior parte delle impostazioni sperimentali non preserva questo complesso microambiente fisiologico, e non consente nemmeno lo studio ex vivo delle cellule staminali muscolari in quiescenza, uno stato cellulare che è cruciale per loro. Qui, viene delineato un protocollo per la coltura ex vivo di cellule staminali muscolari con componenti cellulari della loro nicchia. Attraverso la scomposizione meccanica ed enzimatica dei muscoli, si ottiene una miscela di tipi cellulari, che viene messa in coltura 2D. L'immunocolorazione mostra che entro 1 settimana, più cellule di nicchia sono presenti in coltura insieme alle miofibre e, soprattutto, alle cellule Pax7-positive che mostrano le caratteristiche delle cellule staminali muscolari quiescenti. Queste proprietà uniche rendono questo protocollo un potente strumento per l'amplificazione cellulare e la generazione di cellule staminali quiescenti che possono essere utilizzate per affrontare domande fondamentali e traslazionali.
Introduzione
Il movimento, la respirazione, il metabolismo, la postura del corpo e il mantenimento della temperatura corporea dipendono tutti dal muscolo scheletrico e i malfunzionamenti del muscolo scheletrico possono, quindi, causare patologie debilitanti (ad esempio, miopatie, distrofie muscolari, ecc.) 1. Date le sue funzioni essenziali e l'abbondanza, il muscolo scheletrico ha attirato l'attenzione dei laboratori di ricerca di tutto il mondo che si sforzano di comprendere gli aspetti chiave che supportano la normale funzione muscolare e possono fungere da bersagli terapeutici. Inoltre, il muscolo scheletrico è un modello ampiamente utilizzato per studiare la rigenerazione e la funzione delle cellule staminali, poiché il muscolo sano può autoripararsi completamente dopo una lesione completa e una degenerazione, principalmente a causa delle sue cellule staminali residenti2; Queste sono anche chiamate cellule satelliti e sono localizzate sotto la lamina basale nella periferia delle fibre muscolari3.
Le cellule centrali del muscolo scheletrico adulto sono le miofibre (cellule multinucleate sinciziali lunghe) e le cellule satelliti (cellule staminali con potenziale miogenico che sono quiescenti fino a quando una lesione non le attiva). Queste ultime cellule sono le cellule centrali della rigenerazione muscolare e questo processo non può avvenire in loro assenza 4,5,6,7. Nel loro microambiente immediato, ci sono più tipi di cellule e fattori molecolari che segnalano loro. Questa nicchia si stabilisce gradualmente durante lo sviluppo e fino all'età adulta8. Il muscolo adulto contiene più tipi di cellule (cellule endoteliali, periciti, macrofagi, progenitori fibro-adipogenici-FAP, cellule T regolatorie, ecc.) 9,10 e componenti della matrice extracellulare (laminine, collageni, fibronectina, fibrilline, periostina, ecc.) 11 che interagiscono tra loro e con le cellule satelliti nel contesto della salute, della malattia e della rigenerazione.
Preservare questa complessa nicchia in contesti sperimentali è fondamentale ma impegnativo. Altrettanto difficile è mantenere o tornare alla quiescenza, uno stato cellulare che è critico per le cellule satelliti9. Sono stati introdotti diversi metodi per affrontare parzialmente queste sfide, ognuno con i suoi vantaggi e svantaggi (dettagliati nella sezione di discussione). Qui viene presentato un metodo che può superare parzialmente queste due barriere. I muscoli vengono inizialmente raccolti e poi scomposti meccanicamente ed enzimaticamente prima che la miscela di cellule eterogenee venga messa in coltura. Nel corso della coltura, vengono rilevati molti tipi di cellule della nicchia e si osservano cellule satelliti che sono tornate in quiescenza. Come ultima fase del protocollo, vengono presentate le fasi di immunofluorescenza che consentono la rilevazione di ciascun tipo di cellula attraverso l'uso di marcatori universalmente accettati.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti gli esperimenti sono stati conformi alle normative animali francesi e dell'UE presso l'Institut Mondor de Recherche Biomédicale (INSERM U955), in particolare la direttiva 2010/63/UE. Gli animali sono stati tenuti in ambiente controllato e arricchito presso le strutture zootecniche con i numeri di certificazione A94 028 379 e D94-028-028; Sono stati maneggiati solo da ricercatori autorizzati e custodi di animali e sono stati ispezionati visivamente dal personale di stabulazione per animali per segni di disagio durante la loro vita. Sono stati soppressi mediante lussazione cervicale prima della dissezione. Nessuna procedura interventistica è stata eseguita durante la vita degli animali; pertanto, non è stato necessario ottenere l'approvazione della procedura da parte di un comitato etico e del ministero francese dell'Istruzione superiore, della ricerca e dell'innovazione. Infatti, non è richiesta alcuna autorizzazione etica per l'eutanasia e la dissezione post-mortem secondo la direttiva 2010/63/UE. I risultati presentati in questo manoscritto provengono dalla linea wild-type C57BL/6NRj (vedi Tabella dei Materiali) e dalla linea transgenica Tg:Pax7-nGFP 12 (allevata dal nostro team). Il protocollo è stato applicato a topi maschi e femmine di età compresa tra 8 e 12 settimane.
1. Pre-digestione per la preparazione di reagenti e attrezzature
- Spruzzare gli strumenti di dissezione (forbici dritte e curve, pinze, vedere la tabella dei materiali) con etanolo al 70% e asciugarli con carta. Rivestire una piastra di sughero con un foglio di alluminio e tenere a portata di mano piastre di Petri di 10 cm (una per animale). Avere carta ed etanolo al 70% a portata di mano.
NOTA: Al termine della dissezione, sciacquare gli strumenti di dissezione con acqua, quindi spruzzarli con etanolo al 70% e asciugarli con carta. - Impostare un bagnomaria rotante a 37 °C e preparare la miscela di digestione (20 mL/animale) combinando DMEM con penicillina-streptomicina all'1%, collagenasi 0,5 U/mL, dispasi 3 U/mL (vedere la tabella dei materiali) e BSA allo 0,2% in provette da 50 mL.
- Passare la miscela di digestione attraverso un filtro da 0,22 μm in una cappa per colture cellulari.
NOTA: Si consiglia di preparare la miscela di digestione fresca ogni volta.
2. Preparazione dei reagenti e delle attrezzature dopo la digestione
- Dopo la digestione, la miscela può essere congelata o coltivata. Per il congelamento, preparare il 10% di DMSO: 90% di siero fetale bovino (FBS) e un set di criotubi (1 ml di sospensione cellulare per 2 mL di criotubo). Per la coltura, preparare il terreno di coltura (DMEM integrato con l'1% di penicillina-streptomicina, 4 ng/mL di bFGF e 20% di FBS) e un set di piastre a 8 pozzetti. Le piastre devono essere rivestite prima di placcare le celle (i dettagli sono forniti al punto 7.1).
- Per la colorazione, preparare paraformaldeide (PFA) al 4% in soluzione salina tamponata con fosfato (PBS) (0,15 mL/pozzetto della piastra a 8 pozzetti) e soluzione bloccante (albumina sierica bovina [BSA] priva di IgG al 5% in PBS; 0,15 ml/pozzetto della piastra a 8 pozzetti).
ATTENZIONE: Non respirare la polvere di PFA; prepararlo e maneggiarlo sotto una cappa chimica.
3. Dissezione
- Spruzzare l'animale sottoposto a eutanasia con etanolo al 70%. Fai un'incisione orizzontale (dal lato sinistro del corpo al lato destro) con grandi forbici a livello dell'addome e taglia intorno alla vita. Staccare la pelle dagli arti posteriori per rivelare i muscoli (Figura 1A).
- Posiziona l'animale sulla piastra di sughero ricoperta di carta stagnola e fissa con degli spilli gli arti anteriori e posteriori opposti. Rimuovere rapidamente tutti i muscoli degli arti posteriori (anteriore e posteriore) in una capsula di Petri da 10 cm posta sul ghiaccio (Figura 1B,C). Prestare particolare attenzione a rimuovere il tessuto adiposo dalle aree intorno ai quadricipiti e ai muscoli posteriori. Anche la fascia, i nervi e i tendini possono essere rimossi a questo punto se ciò non compromette il tempo complessivo trascorso per la dissezione.
NOTA: Un tempo di dissezione ottimale per entrambi gli arti posteriori dovrebbe essere di circa 15-20 minuti. Si consiglia di non superare i 30 minuti di tempo di dissezione. - Aggiungi gocce di DMEM ai muscoli di tanto in tanto per mantenerli umidi, ma non troppo, in quanto ciò renderà difficile il taglio. Ripeti per l'altro arto posteriore. Una volta che tutti i muscoli di un animale sono nella capsula di Petri (Figura 1D), tritarli finemente con le forbici per 7-10 minuti per ottenere un omogenato liscio (Figura 1E).
NOTA: In questo protocollo, viene utilizzato DMEM integrato con L-glutammina, piruvato e 4,5 g/L di D-glucosio.
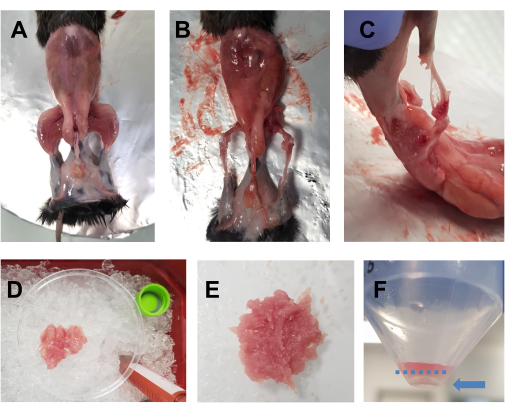
Figura 1: Preparazione muscolare pre-colturale. (A) La pelle viene rimossa per rivelare i muscoli degli arti posteriori, come descritto al punto 3.1. (B,C) Tutti i muscoli degli arti posteriori vengono prelevati (B) intorno e (C) tra le ossa, come descritto al punto 3.2. (D) I muscoli prelevati vengono posti in una capsula di Petri di 10 cm su ghiaccio con gocce di DMEM per mantenerli umidi, come descritto al punto 3.3. (E) I muscoli vengono tritati finemente con le forbici fino ad ottenere una pasta liscia con la consistenza raffigurata in questa immagine. (F) un'immagine del pellet dopo la centrifugazione finale; La freccia blu evidenzia il pallino, che si trova contro il tubo, sotto la linea blu tratteggiata. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Digestione
NOTA: Al termine della digestione, per la sezione 5 sono necessari una centrifuga a 4 °C, un secchio di ghiaccio, tre filtri per celle (100 um, 70 um, 40 um) e tre provette da 50 mL (per animale).
- Preparare e filtrare la miscela di digestione come descritto al punto 1.2. Mantieni il composto sul ghiaccio.
- Una volta che tutti i muscoli sono tritati, mettere l'omogenato in una provetta da 50 ml con 20 ml di miscela per la digestione. Avvolgere i bordi del coperchio con pellicola flessibile per evitare perdite e posizionare il tubo in un bagno d'acqua agitato a 37 °C a velocità medio-bassa (50 giri/min).
- Dopo 1 ora a 37 °C, aprire il coperchio e miscelare pipettando delicatamente sette volte su e giù con una pipetta da 10 mL per ottenere una miscela omogenea. Applicare una nuova pellicola attorno al coperchio e riposizionarla nel bagnomaria agitato. Dopo 1 ora, rimuovere il tubo e spegnere il bagno.
NOTA: Per la coltura, utilizzare questo tempo di incubazione per rivestire le piastre come descritto al punto 7.1 prima di passare alla sezione 5.
5. Filtrazione
- Riempire la provetta di digestione con DMEM freddo (integrato con l'1% di penicillina-streptomicina) fino a 50 ml. Mescolare capovolgendo il tubo tre volte. Conserva il DMEM in un secchiello per il ghiaccio per i passaggi successivi.
- Posizionare un colino per celle da 100 μm su una nuova provetta da 50 ml. Passare la miscela digerita attraverso il colino cellulare nella nuova provetta. Centrifugare a 600 x g per 5 minuti a 4 °C. Versare il surnatante in un contenitore per rifiuti liquidi.
- Risospendere il pellet in 1 mL di DMEM freddo (integrato con l'1% di penicillina-streptomicina). Riempire la provetta fino a 50 mL con lo stesso DMEM. NOTA: Se la centrifugazione viene saltata, il pellet successivo sarà più difficile da identificare e mantenere.
- Posizionare un colino per celle da 70 μm su una nuova provetta da 50 ml. Passare la miscela centrifugata/risospesa attraverso il colino cellulare nella nuova provetta. Centrifugare a 80 x g per 5 minuti a 4 °C.
NOTA: Questo passaggio non è obbligatorio ma è consigliato per eliminare i detriti cellulari. - Posizionare un colino per celle da 40 μm su una nuova provetta da 50 ml. Passare il surnatante attraverso il colino cellulare nella nuova provetta. Centrifugare a 600 x g per 5 minuti a 4 °C, versare il surnatante in un contenitore per rifiuti liquidi e risospendere il pellet in FBS sotto la cappa di coltura. Il pellet è molto piccolo in questa fase (Figura 1F).
NOTA: Il filtraggio attraverso il filtro da 40 μm rimuove i detriti, che darebbero un segnale non specifico nella successiva colorazione delle colture.
6. (Facoltativo) Congelamento
NOTA: La sezione 6 è facoltativa. Il protocollo può essere sospeso dopo il filtraggio, ma ciò può ridurre la sopravvivenza cellulare e il successo della coltura.
- Aggiungere DMSO per ottenere un rapporto 10% DMSO:90% FBS e trasferire in criotubi (1 mL di pellet risospeso per 2 mL di criotubo).
- Posizionare il criotubo a -80 °C in una scatola di polistirolo per una notte. Passare a -150 °C il giorno successivo per la conservazione a lungo termine.
NOTA: È possibile anche la conservazione a breve termine a −80 °C. - Quando si inizia la coltura, scongelare rapidamente il criotubo in un bagno d'acqua a 37 °C fino a quando la sospensione cellulare non si è scongelata. Miscelare con 4 ml di DMEM sotto la cappa di coltura. Centrifugare a 600 x g per 5 min a 4 °C. Pipettare il surnatante e continuare come descritto al punto 7.2.
7. Coltivazione
NOTA: Ci si può aspettare che le sospensioni cellulari congelate o fresche riempiano 24-32 pozzetti di tre o quattro piastre da 8 pozzetti.
- Rivestire le piastre a 8 pozzetti con la soluzione di rivestimento, che deve essere scongelata a 4 °C o su ghiaccio (la soluzione di rivestimento madre viene normalmente mantenuta a −20 °C). Aggiungere 0,4 mL di soluzione di rivestimento in un pozzetto e pipettarlo da un pozzetto all'altro. Dopo aver trasferito la soluzione di rivestimento attraverso tutti i pozzetti, può essere raccolta e ricongelata per colture future. Mantenere le piastre rivestite a 37 °C per 30 minuti prima di placcare le celle.
- Aggiungere DMEM (integrato con l'1% di penicillina-streptomicina) integrato con 4 ng/mL di bFGF (vedere la tabella dei materiali) alla sospensione di cellule FBS per ottenere un rapporto FBS:80% DMEM.
NOTA: Anche se l'aggiunta di bFGF può essere utile nelle colture primarie di mioblasti e nella produzione di cellule satellitari in colture di massa, la sua aggiunta è facoltativa, poiché la sua omissione in colture di massa di ~ 7 giorni non compromette gravemente la resa cellulare. - Piastra 0,4 mL di sospensione per pozzetto (dal punto 7.2) nelle piastre rivestite a 8 pozzetti.
NOTA: Calcolare 30 cm2 di coltura per animale per le preparazioni congelate e fresche. - Incubare le colture a 37 °C con il 5% di CO2 per un massimo di 10 giorni, cambiando il terreno ogni giorno dopo che la coltura inizia a cambiare in un colore giallastro (di solito 5-7 giorni).
NOTA: Per quantificare le cellule nella fase S del ciclo cellulare13, aggiungere 10 μM EdU 2 h prima della fissazione. Per catturare la prima fase S, aggiungere 10 μM EdU dalla placcatura e fissare a 40 h di coltura.
8. Fissazione
NOTA: Le sezioni 8-10 devono essere condotte a temperatura ambiente, salvo diversa indicazione.
- Pipettare il terreno di coltura e fissare le cellule con PFA al 4% (0,15 ml/pozzetto).
ATTENZIONE: Aggiungere PFA sotto una cappa chimica.
NOTA: Se tutti i pozzetti sono fissati contemporaneamente, incubare con PFA a temperatura ambiente per 10 min. Se i pozzetti sono fissati in momenti diversi, aggiungere PFA ai pozzetti da fissare e mantenere la piastra nell'incubatrice a 37 °C per 5 minuti. - Pipettare il PFA e aggiungere PBS per 10 s (0,15 mL/pozzetto). Pipettare il PBS e aggiungere PBS fresco per 5 minuti (0,15 ml/pozzetto).
NOTA: Se tutti i pozzetti sono fissati contemporaneamente, incubare con PBS a temperatura ambiente. Se i pozzetti sono fissati in momenti diversi, aggiungere PBS ai pozzetti fissi e tenere la piastra nell'incubatrice a 37 °C per 5 minuti. Quindi, aggiungere 0,4 ml di PBS e tenere la piastra nell'incubatrice per un massimo di 1 settimana.
9. Permeabilizzazione e blocco
- Al momento della colorazione, pipettare il PBS e permeabilizzare con TritonX 100 allo 0,5% in PBS (0,15 mL/pozzetto) per 8 minuti. Pipettare il TritonX 100, risciacquare con PBS per 10 s (0,15 mL/pozzetto), pipettare il PBS e lavare con PBS per 5 min (0,15 ml/pozzetto).
- Bloccare con BSA senza IgG al 5% in PBS per 30-60 minuti (0,15 mL/pozzetto).
10. Colorazione
- Pipettare il BSA e aggiungere la miscela di anticorpi primari diluita in PBS (0,15 ml/pozzetto) (vedere la tabella dei materiali; diluizioni: anti-CD31 1:100, anti-FOSB 1:200, anti-GFP 1:1.000, anti-KI67 1:1.000, anti-MyHC 1:400, anti-MYOD 1:200, anti-MYOG 1:150, anti-PAX7 1:100, anti-PDGFRa 1:50) per l'incubazione notturna a 4 °C.
NOTA: Dopo l'incubazione degli anticorpi, raccogliere la miscela di anticorpi, aggiungere sodio azide e conservare a 4 °C o -20 °C (secondo le istruzioni del produttore dell'anticorpo) per un futuro riutilizzo. - Pipettare la miscela di anticorpi, risciacquare con PBS per 10 s (0,15 ml/pozzetto), pipettare il PBS e lavare con PBS per 5 min (0,15 ml/pozzetto).
- Pipettare il PBS di lavaggio, aggiungere la miscela di anticorpi secondari (Alexa Fluor 488 anti-topo di capra, Alexa Fluor 555 anti-coniglio di capra, Alexa Fluor 647 di capra, Alexa Fluor 555 anti-topo di capra, Alexa Fluor 488 di capra anti-pollo, tutti utilizzati a diluizioni di 1:500-1.000) e marcatore del nucleo (ad esempio, DAPI) diluito in PBS (0,15 ml/pozzetto) (vedere Tabella dei materiali), e incubare per 1 ora a temperatura ambiente, al riparo dalla luce.
- Pipettare la miscela di anticorpi secondari, risciacquare con PBS per 10 s (0,15 ml/pozzetto), pipettare il PBS, lavare con PBS per 5 minuti (0,15 ml/pozzetto), pipettare il PBS e montare.
NOTA: Se si utilizzano piastre a 8 pozzetti con separatori rimovibili, staccare i separatori prima del montaggio.
Access restricted. Please log in or start a trial to view this content.
Risultati
Questo protocollo consente la coltura di cellule muscolari preservando le cellule satelliti e la maggior parte delle cellule dalla loro nicchia endogena. La Figura 2 riassume le fasi principali del protocollo, mentre le parti essenziali della dissezione e della digestione sono presentate nella Figura 1. Si raccomanda la dissezione della muscolatura degli arti posteriori (Figura 1A-C), poiché questo gruppo di muscoli è ben stud...
Access restricted. Please log in or start a trial to view this content.
Discussione
La funzione del muscolo scheletrico adulto è sostenuta da un insieme finemente orchestrato di interazioni cellulari e segnali molecolari. Qui viene presentato un metodo che consente lo studio di questi parametri in un ambiente ex vivo che assomiglia molto al microambiente fisiologico.
Diversi gruppi hanno riportato metodi in vitro per la coltura di cellule miogeniche. Questi metodi miravano a isolare le cellule satelliti per studiare le loro proprietà progenitrici miogenich...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Per la Figura 2 sono stati utilizzati i modelli di Servier Medical Art (https://smart.servier.com/). Il laboratorio FR è sostenuto dall'Association Française contre les Myopathies - AFM tramite TRANSLAMUSCLE (sovvenzioni 19507 e 22946), dalla Fondation pour la Recherche Médicale - FRM (EQU202003010217, ENV202004011730, ECO201806006793), dall'Agence Nationale pour la Recherche - ANR (ANR-21-CE13-0006-02, ANR-19-CE13-0010, ANR-10-LABX-73) e da La Ligue Contre le Cancer (IP/SC-17130). I finanziatori di cui sopra non hanno avuto alcun ruolo nella progettazione, nella raccolta, nell'analisi, nell'interpretazione o nella stesura di questo studio o nella stesura di questo manoscritto.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| anti-CD31 | BD | 550274 | dilution 1:100 |
| anti-FOSB | Santa Cruz | sc-7203 | dilution 1:200 |
| anti-GFP | Abcam | ab13970 | dilution 1:1000 |
| anti-Ki67 | Abcam | ab16667 | dilution 1:1000 |
| anti-MyHC | DSHB | MF20-c | dilution 1:400 |
| anti-MYOD | Active Motif | 39991 | dilution 1:200 |
| anti-MYOG | Santa Cruz | sc-576 | dilution 1:150 |
| anti-Pax7 | Santa Cruz | sc-81648 | dilution 1:100 |
| anti-PDGFRα | Invitrogen | PA5-16571 | dilution 1:50 |
| b-FGF | Peprotech | 450-33 | concentration 4 ng/mL |
| Bovine serum albumin (BSA) – used for digestion | Sigma Aldrich | A7906-1006 | concentration 0.2% |
| BSA IgG-free, protease-free – used for staining | Jackson ImmunoResearch | 001-000-162 | concentration 5% |
| Cell strainer 40 um | Dominique Dutscher | 352340 | |
| Cell strainer 70 um | Dominique Dutscher | 352350 | |
| Cell strainer 100 um | Dominique Dutscher | 352360 | |
| Collagenase | Roche | 10103586001 | concentration 0.5 U/mL |
| Culture plate | Sarstedt | 94.6140.802 | |
| Dimethyl sulfoxide (DMSO) | Euromedex | UD8050-05-A | |
| Dispase | Roche | 4942078001 | concentration 3 U/mL |
| Dissection forceps size 5 | Fine Science Tools | 91150-20 | |
| Dissection forceps size 55 | Fine Science Tools | 11295-51 | |
| Dissection scissors (big, straight) | Fine Science Tools | 9146-11 | ideal for chopping |
| Dissection scissors (small, curved) | Fine Science Tools | 15017-10 | |
| Dissection scissors (small, straight) | Fine Science Tools | 14084-08 | |
| Dulbecco's Modified Eagle's Medium (DMEM) | ThermoFisher | 41966-029 | |
| EdU Click-iT kit | ThermoFisher | C10340 | |
| Fetal bovine serum – option 1 | Eurobio | CVF00-01 | |
| Fetal bovine serum – option 2 | Gibco | 10270-106 | |
| Matrigel | Corning Life Sciences | 354234 | coating solution |
| Parafilm | Dominique Dutscher | 090261 | flexible film |
| Paraformaldehyde – option 1 | PanReac AppliChem ITW Reagents | 211511.1209 | concentration 4% |
| Paraformaldeyde – option 2 | ThermoFisher | 28908 | concentration 4% |
| Penicillin streptomycin | Gibco | 15140-122 | |
| Shaking water bath | ThermoFisher | TSSWB27 | |
| TritonX100 | Sigma Aldrich | T8532-500 ML | concentration 0.5% |
| Wild-type mice | Janvier | C57BL/6NRj |
Riferimenti
- Frontera, W. R., Ochala, J. Skeletal muscle: A brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Forcina, L., Cosentino, M., Musarò, A. Mechanisms regulating muscle regeneration: Insights into the interrelated and time-dependent phases of tissue healing. Cells. 9 (5), 1297(2020).
- Mauro, A. Satellite cell of skeletal muscle fibers. Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Lepper, C., Partridge, T. A., Fan, C. -M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- McCarthy, J. J., et al. Effective fiber hypertrophy in satellite cell-depleted skeletal muscle. Development. 138 (17), 3657-3666 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Hicks, M. R., Pyle, A. D. The emergence of the stem cell niche. Trends in Cell Biology. 33 (22), 112-123 (2022).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692(2021).
- Gama, J. F. G., et al. Role of regulatory T cells in skeletal muscle regeneration: A systematic review. Biomolecules. 12 (6), 817(2022).
- Loreti, M., Sacco, A. The jam session between muscle stem cells and the extracellular matrix in the tissue microenvironment. NPJ Regenerative Medicine. 7 (1), 16(2022).
- Sambasivan, R., et al. Distinct regulatory cascades govern extraocular and pharyngeal arch muscle progenitor cell fates. Developmental Cell. 16 (6), 810-821 (2009).
- Pereira, P. D., et al. Quantification of cell cycle kinetics by EdU (5-ethynyl-2'-deoxyuridine)-coupled-fluorescence-intensity analysis. Oncotarget. 8 (25), 40514-40532 (2017).
- Bismuth, K., Relaix, F. Genetic regulation of skeletal muscle development. Experimental Cell Research. 316 (18), 3081-3086 (2010).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Lertkiatmongkol, P., Liao, D., Mei, H., Hu, Y., Newman, P. J. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31). Current Opinion in Hematology. 23 (3), 253-259 (2016).
- Scholzen, T., Gerdes, J. The Ki-67 protein: From the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Abou-Khalil, R., Le Grand, F., Chazaud, B. Human and murine skeletal muscle reserve cells. Stem Cell Niche. 1035, 165-177 (2013).
- Pasut, A., Oleynik, P., Rudnicki, M. A. Isolation of muscle stem cells by fluorescence activated cell sorting cytometry. Methods in Molecular Biology. 798, 53-64 (2011).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Qu, Y., Edwards, K., Barrow, J. Isolation, culture, and use of primary murine myoblasts in small-molecule screens. STAR Protocols. 4 (2), 102149(2023).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: Background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2011).
- Saclier, M., Theret, M., Mounier, R., Chazaud, B. Effects of macrophage conditioned-medium on murine and human muscle cells: analysis of proliferation, differentiation, and fusion. Methods in Molecular Biology. 1556, 317-327 (2017).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Molecular Cell. 74 (3), 609-621 (2019).
- Tabula Muris Consortium et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Brunetti, J., Koenig, S., Monnier, A., Frieden, M. Nanopattern surface improves cultured human myotube maturation. Skeletal Muscle. 11 (1), 12(2021).
- Denes, L. T., et al. Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation. Skeletal Muscle. 9 (1), 17(2019).
- LaFramboise, W. A., et al. Effect of muscle origin and phenotype on satellite cell muscle-specific gene expression. Journal of Molecular and Cellular Cardiology. 35 (10), 1307-1318 (2003).
- Azhar, M., Wardhani, B. W. K., Renesteen, E. The regenerative potential of Pax3/Pax7 on skeletal muscle injury. Journal of Generic Engineering and Biotechnology. 20 (1), 143(2022).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198(2016).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon