È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Saggi sull'invecchiamento comportamentale e sulla durata della vita ad alto rendimento utilizzando la macchina per la durata della vita
In questo articolo
Riepilogo
La piattaforma di imaging "The Lifespan Machine" automatizza l'osservazione permanente di grandi popolazioni. Mostriamo i passaggi necessari per eseguire saggi sulla durata della vita, sulla resistenza allo stress, sulla patogenesi e sull'invecchiamento comportamentale. La qualità e la portata dei dati consentono ai ricercatori di studiare gli interventi sull'invecchiamento nonostante la presenza di variazioni biologiche e ambientali.
Abstract
Gli animali geneticamente identici tenuti in un ambiente costante mostrano un'ampia distribuzione della durata della vita, riflettendo un grande aspetto stocastico non genetico dell'invecchiamento conservato in tutti gli organismi studiati. Questa componente stocastica significa che per comprendere l'invecchiamento e identificare interventi di successo che prolungano la durata della vita o migliorano la salute, i ricercatori devono monitorare contemporaneamente grandi popolazioni di animali da esperimento. Il tradizionale punteggio manuale dei decessi limita la produttività e la scala necessarie per i test di ipotesi su larga scala, portando allo sviluppo di metodi automatizzati per i saggi ad alta produttività. Lifespan Machine (LSM) è una piattaforma di imaging ad alto rendimento che combina scanner piani modificati con software di elaborazione delle immagini e convalida dei dati personalizzati per il monitoraggio dei nematodi per tutta la vita. La piattaforma costituisce un importante progresso tecnico in quanto genera dati sulla durata della vita altamente risolti temporalmente da grandi popolazioni di animali su una scala senza precedenti e con una precisione statistica e un'accuratezza pari ai saggi manuali eseguiti da ricercatori esperti. Recentemente, l'LSM è stato ulteriormente sviluppato per quantificare i cambiamenti comportamentali e morfologici osservati durante l'invecchiamento e metterli in relazione con la durata della vita. In questo articolo viene descritto come pianificare, eseguire e analizzare un esperimento automatizzato sulla durata della vita utilizzando LSM. Evidenziamo inoltre i passaggi critici necessari per il successo della raccolta di dati comportamentali e curve di sopravvivenza di alta qualità.
Introduzione
L'invecchiamento è un processo complesso e sfaccettato, caratterizzato da un declino della funzione fisiologica di un organismo, che porta ad un aumento del rischio di malattia e morte nel tempo1. La durata della vita, misurata come il tempo che intercorre tra la nascita o l'inizio dell'età adulta fino alla morte, fornisce un risultato inequivocabile dell'invecchiamento2 e un indicatore indiretto ma rigorosamente quantitativo per misurare il tasso relativo di invecchiamento tra le popolazioni3. Gli studi sull'invecchiamento spesso dipendono da misurazioni accurate della durata della vita, simili agli studi clinici, per confrontare i risultati tra una popolazione esposta a un intervento e un gruppo di controllo non esposto. Sfortunatamente, i problemi di riproducibilità pervadono la ricerca sull'invecchiamento, a volte a causa di esperimenti statisticamente sottodimensionati4 e spesso a causa della sensibilità intrinseca dei saggi sulla durata della vita a sottili variazioni nell'ambiente5. Gli esperimenti robusti richiedono repliche multiple di grandi popolazioni e questo processo beneficia in particolare della scalabilità sperimentale offerta dall'automazione6.
Le rigorose esigenze dei saggi sulla durata della vita derivano dall'imprevedibilità del processo di invecchiamento stesso. Gli individui isogenici ospitati in ambienti identici mostrano tempi di morte e tassi di declino fisiologicodiversi 7, suggerendo che la durata della vita comporta un alto grado di stocasticità 7,8. Pertanto, le grandi popolazioni sono tenute a misurare i cambiamenti quantitativi nel processo di invecchiamento, come i cambiamenti nella durata media o massima della vita, e a superare le distorsioni derivanti dalla variabilità individuale. Inoltre, la capacità di saggi ad alto rendimento sulla durata della vita è fondamentale per supportare gli studi sulle forme delle curve di sopravvivenza e sui modelli delle dinamiche dell'invecchiamento9.
Il nematode Caenorhabditis elegans è un modello inestimabile per la ricerca sull'invecchiamento grazie alla sua breve durata di vita, alla trattabilità genetica e al rapido tempo di generazione, che sottolineano la sua idoneità per saggi di invecchiamento e durata della vita ad alto rendimento. Tradizionalmente, la durata della vita in C. Elegans è stato misurato seguendo una piccola popolazione sincronizzata di circa 50-100 animali nel tempo su supporti solidi e annotando il tempo delle singole morti. Man mano che gli animali invecchiano e perdono mobilità, è necessario valutare manualmente i tempi di morte e controllare individualmente gli animali e controllare i piccoli movimenti della testa o della coda. Questo è di solito un processo noioso e laborioso, anche se sono stati fatti sforzi per accelerarlo 10,11,12. È importante sottolineare che la lentezza delle pipeline sperimentali ostacola i progressi nella nostra comprensione dell'invecchiamento e dell'efficacia degli interventi testati.
Per soddisfare le esigenze della ricerca sull'invecchiamento per i dati quantitativi, sono state sviluppate molte tecnologie per automatizzare la raccolta dei dati, tra cui una notevole gamma di approcci, dalle camere microfluidiche agli scanner piani 13,14,15,16,17,18. L'LSM si differenzia dagli altri metodi per la sua ampia ottimizzazione per la raccolta di dati di durata altamente precisi e accurati, che si ottiene attraverso lo sviluppo di attenti protocolli di calibrazione delle apparecchiature combinati con un'ampia suite software che consente agli utenti di convalidare, correggere e perfezionare le analisi automatizzate13. Sebbene il software possa, in linea di principio, essere applicato a diverse modalità di imaging, in pratica, la maggior parte degli utenti utilizza scanner piani modificati per consentire un controllo preciso della temperatura e dell'umidità ambientale, fattori di fondamentale importanza a causa del loro effetto principale sulla durata della vita19. L'LSM acquisisce immagini dei nematodi ogni 20 minuti a intervalli che vanno da giorni a mesi, a seconda delle condizioni ambientali e del genotipo. I dati prodotti hanno una risoluzione temporale molto più elevata rispetto ai dati dei saggi manuali e le immagini raccolte forniscono una registrazione visiva permanente della posizione del nematode per tutta la durata della vita. Utilizzando metodi di apprendimento automatico, i tempi di morte vengono assegnati automaticamente a ciascun individuo. Questi risultati possono essere convalidati rapidamente e manualmente utilizzando un software client chiamato "Worm Browser". Grazie al suo hardware e software, l'LSM è in grado di generare curve di sopravvivenza statisticamente indistinguibili dal punteggio manuale dei decessi per mano di ricercatori esperti, con l'ulteriore vantaggio di ridurre il carico di lavoro e aumentare la scalabilità13.
L'ultima versione dell'LSM consente anche lo studio dell'invecchiamento comportamentale raccogliendo dati morfologici e comportamentali durante tutta la vita del nematode e riportandoli insieme alla durata della vita di ciascun individuo. In particolare, l'LSM cattura il tempo di cessazione del movimento vigoroso (VMC) di ciascun animale, un punto di riferimento spesso utilizzato per quantificare la "durata della salute" di un individuo come distinto dalla sua durata di vita. Raccogliendo simultaneamente dati sulla durata della vita e sull'invecchiamento comportamentale, l'LSM supporta lo studio degli interventi che possono avere effetti differenziali su diversi esiti fenotipici dell'invecchiamento20. Una varietà di fenotipi osservabili macroscopicamente può essere utilizzata per studiare l'invecchiamento comportamentale, come il movimento del corpo o il pompaggio faringeo21, l'integrità dei tessuti22 e la velocità di movimento o la rotazione indotta da stimoli17. I confronti tra diversi fenotipi di invecchiamento possono supportare l'analisi della struttura causale dei processi di invecchiamento. Ad esempio, il confronto tra VMC e durata della vita è stato recentemente utilizzato per caratterizzare due distinti processi di invecchiamento in C. elegans23.
Sebbene inizialmente sviluppato per misurare la durata della vita in C. elegans, l'LSM supporta la raccolta di dati comportamentali e di sopravvivenza da una serie di specie di nematodi, tra cui C. briggsae, C. tropicalis, C. japonica, C. brenneri, e P. Pacifico23. La tecnologia facilita lo studio dell'effetto degli interventi biologici e ambientali sulla durata della vita, sulla resistenza allo stress e sulla resistenza ai patogeni e può essere accoppiata a strumenti sperimentali come saggi mirati di interferenza dell'RNA o sistemi di degradazione delle proteine inducibili dall'auxina. Ad oggi, è stato utilizzato nella letteratura scientifica per una vasta gamma di applicazioni 6,24,25,26,27,28,29,30.
Qui, delineiamo un protocollo passo-passo per l'esecuzione di un esperimento Lifespan Machine utilizzando piastre di agar, dalle fasi iniziali della configurazione sperimentale all'output delle curve di sopravvivenza risultanti. Una caratteristica distintiva dell'LSM è che lo sforzo è altamente front-loaded, il che significa che la maggior parte del tempo del ricercatore viene speso durante la configurazione sperimentale e, in piccola misura, durante l'acquisizione post-immagine. La raccolta dei dati è completamente automatizzata per tutta la durata dell'esperimento e permette al ricercatore di avere un'esperienza "a mani libere". I passaggi qui descritti sono condivisi da molti tipi diversi di saggi di sopravvivenza: la stessa configurazione sperimentale viene eseguita per i saggi di durata della vita, termotolleranza, stress ossidativo e patogenesi. Nella sezione dei risultati rappresentativi, discutiamo un sottoinsieme di dati da un manoscritto pubblicato di recente per illustrare l'efficacia della pipeline di analisi ed evidenziare i passaggi più importanti durante l'analisi delle immagini23.
Protocollo
1. Requisiti software e hardware
- Scanner piani: in linea di principio, l'LSM può essere implementato utilizzando una varietà di dispositivi di imaging. Istruzioni dettagliate per le modifiche e la messa a fuoco dello scanner sono disponibili altrove13. L'hardware LSM è mostrato nella Figura 1 supplementare.
- Strumenti di analisi dei dati: il software LSM ha tre componenti interagenti: un pacchetto software di controllo dello scanner basato su Linux, un pacchetto di gestione dei metadati basato su browser Web e un pacchetto software di analisi delle immagini client Windows e Linux. Fare riferimento alle istruzioni per l'installazione degli strumenti software pubblicate nel repository GitHub (https://github.com/nstroustrup/lifespan).
- Software di visualizzazione e convalida dei dati: utilizzare Worm Browser, un programma client, per pianificare gli esperimenti, convalidare l'analisi delle immagini, eseguire l'annotazione manuale del movimento del nematode e produrre i dati di sopravvivenza. Gli eseguibili binari sono forniti per il browser worm in Windows 7, Windows 8 e Windows 10 e il browser worm viene compilato dal codice sorgente in Linux o Apple iOS. Una guida all'installazione è disponibile nel repository GitHub menzionato in precedenza.
Figura supplementare 1: Durata della vita Hardware della macchina. Un'unità scanner piana con coperchio aperto per mostrare le lastre caricate, che sono posizionate a faccia in giù in 16 aperture tagliate su un tappetino di gomma. Il tappetino in gomma viene posizionato sulla superficie di uno scanner di vetro. Le etichette per le condizioni sono scritte sui lati delle piastre per evitare problemi durante l'analisi delle immagini. Il nastro di marcatura con il numero ("1") e/o il nome del dispositivo ("Jabba") facilita la successiva verifica della posizione del campione quando si lavora con più dispositivi di scansione. Ulteriori dettagli sui componenti hardware LSM sono disponibili altrove13. Fare clic qui per scaricare il file.
2. Installazione prima del giorno dell'esperimento
- Calibrazione della temperatura dell'incubatore: la temperatura ambientale è uno dei principali determinanti del C. Durata della vita di Elegans 19. Per produrre risultati accurati, eseguire l'acquisizione dell'immagine a una temperatura accuratamente calibrata, mantenuta costante per tutta la durata dell'esperimento. A tal fine, alcuni giorni prima dell'inizio dell'esperimento, misurare e calibrare la temperatura della superficie di ogni scanner durante il funzionamento. Utilizzare termocoppie ad alta precisione come descritto altrove31 (vedere la tabella dei materiali).
- Layout delle piastre dello scanner: prima dell'inizio dell'esperimento, pianificare la disposizione ottimale delle piastre di coltura per ogni scanner.
NOTA: Lo scopo di questa operazione è quello di evitare l'introduzione di fattori confondenti derivanti dalla variazione di temperatura tra gli scanner e sulla superficie di ciascuno scanner. Gli scanner differiscono leggermente nella loro temperatura superficiale media e, inoltre, mostrano sottili distorsioni della temperatura su tutta la loro superficie31.- Posizione della piastra dello scanner: per controllare questi effetti termici nella successiva analisi dei dati, randomizzare eventuali covariate biologiche relative alla posizione dello scanner e standardizzare la posizione della piastra in tutti gli scanner.
- Numero di campioni tra gli scanner: Quando si utilizza il layout del tappetino in gomma 16 (vedere la tabella dei materiali), posizionare quattro piastre per condizione in ogni scanner, per un totale di almeno quattro scanner. Ciò garantisce che ogni condizione sia distribuita su più scanner, in modo tale che gli effetti confondenti della temperatura dello scanner possano essere identificati e rimossi durante l'analisi dei dati13. Per rendere questa analisi più semplice, includere una condizione di riferimento condivisa (ad esempio, campioni wild-type) su ogni scanner.
NOTA: In generale, a causa del posizionamento delle ventole dello scanner, le piastre nell'angolo in alto a destra del tappetino in gomma sono più soggette all'essiccazione. Se necessario, lasciare vuota questa posizione.
- Piastre e preparazione dei campioni
- Colata delle piastre di coltura: Per un'asciugatura ottimale delle piastre di coltura dello scanner (vedere la tabella dei materiali), versare il terreno di coltura agar 4 giorni prima di caricare i nematodi. Sebbene la messa a fuoco dello scanner sia regolabile per consentire l'aggiunta di diversi volumi di agar alle piastre, il volume standard della piastra è di 8 ml.
NOTA: Potrebbe essere utile versare le piastre con una pompa peristaltica, soprattutto per esperimenti di grandi dimensioni. - Semina delle piastre: Seminare le piastre con la coltura batterica desiderata almeno 2 giorni prima dell'inizio dell'esperimento per consentire la corretta essiccazione e crescita del prato batterico. In genere, 200 μL di coltura batterica sono sufficienti per formare un prato che nutrirà 40 nematodi per diverse settimane.
NOTA: Le piastre tipicamente utilizzate per l'imaging sono sigillate in modo più ermetico rispetto alle piastre di Petri per coltura standard; Pertanto, si consiglia di seminare e asciugare le piastre all'interno di una cappa da laboratorio, di solito per circa 1 ora o fino a quando non si asciugano correttamente.
- Colata delle piastre di coltura: Per un'asciugatura ottimale delle piastre di coltura dello scanner (vedere la tabella dei materiali), versare il terreno di coltura agar 4 giorni prima di caricare i nematodi. Sebbene la messa a fuoco dello scanner sia regolabile per consentire l'aggiunta di diversi volumi di agar alle piastre, il volume standard della piastra è di 8 ml.
- Manipolazione dei nematodi
- Dimensione della popolazione: il numero di nematodi che possono essere visualizzati in modo affidabile su una singola piastra dipende dal genotipo, dall'età in cui i nematodi vengono piastrellati e dalla quantità di cibo aggiunto a ciascuna piastra. Per gli esperimenti sulla durata della vita che iniziano nella prima età adulta, caricare circa 40 animali per piatto. Questo numero garantisce cibo a sufficienza ed evita l'affollamento.
- Crescita di grandi popolazioni: per prepararsi all'espansione e alla sincronizzazione della popolazione, iniziare con una popolazione di nematodi appropriata per il metodo di sincronizzazione scelto (vedi sotto). L'obiettivo è quello di eseguire la sincronizzazione sugli animali alla loro età di massima produzione di uova, che per gli animali selvatici N2 è il giorno 2 dell'età adulta32.
NOTA: Un altro motivo per sincronizzare le popolazioni utilizzando gli animali nel loro secondo giorno di età adulta è quello di rimuovere l'età materna come fattore che contribuisce all'eterogeneità della popolazione. L'età materna in C. È stato dimostrato che Elegans influisce su più tratti di fitness nella progenie, con animali selvatici di tipo Day 2 che producono la progenie di "più alta qualità"33. - Esecuzione della sincronizzazione dell'età: per ottenere risultati accurati, sincronizzare l'età degli animali nel modo più preciso possibile. In questo protocollo, la sincronizzazione dell'età viene eseguita utilizzando un trattamento con ipoclorito modificato34. Altri metodi potrebbero includere la sincronizzazione mediante deposizione delle uova, mediante arresto larvale L1 o prelievo manuale delle larve L4.
NOTA: Per la sincronizzazione dell'età mediante trattamento con ipoclorito, aspettatevi di ottenere da tre a quattro ovuli da ogni ermafrodito adulto. - Mantenere le popolazioni libere da progenie: Mantenere le popolazioni libere da progenie esponendo i nematodi durante la loro fase L4 tardiva alla 5-fluoro-2'-desossiuridina (FUdR)35.
NOTA: A basse dosi, FuDR è letale per lo sviluppo degli embrioni senza produrre cambiamenti macroscopicamente visibili alla linea germinale o alterare il tasso di produzione di ovociti. Altri metodi includono l'utilizzo di mutanti sterili alla temperatura, l'uso di costrutti RNAi sterilizzanti o semplicemente l'attesa della senescenza post-riproduttiva per trasferire i nematodi su piastre per l'imaging. - Trasferimento di popolazioni: quando si trasferiscono migliaia di animali da una piastra all'altra, il protocollo standard che prevede l'utilizzo di un filo di platino/iridio diventa laborioso. I metodi che prevedono la sospensione liquida dei nematodi facilitano i trasferimenti e li rendono più efficienti. Raccogliere i nematodi con tampone M9 + Mg (Na2HPO4 42,27 mM, KH2PO4 22,05 mM, NaCl 85,56 mM, MgSO4 1 mM), ridurre il volume totale una volta che i nematodi si sono depositati per gravità, quindi trasferire rapidamente i nematodi alle piastre utilizzate per l'imaging.
NOTA: Il trasferimento dei nematodi in sospensione liquida potrebbe comportare una variazione del numero di animali trasferiti su ciascuna piastra. Cerca di essere coerente con il numero di nematodi su ciascuna piastra per evitare la variabilità sperimentale. - Applicazione degli interventi: l'interruzione e il riavvio dell'acquisizione delle immagini durante un esperimento complica l'analisi delle immagini (vedere la discussione). Pertanto, iniziare gli esperimenti LSM solo dopo che tutta la gestione dei nematodi necessaria è stata completata.
- Sterilizzazione dei tappetini in gomma: Autoclavare un gran numero di tappetini contemporaneamente, avvolgendoli singolarmente in un foglio di alluminio.
NOTA: I tappetini in gomma devono essere sterilizzati tra un utilizzo e l'altro per evitare l'accumulo di contaminanti fungini o batterici. La maggior parte dei tipi di gomma tipicamente utilizzati sono degradati da un trattamento aggressivo con etanolo.
3. Installazione il giorno dell'esperimento
- Supporto per piastre e preparazione del vetro dello scanner: Per semplificare la manipolazione delle piastre, non caricare le piastre di Petri direttamente sulla superficie dello scanner, ma tenerle in posizione utilizzando tappetini di gomma supportati da lastre di vetro (vedere la Tabella dei materiali). Le popolazioni vengono visualizzate attraverso questo vetro, quindi mantieni il vetro pulito e trattato con un rivestimento antiappannamento, idrofobico e sterilizzante (vedi la tabella dei materiali).
- Prima di caricare le piastre nell'incubatrice, pulire la superficie del vetro di supporto della piastra su entrambi i lati con un detergente per vetri antiappannamento.
- Prima di caricare le lastre sul loro vetro di supporto, applicare un trattamento protettivo idrofobico del vetro (vedi Tabella dei Materiali) per ridurre al minimo l'appannamento sul lato del vetro che sarà a contatto con il tappetino in gomma. Stendere bene questo trattamento e lasciarlo sul bicchiere per 5-10 minuti prima di procedere allo step successivo. Pulire energicamente dopo l'applicazione per rimuovere eventuali residui.
- Applicare etanolo al 70% per disinfettare la superficie del vetro che verrà a contatto con il tappetino in gomma. Lasciare agire per 1 minuto o 2 minuti, quindi rimuovere con un panno o un tovagliolo di carta.
- Caricamento delle lastre sugli scanner
- Innanzitutto, posizionare i tappetini in gomma autoclavata sopra il vetro di supporto della piastra trattata.
- Rimuovere il coperchio dalle piastre utilizzate per l'imaging con nematodi caricati e posizionarle su un tappetino di gomma rivolto verso la superficie del vetro. Assicurati che il tappetino di gomma sia ben sigillato attorno a tutte le piastre, ad esempio, aggiungendo un'altra lastra di vetro sopra e assicurandoti che sia piatta o picchiettando sulla parte superiore di ciascuna piastra (le piastre sciolte si muoveranno leggermente e colpiranno il vetro, emettendo un suono, mentre le piastre ben fissate non si muoveranno quando vengono toccate).
NOTA: È utile etichettare singolarmente ogni lastra di vetro di supporto della piastra con nastro adesivo con informazioni sul contenuto della lastra e sullo scanner previsto. Questi dati possono essere utilizzati dopo l'esperimento per risolvere eventuali ambiguità relative alle posizioni delle piastre. - Prima di caricare le piastre negli scanner, scollegare le ventole dello scanner per proteggere le dita dello sperimentatore durante il caricamento delle lastre.
- Far scorrere delicatamente le lastre e la lastra di vetro che le sostiene sulla superficie dello scanner.
NOTA: Evitare di applicare pressione direttamente sul tappetino in gomma, poiché ciò fa scivolare il tappetino sul vetro di supporto della piastra. Quando i tappetini scivolano, le piastre vengono spesso staccate dal tappetino. - Riattivare le ventole dello scanner e verificare visivamente che le ventole anteriori e laterali siano alimentate. Se gli scanner sono spenti, accenderli a questo punto.
4. Acquisizione pre-immagine
NOTA: Nella Figura 1 è illustrato un diagramma di flusso completo che riassume tutte le fasi basate su software durante l'acquisizione delle immagini.
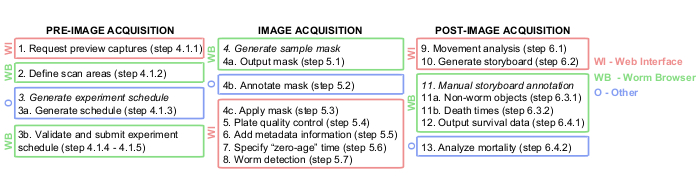
Figura 1: Panoramica grafica della pipeline di analisi delle immagini di Lifespan Machine. Le fasi di pre, durante e post-acquisizione dell'immagine vengono eseguite in gran parte sull'interfaccia web (WI, in rosso) e sul Worm Browser (WB, in verde). Alcuni passaggi vengono eseguiti in altre piattaforme (O, in blu), ad esempio i documenti TXT nel passaggio 3a, Photoshop o equivalente nel passaggio 4b e JMP o equivalente nel passaggio 13. Fare clic qui per visualizzare una versione più grande di questa figura.
- Impostazione dell'acquisizione delle immagini: generare un file che specifica la pianificazione dell'esperimento e la posizione delle lastre su ciascuno scanner per configurare l'acquisizione delle immagini.
NOTA: questo file include metadati importanti come il titolo dell'esperimento, la frequenza di acquisizione delle immagini e la durata totale dell'esperimento. In genere, questo file non viene generato de novo per ogni esperimento, ma al contrario, i file degli esperimenti precedenti vengono riutilizzati come modelli. Per il primo esperimento di un utente, viene fornito un file modello (Fascicolo supplementare 1).- Richiedi acquisizioni di anteprima: specificare la posizione di tutte le lastre su ogni scanner. Vengono forniti diversi strumenti per accelerare questo processo. Innanzitutto, utilizzare lo scanner per ottenere un'immagine dell'intera superficie dello scanner, denominata "Anteprima acquisizione". Assicurarsi che le immagini di acquisizione dell'anteprima mostrino chiaramente l'intera superficie di ciascuna lastra da riprendere (Figura 2A) senza striature o il ritaglio dei bordi della lastra.
- Utilizzando l'interfaccia web, trova la sezione Acquisizione immagini della pagina principale e segui il collegamento chiamato Dispositivi di acquisizione e server di immagini. In quella pagina, fare clic sul pulsante Cerca nuovi dispositivi (ad esempio, scanner) nella casella Server di acquisizione ed elaborazione delle immagini . Monitorare l'avanzamento del server nel rilevamento degli scanner facendo clic sul collegamento [log] accanto al server.
NOTA: Prima di eseguire questo passaggio, assicurarsi che gli scanner desiderati siano accesi e collegati al server. - Nella stessa pagina dell'interfaccia Web, verificare che ogni scanner collegato al server sia visualizzato nella casella Dispositivi di acquisizione immagine . L'etichetta "Mancante" in "Stato attuale" non viene più visualizzata se il dispositivo viene rilevato correttamente. Selezionare la casella di controllo corrispondente a ciascuno scanner contenente le lastre appena caricate.
- Nella parte inferiore della sezione Dispositivi di acquisizione delle immagini , fare clic sul pulsante Richiedi acquisizione anteprima . Entro 1 o 2 minuti, gli scanner dovrebbero accendersi e avviare la scansione.
NOTA: La posizione iniziale delle lastre di supporto in vetro deve essere spesso regolata per portare tutte le lastre nell'area visibile. Le posizioni possono essere corrette ispezionando le immagini di acquisizione in anteprima e apportando modifiche alla posizione della piastra e riprendendo nuove immagini di acquisizione in anteprima. Se le scansioni procedono molto lentamente (diversi minuti per una scansione di acquisizione) o se le immagini di acquisizione dell'anteprima contengono lunghe strisce bianche, questo è un segno che una piastra, il tappetino di gomma o qualche altro oggetto sta bloccando la luce all'interno dell'area di calibrazione dello scanner (indicata da frecce bianche sulla superficie dello scanner). Tutti gli oggetti devono essere riposizionati in modo tale che solo il vetro di supporto in vetro occupi questa regione.
- Utilizzando l'interfaccia web, trova la sezione Acquisizione immagini della pagina principale e segui il collegamento chiamato Dispositivi di acquisizione e server di immagini. In quella pagina, fare clic sul pulsante Cerca nuovi dispositivi (ad esempio, scanner) nella casella Server di acquisizione ed elaborazione delle immagini . Monitorare l'avanzamento del server nel rilevamento degli scanner facendo clic sul collegamento [log] accanto al server.
- Definire le aree di scansione: seguire i passaggi successivi nel Worm Browser per analizzare le immagini di acquisizione in anteprima e assemblarle in un'unica immagine composita, che viene utilizzata per specificare la posizione di ciascuna lastra per l'analisi dei dati. Assicurarsi che l'immagine risultante sia simile a quella della Figura 2B.
- Innanzitutto, utilizzando il Worm Browser, aprire ciascuna immagine di anteprima selezionando l'opzione di menu File > Apri immagine e scegliere l'immagine desiderata.
- Su ogni immagine, fare clic per selezionare le colonne per le regioni con piastre (se il tappetino in gomma ha 16 posizioni delle piastre, selezionare 4 colonne).
NOTA: Le aree di scansione devono essere specificate come colonne alte (non righe larghe) poiché l'acquisizione dello scanner è più lenta per le aree più ampie, con conseguenti immagini sfocate a causa del movimento dei nematodi. - Una volta definite tutte le immagini, esportare le specifiche della regione su disco selezionando la voce di menu Acquisizione immagini > Definisci aree di scansione > Salva le aree di scansione selezionate su disco e scegliendo la posizione desiderata.
- Generare la pianificazione dell'esperimento:
- Seguendo il formato del file supplementare 1, assemblare un file contenente il nome dell'esperimento, le posizioni fisiche di ciascuna colonna sugli scanner (copiato dal file delle aree di scansione generato nel passaggio 4.1.2.3), la durata totale dell'esperimento e la frequenza di acquisizione dell'immagine, quindi salvarlo sia come file TXT che come file XML.
- Quindi, in Worm Browser, fare clic su Image Acquisition > Submit Experiment Schedule (Invia pianificazione esperimento) e scegliere il file XML generato. Il Worm Browser chiederà se visualizzare un riepilogo della pianificazione o eseguire l'esperimento. Fare clic su Genera un file di riepilogo.
- Convalidare il file di riepilogo: dopo aver inviato la pianificazione dell'esperimento, il Worm Browser emetterà un riepilogo della pianificazione. Questo riepilogo viene visualizzato sullo schermo e scritto su disco. Leggilo e verifica le date delle acquisizioni pianificate, nonché la posizione, il nome e il numero di scanner.
- Inviare la pianificazione dell'esperimento: quando si è soddisfatti del file di riepilogo, caricare nuovamente il file XML per la pianificazione dell'esperimento nel browser Worm selezionando l'opzione di menu Acquisizione immagini > Invia pianificazione esperimento. Il Worm Browser chiederà una seconda volta se visualizzare un riepilogo della pianificazione o se eseguire l'esperimento. Questa volta clicca su Esegui! .
NOTA: Pochi minuti dopo l'invio dell'esperimento, è consigliabile utilizzare l'interfaccia Web per confermare che l'esperimento è stato inviato correttamente e che le scansioni vengono raccolte da tutti gli scanner. È normale che le prime scansioni vengano perse, soprattutto negli esperimenti di grandi dimensioni. - Organizzare gli esperimenti sull'interfaccia Web: un cluster di scanner occupato può produrre centinaia di set di dati sperimentali raccolti da molti utenti diversi. Per organizzare questo elenco, assegnare gli esperimenti a gruppi separati, ad esempio corrispondenti al nome dell'utente responsabile dell'esperimento.
- Creare un nuovo gruppo o modificarne uno esistente: creare nuovi gruppi sull'interfaccia Web facendo clic su Gestisci gruppi di esperimenti nella casella denominata Acquisizione immagini. Nella nuova pagina che apparirà, aggiungi il nome desiderato su Crea nuovo gruppo e fai clic su Crea. Per modificare il nome di un gruppo esistente, nella stessa casella scegliere il gruppo desiderato accanto a Modifica gruppo esistente, quindi selezionare Modifica.
- Assegnare esperimenti a un gruppo: per assegnare nuovi esperimenti a un gruppo specifico, vai all'interfaccia Web e trova l'esperimento desiderato, che per impostazione predefinita verrà assegnato al gruppo Nessun gruppo nella parte inferiore dell'elenco degli esperimenti. Fai clic sul collegamento sul lato destro della sezione dell'esperimento in cui viene visualizzato il messaggio Modifica e utilizza l'elenco a discesa per selezionare il nome del gruppo da utilizzare. Quindi, seleziona Salva.
- Annullare un esperimento:
NOTA: L'LSM continuerà a funzionare in modo autonomo fino a quando le scansioni finali non saranno specificate nel programma dell'esperimento. Al termine di un programma sperimentale, l'LSM, per impostazione predefinita, continuerà a raccogliere le scansioni, ma scarterà immediatamente i dati dell'immagine in un processo chiamato scansione automatica. Queste scansioni automatiche vengono eseguite per evitare che gli scanner si spengano e si raffreddino e mantengono un profilo di temperatura standard in modo che eventuali altri esperimenti in esecuzione nello stesso spazio (ma da un esperimento diverso) non siano influenzati dall'arresto di altri scanner.- Interrompi le scansioni automatiche: per interrompere le scansioni automatiche di un esperimento in corso sull'interfaccia Web, fai clic su Modifica accanto all'esperimento desiderato, quindi su Annulla scansioni in sospeso e seleziona Annulla acquisizioni pianificate.
- Richiedi acquisizioni di anteprima: specificare la posizione di tutte le lastre su ogni scanner. Vengono forniti diversi strumenti per accelerare questo processo. Innanzitutto, utilizzare lo scanner per ottenere un'immagine dell'intera superficie dello scanner, denominata "Anteprima acquisizione". Assicurarsi che le immagini di acquisizione dell'anteprima mostrino chiaramente l'intera superficie di ciascuna lastra da riprendere (Figura 2A) senza striature o il ritaglio dei bordi della lastra.
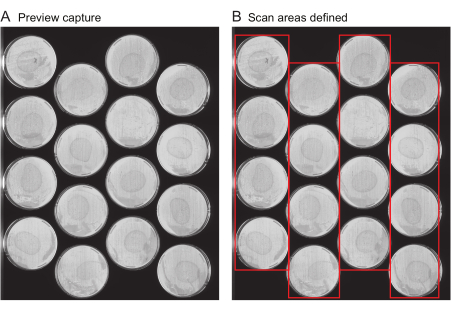
Figura 2: Anteprima dell'immagine di acquisizione e selezione dell'area di scansione. (A) Per ogni scanner dell'esperimento, viene generata un'immagine di acquisizione in anteprima. (B) Selezione di una fila di lastre alla volta (caselle rosse), che aumenta la velocità di scansione e previene la sfocatura del movimento dei vermi a causa di aree di scansione troppo ampie. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Acquisizione delle immagini
NOTA: i passaggi seguenti possono essere eseguiti sia durante l'esecuzione dell'esperimento che al termine dell'esperimento.
- Output del file maschera dell'esperimento: i dati delle immagini grezze provenienti dagli scanner contengono molte aree che non devono essere elaborate (aree al di fuori delle lastre). Per focalizzare l'analisi su ogni singola lastra, viene creata una "maschera" che specifica l'area occupata da ciascuna lastra su ogni scanner. Generare questa maschera disegnando la posizione di ciascuna lastra come sovrapposizione alle immagini raccolte dagli scanner.
- Utilizzando il Worm Browser, scegliere l'esperimento desiderato selezionando File > Seleziona esperimento corrente, quindi fare clic sul nome dell'esperimento.
- Sempre nel Worm Browser, selezionare Acquisizione immagini > Definisci maschere campione > Genera composito maschera esperimento e salvare la maschera nella posizione desiderata. Assicurarsi che il file risultante sia simile a quello della Figura 3A.

Figura 3: Specifica delle posizioni delle lastre per ogni scanner utilizzando maschere campione. Per garantire l'analisi indipendente delle lastre all'interno delle selezioni di colonna mostrate nella Figura 1, le singole lastre devono essere identificate generando una maschera di immagine composita. (A) L'acquisizione delle scansioni degli scanner viene aperta con un software di manipolazione delle immagini (notare il nome dello scanner "han" sopra una selezione scansionata e "a-d" che si riferisce a ciascuna delle colonne). (B) I singoli passaggi della generazione della maschera per contrassegnare la posizione di ogni lastra nella maschera composita richiedono che lo sfondo sia impostato su nero, (C) la rimozione dei bordi frastagliati e dei bordi delle lastre non selezionate mediante l'espansione e quindi la riduzione dello sfondo e (D) la selezione delle lastre in primo piano e il riempimento delle aree interamente con pixel bianchi.) Affinché LSM riconosca le singole lastre nelle righe scansionate, ogni area bianca di una riga viene riempita con una diversa tonalità di grigio, di solito con luminosità crescente. (F) A questo punto, la maschera viene salvata (compressione LZW senza livelli specificati se generata in Photoshop). La maschera viene quindi scansionata dal Worm Browser e viene generata una visualizzazione della maschera da parte del software. Una corretta visualizzazione della maschera dovrebbe visualizzare un quadrato definito per piatto con una piccola croce al centro e un colore diverso per ogni riga. Fare clic qui per visualizzare una versione più grande di questa figura.
- Annota la maschera dell'esperimento: apri il file generato nel passaggio precedente con un programma di manipolazione delle immagini (come Photoshop o GIMP) per contrassegnare la posizione di ogni lastra nell'immagine. Di seguito viene descritta una panoramica di tutti i passaggi di modifica delle maschere con Photoshop.
- In Photoshop, selezionate lo strumento Riempimento con la tolleranza impostata su zero, l'opzione contigua selezionata e l'anti-aliasing deselezionato. Fare clic sullo sfondo grigio per impostarlo completamente su nero. Assicurarsi che l'immagine risultante sia simile a quella della Figura 3B.
- Usate lo strumento bacchetta magica per selezionare lo sfondo nero, con l'aliasing disattivato, la tolleranza azzerata e l'opzione contigua selezionata. Per smussare i bordi, espandere lo sfondo selezionato di 30 pixel facendo clic su Seleziona > Modifica > Espandi. Quindi, riduci la selezione di 20 pixel in Seleziona > Modifica > contratto. Assicurarsi che l'immagine risultante sia simile a quella della Figura 3C.
- Riempite interamente lo sfondo levigato con pixel neri, ad esempio impostando la tolleranza dello strumento Riempimento su 255 e riempiendo l'area selezionata. Quindi, fai clic su Seleziona > inversa per invertire la selezione e seleziona il primo piano. Riempite interamente la nuova regione con pixel bianchi, ad esempio impostando la tolleranza dello strumento di riempimento su 255 e riempiendo l'area con il bianco. Assicurarsi che l'immagine risultante sia simile a quella della Figura 3D.
- Per separare ogni piastra all'interno di una singola regione, riempi ogni riga con una diversa sfumatura di grigio in aumento della luminosità. Questo può essere fatto con lo strumento Riempimento e poi selezionando il colore desiderato, con la tolleranza impostata su 0. Assicurarsi che l'immagine risultante sia simile a quella della Figura 3E. Salvalo in una compressione LZW senza "Livelli" specificati.
NOTA: L'ordine delle piastre è impostato in base al colore delle regioni specificate. Per assegnare un nome alle targhette da 1 a 4 in ordine dall'alto verso il basso, specificare i colori con luminosità crescente per ogni riga. - Nel Worm Browser, selezionare Image Acquisition > Define Sample Masks > Analyze Plate Locations Drawn on Experiment Mask Composite (Analizza le posizioni delle piastre disegnate sul composito della maschera dell'esperimento) e selezionare il file generato nel passaggio precedente. Il software impiegherà ora alcuni istanti per analizzare la maschera inviata.
- Il Worm Browser visualizzerà una visualizzazione maschera. Ispezionare la maschera per individuare eventuali errori nel file. Assicurati che ogni fila di piatti sia riempita con un colore diverso e delineata da un rettangolo colorato. Assicurarsi che l'immagine risultante sia simile a quella della Figura 3F.
NOTA: se una singola lastra mostra due o più cerchi o se due cerchi condividono lo stesso colore, tornare al punto 5.2 per correggere il file maschera e caricarlo nuovamente nel Worm Browser. - Dopo aver verificato che la visualizzazione della maschera sia corretta, nel Worm Browser, selezionare Acquisizione immagini > Definisci maschere campione > Invia composito maschera esperimento analizzato al cluster. Il server di analisi delle immagini analizzerà ora la posizione di tutte le piastre nell'esperimento.
- Applicare la maschera: l'LSM utilizza le maschere per suddividere i dati dell'immagine grezza in singole lastre. Per avviare questo processo, pianificare un processo di applicazione della maschera utilizzando l'interfaccia Web.
- Prima di inviare il lavoro, verificare che tutti gli scanner abbiano aree identificate nella maschera. Vai alla pagina principale dell'interfaccia web, individua il nome dell'esperimento e la colonna denominata Analisi delle immagini e fai clic su Esegui analisi. Verificare che tutti i dispositivi in Campioni di esperimento abbiano aree identificate.
- Per applicare la maschera, sulla stessa interfaccia, fare clic su Nuovo lavoro per tutti i campioni. Nella casella Pianifica un lavoro per singole immagini, selezionare la casella Applica maschera, quindi Salva lavoro.
NOTA: La maschera verrà applicata a tutte le immagini già acquisite, nonché a tutte le immagini acquisite in futuro.
- Eseguire il controllo di qualità della piastra:
NOTA: Le lastre che soffrono di contaminazione, essiccazione o appannamento vengono censurate in questa fase dell'analisi dell'immagine. Nella Figura 4 è mostrato un esempio di piastre contaminate, essiccate, appannate e ottimali. Altri motivi per la censura includono la fame, i piatti vuoti o le larve nelle popolazioni sterili. Le piastre non valide contengono spesso forme complesse che la macchina mira a interpretare come nematodi. È importante escludere le lastre non valide in questa fase per evitare lunghi tempi di elaborazione nelle fasi successive dell'analisi dell'immagine.- Utilizzando l'interfaccia Web, escludere le lastre da censurare trovando l'esperimento desiderato e la colonna denominata Annota informazioni sulla piastra e selezionando Per immagine.
- Per ispezionare le lastre, fare clic su Visualizza immagini.
NOTA: se il passaggio per la visualizzazione delle immagini non funziona correttamente, il server Linux potrebbe non essere configurato correttamente. Le istruzioni su come eseguire questa operazione sono disponibili nella guida all'installazione del software nel repository GitHub sopra menzionato. - Per escludere le targhe, selezionare la casella Censura, selezionare un'opzione nella casella a discesa denominata Motivo censurato, quindi fare clic su Salva per ogni pagina.
- Aggiungere informazioni sui metadati: i metadati descrivono il contenuto di ogni piastra in un esperimento. Queste informazioni vengono poi incluse in tutti i file di dati statistici generati successivamente.
- Per aggiungere informazioni sui metadati relative al ceppo, al genotipo, alla temperatura, al cibo, ecc., vai alla pagina principale dell'interfaccia web, trova l'esperimento desiderato e la colonna denominata Annota informazioni sulla piastra e seleziona Per posizione.
- Immettere le etichette e selezionare gli scanner per i quali salvare i metadati facendo clic su Salva su dispositivi nell'angolo in basso a sinistra.
- Per riutilizzare i metadati tra scanner diversi senza dover reinserire nuovamente tutte le etichette, vai su Carica da dispositivo nell'angolo in alto a destra, seleziona lo scanner da cui riutilizzare i metadati e fai clic su Carica da dispositivo.
- Specificare l'ora "zero-age": per impostazione predefinita, LSM misura il tempo in relazione all'inizio dell'epoca UNIX. Questo è raramente conveniente, quindi è necessaria la specifica di un periodo di riferimento (ad esempio, la data in cui tutti gli individui si sono schiusi o hanno raggiunto l'età adulta).
- Per specificare le informazioni sull'età zero, passare alla pagina principale dell'interfaccia Web, trovare l'esperimento desiderato e la colonna denominata Analisi delle immagini e selezionare Esegui analisi.
- Nella nuova pagina visualizzata, seleziona Nuovo processo per tutte le aree. Nella casella denominata Aggiorna informazioni regione, selezionare l'ora in cui gli animali avevano 0 età, aggiungere le informazioni, quindi fare clic su Aggiorna campi selezionati.
NOTA: Se tutti gli animali non condividono lo stesso tempo di età zero, selezionare invece Nuovo lavoro per tipi di animali specifici e ripetere i passaggi precedenti per ogni gruppo.
- Pianifica il rilevamento dei vermi: l'LSM può automatizzare il rilevamento di ciascun nematode in base alla sua posizione sulla piastra.
- Per avviare il rilevamento automatico dei nematodi per ogni immagine, vai alla pagina principale dell'interfaccia web, trova l'esperimento desiderato e la colonna denominata Analisi delle immagini e seleziona Esegui analisi.
- Nella nuova pagina che apparirà, fare clic su Nuovo processo per tutte le regioni, quindi sulla casella denominata Pianifica un processo per singole immagini e selezionare le caselle Filtro mediano > Soglia > Rilevamento worm > Salva processo. Questi lavori verranno applicati a tutte le immagini acquisite in passato e in futuro.
NOTA: Per programmare un lavoro solo per un ceppo o una condizione specifica, fare clic su Lavori per tipi di animali specifici. La classificazione degli oggetti viene eseguita utilizzando i modelli SVM specificati come file memorizzati nella sottocartella Models della directory di archiviazione a lungo termine di LSM. I set di parametri di rilevamento dei nematodi V2.0 per LSM possono essere scaricati dal repository GitHub.
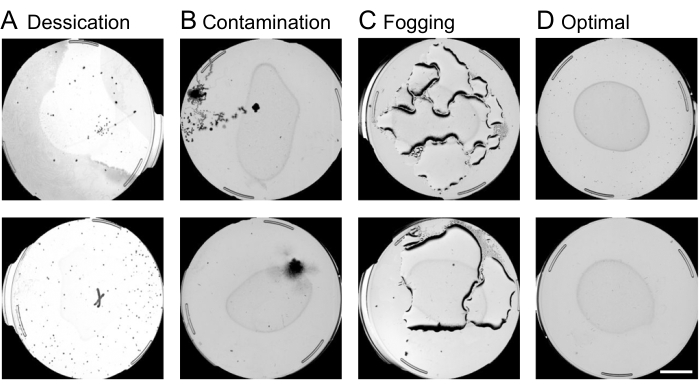
Figura 4: Controllo della qualità delle lastre tramite l'interfaccia web. La censura delle lastre non ottimali sull'interfaccia web prima dell'analisi del movimento del worm è fondamentale per accelerare la pipeline di elaborazione delle immagini. Esempi di piastre soggette a rimozione includono condizioni di (A) essiccazione, (B) contaminazione o (C) appannamento, in contrapposizione. (D) Piastre ottimali da includere in ulteriori analisi. Una barra di scala di 10 mm viene sovrapposta a un'immagine di acquisizione in anteprima. Fare clic qui per visualizzare una versione più grande di questa figura.
6. Acquisizione post-immagine
NOTA: una volta completato il rilevamento dei worm, tutti i dati raccolti dall'esperimento devono essere aggregati nel tempo per tenere traccia di ogni individuo nel corso della sua vita e identificare tutti i tempi di morte degli individui. Attendere che tutti gli animali dell'esperimento siano morti e che tutti i processi di rilevamento dei vermi siano stati completati, quindi eseguire i seguenti passaggi:
- Pianifica l'analisi del movimento:
- L'analisi del movimento integra tutti i dati sperimentali nel tempo per stimare i tempi di morte. Per avviare questo processo, passare alla pagina principale dell'interfaccia Web e trovare l'esperimento desiderato nella colonna denominata Analisi delle immagini. Selezionare il collegamento Esegui analisi (Run Analysis).
- Nella nuova pagina visualizzata, fare clic sul collegamento Nuovo processo per tutte le regioni e, dal menu a discesa, Pianifica un processo per un'intera regione, selezionare Analizza movimento verme e fare clic sul pulsante Salva lavoro.
- Il server di acquisizione delle immagini LSM inizierà automaticamente ad analizzare il movimento su tutte le lastre.
NOTA: L'analisi del movimento è il lavoro più grande. Su un moderno processore multi-core, l'analisi di ciascuna piastra di un esperimento della durata di 1 mese può richiedere 20 minuti o più.
- Generare uno storyboard: al termine dell'analisi del movimento, lo storyboard LSM consente agli utenti di convalidare manualmente i risultati automatizzati e garantire che il software stia facendo ipotesi corrette sulla morfologia e sul comportamento dei nematodi.
- Nella pagina principale dell'interfaccia Web individuare l'esperimento desiderato e la colonna denominata Analisi delle immagini, quindi selezionare Esegui analisi. Nella nuova pagina visualizzata, fai clic su Nuovo processo di esperimento. Quindi, nella sezione Pianifica un processo per un'intera regione, seleziona Genera storyboard animale e fai clic su Salva processo.
- Al termine della generazione dello storyboard, passare al Worm Browser e selezionare l'esperimento desiderato. Torna al menu principale, seleziona Convalida > Sfoglia l'intero esperimento > subito dopo la morte di ogni worm.
- Annotazione degli storyboard nel browser worm: uno storyboard tipico nel browser worm dovrebbe essere simile al seguente Figura 5.
- Annotazione di oggetti "non worm"
NOTA: ogni oggetto rilevato durante il movimento viene visualizzato nello storyboard, ordinato in base al tempo di morte stimato. A meno che l'utente non specifichi diversamente, ogni oggetto verrà incluso nelle curve di sopravvivenza risultanti. La classificazione degli oggetti LSM è intenzionalmente calibrata per avere un alto tasso di falsi positivi, come compromesso per ridurre al minimo il numero di nematodi non rilevati. L'esclusione di oggetti non vermi è importante per ottenere curve di sopravvivenza di alta qualità (vedere i risultati rappresentativi). Nella prima e nell'ultima pagina dello storyboard si trova in genere un numero elevato di oggetti non worm, che possono essere rapidamente esclusi manualmente in blocco.- Per escludere oggetti non worm nello storyboard, fare clic con il pulsante destro del mouse sull'immagine dell'oggetto. L'oggetto escluso sarà ora delineato da un riquadro bianco. Per escludere più oggetti contemporaneamente, tenere premuto il tasto Ctrl e fare clic con il pulsante destro del mouse su qualsiasi oggetto per escludere tutti gli oggetti nella pagina dello storyboard.
- Dopo aver escluso un oggetto dall'analisi, è possibile includerlo nuovamente facendo nuovamente clic con il pulsante destro del mouse due volte.
- Per salvare le annotazioni effettuate durante l'annotazione dello storyboard, fare clic sul pulsante Salva . Si consiglia di salvare frequentemente l'avanzamento durante l'annotazione.
- Annota i tempi di morte:
NOTA: Senza l'intervento dell'utente, l'LSM stima accuratamente i tempi di morte per la maggior parte delle popolazioni. Tuttavia, si raccomanda di confermare regolarmente l'accuratezza dei risultati automatizzati convalidando manualmente un sottoinsieme casuale di individui da ciascun esperimento. Particolare attenzione dovrebbe essere prestata agli individui più brevi e più longevi, poiché eventuali errori nell'analisi automatizzata tendono a raggrupparsi in questi gruppi.- Fare clic con il pulsante sinistro del mouse una volta su un oggetto dello storyboard per aprire una nuova finestra in cui vengono visualizzate informazioni dettagliate sulle serie temporali relative all'oggetto. Questa finestra permette l'ispezione di tutte le immagini raccolte dell'oggetto durante l'esperimento, nonché la quantificazione della dinamica e della morfologia del movimento dell'oggetto. Utilizzando la stessa interfaccia, annota manualmente i tempi di morte. L'interfaccia per l'annotazione dell'ora del decesso è illustrata nella Figura 6.
- Per annotare manualmente l'ora della morte, fare clic con il pulsante sinistro del mouse sulla barra inferiore nel punto corrispondente all'ora della morte. Utilizzare la barra spaziatrice e le frecce destra o sinistra della tastiera per spostarsi tra gli intervalli di tempo oppure fare clic direttamente sulla barra nell'intervallo di tempo desiderato.
NOTA: La visualizzazione rappresenta lo stato di movimento degli animali nel tempo, come un grafico a barre orizzontali con il tempo di marcatura dell'asse x. La sezione rosa/viola indica il periodo di tempo in cui l'oggetto si muove vigorosamente, il giallo indica un movimento debole, il rosso indica animali che non si muovono e il verde indica il periodo di espansione associato alla morte. I nematodi mostrano eventi morfologici caratteristici associati alla morte: una graduale contrazione del corpo che di solito si verifica prima della morte, seguita da una rapida espansione del corpo durante o immediatamente dopo la morte (Figura 6B). Gli oggetti non vermiformi come la polvere o le ombre non mostrano queste dinamiche nelle dimensioni del corpo e, invece, in genere seguono un cambiamento lineare e graduale nelle dimensioni e nell'intensità nel tempo. Queste diverse dinamiche corporee forniscono un metodo rapido e semplice per una rapida classificazione ed esclusione manuale. - A seconda dell'approccio analitico, il tempo di morte può essere considerato come il tempo di cessazione del movimento (l'inizio della barra rossa nella visualizzazione del movimento) o come il tempo di espansione associata alla morte (la barra verde nella visualizzazione del movimento). Per annotare manualmente gli eventi di contrazione ed espansione, fare clic con il pulsante destro del mouse sulla barra inferiore nell'intervallo di tempo desiderato.
- Alcune visualizzazioni rudimentali dei dati sulla mortalità sono fornite in modo nativo all'interno del client Worm Browser. Le curve di sopravvivenza e la diagnostica del tempo di morte sono mostrate per ogni popolazione presente nello storyboard (Figura 7). Guarda le curve di sopravvivenza sul lato sinistro e il grafico a dispersione che confronta il tempo di cessazione del movimento vigoroso (VMC) con l'ora della morte per ogni individuo sul lato destro dello storyboard.
NOTA: È possibile raggruppare questi risultati in base a diversi parametri sperimentali mediante sottoimpostazioni sulla barra inferiore per condizioni quali ceppi, scanner o piastre specifici. I singoli worm possono essere selezionati in base ai loro tempi di morte facendo clic con il pulsante sinistro del mouse sui singoli punti nel grafico VMC rispetto al tempo di morte.
- Annotazione di oggetti "non worm"
- Scrittura dei dati di mortalità su disco: LSM produce dati di mortalità sotto forma di file CSV. Traccia le curve di sopravvivenza in uscita e analizzale su qualsiasi software statistico come R, SAS, STATA o JMP.
- Per generare questi file, scegliere l'esperimento nel Worm Browser e, dal menu, selezionare File di dati, Tempi di morte, quindi fare clic su Genera orari di morte per l'esperimento corrente. L'LSM genererà un file di output con i dati di sopravvivenza dell'esperimento, che verranno salvati nella directory dei risultati.
- Se sono state eseguite annotazioni manuali sullo storyboard, nel Worm Browser verrà visualizzato un messaggio che chiede come gestire le annotazioni manuali. Fare clic su "Immediatamente" per includere annotazioni manuali nel file dei tempi di morte emessi.
NOTA: i file dei dati sulla mortalità vengono scritti nella directory dei risultati specificata nel file imageserver.ini. Vengono scritti una varietà di file, ma la versione più comunemente usata è "survival_simple/survival=machine_hand", che include tutte le annotazioni manuali fatte usando lo storyboard. - Analizza i dati di mortalità nel software statistico di scelta.
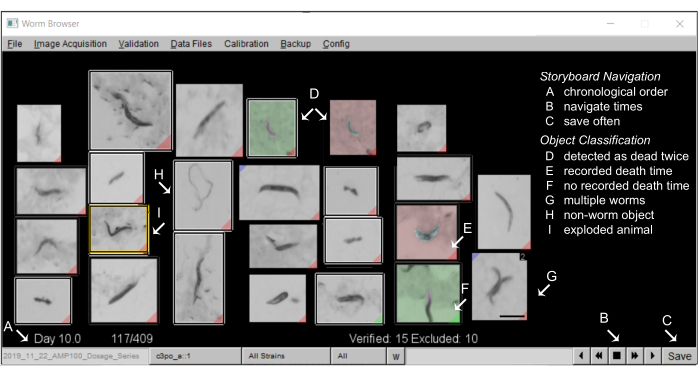
Figura 5: Storyboard di un animale nel Worm Browser. (A) Tutti i vermi stazionari sono mostrati in ordine cronologico di tempo di morte annotato dalla macchina. Per spostarsi nello storyboard, premere i pulsanti nell'angolo (B) in basso a destra e (C) salvare spesso le annotazioni. (D) Le immagini con uno sfondo non grigio raffigurano due eventi di morte dei vermi (morte precoce come verde, morte successiva come rosso), che possono verificarsi quando due vermi muoiono vicini l'uno all'altro, o quando i vermi morti vengono spostati da un verme di passaggio e sono, quindi, rilevati come morti due volte. (E) Un tag rosso nell'angolo inferiore di un'immagine identifica i vermi con un tempo di morte rilevato; (F) un'etichetta verde indica dove un oggetto non è rimasto fermo abbastanza a lungo da registrare un tempo di morte. (G) Più worm nello stesso frame possono essere contrassegnati premendo Maiusc e facendo clic con il pulsante sinistro del mouse. (H) Gli oggetti non worm vengono esclusi dall'analisi facendo clic con il pulsante destro del mouse. (I) I vermi esplosi vengono censurati dall'analisi facendo clic sull'immagine corrispondente (si apre una finestra di annotazione manuale) e premendo Maiusc e facendo clic con il pulsante destro del mouse finché non viene visualizzato il messaggio "animale esploso". Una barra di scala di 0,5 mm e le etichette sono sovrapposte allo screenshot di una finestra di Worm Browser. Fare clic qui per visualizzare una versione più grande di questa figura.
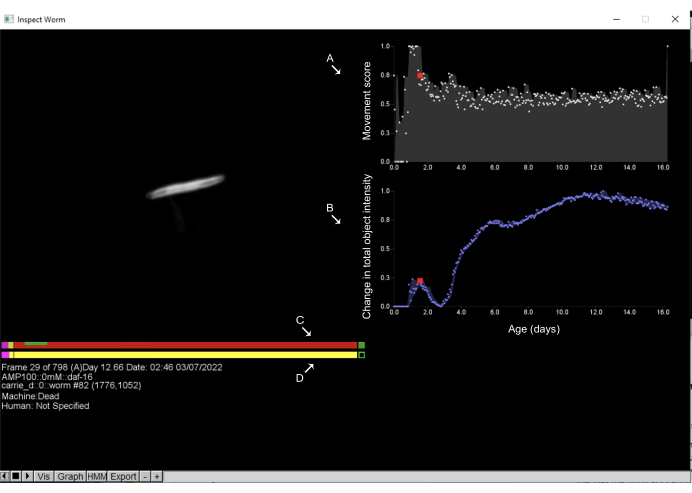
Figura 6: Ispezione degli oggetti e annotazione dei tempi di morte nel Worm Browser. Facendo clic con il pulsante sinistro del mouse su qualsiasi oggetto nello storyboard di Worm Browser si apre una nuova interfaccia e consente all'utente di ispezionare le dinamiche di movimento dell'oggetto. Sul lato destro viene visualizzato il punteggio di movimento (A), che quantifica il movimento dell'oggetto; Questo è stimato dalla variazione dell'intensità dei pixel tra osservazioni consecutive. Inoltre, sul lato destro, (B) viene visualizzata la variazione dell'intensità totale dell'oggetto, che quantifica le variazioni delle dimensioni dell'oggetto. Sul lato sinistro, la barra superiore mostra la stima (C) della macchina del tempo di morte, mentre la barra inferiore è l'annotazione (D) della mano umana. Facendo clic su un punto qualsiasi delle barre e premendo la barra spaziatrice, l'utente può spostarsi attraverso gli intervalli di tempo in cui è stata visualizzata l'immagine del worm. Su queste barre, il rosa rappresenta il tempo trascorso in un movimento vigoroso, il rosso rappresenta il tempo trascorso nella morte e il giallo è tutto ciò che sta nel mezzo. Il tempo trascorso in espansione e contrazione dopo il tempo di morte è mostrato in verde. Le etichette vengono sovrapposte allo screenshot di una finestra di Worm Browser. Fare clic qui per visualizzare una versione più grande di questa figura.
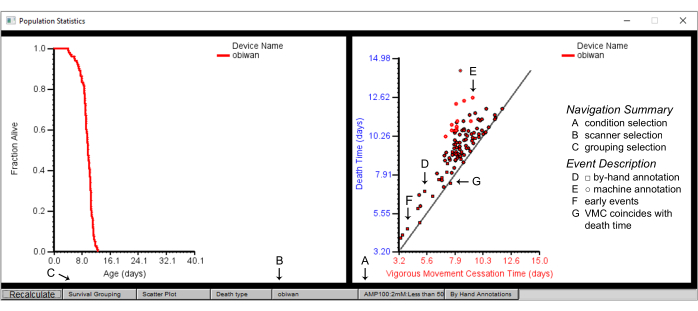
Figura 7: Statistiche di riepilogo della popolazione nel browser Worm. Statistiche di popolazione per il dispositivo scanner "obiwan", con un grafico della sopravvivenza (pannello di sinistra) e un grafico a dispersione del tempo di cessazione del movimento vigoroso (VMC) rispetto al tempo di morte (pannello di destra). I grafici sono i dettagli di (A) una condizione, ottenuti da (B) uno scanner ottenuto selezionando prima (C) il raggruppamento di sopravvivenza per ceppo. (D) Le forme quadrate nel grafico a dispersione rappresentano gli eventi annotati a mano, mentre (E) le forme circolari rappresentano gli eventi annotati dalla macchina. (F) L'annotazione manuale è spesso richiesta per eventi di morte che si verificano precocemente o (G) quelli in cui il tempo di cessazione del movimento vigoroso coincide con il tempo di morte. Le etichette vengono sovrapposte allo screenshot di una finestra di Worm Browser. Fare clic qui per visualizzare una versione più grande di questa figura.
Risultati
La riproducibilità sperimentale nei saggi di durata della vita è impegnativa e richiede sia condizioni sperimentali strettamente controllate che grandi popolazioni per ottenere una risoluzione statistica sufficiente 4,36. L'LSM è particolarmente adatto per il rilevamento di grandi popolazioni di animali in un ambiente costante con un'elevata risoluzione temporale. Per dimostrare la capacità dell'LSM, evidenziare le fasi cruciali dell'analisi e aiutare i ricer...
Discussione
Qui forniamo un protocollo dettagliato e accessibile per l'esecuzione di un esperimento utilizzando l'ultima versione di Lifespan Machine. Abbiamo dimostrato che il passaggio critico per ottenere curve di sopravvivenza ben risolte è l'esclusione manuale di oggetti non vermi durante l'acquisizione post-immagine. L'annotazione manuale del tempo di morte ha un piccolo effetto sulla forma complessiva delle curve di sopravvivenza, dimostrando che la stima del tempo di morte completamente automatizzata è efficiente anche sen...
Divulgazioni
Gli autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Ringraziamo Julian Ceron e Jeremy Vicencio (IDIBELL Barcelona) per aver prodotto l'allele rpb-2 (cer135). Questo progetto è stato finanziato dal Consiglio europeo della ricerca (CER) nell'ambito del programma di ricerca e innovazione Horizon 2020 dell'Unione europea (accordo di sovvenzione n. 852201), dal Ministero spagnolo dell'Economia, dell'Industria e della Competitività (MEIC) al partenariato EMBL, dal Centro de Excelencia Severo Ochoa (CEX2020-001049-S, MCIN/AEI /10.13039/501100011033), dal Programma CERCA/Generalitat de Catalunya, dal premio MEIC Excelencia BFU2017-88615-P, e un premio della Glenn Foundation for Medical Research.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-Naphtaleneacetic acid (Auxin) | Sigma | N0640 | Solubilize Auxin in 1M potassium hydroxide and add into molten agar |
| 5-fluoro-2-deoxyuridine (FUDR) | Sigma | F0503 | 27.5 μg/mL of FUDR was used to eliminate progeny from populations on UV-inactivated bacteria |
| Glass cleaner | Kristal-M | QB-KRISTAL-M125ml | |
| Hydrophobic anti-fog glass treatment | Rain-X Scheibenreiniger | C. 059140 | |
| Rubber matt | Local crafstman | Cut on a high-strength EPDM rubber sheet stock | |
| Scanner glass | Local hardware supplier | 9" x 11.5" inch glass sheet | |
| Scanner plates | Life Sciences | 351006 | 50 mm x 9 mm, polystyrene petri dish |
| USB Reference Thermometer | USB Brando | ULIFE055500 | For calibrating temperature of scanners |
Riferimenti
- Harman, D. The aging process: Major risk factor for disease and death. Proceedings of the National Academy of Sciences of the United States of America. 88 (12), 5360-5363 (1991).
- Vaupel, J. W. Biodemography of human ageing. Nature. 464 (7288), 536-542 (2010).
- Mair, W., Goymer, P., Pletcher, S. D., Partridge, L. Demography of dietary restriction and death in Drosophila. Science. 301 (5640), 1731-1733 (2003).
- Petrascheck, M., Miller, D. L. Computational analysis of lifespan experiment reproducibility. Frontiers in Genetics. 8, 92 (2017).
- Lucanic, M., et al. Impact of genetic background and experimental reproducibility on identifying chemical compounds with robust longevity effects. Nature Communications. 8 (1), 14256 (2017).
- Banse, S. A., et al. Automated lifespan determination across Caenorhabditis strains and species reveals assay-specific effects of chemical interventions. Geroscience. 41 (6), 945-960 (2019).
- Herndon, L. A., et al. Stochastic and genetic factors influence tissue-specific decline in ageing C. elegans. Nature. 419 (6909), 808-814 (2002).
- Kirkwood, T. B., et al. What accounts for the wide variation in life span of genetically identical organisms reared in a constant environment. Mechanisms of Ageing and Development. 126 (3), 439-443 (2005).
- Stroustrup, N., et al. The temporal scaling of Caenorhabditis elegans ageing. Nature. 530 (7588), 103-107 (2016).
- Hamilton, B., et al. A systematic RNAi screen for longevity genes in C. elegans. Genes & Development. 19 (13), 1544-1555 (2005).
- Lee, S. S., et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nature Genetics. 33 (1), 40-48 (2003).
- Cornwell, A. B., Llop, J. R., Salzman, P., Thakar, J., Samuelson, A. V. The replica set method: A high-throughput approach to quantitatively measure Caenorhabditis elegans lifespan. Journal of Visualized Experiments. (136), e57819 (2018).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: A quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652 (2017).
- Hulme, S. E., et al. Lifespan-on-a-chip: Microfluidic chambers for performing lifelong observation of C. elegans. Lab on a Chip. 10 (5), 589-597 (2010).
- Kerr, R. A., Roux, A. E., Goudeau, J. F., Kenyon, C. The C. elegans observatory: High-throughput exploration of behavioral aging. Frontiers in Aging. 3, 932696 (2022).
- Javer, A., Ripoll-Sánchez, L., Brown, A. E. Powerful and interpretable behavioural features for quantitative phenotyping of Caenorhabditis elegans. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1758), 20170375 (2018).
- Miller, H., et al. Genetic interaction with temperature is an important determinant of nematode longevity. Aging Cell. 16 (6), 1425-1429 (2017).
- Bansal, A., Zhu, L. J., Yen, K., Tissenbaum, H. A. Uncoupling lifespan and healthspan in Caenorhabditis elegans longevity mutants. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), E277-E286 (2015).
- Huang, C., Xiong, C., Kornfeld, K. Measurements of age-related changes of physiological processes that predict lifespan of Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 101 (21), 8084-8089 (2004).
- Garigan, D., et al. Genetic analysis of tissue aging in Caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Oswal, N., Martin, O. M., Stroustrup, S., Bruckner, M. A. M., Stroustrup, N. A hierarchical process model links behavioral aging and lifespan in C. elegans. PLoS Computational Biology. 18 (9), 1010415 (2022).
- Sen, I., et al. DAF-16/FOXO requires protein phosphatase 4 to initiate transcription of stress resistance and longevity promoting genes. Nature Communications. 11 (1), 138 (2020).
- Schiffer, J. A., et al. et al.Caenorhabditis elegans processes sensory information to choose between freeloading and self-defense strategies. Elife. 9, 56186 (2020).
- Bazopoulou, D., et al. Developmental ROS individualizes organismal stress resistance and lifespan. Nature. 576 (7786), 301-305 (2019).
- Guerrero-Rubio, M. A., Hernández-García, S., García-Carmona, F., Gandía-Herrero, F. Extension of life-span using a RNAi model and in vivo antioxidant effect of Opuntia fruit extracts and pure betalains in Caenorhabditis elegans. Food Chemistry. 274, 840-847 (2019).
- Janssens, G. E., et al. Transcriptomics-based screening identifies pharmacological inhibition of Hsp90 as a means to defer aging. Cell Reports. 27 (2), 467-480 (2019).
- Kasimatis, K. R., Moerdyk-Schauwecker, M. J., Phillips, P. C. Auxin-mediated sterility induction system for longevity and mating studies in Caenorhabditis elegans. G3: Genes, Genomes, Genetics. 8 (8), 2655-2662 (2018).
- Lin, X. -. X., et al. DAF-16/FOXO and HLH-30/TFEB function as combinatorial transcription factors to promote stress resistance and longevity. Nature Communications. 9 (1), 4400 (2018).
- Stroustrup, N., et al. The temporal scaling of Caenorhabditis elegans ageing. Nature. 530 (7588), 103-107 (2016).
- Byerly, L., Cassada, R., Russell, R. The life cycle of the nematode Caenorhabditis elegans: I. Wild-type growth and reproduction. Developmental Biology. 51 (1), 23-33 (1976).
- Perez, M. F., Francesconi, M., Hidalgo-Carcedo, C., Lehner, B. Maternal age generates phenotypic variation in Caenorhabditis elegans. Nature. 552 (7683), 106-109 (2017).
- Wilkinson, D. S., Taylor, R. C., Dillin, A. Analysis of aging in Caenorhabditis elegans. Methods in Cell Biology. 107, 353-381 (2012).
- Hosono, R. Sterilization and growth inhibition of Caenorhabditis elegans by 5-fluorodeoxyuridine. Experimental Gerontology. 13 (5), 369-373 (1978).
- Lithgow, G. J., Driscoll, M., Phillips, P. A long journey to reproducible results. Nature. 548 (7668), 387-388 (2017).
- Zhang, L., Ward, J. D., Cheng, Z., Dernburg, A. F. The auxin-inducible degradation (AID) system enables versatile conditional protein depletion in C. elegans. Development. 142 (24), 4374-4384 (2015).
- Baeriswyl, S., et al. Modulation of aging profiles in isogenic populations of Caenorhabditis elegans by bacteria causing different extrinsic mortality rates. Biogerontology. 11 (1), 53 (2010).
- Banse, S. A., Blue, B. W., Robinson, K. J., Jarrett, C. M., Phillips, P. C. The Stress-Chip: A microfluidic platform for stress analysis in Caenorhabditis elegans. PLoS One. 14 (5), e0216283 (2019).
- Banse, S. A., et al. Automated lifespan determination across Caenorhabditis strains and species reveals assay-specific effects of chemical interventions. Geroscience. 41 (6), 945-960 (2019).
- Swindell, W. R. Accelerated failure time models provide a useful statistical framework for aging research. Experimental Gerontology. 44 (3), 190-200 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon