È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Respirometria ad alta risoluzione per valutare la funzione mitocondriale negli spermatozoi umani
In questo articolo
Erratum Notice
Riepilogo
L'analisi della funzione mitocondriale degli spermatozoi mediante respirometria ad alta risoluzione consente di misurare il consumo di ossigeno degli spermatozoi che si muovono liberamente in un sistema a camera chiusa. La tecnica può essere applicata per misurare la respirazione negli spermatozoi umani, che fornisce informazioni sulle caratteristiche e sull'integrità mitocondriale degli spermatozoi.
Abstract
La qualità dello sperma viene spesso studiata mediante lo spermiogramma di routine, che è descrittivo e spesso inconcludente. L'infertilità maschile è associata a un'alterata attività mitocondriale degli spermatozoi, quindi la misurazione della funzione mitocondriale degli spermatozoi è un indicatore della qualità dello sperma. La respirometria ad alta risoluzione è un metodo per misurare il consumo di ossigeno di cellule o tessuti in un sistema a camera chiusa. Questa tecnica può essere implementata per misurare la respirazione negli spermatozoi umani e fornisce informazioni sulla qualità e l'integrità dei mitocondri degli spermatozoi. La respirometria ad alta risoluzione consente alle cellule di muoversi liberamente, il che è un vantaggio a priori nel caso degli spermatozoi. Questa tecnica può essere applicata con spermatozoi intatti o permeabilizzati e consente di studiare la funzione mitocondriale degli spermatozoi intatti e l'attività dei singoli complessi della catena respiratoria. Lo strumento ossigrafo ad alta risoluzione utilizza sensori per misurare la concentrazione di ossigeno accoppiati a un software sensibile per calcolare il consumo di ossigeno. I dati vengono utilizzati per calcolare gli indici respiratori in base ai rapporti di consumo di ossigeno. Di conseguenza, gli indici sono le proporzioni di due tassi di consumo di ossigeno e sono normalizzati internamente al numero di cellule o alla massa proteica. Gli indici respiratori sono un indicatore della funzione mitocondriale e della disfunzione degli spermatozoi.
Introduzione
Si stima che l'infertilità maschile rappresenti il 40%-50% di tutti i casi di infertilità nelle coppie1. Lo spermiogramma convenzionale svolge un ruolo cruciale nel determinare la fertilità maschile; Tuttavia, circa il 15% degli uomini infertili ha parametri spermatici normali2. Inoltre, lo spermiogramma di routine fornisce informazioni limitate sulla funzione degli spermatozoi e non riflette i difetti sottili degli spermatozoi3.
I mitocondri degli spermatozoi hanno una struttura speciale, in quanto sono disposti come una guaina elicoidale attorno ai flagelli. La guaina mitocondriale contiene un numero variabile di mitocondri collegati da linker intermitocondriali e ancorati al citoscheletro da disposizioni proteiche ordinate sulla membrana mitocondriale esterna 4,5. Questa struttura rende particolarmente difficile l'isolamento dei mitocondri degli spermatozoi. Pertanto, la maggior parte degli studi sulla funzione mitocondriale degli spermatozoi utilizza analisi in situ o spermatozoi demembranati6.
La struttura e la funzione mitocondriale degli spermatozoi sono state costantemente collegate all'infertilità maschile 7,8,9,10,11, suggerendo che l'analisi della struttura e della funzione di questi organelli può essere un buon candidato per l'inclusione nell'analisi dello sperma.
I mitocondri svolgono un ruolo importante nel metabolismo energetico cellulare, in particolare utilizzando l'ossigeno per produrre adenosina trifosfato (ATP) attraverso la fosforilazione ossidativa (OXPHOS). Negli spermatozoi, in particolare, la fonte di ATP (glicolisi vs. OXPHOS) è controversa e molti dei dati rimangono controversi e dipendono da diversi approcci sperimentali 4,12,13. Le misurazioni della respirazione mediante ossimetria offrono informazioni significative sulla capacità respiratoria mitocondriale, sull'integrità mitocondriale e sul metabolismo energetico della cellula14,15,16. Tradizionalmente, questa tecnica è stata eseguita utilizzando l'elettrodo di ossigeno Clark, uno strumento che è stato utilizzato per misurare la respirazione mitocondriale per più di 50 anni17,18. Inoltre, il consumo di ossigeno mitocondriale degli spermatozoi è stato analizzato utilizzando il classico elettrodo di ossigeno Clark 19,20,21. La respirometria ad alta risoluzione (HRR) mediante ossigrafi (Oroboros) fornisce una sensibilità maggiore rispetto all'utilizzo di dispositivi di respirometria classici22. Gli ossigrafi sono composti da due camere con porte di iniezione e ogni camera ha un sensore di ossigeno polarografico. Con questa tecnica è possibile analizzare vetrini di tessuto, cellule e sospensioni mitocondriali isolate. Il campione viene continuamente agitato nella camera e, durante l'esperimento, viene misurato il consumo di ossigeno e i tassi di ossigeno vengono calcolati utilizzando un software specifico. Le camere mostrano una ridotta perdita di ossigeno, che è un vantaggio rispetto ai dispositivi convenzionali con elettrodi di ossigeno14,23.
Come per altre cellule, nel caso degli spermatozoi, la sensibilità dell'apparecchiatura HRR è superiore a quella della respirometria convenzionale, il che significa che l'apparecchiatura HRR può essere utilizzata per l'analisi di un numero limitato di spermatozoi intatti o permeabilizzati. Esistono due strategie principali per valutare la funzione mitocondriale degli spermatozoi mediante HRR: (a) misurare il consumo di ossigeno nelle cellule intatte, che comporta la riproduzione della funzione respiratoria in un mezzo contenente substrati come il glucosio, o (b) misurare il consumo di ossigeno nelle cellule permeabilizzate utilizzando uno dei complessi OXPHOS, con l'aggiunta di substrati specifici per monitorare ciascuna funzione separatamente.
Nel presente studio, descriviamo l'uso dell'HRR per determinare la respirazione mitocondriale negli spermatozoi umani.
Protocollo
Gli esperimenti sono stati approvati dal Comitato Etico della Facultad de Medicina de la Universidad de la República, Montevideo, Uruguay.
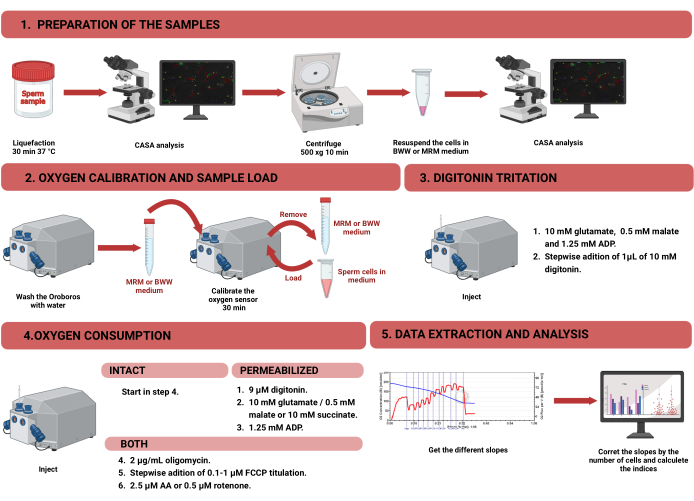
Figura 1: Flusso di lavoro per la respirometria ad alta risoluzione per valutare la funzione mitocondriale in spermatozoi umani intatti e permeabilizzati. Il protocollo è stato suddiviso in quattro diverse fasi: 1) preparazione del campione, 2) calibrazione dell'ossigeno nello strumento Oroboros, 3) misurazione del consumo di ossigeno per cellule intatte e permeabilizzate e 4) estrazione dei dati dall'apparecchiatura e analisi. Abbreviazioni: CASA = analisi dello sperma assistita da computer; BWW = Biggers Whitten Whittingham medio; MRM = mezzo di respirazione mitocondriale; ADP = adenosina difosfato; FCCP = cianuro di carbonile -p-trifluorometossifenilidrazone; AA = antimicina A. Fare clic qui per visualizzare una versione più grande di questa figura.
NOTA: Il flusso di lavoro per misurare il consumo di ossigeno negli spermatozoi utilizzando HRR è mostrato nella Figura 1. Le informazioni sui materiali, le attrezzature e i reagenti utilizzati nel protocollo sono presentate nell'Indice dei materiali.
1. Preparazione del campione
- Raccolta dei campioni
- Raccogliere lo sperma umano appena eiaculato mediante masturbazione dopo un'astinenza consigliata di 3 giorni in un contenitore di plastica sterile. Trasportare immediatamente i campioni in laboratorio.
- Incubare i campioni per 30-60 minuti a temperatura ambiente (RT) per liquefare completamente24.
- Dopo la liquefazione, conservare i campioni a 37 °C fino all'inizio dell'esperimento.
- Valutazione dello sperma con l'analisi dello sperma assistita da computer (CASA)
- Mescolare il campione e caricare 7 μL in una camera per il conteggio degli spermatozoi preriscaldata.
- Posizionare la camera sul tavolino preriscaldato (37 °C) di un microscopio a luce diretta.
- Aprire il software computerizzato per l'analisi dello sperma ed entrare nel modulo di motilità e concentrazione (cliccare su Mot).
- Selezionare la configurazione che corrisponde alle condizioni dello sperma umano.
NOTA: La configurazione deve essere adattata al tipo e alla profondità della camera, nonché alla specie campione e al sistema CASA. - Analizza in modo casuale 10 campi diversi per camera facendo clic sul pulsante Analizza .
- Fare clic su Risultati per ottenere la concentrazione e la motilità del campione.
- Preparazione delle cellule
NOTA: Se l'HRR non è calibrato, iniziare con i passaggi 2.1-2.2 prima di preparare le celle (passaggio 1.3). È importante misurare il consumo di ossigeno immediatamente quando gli spermatozoi vengono risospesi nel terreno.- Centrifugare i campioni a 400 x g per 10 minuti a RT.
- Rimuovere il plasma seminale e risospendere gli spermatozoi in 2 mL di Biggers Whitten Whittingham (BWW) per esperimenti con cellule intatte o mezzo di respirazione mitocondriale (MRM) per studi con cellule permeabilizzate. Le composizioni dei supporti sono riportate nella Tabella 1.
- Ripetere i passaggi descritti al punto 1.2 per gli studi sulla concentrazione degli spermatozoi.
2. Respirometria ad alta risoluzione: analisi OXPHOS
NOTA: HRR integra ossigrafi altamente sensibili (Oxygraph-2 K; Oroboros Instruments GmbH, Innsbruck, Austria) con software (DatLab, versione 4.2; Oroboros Instruments GmbH). I dati sperimentali vengono visualizzati come concentrazione di ossigeno in funzione del tempo (come pmol di O2/106 cellule·min−1) e come trasformazioni in tempo reale di questi dati, consentendo allo sperimentatore di monitorare la respirazione (consumo di ossigeno, flusso di ossigeno) di campioni biologici e biochimici mentre l'esperimento è ancora in corso. L'HRR può essere utilizzato per seguire la respirazione delle cellule vive e mobili, il che è particolarmente utile per gli spermatozoi, la cui motilità è associata alla qualità dello sperma e al potenziale di fertilità. Il laboratorio utilizza un HRR Oroboros Oxygraph2-k, Oroboros Instruments, con due camere. I passaggi descritti in questo protocollo devono essere eseguiti in modo indipendente per entrambe le camere da 2 mL.
- Preparazione dell'attrezzatura
- Accendere l'HRR e collegarlo al software di respirometria (DatLab) per l'acquisizione e l'analisi dei dati.
- Sostituire l'etanolo al 70% nella camera dell'ossigrafo con ddH2O. Agitare continuamente con l'ancoretta magnetica nella camera a 750 giri/min. Lasciare riposare per 10 minuti e successivamente aspirare la bidistillazione (dd) H2O.
- Lavare la camera tre volte con ddH2O per 5 minuti ogni volta.
NOTA: Questo passaggio è necessario per rimuovere l'etanolo rimanente dalle camere. Gli spermatozoi sono molto sensibili all'etanolo. La registrazione potrebbe essere compromessa se questo passaggio viene omesso.
- Calibrazione dei sensori di ossigeno
NOTA: La procedura di calibrazione varia leggermente a seconda dello strumento. Eseguire una calibrazione dell'aria del sensore polarografico di ossigeno come descritto dal produttore25. In questa sezione viene spiegato brevemente il protocollo di calibrazione.- Rimuovere il ddH 2 O e pipettare2mL dello stesso terreno utilizzato per la preparazione delle cellule nella camera. Posizionare i tappi, lasciando una bolla di ricambio d'aria.
NOTA: È importante conoscere il volume della camera per determinare l'esatto volume di fluido necessario. - Registrare i valori di calibrazione dell'ossigeno (fare clic su Layout > 01 Calibration Exp. Gr3-Temp) per monitorare le prestazioni della membrana del sensore agitando il fluido con l'ancoretta a 750 giri/min per almeno 30 minuti a 37 °C. Utilizzare le altre impostazioni come menzionato: guadagno per sensore: 2; tensione di polarizzazione: 800 mV; Intervallo di registrazione dei dati: 2,0 s.
NOTA: Si prevede di ottenere una pendenza di O 2 non corretta (linea rossa) entro ±2 pmol∙s−1∙mL−1 con un segnale stabile dal sensore polarografico. - Trascinare il mouse tenendo premuto il pulsante sinistro del mouse e il tasto Maiusc per selezionare un'area in cui la variazione della concentrazione di ossigeno (concentrazione di O2 Y1, linea blu) è stabile.
- Aprire la finestra Calibrazione O2 (fare clic su Oxygraph > Calibrazione O2). In Calibrazione aria, modificare il contrassegno selezionato nella regione selezionata al punto 2.2.3. Termina facendo clic su Calibra e copia negli appunti.
- Interrompi la registrazione e salva facendo clic su Oxygraph > Ok Control > Salva e Disconnetti.
NOTA: questo set di dati deve essere salvato in modo che possa essere utilizzato in tutti gli esperimenti del giorno. La calibrazione viene eseguita solo una volta al giorno per ciascun fluido.
- Rimuovere il ddH 2 O e pipettare2mL dello stesso terreno utilizzato per la preparazione delle cellule nella camera. Posizionare i tappi, lasciando una bolla di ricambio d'aria.
- Titolazione di permeabilizzazione della digitonina
- Aprire la camera e aspirare il fluido all'interno.
- Caricare nella camera almeno 24 x 10 6 e non più di 70 x 106 spermatozoi in un volume finale di 2 mL di MRM.
NOTA: È importante misurare il numero di cellule nella camera per regolare il consumo di ossigeno alla fine dell'esperimento. Non è possibile misurare un numero di celle inferiore a quello consigliato. - Chiudere la camera spingendo i tappi fino in fondo e aspirare il liquido rimanente nella parte superiore. Iniziare l'esperimento con le stesse impostazioni della calibrazione: velocità di agitazione: 750 giri/min; temperatura: 37 °C; guadagno per sensore: 2; tensione di polarizzazione: 800 mV; e intervallo di registrazione dei dati: 2,0 s.
- Per caricare la calibrazione, fare doppio clic sulla casella Pos Calib nell'angolo in basso. Aprire la calibrazione eseguita al punto 2.2 (fare clic su Oxygraph > O2 Calibration > Copy from File) e fare clic su Calibrate and Copy to Clipboard.
NOTA: La casella POS Calib cambierà da gialla a verde. I dati vengono visualizzati nei grafici del flusso di ossigeno corretto per volume (Layout 05 Flusso per volume non corretto). Diversi layout sono disponibili in Oxygraph > Layout. - Aggiungere 5 μL di adenosina difosfato 0,5 M (ADP), 10 μL di glutammato 2 M e 2,5 μL di malato 0,4 M (concentrazioni finali: 1,25 mM, 10 mM e 0,5 mM). Misurare il consumo di ossigeno fino a quando il segnale non si stabilizza.
NOTA: Le microsiringhe Hamilton di precisione vengono utilizzate per l'iniezione attraverso la porta di caricamento nel tappo. Utilizzare una siringa per farmaco per evitare la contaminazione incrociata. Fare clic su F4 per registrarsi e segnare nel registro dell'ossigeno quando viene aggiunto un trattamento.
NOTA: I substrati vengono preparati in acqua ultrapura e conservati a -20 °C per 3 mesi. - Tritate aggiungendo 1 μL di digitonina 10 mM in fasi successive fino a quando il consumo di ossigeno raggiunge un livello massimo.
NOTA: Un lavaggio accurato con acqua, etanolo al 70% ed etanolo al 100% è essenziale se la stessa camera viene utilizzata per due esperimenti nello stesso giorno.
NOTA: Digitonin viene preparato in acqua ultrapura e conservato a -20 °C per 3 mesi.
- Protocollo di valutazione respiratoria di routine per spermatozoi intatti e permeabilizzati (complesso I o complesso II)
- Aprire la camera e aspirare il fluido all'interno.
- Caricare nella camera almeno 24 x 10 6 e non più di 70 x 106 spermatozoi in un volume finale di 2 mL di BWW (analisi delle cellule intatte) o MRM (analisi delle cellule permeabilizzate).
- Iniziare l'esperimento con le stesse impostazioni della calibrazione (questo è descritto al punto 2.3.3).
- Caricare la calibrazione eseguita al punto 2.2 come descritto al punto 2.3.4.
- Registrare la respirazione delle cellule per almeno 5 minuti fino a quando non si ottiene un segnale stabile. Questa misurazione corrisponde alla respirazione basale nelle cellule intatte.
- Se l'esperimento è con cellule intatte, procedere al passaggio 2.4.9. Per le cellule permeabilizzate, iniettare 4,5 μL di digitonina 10 mM (concentrazione finale: 22,5 μM). Permeabilizzare le cellule per 5 min.
- Aggiungere i substrati: 10 μL di glutammato 2 M e 2,5 μL di malato 0,4 M (concentrazioni finali: 10 mM e 0,5 mM, rispettivamente) per il complesso I o 20 μL di succinato 1 M (concentrazione finale: 10 mM) per il complesso II. Misurare il consumo di ossigeno fino a quando il segnale non aumenta e si stabilizza. Questo è lo stato 4, che significa respirazione supportata dal complesso basale I o dal complesso basale II in assenza di ADP.
NOTA: I substrati vengono preparati in acqua ultrapura e conservati a -20 °C per 3 mesi. - Iniettare 5 μL di ADP 0,5 M (concentrazione finale: 1,25 mM). Misurare il consumo di ossigeno fino a quando il segnale non aumenta e si stabilizza. L'aggiunta di ADP aumenta il segnale corrispondente al massimo consumo di ossigeno attraverso il complesso I o il complesso II (stato 3, nelle cellule permeabilizzate).
- Aggiungere 1 μL di oligomicina 4 mg/mL (concentrazione finale: 2 μg/mL), un inibitore dell'ATP sintetasi. Misurare il consumo di ossigeno fino a quando il segnale diminuisce e si stabilizza.
NOTA: L'oligomicina viene preparata in etanolo e conservata a -20 °C per 3 mesi. - Titolare aggiungendo 1 μL di 0,1 mM a 1 mM di cianuro di carbonile-P-trifluorometossi-fenilidrazone (FCCP) in fasi successive fino a raggiungere una frequenza respiratoria massima disaccoppiata. Misurare il consumo di ossigeno fino a quando il segnale non aumenta e si stabilizza.
NOTA: FCCP viene preparato in etanolo e conservato a -20 °C per 3 mesi. - La concentrazione finale di FCCP dipende dal campione. Interrompere l'iniezione del farmaco quando il consumo di ossigeno inizia a diminuire.
- Infine, iniettare 1 μL di antimicina A 5 mM (concentrazione finale di 2,5 μM). Si tratta di un inibitore del complesso III per discriminare tra il consumo di ossigeno mitocondriale e quello residuo (respirazione non mitocondriale). Per l'analisi del complesso I, aggiungere 1 μL di rotenone 1 mM (concentrazione finale 0,5 μM), un inibitore di questo complesso, invece di AA. Misurare il consumo di ossigeno fino a quando il segnale diminuisce e si stabilizza.
NOTA: I farmaci sono preparati in etanolo e conservati a -20 °C per 3 mesi.
3. Estrazione e analisi dei dati
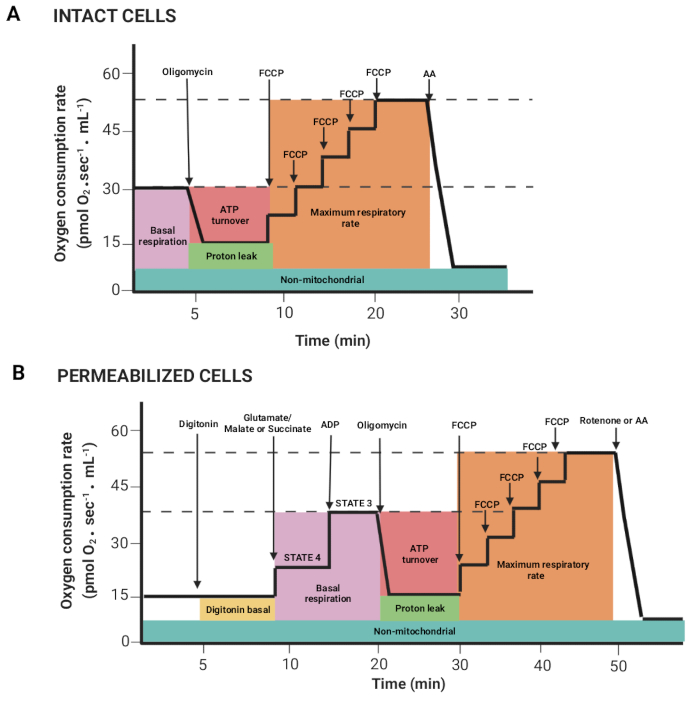
Figura 2: Acquisizione di parametri respiratori da un esperimento di respirometria ad alta risoluzione. (A,B) Rappresentazioni schematiche di grafici ottenuti, come descritto in Figura 1, rispettivamente per cellule intatte e permeabilizzate. Questi parametri sono stati descritti in precedenza15. Fare clic qui per visualizzare una versione più grande di questa figura.
- Trascinare il mouse premendo il tasto sinistro del mouse e il tasto Maiusc per selezionare le regioni in cui il flusso di ossigeno per volume correlato (Y2 O2 slope uncorr., linea rossa) è stabile dopo l'iniezione di un substrato o di un inibitore. La figura 2 mostra i diversi parametri ottenuti dal registro precedentemente descritto15.
NOTA: I parametri dipendono dall'esperimento; tutti sono i seguenti: respirazione basale in cellule intatte e respirazione in presenza di glutammato/malato o succinato (stato 4), ADP (stato 3), oligomicina (perdita di protoni), FCCP (frequenza respiratoria massima), rotenone/AA (respirazione non mitocondriale). Nelle cellule permeabilizzate, la respirazione basale corrisponde allo stato 3. - Fare clic sulle finestre Indicatori > statistiche ed esportare i dati.
- Normalizza i dati ottenuti per 1 milione di spermatozoi. Le unità dei pendii sono pmolO2·s−1·mL−1·10−6 cellule.
- Sottrarre il consumo di ossigeno non mitocondriale da tutti i valori prima di calcolare gli indici.
- Calcolare gli indici utilizzando le varie equazioni precedentemente descritte15:

Risultati
Determinazione della concentrazione ottimale di digitonina negli spermatozoi
In questo protocollo, presentiamo l'uso dell'HRR per monitorare in tempo reale i cambiamenti in OXPHOS negli spermatozoi umani. Poiché il metodo può essere utilizzato per analizzare spermatozoi intatti o permeabilizzati alle digitonine, presentiamo innanzitutto la standardizzazione della concentrazione di digitonina necessaria per permeabilizzare gli spermatozoi (Figura 3).
Discussione
L'HRR dipende in modo critico da diverse fasi: (a) la manutenzione dell'apparecchiatura, (b) la calibrazione accurata dei sensori di ossigeno, (c) la titolazione del disaccoppiatore26 e, infine, (d) l'uso adeguato degli indici che rappresentano la funzione mitocondriale. La manutenzione dell'attrezzatura è fondamentale. Si raccomanda di sostituire regolarmente le membrane del sensore polarografico di ossigeno e di correggere lo sfondo strumentale. Un lavaggio estensivo dopo il prelievo degli sper...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo la clinica di Andrologia Fertilab, in particolare José María Montes e Andrea Torrents, per averci permesso di accedere ai donatori. Finanziamento: A.C. è sostenuto da borse di studio dell'Universidad de la República (CSIC_2018, Espacio Interdisciplinario_2021). Ulteriori finanziamenti sono stati ottenuti dal Programa de Desarrollo de Ciencias Básicas (PEDECIBA, Uruguay). P.I. e R.S. sono sostenuti dall'Universidad de la República (I+D, CSIC 2014; I+D, CSIC 2016, Iniciación a la Investigación, CSIC 2019 e FMV_1_2017_1_136490 ANII- Uruguay). P.I. è supportato da POS_FMV_2018_1_1007814 e CAP-UDELAR 2020. Le figure sono state illustrate utilizzando Biorender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| Acid free- Bovine serum albumine | Sigma Aldrich | A8806 | |
| Adenosine 5'-diphosphate monopotassium salt dihydrate | Sigma Aldrich | A5285 | |
| Animycin A from streptomyces sp. | Sigma Aldrich | A8674 | |
| Calcium chloride | Sigma Aldrich | C4901 | |
| carbonyl cyanide-P- trifluoromethoxy-phenylhydrazone | Sigma Aldrich | C2920 | |
| DatLab sofware version 4,2 | Oroboros Instruments GmbH | N/A | |
| D-glucose | Sigma Aldrich | G7021 | |
| Digitonin | Sigma Aldrich | D141 | |
| EGTA | Sigma Aldrich | E4378 | |
| HEPES | Sigma Aldrich | H3375 | |
| L glutamic acid | Sigma Aldrich | G1251 | |
| L malic acid | Sigma Aldrich | M1000 | |
| Magnesium sulphate | Sigma Aldrich | M7506 | |
| Microliter Syringes | Hamilton | 87900 or 80400 | |
| Microscope camera | Basler | acA780-75gc | |
| Microscope Eclipse E200 with phase contrast 10X Ph+ | Nikon | N/A | |
| Monopotassium phosphate | Sigma Aldrich | P5655 | |
| MOPS | Sigma Aldrich | M1254 | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Oxygraph-2 K | Oroboros Instruments GmbH | N/A | |
| Potassium chloride | Sigma Aldrich | P3911 | |
| Power O2k-Respirometer | Oroboros Intruments | 10033-01 | |
| Rotenone | Sigma Aldrich | R8875 | |
| Saccharose | Sigma Aldrich | S0389 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium lactate | Sigma Aldrich | L7022 | |
| Sodium pyruvate | Sigma Aldrich | P2256 | |
| Sperm class analyzer 6.3.0.59 Evolution-SCA Research | Microptic | N/A | |
| Sperm Counting Chamber DRM-600 | Millennium Sciences CELL-VU | N/A | |
| Succinate disodium salt | Sigma Aldrich | W327700 |
Riferimenti
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13, 37 (2015).
- Guzick, D. S., et al. Sperm morphology, motility, and concentration in fertile and infertile men. The New England Journal of Medicine. 345 (19), 1388-1393 (2001).
- Wang, C., Swerdloff, R. S. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertility and Sterility. 102 (6), 1502-1507 (2014).
- Amaral, A. Energy metabolism in mammalian sperm motility. WIREs Mechanisms of Disease. 14 (5), e1569 (2022).
- Leung, M. R., et al. In-cell structures of conserved supramolecular protein arrays at the mitochondria-cytoskeleton interface in mammalian sperm. Proceedings of the National Academy of Sciences of the United States of America. 118 (45), e2110996118 (2021).
- Moraes, C. R., Meyers, S. The sperm mitochondrion: Organelle of many functions. Animal Reproduction Science. 194, 71-80 (2018).
- Cassina, A., et al. Defective human sperm cells are associated with mitochondrial dysfunction and oxidant production. Biology of Reproduction. 93 (5), 119 (2015).
- Marchetti, C., Obert, G., Deffosez, A., Formstecher, P., Marchetti, P. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm. Human Reproduction. 17 (5), 1257-1265 (2002).
- Amaral, A., Lourenço, B., Marques, M., Ramalho-Santos, J. Mitochondria functionality and sperm quality. Reproduction. 146 (5), R163-R174 (2013).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), e13666 (2021).
- Uribe, P., et al. Use of the fluorescent dye tetramethylrhodamine methyl ester perchlorate for mitochondrial membrane potential assessment in human spermatozoa. Andrologia. 49 (9), e12753 (2017).
- Storey, B. T. Mammalian sperm metabolism: Oxygen and sugar, friend and foe. The International Journal of Developmental Biology. 52 (5-6), 427-437 (2008).
- Tourmente, M., Sansegundo, E., Rial, E., Roldan, E. R. S. Capacitation promotes a shift in energy metabolism in murine sperm. Frontiers in Cell and Developmental Biology. 10, 950979 (2022).
- Gnaiger, E., Dykens, J. A., Will, Y. Chapter 12 - Polarographic oxygen sensors, the oxygraph, and high-resolution respirometry to assess mitochondrial function. Drug-Induced Mitochondrial Dysfunction. , 325-352 (2008).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Awadhpersad, R., Jackson, C. B. High-resolution respirometry to assess bioenergetics in cells and tissues using chamber- and plate-based respirometers. Journal of Visualized Experiments: JoVE. (176), e63000 (2021).
- Chance, B., Williams, G. R. A simple and rapid assay of oxidative phosphorylation. Nature. 175 (4469), 1120-1121 (1955).
- Li, Z., Graham, B. H. Measurement of mitochondrial oxygen consumption using a Clark electrode. Methods in Molecular Biology. 837, 63-72 (2012).
- Stendardi, A., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. International Journal of Andrology. 34 (3), 247-255 (2011).
- Ferramosca, A., Focarelli, R., Piomboni, P., Coppola, L., Zara, V. Oxygen uptake by mitochondria in demembranated human spermatozoa: A reliable tool for the evaluation of sperm respiratory efficiency. International Journal of Andrology. 31 (3), 337-345 (2008).
- Ferramosca, A., et al. Modulation of human sperm mitochondrial respiration efficiency by plant polyphenols. Antioxidants. 10 (2), 217 (2021).
- Gnaiger, E., Steinlechner-Maran, R., Méndez, G., Eberl, T., Margreiter, R. Control of mitochondrial and cellular respiration by oxygen. Journal of Bioenergetics and Biomembranes. 27 (6), 583-596 (1995).
- . O2k Quality Control 1: Polarographic oxygen sensors and accuracy of calibration Available from: https://www.bioblst.at/images/archive/7/77/20210819114548%21MiPNet06.03_POS-Calibration-SOP.pdf (2020)
- WHO Laboratory Manual for the Examination and Processing of Human Semen. World Health Organization Available from: https://www.who.int/publications/i/item/9789240030787 (2010)
- . O2k-protocols SOP: O2k quality control 1 Available from: https://www.bioblast.at/images/9/9c/MiPNet06.03_POS-Calibration-SOP_DatLab8.pdf (2021)
- Gnaiger, E. . Mitochondrial Pathways and Respiratory Control. , (2012).
- Steinlechner-Maran, R., Eberl, T., Kunc, M., Margreiter, R., Gnaiger, E. Oxygen dependence of respiration in coupled and uncoupled endothelial cells. The American Journal of Physiology. 271, C2053-C2061 (1996).
- Holt, W. V., Van Look, K. J. W. Concepts in sperm heterogeneity, sperm selection and sperm competition as biological foundations for laboratory tests of semen quality. Reproduction. 127 (5), 527-535 (2004).
- Sousa, A. P., et al. Not all sperm are equal: Functional mitochondria characterize a subpopulation of human sperm with better fertilization potential. PloS One. 6 (3), e18112 (2011).
- Moscatelli, N., et al. Single-cell-based evaluation of sperm progressive motility via fluorescent assessment of mitochondria membrane potential. Scientific Reports. 7, 17931 (2017).
- Ferreira, J. J., et al. Increased mitochondrial activity upon CatSper channel activation is required for mouse sperm capacitation. Redox Biology. 48, 102176 (2021).
- Irigoyen, P., et al. Mitochondrial metabolism determines the functional status of human sperm and correlates with semen parameters. Frontiers in Cell and Developmental Biology. 10, 926684 (2022).
Erratum
Formal Correction: Erratum: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa
Posted by JoVE Editors on 9/26/2023. Citeable Link.
An erratum was issued for: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa. The Protocol and Representative Result sections were updated.
Step 2.4.12 of the Protocol was updated from:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex II inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
to:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex III inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
Figure 3 in the Representative Results section was updated from:
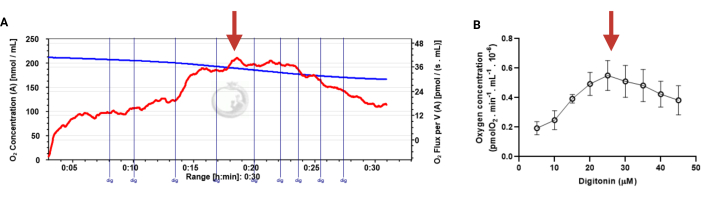
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
to:
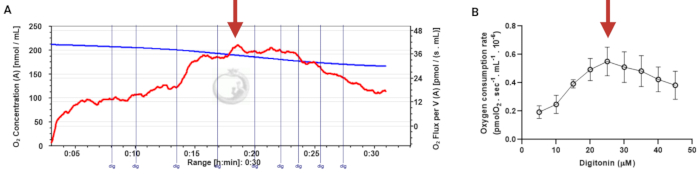
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon