Punteggio dell'infiammazione del sistema nervoso centrale, della demielinizzazione e della lesione assonale nell'encefalomielite autoimmune sperimentale
In questo articolo
Riepilogo
L'encefalomielite autoimmune sperimentale (EAE) funge da modello animale di sclerosi multipla. Questo articolo descrive un approccio per valutare l'infiammazione del midollo spinale, la demielinizzazione e la lesione assonale nell'EAE. Inoltre, viene presentato un metodo per quantificare i livelli di luce solubile dei neurofilamenti nel siero dei topi, facilitando la valutazione del danno assonale nei topi vivi.
Abstract
L'encefalomielite autoimmune sperimentale (EAE) è un modello immunologico comune di sclerosi multipla (SM). Questa malattia può essere indotta nei roditori dall'immunizzazione attiva con componenti proteiche della guaina mielinica e dell'adiuvante di Freund completo (CFA) o dal trasferimento di cellule T effettrici specifiche della mielina da roditori innescati con proteina mielinica/CFA in roditori naïve. La gravità dell'EAE è in genere valutata su una scala clinica a 5 punti che misura il grado di paralisi ascendente, ma questa scala non è ottimale per valutare l'entità del recupero dall'EAE. Ad esempio, i punteggi clinici rimangono elevati in alcuni modelli di EAE (ad esempio, il modello di EAE indotto dal peptide della glicoproteina oligodendrocitaria mielinica [MOG]) nonostante la risoluzione dell'infiammazione. Pertanto, è importante integrare il punteggio clinico con il punteggio istologico dell'EAE, che fornisce anche un mezzo per studiare i meccanismi alla base del danno cellulare nel sistema nervoso centrale (SNC).
Qui, viene presentato un semplice protocollo per preparare e colorare il midollo spinale e le sezioni cerebrali dei topi e per valutare l'infiammazione, la demielinizzazione e la lesione assonale nel midollo spinale. Il metodo per valutare l'infiltrazione leucocitaria nel midollo spinale può essere applicato anche per valutare l'infiammazione cerebrale nell'EAE. Viene inoltre descritto un protocollo per misurare la luce del neurofilamento solubile (sNF-L) nel siero dei topi utilizzando un test SIMOA (Small Molecule Assay), che fornisce un feedback sull'entità della lesione complessiva del SNC nei topi vivi.
Introduzione
L'encefalomielite autoimmune sperimentale (EAE) è il modello murino più comune per la malattia demielinizzante umana, la sclerosi multipla (SM)1. La patologia infiammatoria classica della SM, che include l'infiltrazione di cellule helper T produttrici di IFN-γ (gamma) e IL-172, l'infiltrazione di monociti infiammatori3, la formazione di lesioni demielinizzanti infiammatorie perivascolari e sub-meningee4 e l'insorgenza di lesioni assonali4 nel sistema nervoso centrale (SNC), è osservata anche in EAE 5,6,7,8,9 . La somiglianza nei meccanismi immunitari tra EAE e SM ha reso EAE un modello preclinico adatto per testare l'efficacia e i meccanismi d'azione di una serie di terapie immunologiche approvate per la SM, tra cui natalizumab, fingolimod, dimetilfumarato e glatiramer acetato (rivisto in 1,5). Alcuni regimi EAE modellano altri aspetti della patologia progressiva della SM oltre al danno assonale, tra cui lo sviluppo di infiammazione sub-meningea nel cervello, demielinizzazione cronica, atrofia del midollo spinale, sinapsi e perdita di neuroni 6,10,11,12. Pertanto, l'EAE ha un'utilità per lo screening dell'efficacia delle terapie neuroprotettive per la SM.
L'EAE è indotta nei roditori in diversi modi. L'immunizzazione attiva è il metodo di induzione più comune e prevede l'immunizzazione dei roditori con antigeni mielinici (proteine intere o peptidi) emulsionati in CFA integrati con Mycobacterium tuberculosis13 ucciso dal calore. A seconda del ceppo di topo, la tossina della pertosse (PTX) viene somministrata anche il giorno 0 e il giorno 2 dell'immunizzazione per aumentare la penetranza della malattia13. L'EAE può anche essere indotta trasferendo adottivamente cellule T specifiche per la mielina ottenute da topi innescati da mielina/CFA in topi sani14 o può svilupparsi spontaneamente in topi che sovraesprimono i recettori delle cellule T specifici per i principali antigeni della mielina5.
La gravità e la progressione della malattia EAE sono comunemente valutate utilizzando una scala clinica discreta a 5 punti: 1 – zoppia della coda, 2 – debolezza degli arti posteriori o del piede, 3 – paralisi completa in uno o entrambi gli arti posteriori, 4 – debolezza degli arti anteriori, 5 – moribondo o morto13. Questo sistema di punteggio clinico è valido nel documentare la progressione della paralisi ascendente che si verifica all'esordio della malattia, ma è meno sensibile nel catturare l'entità del recupero dagli attacchi infiammatori del SNC. Ad esempio, sia ai topi che deambulano con difficoltà che ai topi che deambulano facilmente ma mostrano debolezza nell'afferrare i piedi viene assegnato un punteggio di 2 sulla scala EAE. I punteggi possono rimanere elevati nella fase post-acuta dell'EAE a causa della presenza di lesioni o perdite assoniche permanenti, anche nonostante la risoluzione della risposta infiammatoria9. Ci sono stati una serie di tentativi di sviluppare sistemi di punteggio più raffinati, test comportamentali, misure della forza degli arti posteriori e della presa e sistemi di monitoraggio a infrarossi per catturare meglio le differenze nei deficit clinici in EAE 9,16,17,18; Tuttavia, queste misure di punteggio più complesse non distinguono il contributo dell'infiammazione rispetto al danno tissutale ai deficit neurologici sottostanti. Pertanto, l'approccio gold standard per valutare la gravità dell'EAE è quello di condurre un punteggio sia clinico che istologico.
Qui, viene descritto un protocollo su come sezionare e incorporare campioni di midollo spinale e cervello di topo in paraffina in modo da catturare il processo stocastico di formazione della lesione che si verifica nell'EAE. Viene anche presentato un protocollo su come colorare le sezioni con Luxol fast blue (LFB), originariamente creato da Kluver e Barrera19, che rileva la mielina nel SNC. Le sezioni sono colorate con il solo LFB (per l'analisi della demielinizzazione) o sono controcolorate con ematossilina ed eosina (H&E) per aiutare a visualizzare e valutare le lesioni infiammatorie. Vengono inoltre forniti protocolli per quantificare la presenza di leucociti totali (CD45), la perdita di mielina e il numero di assoni danneggiati (SMI-32) nel midollo spinale utilizzando anticorpi disponibili in commercio, tecniche immunoistochimiche (IHC) e software accessibili al pubblico. Il protocollo utilizzato per quantificare i leucociti nel midollo spinale può essere applicato anche per quantificare i leucociti nel cervello.
La valutazione istologica della perdita assonale e della lesione nel cervello è relativamente più difficile che nel midollo spinale poiché i tratti di sostanza bianca cerebrale non corrono parallelamente l'uno all'altro. La misurazione della luce del neurofilamento sierico (sNF-L) è emersa come un promettente biomarcatore per il danno neuronale nella SM20,21. Studi recenti hanno esteso questa tecnologia all'EAE 22,23,24. Qui, viene presentato un metodo per misurare la luce del neurofilamento sierico (sNF-L) nei topi viventi utilizzando un test SIMOA (Small Molecule Assay). Questo metodo richiede solo una piccola quantità di siero e può essere eseguito su topi vivi in appena mezza giornata, fornendo un rapido feedback su come una terapia testata sta influenzando la lesione complessiva del sistema nervoso centrale. Tutti i metodi qui descritti possono essere applicati a topi di qualsiasi sesso o ceppo.
Protocollo
Tutti gli esperimenti condotti con i topi sono stati eseguiti secondo i protocolli di utilizzo degli animali approvati dall'Unity Health Toronto Animal Care Committee, seguendo le linee guida stabilite dal Canadian Council on Animal Care. Assicurarsi di indossare un camice da laboratorio, guanti protettivi e occhiali durante le procedure di laboratorio.
1. Prelievo e fissaggio del cervello e del midollo spinale
- Sopprimere il topo secondo le politiche istituzionali. Sdraiare il topo prono su un tavolo da dissezione e decapitare con le forbici chirurgiche (tagliando verso il basso).
- Usando la pinza Adson (in mano non dominante), afferra la pelle sulla parte superiore della testa del topo. Quindi praticare un'incisione di 2,5 cm nella pelle sulla parte superiore della testa usando le forbici chirurgiche.
- Usa le dita per spingere lateralmente la pelle della testa per visualizzare il cranio sottostante.
- Stabilizza la testa del topo afferrando le orbite degli occhi con le pinze Adson standard.
- Usando delle forbici sottili (mano dominante), fai dei piccoli tagli nel cranio lungo la linea mediana dalla colonna cervicale ai bulbi olfattivi.
NOTA: Incorporare solo pochi millimetri di punte di forbice sotto il cranio alla volta per evitare di danneggiare il cervello sottostante. - Usa la pinza Adson con i denti per riflettere il cranio lateralmente per rivelare il cervello sottostante.
- Tenere la testa con la mano non dominante. Tenendo le forbici chiuse (mano dominante), estrarre il midollo spinale dal rachide cervicale e spingere delicatamente il cervello fuori dal cranio, tagliando i nervi cranici.
- Mettere il cervello in una provetta conica contenente 10 ml di formalina tamponata neutra al 10% etichettata con l'ID dell'animale.
- Incidi il pelo lungo la linea mediana del busto del topo dal collo alla coda.
- Usa le dita per spingere la pelle lateralmente per visualizzare la colonna vertebrale.
- Usando le forbici chirurgiche, taglia verso il basso attraverso la colonna vertebrale all'altezza in cui i femori si attaccano all'anca.
- Usa le forbici chirurgiche per tagliare la parete del corpo su ciascun lato della colonna vertebrale dall'anca al collo. Taglia via tutti gli organi attaccati.
- Metti la colonna vertebrale contenente il midollo spinale nello stesso tubo di formalina che contiene il cervello. Lascia che il cervello e la colonna vertebrale si fissino per 5-7 giorni.
NOTA: La tempistica della fissazione è importante. Alcuni anticorpi non funzionano se il tessuto è fissato in modo eccessivo. Se il tessuto è sottofissato, è difficile estrudere il midollo spinale dalla colonna vertebrale nella fase 2.
2. Macroscopia ed elaborazione del midollo spinale e del cervello
NOTA: I seguenti passaggi si svolgono in una cappa aspirante. Prima di iniziare, preparare 2 piastre di Petri pulite da 10 cm, un pallone di Erlenmeyer dotato di un imbuto rivestito di carta da filtro, due bisturi (uno per tagliare l'osso e uno per tagliare i tessuti del SNC), carta per lenti, una matita, cassette per inclusione e barattoli di campioni preriempiti con formalina al 10%.
- Usando le forbici, taglia un piccolo pezzo di carta per lenti (della stessa larghezza ma del doppio della lunghezza della cassetta) e mettilo in una capsula di Petri.
- Etichettare una cassetta di plastica con l'ID del campione usando una matita.
- Versare il tubo contenente il cervello e la colonna vertebrale fissi nell'imbuto. Trasferisci la colonna vertebrale e il cervello nella capsula di Petri vuota.
NOTA: La formalina usata filtra nel pallone di Erlenmeyer e può essere riutilizzata al punto 2.13. - Dividi grossolanamente il cervello in sei pezzi coronali usando un bisturi. Fai un taglio caudale al cervelletto, uno al centro del cervelletto, uno appena rostrale al cervelletto e due tagli nel cervello rostrale rimanente, creando 3 fette coronali aggiuntive di uguale spessore.
- Usando una pinza, trasferisci i campioni di cervello su una metà della carta della lente nella capsula di Petri.
- Taglia il midollo spinale in tre pezzi usando il bisturi: il primo taglio viene praticato nella parte inferiore della gabbia toracica e il secondo taglio viene eseguito appena sotto la curvatura del rachide cervicale.
- Usando lo stesso bisturi, tagliare il pezzo di colonna vertebrale sacrale all'estremità caudale fino a quando il midollo spinale non può essere visualizzato.
- Prendi la colonna vertebrale toracica (mano non dominante). Tenere la pinza Adson con i denti ben chiusi (mano dominante) e spingere delicatamente l'estremità della pinza nell'apertura più piccola della colonna vertebrale con un leggero movimento di torsione. Il cavo dovrebbe fuoriuscire dall'altra estremità.
NOTE: Qualsiasi strumento con estremità arrotondata delle dimensioni del midollo spinale funzionerà per questo scopo. Se il midollo spinale non fuoriesce naturalmente, non forzarlo. Invece, usa delle forbici sottili per tagliare le ossa lungo il lato della colonna vertebrale e aprirle per rivelare il midollo spinale. In alternativa, fissare il midollo spinale e il cervello per qualche giorno in più in formalina; Tuttavia, lo stesso tempo di fissazione dovrebbe essere applicato a tutti i campioni per evitare di introdurre variabilità nella colorazione degli anticorpi. - Prendi la pinza Adson standard (mano dominante). Sempre tenendo il pezzo di midollo spinale con la mano meno dominante, usa una pinza per estrarre delicatamente il midollo emergente dalla colonna. Posizionare il pezzo di midollo spinale nella capsula di Petri contenente la carta per lenti.
- Ripeti questo processo per i pezzi della colonna lombare/sacrale e cervicale.
- Dividere i tre pezzi del midollo spinale (cervicale, toracico, lombare/sacrale) in sezioni trasversali più piccole usando un bisturi. Taglia almeno 15 segmenti, ognuno dei quali deve avere uno spessore inferiore a 2 mm.
NOTA: Assicurarsi che i segmenti siano più corti che larghi, in modo che le sezioni cadano più facilmente in sezione trasversale durante il processo di incorporamento nel passaggio 3. - Disporre i pezzi del midollo spinale sulla stessa metà della carta delle lenti contenente i pezzi di cervello. Piega la carta per lenti per inserire i pezzi di fazzoletto e mettili nella cassetta etichettata.
NOTA: La carta dell'obiettivo impedisce a piccoli pezzi di tessuto di fuoriuscire dalla cassetta durante l'elaborazione. - Trasferire la cassetta in un barattolo contenente formalina riciclata o fresca.
- Ripetere i passaggi da 2.1 a 2.13 per i campioni rimanenti.
- Dopo 5-7 giorni dalla fissazione, trasferire le cassette dal contenitore dei campioni nel primo bagno di formalina nel processatore automatico di tessuti (vedere la tabella dei materiali). Eseguire il processatore di tessuti durante la notte secondo il programma descritto nella Tabella supplementare 1. I campioni vengono tenuti in cera di paraffina calda fino all'inclusione.
3. Inclusione e taglio di sezioni cerebrali e del midollo spinale
- Trasferire le cassette dal processore alla camera di mantenimento calda della stazione di inclusione della paraffina (vedere la tabella dei materiali).
- Incorporare le sezioni trasversali del midollo spinale e del cervello di ciascun topo in un singolo blocco di paraffina come segue (Figura 1):
- Per prima cosa, versa la cera di paraffina solo per coprire il fondo dello stampo. Usando una pinza fine, posizionare i pezzi della sezione trasversale coronale e del midollo spinale del cervello nella paraffina sul fondo dello stampo.
- Trasferire lo stampo sulla superficie di raffreddamento per alcuni secondi per fissare i pezzi del cervello e del midollo spinale in posizione. Riportare lo stampo sulla superficie riscaldata e riempirlo fino all'orlo con paraffina calda.
- Posizionare il coperchio della cassetta (etichettato con l'ID del campione) sopra lo stampo. Versare altra paraffina sopra il coperchio della cassetta. Trasferire lo stampo nella stazione di raffreddamento per consentire alla cera di solidificarsi (raffreddare per 30-60 minuti).
NOTA: L'inclusione di sezioni del midollo spinale richiede pratica. Per migliorare il successo, utilizzare lunghezze più corte del midollo spinale (<2 mm) poiché è più probabile che cadano in sezione trasversale. Le lenti oculari chirurgiche possono essere indossate per aiutare a distinguere se i pezzi del midollo spinale sono in sezione trasversale. - Montare il blocco di paraffina sul microtomo rotante. Tagliare il blocco fino a quando i tessuti di interesse non compaiono nella sezione della paraffina.
- Tagliare nastri di 5 μM di sezioni di ciascun blocco e trasferirli a bagnomaria a 42 °C.
- Raccogli le sezioni sui vetrini e posizionali in una rastrelliera di vetro.
- Cuocere le fette a 37 °C in forno asciutto per una notte. Raffreddare i vetrini prima di procedere alla colorazione.
4. De-paraffinazione e reidratazione delle sezioni in preparazione alla colorazione
NOTA: I passaggi vengono eseguiti in una cappa aspirante. Prima di iniziare, preparare bagni di solventi. Preparare 5 L di 1x PBS (1 L ddH2O, 8 g NaCl, 0,2 g KCl, 1,44 g Na2HPO4, 0,24 g KH2PO4; pH = 7,4) con 0,05% Tween-20 (PBS-T) per tutte le fasi di lavaggio.
- De-paraffinizzare ponendo i vetrini in due bagni consecutivi di xilene o di un solvente non a base di xilene su uno shaker per 5 minuti ciascuno con una leggera agitazione.
- Reidratare i tessuti trasferendo i vetrini attraverso bagni successivi di percentuali decrescenti di etanolo: 2 x etanolo al 100% (5 minuti ciascuno), 2 x etanolo al 95% (3 minuti ciascuno) e 1 x etanolo al 70% (3 minuti). Tenere in etanolo al 95% per la colorazione LFB e reidratare al 70% di etanolo e tenere in PBS-T per l'immunoistochimica (IHC).
5. LFB per la mielina con H&E
- Preparare una soluzione di LFB allo 0,1% (0,2 g LFB, vedi tabella dei materiali, 200 mL di etanolo al 95%, 0,5 mL di acido acetico glaciale). Mescolare e filtrare in un pallone di Erlenmeyer. Conservare in flacone scuro fino al momento dell'uso.
- Trasferire le sezioni di etanolo al 95% in una griglia per vetrini che viene posizionata in un piatto di colorazione contenente LFB. Coprire il piatto e sigillare con pellicola di paraffina per evitare l'evaporazione.
- Incubare le sezioni a 56 °C in forno per una notte (massimo 16 h).
- La mattina seguente, trasferire i vetrini in un bagno ddH2O e mantenere.
- Nel frattempo, preparare (1) una soluzione fresca di carbonato di litio allo 0,05% (0,05 g di carbonato di litio, 100 mL ddH2O); (2) Soluzione di eosina Y (aggiungere 2 g di sale di eosina a 40 mL ddH20 e mescolare fino a scioglimento e quindi mescolare con 160 mL di etanolo al 95%).
- Preparare i seguenti bagni: 1 x carbonato di litio, 3 x 70% etanolo, 3 x 95% etanolo, 2 x 100% etanolo, 3 x ddH20. Posizionare i bagni in ordine di utilizzo (vedere la Tabella supplementare 2).
- Seguire i passaggi descritti nella Tabella supplementare 2.
- Dopo che i vetrini sono asciutti, visualizzare le lesioni demielinizzanti al microscopio.
6. LFB per la mielina senza H&E
- Eseguire questa procedura di colorazione per l'analisi della mielina.
NOTA: La procedura è identica al punto 5 (vedere la Tabella Suppletiva 2), ma ha un flusso di lavoro abbreviato. Dopo il passaggio 4, continuare la procedura iniziando dal passaggio 10.
7. Recupero dell'antigene e spegnimento della perossidasi per colorazioni immunoistochimiche (IHC)
NOTA: Prima di iniziare, preparare 100 mL di perossido di idrogeno in metanolo (1 parte di soluzione di perossido di idrogeno al 30% in 9 parti di metanolo al 100%, in una cappa aspirante). Preparare 1 L di tampone citrato da 10 mM con Tween-20 (2,94 g di citrato trisodico, sciolto in 1 L di ddH20 in un becher su piastra di agitazione, portare il pH a 6,0 e aggiungere 500 μl di Tween-20). Preparare PBS-T (vedere il passaggio 4). Tutti i lavaggi vengono eseguiti in bagni di PBS-T con leggera agitazione (su uno shaker) se non diversamente indicato.
- Estinguere la perossidasi endogena ponendo vetrini in perossido di idrogeno al 3% in metanolo per 15 minuti (in cappa aspirante). Lavare i vetrini due volte in PBS-T (2 minuti ciascuno).
- Trasferire i vetrini in un supporto per vetrini di metallo e metterli in 1 L di tampone citrato in una pentola a pressione. Sigillare il coperchio e aggiungere un tappo di gomma sulla parte superiore dello sfiato di fuoriuscita del vapore.
- Cuocere alla massima potenza nel microonde fino a quando non si apre la linguetta gialla sulla pentola a pressione, che indica che è stata raggiunta la pressione massima. Cuocere per altri 5 minuti alla massima pressione, quindi rimuovere la pentola a pressione dal microonde utilizzando guanti protettivi.
- Depressurizzare rimuovendo il tappo. Rimuovere il coperchio e lasciare raffreddare i vetrini nel tampone citrato per 20 minuti, quindi procedere con il metodo di colorazione desiderato.
ATTENZIONE: Fare un passo indietro quando si rilascia il vapore in quanto può causare ustioni.
8. Immunoistochimica CD45
NOTA: Questo metodo IHC viene utilizzato per visualizzare i leucociti infiltranti. Le fasi di blocco dell'avidina/biotina sono combinate con le fasi di blocco e di incubazione degli anticorpi primari.
- Preparare il tampone bloccante (2% BSA, 2% siero di coniglio in 1x PBS).
- Trasferire i vetrini sul vassoio di vetro e lavare due volte con PBS-T (2 minuti ciascuno). Preparare la soluzione di avidina/bloccante (4 gocce/mL di avidina in 2% BSA/2% siero di coniglio in 1 x PBS, vedere la tabella dei materiali).
- Asciugare il PBS-T in eccesso intorno al tessuto utilizzando una carta velina da laboratorio. Usando una penna idrofoba, disegna un cerchio attorno al tessuto e posiziona il vetrino nella camera umida.
- Applicare la soluzione di avidina/bloccante su ciascuna sezione (400 μL/vetrino).
- Coprire la camera umida e incubare per 30 minuti a temperatura ambiente. Durante questa fase, preparare l'anticorpo anti-CD45 (Tabella supplementare 3) in tampone bloccante contenente biotina (4 gocce/mL di biotina, 2% BSA/2% siero di coniglio in 1x PBS).
- Picchiettare la soluzione bloccante dal farla scorrere su una salvietta da laboratorio priva di lanugine. Tamponare intorno al tessuto con una salvietta da laboratorio per rimuovere il liquido in eccesso.
- Riposizionare il vetrino in una camera umida. Aggiungere 400 μL di soluzione di anticorpi CD45 (vedere Tabella dei materiali) nella sezione. Incubare per una notte a 4 °C in una camera umida coperta.
- Il giorno successivo, drenare l'anticorpo primario e lavare i vetrini 3 volte in PBS-T (5 minuti ciascuno).
- Asciugare l'area intorno alla sezione utilizzando un laboratorio privo di lanugine e quindi aggiungere 400 μL di anticorpo secondario (diluizione 1:200 in tampone bloccante) su ciascuna sezione. Incubare a temperatura ambiente per 1 h.
- Nel frattempo, preparare il reagente ABC (vedere la tabella dei materiali) aggiungendo 2 gocce di reagente A a 5 mL di PBS 1x e mescolare. Aggiungere 2 gocce di reagente B alla stessa soluzione e mescolare (preparare ~30 minuti prima dell'uso).
- Lavare i vetrini in 3 cambi di 1x PBS-T (5 minuti ciascuno) e posizionare i vetrini in una camera umida.
- Aggiungere 400 μL di reagente ABC alle sezioni. Coprire la camera umida e incubare per 30 minuti a temperatura ambiente.
- Lavare i vetrini in 3 cambi di 1x PBS-T (5 min ciascuno). Nel frattempo, preparare una quantità adeguata di soluzione DAB in una provetta da centrifuga da 15 mL ricoperta di pellicola secondo le istruzioni del produttore (vedere la tabella dei materiali).
- Prendi un vetrino e metti a fuoco una sezione del midollo spinale al microscopio. Aggiungere 400 μL di DAB al vetrino e avviare il timer di laboratorio.
- Visualizza la sezione mentre si sta sviluppando e arresta il timer quando i leucociti sono marroni. Trasferire il vetrino in un bagno ddH20 per arrestare la reazione. Tenere in acqua per 5 min. Lo stesso tempo di sviluppo viene utilizzato per le restanti diapositive.
ATTENZIONE: Il DAB è cancerogeno. Smaltire i rifiuti DAB e i rifiuti post-DAB ddH2O come rifiuti pericolosi. - Countertain slides con ematossilina di Mayer per ~4-10 min (vedere Tabella supplementare 2). Sciacquare i vetrini sotto l'acqua corrente del rubinetto per 10 min.
- Disidratare in etanolo al 95% (1 x 3 min), seguito da etanolo assoluto al 100% (2 x 3 min ciascuno).
- Spostandosi in una cappa aspirante, trasferire i vetrini in xilene o in un solvente sostitutivo dello xilene per 5 minuti. Coprioggetti con il mezzo di montaggio e lasciare asciugare i vetrini per 1-2 giorni nella cappa aspirante.
ATTENZIONE: Se si utilizza lo xilene, utilizzare doppi guanti e pinze per maneggiare i vetrini durante il vetrino, poiché è tossico e può dissolvere i guanti. - Pulisci i vetrini con xilene ed esegui la scansione con uno scanner per vetrini con un ingrandimento di 20x.
9. SMI-32 IHC per danni assonali
NOTA: Questo protocollo utilizza un anticorpo SMI-32 di topo, che reagisce contro il neurofilamento pesante non fosforilato, che può accumularsi negli assoni danneggiati25. Poiché questo anticorpo è stato allevato nel topo e rileva un antigene di topo, si consiglia di utilizzare un kit Mouse on Mouse (MOM). In questa procedura, la fase di blocco dell'avidina/biotina viene eseguita come fase separata dall'incubazione dell'anticorpo primario. Prima di iniziare questo protocollo, de-paraffinare, reidratare, estinguere l'attività della perossidasi endogena ed eseguire il recupero dell'antigene come descritto nei passaggi 4 e 7.
- Lavare due volte le sezioni con 2 PBS-T (2 minuti ciascuna). Rimuovere il liquido in eccesso intorno alle sezioni utilizzando un fazzoletto di laboratorio e disegnare un cerchio attorno ai tessuti utilizzando una penna idrofoba.
- Aggiungere 400 μL di tampone bloccante (2% (p/v) di siero di capra in 1x PBS-T) con avidina (4 gocce/mL) alle sezioni. Incubare per 15 minuti a temperatura ambiente.
- Immergere i vetrini due volte in 1x PBS-T. Aggiungere 400 μL di tampone bloccante con biotina (4 gocce/mL) al vetrino e incubare per 15 minuti a temperatura ambiente.
- Lavare i vetrini in un bagno 1 x PBS-T per 2 minuti. Nel frattempo, preparare il reagente bloccante MOM aggiungendo 2 gocce di soluzione madre (vedere la tabella dei materiali) a 2,5 mL di PBS 1x.
- Aggiungere 400 μL di reagente MOM sulla sezione. Incubare per 1 ora a temperatura ambiente.
- Lavare i vetrini due volte in un bagno 1x PBS-T per 2 minuti. Nel frattempo, preparare il diluente MOM aggiungendo 300 μL di soluzione madre concentrata proteica a 3,75 mL di PBS 1x.
- Aggiungere 400 μL di diluente MOM e incubare per 5 minuti a temperatura ambiente. Nel frattempo diluire l'anticorpo SMI-32 (vedere Tabella dei materiali) nel diluente MOM.
- Prelevare il diluente dai vetrini e aggiungere 400 μL di soluzione di anticorpi SMI-32 sulla sezione. Coprire la camera umida e incubare per 30 minuti a temperatura ambiente.
- Lavare i vetrini due volte in un bagno 1x PBS-T per 2 minuti, ciascuno con una leggera agitazione. Nel frattempo, diluire il reagente di lavoro IgG anti-topo MOM nel diluente (10 μL di riserva in 2,5 mL di diluente).
- Aggiungere 400 μL di reagente di lavoro IgG anti-topo per vetrino. Incubare per 10 min.
- Lavare i vetrini due volte in un bagno 1x PBS-T per 2 minuti ciascuno. Continuare la colorazione seguendo i passaggi descritti nel protocollo di colorazione CD45 (fase 8.11 – 8.19).
10. Punteggio LFB e H&E per la presenza di lesioni demielinizzanti
NOTA: Di seguito è riportato un approccio analitico che può essere applicato per ottenere informazioni rapide sulla gravità della demielinizzazione infiammatoria. Questa analisi viene condotta in sezioni del midollo campionate a diversi livelli (cervicale, toracico e lombare, almeno 3 sezioni per livello). Fare riferimento all'Allen Brain Atlas for Mouse spinal cord26 per identificare il livello anatomico del midollo spinale. Questa analisi richiede file TIFF. Se le immagini acquisite sono in formato .czi, seguire le istruzioni nella Tabella supplementare 4 per convertire i file czi in file TIFF.
- Aprire l'immagine TIFF della sezione da analizzare trascinando e rilasciando il file in ImageJ. Osservare la sezione del midollo spinale in 4 quadranti: dorsale, laterale sinistro, laterale destro e anteriore (Figura 2A,B).
- Punteggio per la presenza di lesioni demielinizzanti in ciascun quadrante, come illustrato nella Figura 2.
NOTA: La presenza di una lesione determina un punteggio di 1 in quel quadrante, per un totale di 4 punti possibili per sezione. Viene assegnato un punteggio pari a 1 anche se sono presenti più lesioni all'interno di un quadrante. - Sommare tutti i punti per ogni topo e dividere per il numero totale di quadranti campionati per ottenere la frazione di quadranti con lesioni sub-meningee.
11. Calcolo della frazione di area della colorazione LFB nella sostanza bianca del midollo spinale
NOTA: Questa analisi misura la frazione percentuale dell'area della sostanza bianca del midollo spinale colorata con LFB.
- Aprire una sezione macchiata da LFB salvata come file TIFF trascinando o rilasciando il file in ImageJ.
- Fare clic su Immagine > Digitare > 8 bit per produrre un'immagine in scala di grigi. Fare clic su Immagine > regolare > soglia. Regolare il cursore inferiore in modo che la sovrapposizione rossa catturi tutte le regioni scure (mielina) visibili a occhio nudo (Figura 2C–E). Fare clic su Applica.
- Fare clic su Analizza > Strumenti > Gestisci ROIper aprire Gestione ROI.
- Selezionare lo strumento di disegno poligonale nella barra degli strumenti di ImageJ. Questo strumento di disegno consente di delineare una regione del midollo spinale con il mouse del computer.
- Delinea la regione dorsale del midollo spinale e aggiungi il poligono a ROI Manager facendo clic su t sulla tastiera.
- Delinea la regione antero-laterale della sostanza bianca del midollo spinale e aggiungi il poligono al gestore del ROI.
NOTA: Durante il tracciamento, escludere i vasi sanguigni di grandi dimensioni, le lacerazioni nel tessuto, gli artefatti e le aree adiacenti al corno dorsale (Figura 2A,B freccia), che normalmente sono meno mielinizzate. Sii il più preciso possibile durante il tracciamento poiché l'inclusione di uno sfondo bianco eccessivo distorcerà i risultati. - Fare clic su Analizza > Imposta misure e selezionare Frazione area.
- Fare clic su Misura in Gestione ROI. Questo darà la frazione dell'area delineata che è macchiata con LFB.
- Dalla casella dei risultati appena prodotti, copiare i valori in Excel e chiudere la finestra dell'immagine. Calcolare la percentuale media di frazione dell'area colorata per le regioni dorsale e ventro-laterale. Calcola la media di questi per ottenere un valore per quella sezione.
- Ripetere i passaggi 11.1–11.9 per le sezioni cervicale, toracica e lombare (N = 3/livello/topo).
- Calcola la percentuale media della frazione di mielina per tutte le sezioni per ogni mouse. La percentuale di demielinizzazione viene stimata sottraendo la % di colorazione dell'area da 100.
12. Analisi del numero di cellule CD45+ e degli ovoidi assoniali SMI-32+
- Trascinare e rilasciare un'immagine TIFF colorata CD45 o SMI-32 in ImageJ. Fare clic su Analizza > Imposta scala > Globale > Ok per impostare la barra di scala su tutte le immagini. Si noti che questa operazione viene eseguita solo per la prima immagine.
- Seleziona lo strumento di disegno poligonale e traccia intorno alla materia grigia usando il mouse del computer. Fare clic su Analizza > Misura e registrare i risultati in Excel come "Area della materia grigia".
- Con il poligono disegnato ancora sull'immagine, rimuovere la materia grigia dall'immagine facendo clic sul tasto Canc (tastiera). Questa azione lascia solo la sostanza bianca da analizzare.
- Delinea l'intera sezione del midollo spinale utilizzando lo strumento di disegno poligonale . Escludere tutte le regioni di tessuto mancanti o danneggiate.
- Fare clic su Analizza > Misurare e registrare i risultati come "Area tissutale totale" nel file Excel.
- Fare clic su Immagine > Colore > Deconvoluzione del colore. Dalla finestra a discesa dei vettori, selezionare H DAB. Appariranno tre nuove finestre: mantieni la finestra di colore marrone (canale DAB) ed elimina le altre finestre dell'immagine.
- Fare clic su Immagine > regolare > soglia. Regolare il cursore inferiore per definire la soglia dell'immagine in modo che la sovrapposizione rossa catturi la stessa quantità di macchie marroni rilevate dall'occhio. Fare clic su Applica.
- Fare clic su Elabora > Spartiacque > binario. A questo punto, confronta l'immagine originale e l'immagine binaria per assicurarti che siano in accordo.
- Fare clic su Analizza > Analizza particelle. Selezionare Mostra sovrapposizione e modificare le impostazioni: Dimensione = 5 - 150 μm2, Circolarità = 0,4 - 1. Fare clic su OK.
NOTA: queste impostazioni consentono di includere singole celle e piccoli gruppi di celle che non sono state divise con la funzione Spartiacque anziché escluderle nell'analisi. - Nella finestra dei risultati, registrare l'ultimo numero nella colonna più a sinistra in Excel, che rappresenta il conteggio totale delle particelle. Quindi, calcolare l'area della sostanza bianca (area totale del tessuto – area della sostanza grigia in mm2). Esprimere il numero totale di particelle per area di sostanza bianca (conteggio/mm2).
- Ripetere i passaggi per ogni immagine RGB salvata. Una volta che tutte le sezioni del midollo spinale sono state analizzate per un topo, calcolare la media del numero di particelle per mm2 di tessuto per quel topo.
NOTA: Il flusso di lavoro utilizzato per analizzare i leucociti del midollo spinale può essere applicato anche alle regioni cerebrali.
13. Misurazione di sNF-L mediante un test SIMOA
- Raccogliere 100-200 μL di sangue da topi vivi mediante sanguinamento safenico utilizzando provette capillari o tramite puntura cardiaca utilizzando una siringa e un ago da 25 G (procedura terminale). Per quest'ultimo, trasferire il sangue in una provetta da microcentrifuga da 1,5 mL.
- Lasciare coagulare il sangue a temperatura ambiente per 30-60 minuti.
- Centrifugare i campioni a 2660 x g per 5 minuti a 4 °C e pipettare la frazione superiore (siero) in una nuova provetta per microcentrifuga. Conservare il siero a -80 °C fino al momento dell'uso.
- Preparazione: Lasciare che i calibratori e i controlli (kit del saggio con luce NF, vedere la tabella dei materiali) si riscaldino a temperatura ambiente per 1 ora prima dell'uso. Estrarre il substrato enzimatico (RGP) dal frigorifero e porre a bagnomaria a 30 °C per almeno 30 minuti, facendo vortice ogni 10 minuti.
- Scongelare i campioni di siero sul ghiaccio. Una volta scongelati, frullare delicatamente i campioni e centrifugarli a 10000 x g per 5 minuti per pellettare eventuali detriti.
- Caricare la piastra: Vorticare i calibratori e i controlli. Caricare i calibratori in duplicato, i controlli in doppio e i campioni di siero in duplicato sulla piastra a 96 pozzetti fornita con il kit. I campioni di siero sono diluiti in un rapporto 1:3 con il diluente fornito nel kit. Sigillare la piastra.
- Accendere la macchina SIMOA (vedere la tabella dei materiali) nell'ordine di computer, programma e quindi macchina. Consentire alla macchina di inizializzare ed eseguire la manutenzione Start of Day .
- Vorticare le perle magnetiche per 30 s.
- Carica reagenti sullo schermo, fare doppio clic sulla posizione del rack in cui deve essere posizionato il flacone del reagente, quindi eseguire la scansione del codice a barre del flacone.
- Posizionare le sfere magnetiche nella posizione di agitazione sul rack (posizioni 1–3).
- Continuare, caricando il rivelatore, il reagente SBG e il reagente RGP nella macchina.
- Fare clic su Impostazioni sul software. Assicurarsi che la modalità di campionamento sia sulla piastra. Nella scheda Esecuzione dell'installazione assegnare un nome all'esperimento.
- Assegnare i pozzetti sulla piastra per i calibratori come segue: Fare clic sul pozzetto, quindi selezionare il saggio. Selezionare calibrare A , quindi fare clic su Ascendente. Evidenziare i pozzetti A1-8, quindi fare clic su Repliche (2) per assegnare le coordinate per i calibratori da eseguire in duplicato. Eseguire utilizzando il protocollo pulito.
NOTA: Fare riferimento al certificato di analisi (sito Web del produttore) per ottenere le concentrazioni di ciascun calibratore per ogni particolare numero di lotto. Una volta assegnati i pozzetti, non è possibile allontanarsi da questa schermata senza perdere il lavoro, fino a quando la piastra non è bloccata in posizione. - Assegna gli esempi attenendoti alla procedura riportata di seguito:
- In basso a destra dello schermo, fare clic sul pulsante per assegnare i campioni. Evidenziare i pozzetti in cui devono essere posizionati i campioni.
- Selezionare dall'elenco il test da eseguire, scegliere il numero di repliche e specificare la diluizione integrata di 4x.
- Con i pozzetti ancora evidenziati, immettere un prefisso per l'ID del campione e il numero iniziale, quindi fare clic su genera per produrre ID sequenziali per i campioni. Ripetere i passaggi per i campioni di controllo.
- Caricare la piastra nel portatarga (da A1 a A12).
- Nell'interfaccia dello schermo, fare clic su esempi di programmazione completati e procedere alla scheda delle risorse di sistema. Verificare che tutti i contenitori dei reagenti siano pieni e che i contenitori dei rifiuti siano vuoti.
- Fare clic su Esegui.
- Al termine dell'analisi, controllare la curva di calibrazione nella scheda "Riduzione dati" selezionando il nome del saggio e della piastra.
- Vai su "Cronologia esecuzioni" e usa i filtri per trovare l'esecuzione più recente. Selezionare Esegui e quindi tutti i risultati. Fare clic su Esporta e salvare il file .csv. Fare clic su report, quindi selezionare batch calibration report e selezionare l'esecuzione recente. Visualizzare l'anteprima del report ed esportarlo.
- Eseguire la manutenzione di fine giornata consigliata dal produttore. Spegnere il programma, la macchina e quindi il computer.
Risultati Rappresentativi
La Figura 3 mostra l'IHC rappresentativa e la colorazione istochimica, con esempi di lesioni EAE acute (a sinistra) e più vecchie (a destra). La colorazione rappresentativa di CD45 con controcolorazione dell'ematossilina è mostrata nella Figura 3A,B. Le Figure 3C-F mostrano esempi di colorazione LFB con (Figura 3C,D) o senza (Figura 3E,F) la controcolorazione H&E. Sebbene l'ematossilina non sia specifica per le cellule immunitarie, i nuclei delle cellule immunitarie si colorano in modo più scuro e possono essere distinti dalle cellule residenti nel SNC. La Figura 3G,H mostra una colorazione rappresentativa degli assoni SMI-32+, controcolorati con ematossilina. Si noti l'aumento dell'aspetto di questa macchia nelle lesioni EAE più vecchie.
Il danno delle tracce mielinizzanti è più diffuso nel midollo spinale nell'EAE murino attivo e questo è il principale fattore di paralisi in questa malattia 7,9. Pertanto, il punteggio per la presenza di infiammazione e danno tissutale nel midollo spinale è prioritario nelle analisi istologiche. Le lesioni EAE si verificano sporadicamente in diverse regioni (anteriore, laterale o dorsale) (Figura 2A,B) e a diversi livelli (sacrale, lombare, toracico, cervicale) del midollo spinale. Il metodo di inclusione descritto garantisce un buon campionamento delle lesioni in tutto il midollo ombelicale. Vengono incorporate più sezioni di quelle analizzate, poiché alcune sezioni possono danneggiarsi durante il processo di lavorazione o sezionamento. Per garantire un campionamento rappresentativo, vengono analizzate almeno 3 sezioni rappresentative a livello cervicale, toracico e lombare del midollo spinale per ciascun topo. L'identità di ogni campione è nascosta in modo che la persona che conduce l'analisi non sia influenzata nella selezione delle sezioni rappresentative per l'analisi.
Per ottenere informazioni rapide sulle differenze nella gravità istologica dell'EAE, è possibile valutare la presenza di lesioni demielinizzanti sub-meningee nei quadranti del midollo spinale in sezioni selezionate (Figura 2A,B). Si tratta di un metodo rapido che può essere eseguito su immagini scansionate o utilizzando un microscopio ottico. Questa analisi è sufficientemente sensibile da rilevare le differenze nella gravità istologica dell'EAE tra i gruppi quando l'EAE è grave in un gruppo e lieve in un altro. Ad esempio, nell'esperimento in Figura 4, l'EAE è stato indotto in femmine wild type (WT) e topi con una delezione in OGR1 (OGR1 KO) utilizzando MOG p35-55/CFA più PTX. I topi del gruppo WT hanno sviluppato EAE grave con paralisi completa, mentre il gruppo knockout OGR1 ha sviluppato una malattia lieve. Questa differenza nel punteggio clinico corrispondeva a una differenza nella frazione di quadranti che presentavano lesioni sub-meningee (Figura 4C).
È importante integrare il punteggio delle lesioni demielinizzanti con la frazione percentuale dell'area della colorazione della mielina per catturare l'entità della perdita di mielina e/o assoni mielinizzati durante l'attacco autoimmune. Nell'esempio della Figura 4, anche la percentuale di frazione mielinica differiva significativamente tra i topi OGR1 e WT (Figura 4D). La percentuale di frazione mielinica è anche significativamente correlata con il punteggio cumulativo EAE nei topi con EAE (Figura 4E) e quindi funge da buona misura del danno tissutale complessivo in questa malattia. Si noti che questo protocollo non distingue l'intensità della colorazione mielinica. Se questo è il risultato desiderato, è necessario condurre una colorazione in immunofluorescenza per le proteine della mielina come la proteina proteolipidica o la proteina basica della mielina e misurare l'intensità di questa colorazione.
Nel caso in cui l'EAE sia grave in entrambi i gruppi di confronto, una frazione maggiore di quadranti del midollo spinale conterrà lesioni infiammatorie/demielinizzanti. In questo caso, un approccio più sensibile per segnare l'infiammazione è quello di contare il numero di leucociti CD45+ per mm2 di sostanza bianca (vedere colorazione rappresentativa nella Figura 3A). Il clone dell'anticorpo CD45 qui descritto rileva tutti i leucociti infiltranti e colora solo occasionalmente le microglia che sovraregolano l'espressione di CD45 nell'EAE (vedi freccia aperta nella Figura 3B) ed è quindi utile per catturare l'infiltrazione delle cellule immunitarie periferiche.
Negli studi EAE a lungo termine (>20 giorni), si raccomanda di eseguire anche un'analisi della lesione assonale. La colorazione SMI-32 nelle sezioni del midollo spinale è un metodo sensibile per rilevare gli assoni danneggiati. Sebbene l'infiammazione nel midollo spinale si attenui con il tempo e gli assoni risparmiati possano ri-mielinizzare, gli assoni sopravvissuti mostrano un'estensione differenziale della lesione residua9 (Figura 3G,H). Ad esempio, nel modello di EAE indotto da MOG p35-55 nei topi C57BL6/J, l'entità della lesione assonale e della perdita è un driver dei punteggi clinici dopo che il processo infiammatorio si è attenuato9. La Figura 5 mostra un esempio di questo in un esperimento EAE in topi maschi e femmine WT topi e topi che sono carenti di un gene chiamato recettore-delta attivato dal proliferatore dei perossisomi (PPAR-delta) nel compartimento mieloide (LysMCre: Ppardfl/fl). Nei maschi, i topi WT hanno riacquistato la funzione degli arti posteriori, ma i punteggi clinici sono rimasti elevati nel gruppo maschile LysMCre: Ppardfl/fl. Al contrario, nell'esperimento sulle femmine, entrambi i gruppi sperimentali hanno avuto punteggi elevati per tutto il tempo. A prima vista, questo risultato ha suggerito che PPAR-delta ha avuto un effetto sesso-specifico nell'EAE; tuttavia, il punteggio patologico del midollo spinale ha rivelato che i topi di entrambi i sessi nel gruppo LysMCre: Ppardfl/fl avevano un aumento del danno assonale rispetto alle controparti WT (Figura 5B). Un effetto genotipico sui punteggi clinici probabilmente non è stato osservato nelle femmine perché i topi femmina WT tendevano a mostrare un aumento del danno assonale, che si manifestava in deficit neurologici cronici.
In questo stesso esperimento, è stato riscontrato che i topi femmina LysMCre: Ppardfl/fl hanno un'infiltrazione di cellule T più estesa nel cervelletto, fornendo un esempio di come il punteggio dell'infiammazione cerebrale possa essere utile nell'EAE. Nell'EAE, l'infiammazione nel cervello si trova prevalentemente nel cervelletto e nel tronco encefalico (Figura 6A, D, G), ma può anche essere trovata nelle meningi (viste sotto l'ippocampo nella Figura 6C), vicino ai ventricoli (Figura 6F) e in altri tratti della sostanza bianca, tra cui il nervo ottico e il corpo colloso (Figura 6B, E). Il punteggio dell'infiammazione cerebrale viene eseguito in una regione cerebrale specifica (ad esempio, la sostanza bianca cerebellare) contando il numero di cellule CD45 per regione di tessuto mm2 utilizzando la stessa metodologia delineata per il protocollo del midollo spinale. Nel metodo di macroscopia qui descritto, un taglio si trova al centro del cervelletto, che fornisce la prospettiva del cervelletto e del tronco encefalico, come mostrato nella Figura 6A.
La misurazione di sNF-L mediante un test SIMOA è diventata un biomarcatore utile per valutare il danno assonale in corso e le risposte alla terapia nella SM recidivante-remittente 20,21,27,28. Lo stesso kit di analisi SIMOA utilizzato per misurare gli esseri umani sNF-L può essere applicato per misurare sNFL 22,23,24 nel topo. Per esplorare quanto bene questo test si comporti nel rilevare la lesione assonale nell'EAE, sNF-L è stato misurato in topi femmina C57BL6/J all'end-point di un esperimento EAE e i livelli sono stati confrontati con quelli in topi di controllo sani di sesso abbinato che non avevano EAE. È stato riscontrato che i topi con EAE avevano livelli molto più elevati di sNF-L rispetto ai topi sani (Figura 7A) e questi livelli erano correlati con la densità degli assoni SMI-32+ nel midollo spinale (Figura 7B). Rispetto al punteggio istologico della lesione assonale, il test SIMOA è più veloce (dal sanguinamento dei topi ai risultati possono essere raggiunti in poco più di mezza giornata) e quindi fornisce un rapido feedback su come funziona un trattamento nei topi vivi. Questo test ha anche il vantaggio di riflettere la lesione assonale sia nel midollo spinale che nel cervello.

Figura 1: Blocco rappresentativo della paraffina delle sezioni cerebrali e del midollo spinale. Le 5 sezioni coronali del cervello e le sezioni trasversali del midollo spinale (1,5-2 mm di spessore) sono incorporate nello stesso blocco in modo da poter essere tagliate in un'unica sezione. Almeno 15 sezioni del midollo spinale devono essere incorporate, consentendo un'adeguata selezione delle sezioni per l'analisi. Fare clic qui per visualizzare una versione più grande di questa figura.
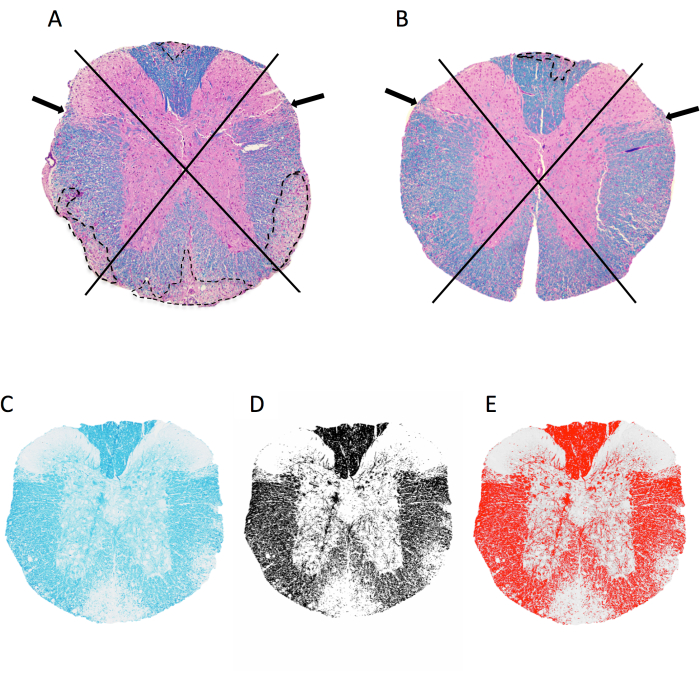
Figura 2: Punteggio dell'infiammazione meningea e della percentuale di area mielinica a livello del midollo spinale toracico. (A,B) mostrano immagini del midollo spinale toracico di una femmina di topo C57BL6/J con EAE indotta da MOG p35-55 colorata con LFB/H&E. Viene mostrato l'approccio utilizzato per visualizzare i quadranti e gli esempi di lesioni demielinizzanti (tracciate in linea tratteggiata). Il topo in A ha 4 dei 4 quadranti con lesioni demielinizzanti confluenti, mentre il topo in B ha 1 dei 4 quadranti colpiti. Il topo in B ha una certa infiammazione in altri quadranti, ma questa non si è manifestata in una lesione confluente e quindi non è segnata. (C–E) Esempio di immagine LFB e l'immagine in scala di grigi e con soglia in imageJ. Fare clic qui per visualizzare una versione più grande di questa figura.
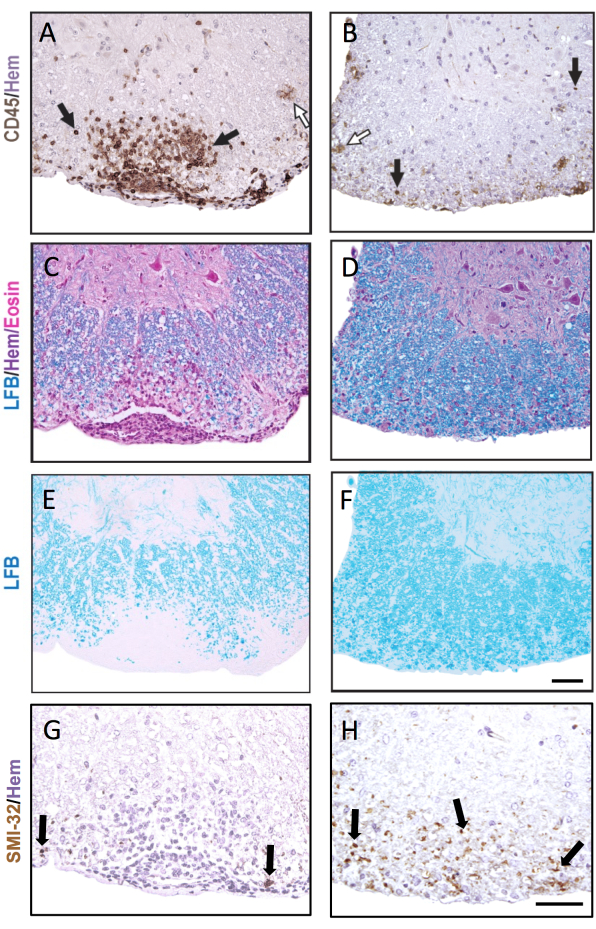
Figura 3: Sezioni del midollo spinale colorate con CD45, LFB H&E, LFB e SMI-32. Esempi di lesione sub-meningea precoce (A,C,E,G) e tardiva (B,D,F,H) nel midollo spinale colorata per l'anticorpo CD45 (A,B), LFB/H&E (C,D), LFB da solo (E,F) e l'anticorpo SMI-32 (G,H). Le frecce nere mostrano esempi di cellule colorate con ciascun rispettivo anticorpo. Le frecce bianche mostrano le microglia putative che sono state colorate come CD45+. Barra graduata = 50 μm. Questa figura mostra la colorazione rappresentativa delle lesioni nel midollo spinale di un topo femmina C57BL6/J durante l'EAE ed evidenzia come la patologia possa essere diversa tra le diverse sezioni del midollo spinale. Fare clic qui per visualizzare una versione più grande di questa figura.
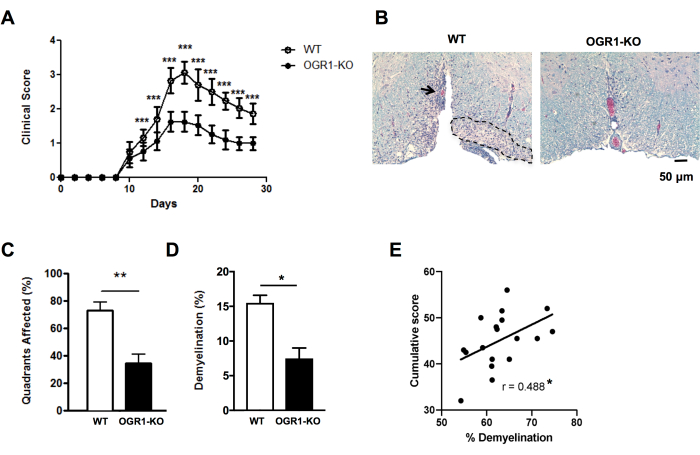
Figura 4: Applicazione del punteggio per le lesioni e la percentuale di demielinizzazione nell'EAE. Viene mostrato un esempio di un esperimento EAE in cui topi femmina carenti del gene del recettore 1 accoppiato alla proteina G (OGR1) del cancro ovarico sullo sfondo C57BL6/J hanno sviluppato EAE clinici meno gravi rispetto ai topi femmina C57BL6/J wildtype (WT). L'EAE è stata indotta dall'immunizzazione con MOG p35-55/CFA più PTX e i topi sono stati valutati secondo la seguente scala clinica: 1 = paralisi della coda. 2 = debolezza degli arti posteriori e del piede, 3 = paralisi degli arti posteriori, 4 = debolezza degli arti anteriori, 5 = moribondo. (A) Punteggi clinici medi + SEM dei topi nel tempo. (B) È mostrato un esempio di colorazione LFB/H&E nel midollo spinale ventrale. Barra della scala = 50 μm. (C) Media + quadranti percentuali SEM che contenevano lesioni demielinizzanti. (D) Media + percentuale di demielinizzazione SEM in ciascun gruppo. (E) mostra il risultato di un altro esperimento in EAE indotto da MOG p35-55 in topi C57BL6/J in cui i punteggi EAE dei singoli topi sono stati sommati nei 30 giorni di osservazione ed erano correlati con la percentuale di demielinizzazione nel midollo spinale. Le correlazioni sono state eseguite utilizzando un test di Spearman. I pannelli in (A-D) sono adattati da Souza C et al.29. I dati di cui al punto (E) sono dati originali. *P<0,05, **P<0,01, ***P<0,001. Fare clic qui per visualizzare una versione più grande di questa figura.
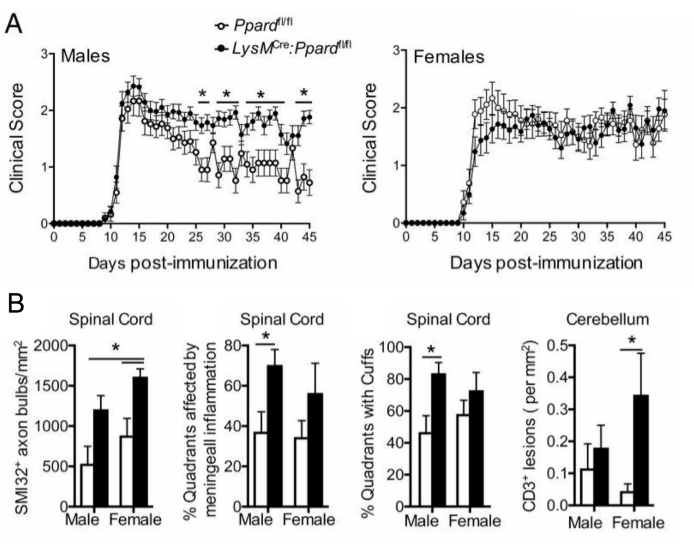
Figura 5: Applicazione della colorazione SMI-32 per comprendere l'effetto di un genotipo sul fenotipo clinico dell'EAE. Questa figura mostra un esempio di un esperimento EAE in cui topi maschi e femmine wildtype (portano allele floxed di Ppard) e topi mutanti Ppard mieloidi specifici (LysMCre: Ppardfl/fl) sullo sfondo C57BL6/J sono stati immunizzati con MOG p35-55/CFA e PTX e sono stati seguiti per 45 giorni. (A) mostra i punteggi clinici medi + SEM dei topi. (B) mostra i risultati medi + SEM del punteggio istologico del numero di assoni SMI-32+ nel midollo spinale, %quadranti con lesioni submeningee, quadranti percentuali con cuffia perivascolare e lesioni #CD3 nel cervelletto per tessuto mm2 . Questo esperimento ha mostrato un effetto genotipico sulla colorazione di SMI-32. Questa figura è adattata da Drohomyrecky. et al.15. Fare clic qui per visualizzare una versione più grande di questa figura.
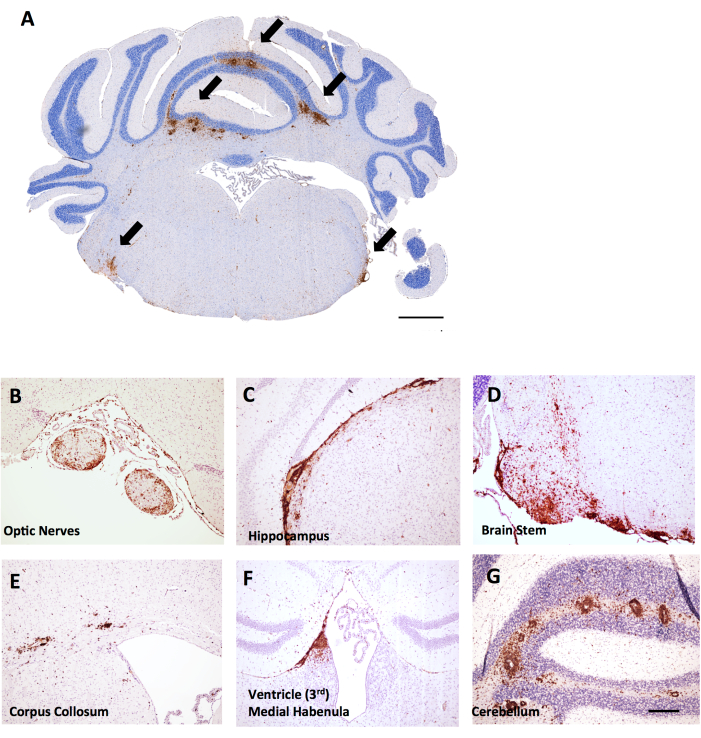
Figura 6: Esempi di colorazione CD45+/ematossilina nelle sezioni coronali cerebrali nell'EAE indotta da MOG p35-55 in topi femmina C57BL6/J. Le lesioni CD45+ sono mostrate in marrone. (A) Lesioni CD45+ nel tronco encefalico delle sezioni coronali. Barra della scala = 150 μm. (B–G) Esempi di lesioni CD45+ nei nervi ottici (B), estensioni meningee sotto l'ippocampo (C), il tronco encefalico (D), il corpo colloso (E), l'habenula mediale vicino al ventricolo (F) e il cervelletto (G). Barra della scala: (B–G) = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
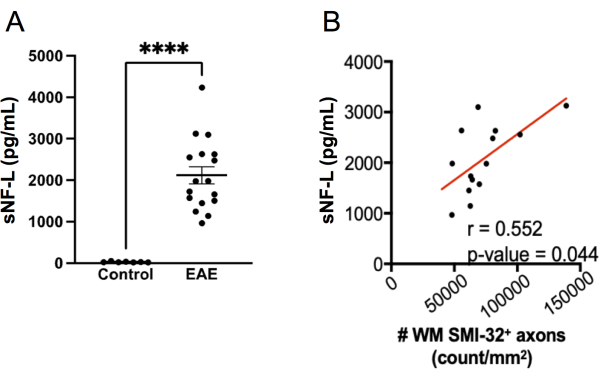
Figura 7: Livelli di sNF-L nel siero nell'EAE indotto da MOG p35-55. (A) Livelli sierici di NFL raccolti da topi di controllo femminile e EAE all'endpoint di un esperimento. I dati sono stati analizzati utilizzando un test di Mann Whitney a due code. (valore ****p < 0,0001). (B) Le sezioni del midollo spinale sono state raccolte all'estremità e colorate con SMI-32. Il numero di cellule positive per area di tessuto della sostanza bianca è stato determinato e correlato con NF-L sierico all'endpoint utilizzando un test di Spearman. Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella supplementare 1: Descrizione dei bagni utilizzati nella lavorazione dei tessuti. Le cassette vengono spostate automaticamente attraverso queste serie di bagni utilizzando un processore automatizzato. Fare clic qui per scaricare il file.
Tabella supplementare 2: Fasi della colorazione Luxol Fast Blue ed ematossilina ed eosina. Questa tabella delinea l'ordine dei passaggi nel protocollo di colorazione Luxol Fast Blue ed Ematossilina ed Eosina. Fare clic qui per scaricare il file.
Tabella supplementare 3: Anticorpi utilizzati per la colorazione immunoistochimica. Sono descritti gli anticorpi utilizzati in questo protocollo e quelli che possono essere utilizzati per esplorare ulteriormente l'infiammazione, la microgliosi e l'astrogliosi. Fare clic qui per scaricare il file.
Tabella supplementare 4: Come convertire i file .czi in TIFF. Si noti che è ottimale utilizzare un'immagine ad alta risoluzione, ma le immagini a media risoluzione possono essere salvate se la memoria di lavoro del computer è limitata. È imperativo utilizzare immagini della stessa risoluzione in tutte le analisi. Si noti inoltre che l'ultima immagine della serie è l'etichetta della diapositiva. Evitare di leggere l'etichetta per assicurarsi che l'analisi sia in cieco. 30,31 Clicca qui per scaricare questo file.
Discussione
La colorazione istologica del midollo spinale è uno strumento importante per valutare la gravità della malattia EAE, in particolare nei casi in cui vi sono differenze tra i gruppi di trattamento nell'entità del recupero dalla malattia nella fase post-acuta della malattia. La colorazione per l'infiltrazione di cellule immunitarie (CD45), la mielina (LFB) e il danno assonale (SMI-32) aiuta a caratterizzare la causa sottostante dei punteggi clinici alterati nei topi. Il protocollo di colorazione istologica qui descritto fornisce una prospettiva dell'infiammazione e dell'estensione della mielina e della lesione assonale. Inoltre, i risultati mostrati convalidano la misurazione di sNF-L come metodo per valutare l'entità del danno neuronale complessivo nell'EAE.
I parametri critici per questa analisi sono garantire che i ricercatori siano ciechi all'identità delle sezioni e che ci sia un campionamento equivalente a ciascun livello del midollo spinale nei diversi topi. Questo perché la gravità dell'infiammazione può essere maggiore a livelli più bassi del midollo. Un altro parametro critico è la dimensione dei gruppi sperimentali. Il midollo spinale e il cervello vengono in genere prelevati da 6-8 topi per gruppo all'endpoint per vedere differenze significative tra i gruppi con trattamenti o genotipi con dimensioni di effetto modeste. È anche importante assicurarsi che i topi selezionati, quando viene calcolata la media, abbiano punteggi medi rappresentativi dell'intero gruppo. Per quanto riguarda la risoluzione dei problemi, un problema comune riscontrato da coloro che non hanno esperienza con il protocollo è che il midollo spinale è fissato per un periodo di tempo insufficiente e non è facilmente estrudente dalla colonna vertebrale. In questo caso, il midollo spinale può essere sezionato manualmente dalla colonna tagliando lungo i processi spinosi utilizzando forbici sottili e aprendo la colonna per rivelare il midollo spinale. In alternativa, i tessuti possono essere fissati per qualche giorno in più senza interferire con il successo della colorazione anticorpale. I cloni di anticorpi qui descritti lavorano in tessuto fissato fino a 2 settimane in formalina.
L'inclusione dei pezzi del midollo spinale richiede abilità e pratica. Si consiglia di indossare occhialini e di dirigere una lampada sulla stazione di inclusione per visualizzare meglio se le sezioni cadono in sezione trasversale o in sezione longitudinale. Mantenere la lunghezza dei pezzi del midollo spinale a meno di 2 mm durante l'ingrossamento li aiuterà a cadere in sezione trasversale. Un altro problema comune riscontrato per gli utenti meno esperti è che l'LFB evapora durante l'incubazione notturna, lasciando metà del vetrino macchiato e metà non colorato. Per evitare l'evaporazione, il piatto di colorazione in vetro deve essere sigillato con pellicola termoplastica e poi pellicola trasparente. Se si verifica un'evaporazione e le sezioni sono macchiate in modo non uniforme, si consiglia di de-blu completamente i vetrini con carbonato di litio e di ricolorarli nuovamente in LFB durante la notte. Un altro problema comune è che gli utenti non de-blu completamente la materia grigia dopo LFB. È fondamentale esaminare le singole sezioni al microscopio per assicurarsi che sia stata raggiunta una quantità sufficiente di debluzione prima di procedere con altri passaggi del protocollo. Inoltre, sebbene i coloranti IHC CD45 e SMI-32 funzionino in modo robusto, è comunque importante individuare le concentrazioni di anticorpi negli esperimenti preliminari per ogni nuovo lotto di anticorpi ricevuto. Questo può essere fatto testando una varietà di concentrazioni dell'anticorpo su una sezione di controllo positivo (midollo spinale EAE). La prima colorazione deve includere anche un controllo negativo che consiste nel solo anticorpo secondario senza aggiunta di anticorpi primari. Infine, è fondamentale nell'analisi delle immagini per definire la soglia delle singole immagini, poiché la colorazione può essere irregolare tra diapositive o sezioni.
Questo protocollo utilizza un software disponibile gratuitamente. Se non si ha accesso a un processore, a un embedder o a un microtomo, questi passaggi possono essere affidati a un nucleo di patologia ospedaliera che offre questi servizi. Inoltre, se non si ha accesso a uno scanner per vetrini, è possibile utilizzare un microscopio ottico dotato di una videocamera per salvare le immagini TIFF del midollo spinale o delle regioni cerebrali. Per un flusso di lavoro basato su microscopio, acquisire sezioni LFB o LFB/H&E a bassa potenza (ingrandimento 40x) e per la colorazione CD45 e SMI-32, acquisire almeno quattro finestre centrate nelle parti ventrale, dorsale e laterale del midollo spinale (ingrandimento 200x per CD45 e ingrandimento 400x per SMI-32). L'analisi delle immagini può essere eseguita su queste immagini per quantificare la colorazione in modo simile a quanto descritto.
La decisione di quale approccio istologico adottare per valutare l'EAE dipende da quanto i punteggi clinici differiscono tra i gruppi. Ad esempio, se ci sono differenze drastiche nel punteggio clinico dell'EAE (un gruppo ha ricevuto l'EAE e uno no), questo di solito si riferisce a differenze nell'infiammazione mediata periferica. In questo caso, il punteggio per la presenza di lesioni demielinizzanti sulle sezioni colorate con LFB/H&E è sufficiente e rivelerà le differenze tra i gruppi. Se i gruppi sono più simili nel punteggio clinico all'esordio e ci sono invece differenze nell'entità del recupero clinico (ad esempio, l'esperimento nella Figura 5A), è meglio applicare l'intero flusso di lavoro istologico qui delineato, incluso il punteggio dell'infiammazione cerebrale nel tronco encefalico e nel cervelletto, per distinguere se le differenze nella cronicità della malattia sono correlate a differenze nell'infiammazione o nel danno tissutale. Se si riscontrano differenze nell'infiammazione valutate dalla conta dei CD45, è possibile effettuare ulteriori studi IHC per colorare le cellule T (anti-CD3), i monociti/macrofagi infiltranti (Mac3) e la microglia (Iba-1/TMEM119) (i cloni di anticorpi raccomandati sono nella Tabella supplementare 3). L'attivazione della microglia si riflette in un aumento dell'intensità della colorazione di Iba-1 sulla microglia Iba-1+TMEM-19+ a doppia marcatura e in una maggiore retrazione dei processi della microglia che può essere valutata mediante l'analisi di Sholl sulla sezione32. Inoltre, tecniche come la citometria a flusso o il sequenziamento dell'RNA a singola cellula possono essere applicate per condurre una caratterizzazione più approfondita della frequenza e del fenotipo delle popolazioni immunitarie nel cervello e nel midollo spinale.
Il conteggio degli assoni SMI-32+ è un metodo sensibile per rilevare la lesione degli assoni in EAE32,33 e in MS34. SMI-32, che rileva la forma non fosforilata del neurofilamento pesante o medio, si accumula nei bulbi terminali dei neuroni trancinati. Un'alternativa per rilevare gli assoni danneggiati è quella di colorarsi con la proteina precursore dell'amiloide (APP) che può accumularsi negli assoni a causa dell'interruzione del trasporto degli assoni33. Il modello di colorazione per SMI-32 e APP, sebbene entrambi riflettano entrambi una lesione assonale, in genere non si sovrappongono, indicando che stanno rilevando patologie diverse33. Si possono anche integrare le misure istologiche della lesione assonale misurando la sNF-L, che è una misura rapida e sensibile della lesione assonale in corso sia nel midollo spinale che nel cervello. Offre il vantaggio che può essere fatto in mezza giornata nei topi vivi. Uno svantaggio di questo metodo è che i kit sono costosi e la macchina è altamente specializzata. L'azienda che vende il kit sNF-L offre un servizio a pagamento per coloro che non hanno accesso a una macchina SIOMA. Un'alternativa alla valutazione della lesione assonale è quella di valutare la perdita di assoni contando gli assoni nelle sezioni del midollo spinale colorate di blu con toluidina12 o contando i fasci di neurofilamenti rilevati da SMI-31 nelle aree della sostanza bianca del midollo spinale32. Entrambi questi sono approcci più laboriosi rispetto alla misurazione SMI-32 o sNF-L.
Se i punteggi clinici dell'EAE differiscono tra i gruppi, ma il punteggio per l'infiammazione, la demielinizzazione e la lesione assonale non rivela differenze tra i gruppi, può essere utile colorare per l'attivazione degli astrociti utilizzando GFAP (vedere la Tabella supplementare 3 per il clone di anticorpo raccomandato). L'attivazione degli astrociti è associata ad un aumento della colorazione della GFAP e questo ha dimostrato di essere correlato con la progressione dell'EAE in alcuni modelli di EAE, incluso l'EAE cronico nel ratto DA35.
In conclusione, questo protocollo descrive i metodi e fornisce un flusso di lavoro di analisi per condurre il punteggio istologico dell'EAE.
Divulgazioni
Shannon Dunn è consulente per FSD Lucid Psycheceuticals.
Riconoscimenti
Ringraziamo il Dr. Raymond Sobel (Stanford University) per averci mostrato il suo metodo per grossolanare e correggere sezioni del cervello e del midollo spinale. Ringraziamo Kyle Roberton e Milan Ganguly del Toronto Centre for Phenogenomics per aver appreso il metodo di inclusione e per aver tagliato così tante sezioni del nostro cervello e del midollo spinale. Ringraziamo il Dr. Matthew Cussick e il Dr. Robert Fujinami (Università dello Utah) per aver condiviso i loro protocolli per valutare l'infiammazione submeningea e perivascolare nel midollo spinale. Ringraziamo Shalina Ousman per aver condiviso il clone dell'anticorpo CD45. Ringraziamo Xiofang Lu per la formazione sul processatore di tessuti e sulla stazione di inclusione dei tessuti e per la manutenzione di queste apparecchiature presso il Keenan Research Centre of Biomedical Research presso il St. Michael's Hospital. Questo lavoro è stato sostenuto da una sovvenzione biomedica di MS Canada (a SED). Carmen Ucciferri è sostenuta da una borsa di studio del governo canadese. Nuria Alvarez-Sanchez è supportata da una borsa di studio post-dottorato Keenan.
Materiali
| Name | Company | Catalog Number | Comments |
| 10% Neutral Buffered Formalin | Sigma Aldrich | HT501128-4L | Used to fix spinal cord and brain specimens |
| 1000 mL Glass Beaker | Pyrex | 1000 | |
| 15 mL Falcon Tube | Starstedt | 62.554.100 | Fixing and storing spinal cord and brain |
| 250 mL Erlenmeyer Flask | Pyrex | 4980 | |
| 500 mL Glass Beaker | Pyrex | 1003 | |
| 92 mm x 16 mm Petri Dishes | Starstedt | 82-1473-001 | Used in the tissue grossing procedure |
| 95% Ethyl Alcohol | Commercial Alcohols | P016EA95 | Dehydration and rehydration steps |
| ABC Elite Kit | Vector Labratories | PK6100 | Used for immunohistochemistry labeling |
| Aqua Hold 2 PAP Pen | Cole Parmer | UZ-75955-53 | Used for drawing around tissue sections in Immunohistochemical Staining |
| Avidin/Biotin Blocking Kit | Vector Labratories | SP-2001 | |
| Biosafety Cabinet | Any | ||
| Biotinylated rabbit anti-rat IgG | Vector Labratories | BA-4000 | Used for CD45 staining |
| C57BL6/J Mice | Jackson Laboratory | Stock # 664 | These mice were used in experiments shown in paper. |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST Plus | |
| CitriSolv | Fisher Scientific | 04-355-121 | Used for de-waxing. Is an alternative to xylene |
| DAB Kit | Vector Labratories | SK-4100 | Used for developing in immunohistochemistry |
| ddH2O | - | - | |
| Disposable Scalpel | Magna | M92-10 | Used for grossing spinal cord and brain |
| DWK Life Sciences (Wheaton) glass staining dish | Cole Parmer | UZ-48585-60 | Used for histochemical staining and washes |
| DWK Life Sciences (Wheaton) glass staining rack | Cole Parmer | 10061392 | Used for immunohistochemistry and histochemistry |
| Eosin Y | Bioshop | 173772-87-1 | Stains cytoplasm |
| Feather Microtome Blades | Fisher Scientific | 12-634-1C | Used for sectioning paraffin |
| Filter Paper | Whatman | 1001110 | Used to filter the formalin (during grossing) and the luxol fast blue |
| Fine Surgical Scissors | Fine Science Tools | 14160-10 | Used to snip brain and the skull |
| Fumehood | Any | ||
| Gibco DPBS | Fisher Scientific | 14190944 | |
| Glacial Acetic Acid | BioShop | ACE333.4 | Used in the luxol fast blue staining procedure |
| Histoplex Histology Containers | Starplex Scientific | 565-060-26 | Fixing spinal cord and brain |
| Hydrogen Peroxide | Fisher Chemicals | H325-500 | Used to remove endogenous peroxidase in the tissue |
| ImageJ | NIH | https://imagej.nih.gov/ij/download.html | |
| Kimtech Science Kimwipes | Kimberly Clark Professional | 34155 | Used for immunohistochemistry |
| Lens paper | VWR | 52846-001 | Used for trapping spinal cord species in cassette during processing |
| Light microscope | Any | ||
| Lithium carbonate | Sigma Aldrich | 554-13-3 | De-blueing after luxol fast blue staining |
| Luxol blue | Sigma Aldrich | 1328-51-4 | Stains CNS myelin |
| M.O.M Immunodetection Kit | Vector Labratories | BMK-2202 | Used to stain SMI-32 |
| Methanol | Fisher Chemicals | A454.2 | Used for fixation |
| Mayer's Hematoxylin | Electron Microscopy Sciences | 26381-02 | Stains nuclei |
| Micro-Adson Forceps with Teeth | Fine Science Tools | 11027-12 | Used for reflecting the skull during dissections |
| Microcentrifuge | Eppendorf | Model 5417R | |
| Microvette Capillary Tubes CB 300 Z | Starstedt | 16.440.100 | Used for blood collection |
| Micrscope Cover Glass | Fisher Scientific | 12545A | Used for coverslipping |
| Mini Shaker | VWR | 12620-938 | Used for making buffers |
| NF light kit | Quanterix | 103186 | This kit can be used for detection of mouse or human soluble neurofilament in serum |
| Nitrile Gloves | VWR | 76307-462 | Safety |
| Normal Goat Serum | Vector Labratories | S-1000 | Blocking reagent |
| Normal Rabbit Serum | Vector Labratories | S-5000 | Blocking reagent |
| OmniSette Tissue Cassettes | Fisher Scientific | M4935FS | Used for embedding spinal cord and brain |
| p1000 Pipette and Tips | various | ||
| p200 Pipette and Tips | various | ||
| Paraffin Embedding station | Leica Biosystems | Model EG1160 | |
| Paraplast Tissue Infiltration/Embedding Medium | Leica Biosystems | 39601006 | Used for embedding spinal cord and brain |
| Permount Mounting Medium | Fisher Chemicals | SP15-100 | Used for mounting coverslips on slides |
| pH meter | Fisher Scientific | 13636AB315B | Used for pHing buffers |
| Plastic Transfer Pipettes | Fisher Scientific | 13-711-20 | Used for pHing buffers |
| Potassium Chloride | BioShop | 7447-40-7 | Used for making PBS |
| Potassium Phosphate Monobasic | BioShop | 7778-77-0 | Used for making PBS |
| Pressure Cooker | Nordic Ware | Tender Cooker | |
| Purified rat anti-mouse CD45 | Vector Labratories | 553076 | Detects leukocytes |
| Reagent grade alcohol 100% | VWR | 89370-084 | Dehydration and rehydration steps |
| Reagent grade alcohol 70% | VWR | 64-17-5 | Dehydration and rehydration steps |
| Rotary Microtome | Leica Biosystems | Model RM2235 | |
| Simoa Machine | Quanterix | HD-X | |
| Slide Scanner | Zeiss | AxioScan.Z1 | |
| SMI-32 mouse IgG1 antibody | Biolegend | 801701 | Detects damaged axons |
| Sodium Chloride | BioShop | 7647-14-5 | Used for making PBS |
| Sodium Phosphate Dibasic | Bioshop | 7558-79-4 | Used for making PBS |
| Standard Adson Forceps | Fine Science Tools | 11150-10 | Used for dissection steps |
| Superfrost Plus Microscope slides | Fisher Scientific | 12-550-15 | Used to collect sections |
| Surgical Tough Cuts | Fine Science Tools | 14110-15 | Used to cut through the spine, body wall, and skin |
| Tissue Processor | Leica Biosystems | Model TP1020 | |
| Tri-soldium citrate | Thermo Fisher Scientific | 03-04-6132 | Used for antigen retrieval |
| Tween-20 | BioBasic | 9005-64-5 | Used for washing sections |
| X-P Pierce XP-100 plate seal | Excel Scientific | 12-140 | Used for the sNF-L Assay |
| Xylene | Fisher Chemicals | 1330-20-7 | Used for de-waxing and clearing sections |
| Funnel | Cole Parmer | RK-63100-64 | Used to filter formalin before grossing tissue |
| Stir Plate | Any | Used to make solutions | |
| Oven | Any | Used to bake tissue sections after cutting | |
| Parafilm | Bemis | 13-374-10 | Used to seal LFB staining dish |
| Microwave | Any | Timing may vary depending on the microwave model | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 9048-46-8 | Used to make blocking buffer |
| 1.5 mL Microcentrifuge Tubes | Fisher Scientific | 05-408--129 | Used to store mouse serum samples |
| Vortex | Any | Used to prepare samples for sNF-L assay | |
| Waterbath | Any | Used to warm enzyme substrate for sNF-L assay |
Riferimenti
- Constantinescu, C. S., Farooqi, N., O'Brien, K., Gran, B. Experimental autoimmune encephalomyelitis (EAE) as a model for multiple sclerosis (MS). Br J Pharmacol. 164 (4), 1079-1106 (2011).
- Rasouli, J., et al. Expression of GM-CSF in T is increased in multiple sclerosis and suppressed by IFN-beta therapy. J Immunol. 194 (11), 5085-5093 (2015).
- Zrzavy, T., et al. Loss of 'homeostatic' microglia and patterns of their activation in active multiple sclerosis. Brain. 140 (7), 1900-1913 (2017).
- Kutzelnigg, A., Lassmann, H. Pathology of multiple sclerosis and related inflammatory demyelinating diseases. Handb Clin Neurol. 122, 15-58 (2014).
- Glatigny, S., Bettelli, E. Experimental autoimmune encephalomyelitis (EAE) as animal models of multiple sclerosis (MS). Cold Spring Harb Perspect Med. 8 (11), (2018).
- Kipp, M., Nyamoya, S., Hochstrasser, T., Amor, S. Multiple sclerosis animal models: A clinical and histopathological perspective. Brain Pathol. 27 (2), 123-137 (2017).
- Nikic, I., et al. A reversible form of axon damage in experimental autoimmune encephalomyelitis and multiple sclerosis. Nat Med. 17 (4), 495-499 (2011).
- Croxford, A. L., et al. The cytokine GM-CSF the inflammatory signature of CCR2+ monocytes and licenses autoimmunity. Immunity. 43 (3), 502-514 (2015).
- Jones, M. V., et al. Behavioral and pathological outcomes in MOG 35-55 experimental autoimmune encephalomyelitis. J Neuroimmunol. 199 (1-2), 83-93 (2008).
- Zuo, M., et al. Age-dependent gray matter demyelination is associated with leptomeningeal neutrophil accumulation. JCI Insight. 7 (12), 158144 (2022).
- Bannerman, P. G., et al. Motor neuron pathology in experimental autoimmune encephalomyelitis: Studies in thy1-yfp transgenic mice. Brain. 128, 1877-1886 (2005).
- Cahill, L. S., et al. Aged hind-limb clasping experimental autoimmune encephalomyelitis models aspects of the neurodegenerative process seen in multiple sclerosis. Proc Natl Acad Sci U S A. 116 (45), 22710-22720 (2019).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1810-1819 (2006).
- Stromnes, I. M., Goverman, J. M. Passive induction of experimental allergic encephalomyelitis. Nat Protoc. 1 (4), 1952-1960 (2006).
- Drohomyrecky, P. C. Peroxisome proliferator-activated receptor-delta acts within peripheral myeloid cells to limit the expansion of myelin-reactive T cells during experimental autoimmune encephalomyelitis (EAE). J. Immunol. 10, 2588-2601 (2019).
- Osorio-Querejeta, I., et al. The innovative animal monitoring device for experimental autoimmune encephalomyelitis ("I am D EAE"): A more detailed evaluation for improved results. Mult Scler Relat Disord. 63, 103836 (2022).
- Wang, C., et al. Induction and diverse assessment indicators of experimental autoimmune encephalomyelitis. J Vis Exp. (187), e63866 (2022).
- Shahi, S. K., Freedman, S. N., Dahl, R. A., Karandikar, N. J., Mangalam, A. K. Scoring disease in an animal model of multiple sclerosis using a novel infrared-based automated activity-monitoring system. Sci Rep. 9, 19194 (2019).
- Kluver, H., Barrera, E. A method for the combined staining of cells and fibers in the nervous system. J Neuropathol Exp Neurol. 12 (4), 400-403 (1953).
- Disanto, G., et al. Serum neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol. 81 (6), 857-870 (2017).
- Novakova, L., et al. Monitoring disease activity in multiple sclerosis using serum neurofilament light protein. Neurology. 89 (22), 2230-2237 (2017).
- Pouzol, L., et al. Act-1004-1239, a first-in-class CXCR7 antagonist with both immunomodulatory and promyelinating effects for the treatment of inflammatory demyelinating diseases. FASEB J. 35 (3), 21431 (2021).
- Breakell, T., et al. Obinutuzumab-induced B-cell depletion reduces spinal cord pathology in a CD20 double transgenic mouse model of multiple sclerosis. Int J Mol Sci. 21 (18), 6864 (2020).
- Aharoni, R., et al. Neuroprotective effect of glatiramer acetate on neurofilament light chain leakage and glutamate excess in an animal model of multiple sclerosis. Int J Mol Sci. 22 (24), 13419 (2021).
- Sternberger, L. A., Sternberger, N. H. Monoclonal antibodies distinguish phosphorylated and nonphosphorylated forms of neurofilaments in situ. Proc Natl Acad Sci U S A. 80 (19), 6126-6130 (1983).
- Kuhle, J., et al. Serum neurofilament is associated with progression of brain atrophy and disability in early MS. Neurology. 88 (9), 826-831 (2017).
- Benkert, P., et al. Serum neurofilament light chain for individual prognostication of disease activity in people with multiple sclerosis: A retrospective modelling and validation study. Lancet Neurol. 21 (3), 246-257 (2022).
- D'Souza, C. A., et al. OGR1/GPR68 modulates the severity of experimental autoimmune encephalomyelitis and regulates nitric oxide production by macrophages. PLoS One. 11 (2), 0148439 (2016).
- Doroshenko, E. R., et al. Peroxisome proliferator-activated receptor-delta deficiency in microglia results in exacerbated axonal injury and tissue loss in experimental autoimmune encephalomyelitis. Front Immunol. 12, 570425 (2021).
- Soulika, A. M., et al. Initiation and progression of axonopathy in experimental autoimmune encephalomyelitis. J Neurosci. 29 (47), 14965-14979 (2009).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. N Engl J Med. 338 (5), 278-285 (1998).
- Lassmann, H., Bradl, M. Multiple sclerosis: Experimental models and reality. Acta Neuropathol. 133 (2), 223-244 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon