È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Criobiopsia polmonare transbronchiale per la diagnosi di malattie polmonari interstiziali e lesioni polmonari periferiche - Un approccio graduale
In questo articolo
Riepilogo
La criobiopsia polmonare transbronchiale (TBLC) per la diagnosi della malattia polmonare interstiziale e delle lesioni polmonari periferiche è una procedura diagnostica e sicura ad alto rendimento. Descriviamo un approccio graduale per condurre la TBLC per le diverse indicazioni menzionate con un broncoscopio flessibile, che potrebbe essere utile per i broncoscopisti alle prime armi che eseguono TBLC.
Abstract
La criobiopsia polmonare transbronchiale (TBLC) è una procedura invasiva sempre più implementata nell'ultimo decennio come alternativa alla biopsia polmonare (SLB) della chirurgia toracica video-assistita per la diagnosi di malattie polmonari interstiziali (ILD). L'indicazione per la TBLC è stata principalmente quella di sottoclassificare uno specifico sottotipo di ILD quando ciò non può essere ottenuto sulla base di una precedente discussione di gruppo multidisciplinare. Sebbene la SLB sia considerata il gold standard per stabilire una diagnosi istologica, la TBLC è stata gradualmente suggerita come la modalità diagnostica istologica di prima scelta nei pazienti con ILD non classificate a causa di una resa diagnostica comparabile con SLB, ma superiore alla SLB in termini di complicanze, inclusa la mortalità. Negli ultimi anni, anche l'ecografia endobronchiale radiale (R-EBUS) e la TBLC guidata dalla broncoscopia a navigazione elettromagnetica (ENB) per le lesioni polmonari periferiche sono state descritte come procedure sicure, che possono migliorare la resa diagnostica rispetto alle biopsie con forcipe. Tuttavia, le proprietà diagnostiche del TBLC si basano sulla qualità delle prestazioni della procedura. Questo articolo ha lo scopo di descrivere l'approccio graduale alla conduzione del TBLC con un broncoscopio flessibile per le diverse indicazioni menzionate, che potrebbe essere utile per i broncoscopisti alle prime armi che eseguono TBLC.
Introduzione
Le malattie polmonari interstiziali (ILD) costituiscono un gruppo di malattie polmonari acute e croniche che colpiscono uno o più di tutti i componenti del parenchima polmonare che formano l'interstizio come bronchi, alveoli, tessuto connettivo e vasi sanguigni e linfatici. Nonostante siano malattie rare, gli oltre 200 diversi sottotipi di ILD rappresentano una categoria di malattie eterogenea con diverse caratteristiche cliniche, radiologiche e cito-istologiche. Le ILD si manifestano tipicamente come infiammazione, fibrosi o una combinazione di entrambe, che sono le cause alla base dei sintomi abitualmente percepiti dai pazienti come tosse secca, dispnea da sforzo e affaticamento 1,2.
Le ILD sono classificate come polmonite interstiziale idiopatica (IIP), polmonite interstiziale di eziologia nota (ad esempio, malattia del tessuto connettivo, malattia polmonare interstiziale, ILD indotta da farmaci e pneumoconiosi lavoro-correlata), affezione interstiziale granulomatosa (ad esempio, polmonite da sarcoidosi e ipersensibilità) e ILD orfane (ad esempio, malattie polmonari cistiche multiple e polmonite eosinofila)1. Questa categorizzazione e l'ulteriore sottotipizzazione diagnostica sono fondamentali per determinare il trattamento e il follow-up ottimali e consentono la prognosi. Tuttavia, poiché il puzzle diagnostico può essere impegnativo, si raccomanda l'interpretazione delle informazioni cliniche disponibili (tra cui anamnesi, disposizione e potenziali esposizioni) e paracliniche come la tomografia computerizzata ad alta risoluzione del torace (HRCT), la fisiologia polmonare e l'autoimmunologia ottenute sulla base di una discussione di gruppo multidisciplinare (MDD) 3,4,5. Se non è possibile ottenere una diagnosi sicura di MDD 6,7, il campionamento istologico per aumentare la probabilità di una diagnosi definita di sottotipo ILD è indicato dall'uso della criobiopsia polmonare transbronchiale (TBLC)8,9. In pazienti ben selezionati, la TBLC è considerata una procedura invasiva sicura con un'accuratezza diagnostica vicina a quella della biopsia polmonare (SLB) per chirurgia toracica video-assistita, che è ancora considerata il gold standard istologico per la diagnostica istologica dell'ILD 10,11,12,13,14 . La procedura TBLC viene eseguita come broncoscopia sistematica, applicando speciali criosonde per il campionamento istologico e con la guida fluoroscopica raccomandata. Si raccomanda che la TBLC venga eseguita in centri ILD terziari utilizzando un setting MDD e da pneumologi interventisti che hanno familiarità con la gestione delle complicanze TBLC, che hanno seguito una formazione in un centro dedicato con esperienza TBLC 9,10,11,15,16,17.
La TBLC ha recentemente attirato l'attenzione anche come procedura da combinare con l'ecografia endobronchiale radiale (R-EBUS) per la diagnostica ILD18,19. Inoltre, la TBLC è stata combinata sia con l'R-EBUS che con la broncoscopia a navigazione elettromagnetica (ENB) per la diagnosi delle lesioni polmonari periferiche (PPL) per migliorare la resa diagnostica rispetto alle biopsie convenzionali con pinze transbronchiali20,21. Tuttavia, questo approccio relativamente nuovo per la diagnostica della PPL non è ancora stato implementato come procedura standard e quindi giustifica ulteriori prove in questo settore specifico. Lo scopo del presente rapporto è quello di descrivere un approccio graduale alla conduzione di TBLC con un broncoscopio flessibile in un contesto clinico per le indicazioni menzionate.
Protocollo
Gli autori provengono da due centri TBLC danesi (Odense University Hospital e Aarhus University Hospital) che conducono entrambi ricerche in conformità con i principi della Dichiarazione di Helsinki. L'approvazione etica non era necessaria in quanto lo studio era di natura osservazionale. Tutti i pazienti inclusi ai fini della ricerca hanno dato il loro consenso informato scritto. È importante sottolineare che l'approccio graduale descritto per la conduttanza TBLC si riferisce all'uso di un broncoscopio flessibile e si basa su una combinazione di raccomandazioni provenienti da linee guida internazionali, dichiarazioni di esperti, revisioni all'avanguardia ed esperienze dei due centri TBLC 9,10,11,15,16,17,22,23,24 ,25.
1. Considerazioni sul preTBLC
- Assicurarsi che la TBLC sia indicata, il che è giustificato nei pazienti in cui l'integrazione delle informazioni provenienti da HRCT, biochimica e autoimmunologia in una precedente MDD che coinvolge pneumologi e radiologi non è stata in grado di stabilire una diagnosi sicura di ILD.
- Selezionare i pazienti appropriati evitando le controindicazioni descritte nella Tabella 1.
| Controindicazioni relative | Controindicazioni assolute |
| La capacità vitale forzata (FVC) < il 50% del valore previsto | Trombocitopenia < 50 x 109/L o INR > 1,5 |
| La capacità di diffusione del monossido di carbonio per il polmone (DLCO) < il 35% del valore previsto | Diatesi emorragica non corretta |
| La pressione arteriosa polmonare sistolica > 50 mmHg (ad esempio, stima basata su un'ecocardiografia) | Declino progressivo e clinico dovuto ad un aumentato rischio di complicanze nei pazienti con funzione polmonare compromessa |
| Indice di massa corporea > 35 kg/m2 |
Tabella 1: Controindicazioni per TBLC. Controindicazioni relative e assolute per la conduttanza TBLC. Abbreviazione: TBLC = criobiopsia polmonare transbronchiale.
2. Preparazione preTBLC
- Esaminare l'HRCT e i suggerimenti del radiologo toracico per pianificare da quale campionamento istologico dei segmenti bronchiali (BS) è meglio accessibile in base alla manifestazione radiologica della malattia.
- Verificare che il sistema funzioni prima delle prestazioni TBLC.
- Premere il pulsante della capacità del serbatoio del gas (anidride carbonica (CO2) o protossido di azoto (NO)) sul pannello delle impostazioni per controllare il volume del gas nella bombola.
- Posizionare la criosonda su un vassoio e osservare la sonda mentre si preme l'interruttore a pedale per 5-10 s. Cerca una palla di ghiaccio sulla punta della sonda che indichi che funziona correttamente (Figura 1).
- Utilizzare l'anestesia generale (GA) o la sedazione profonda sotto TBLC e considerare la premedicazione con acido tranexamico di 0,5-1 g per ridurre il rischio di sanguinamento.
- Posizionare uno speciale tubo endotracheale a doppio luminale (ETT) di 7,5-8,5 mm nella trachea.
NOTA: L'ETT ha un canale principale che consente l'accesso al broncoscopio mentre il paziente è ventilato e ha un canale laterale minore che funge da canale di lavoro per il catetere bloccante bronchiale.- Spruzzare continuamente con anestesia locale (ad es. spray di lidocaina al 10%) per ridurre la tosse. Vedere anche il passaggio 3.5.
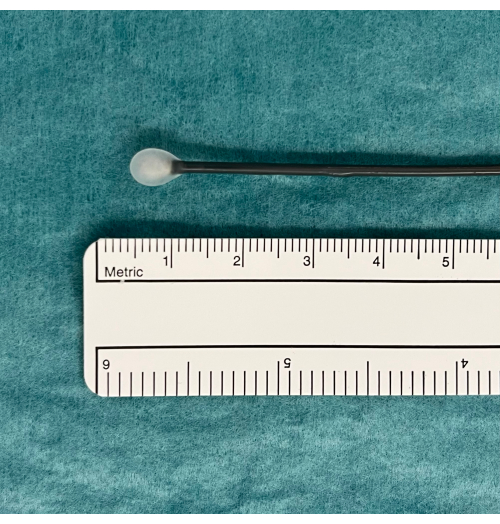
Figura 1: Una palla di ghiaccio come indicazione dell'attrezzatura TBLC utilizzabile. Un pedale attiva la diffusione del gas CO2 dal serbatoio e il congelamento indotto. Questo viene testato in acqua dove una palla di ghiaccio apparirà sulla punta della criosonda se funziona correttamente. Abbreviazione: TBLC = criobiopsia polmonare transbronchiale. Clicca qui per visualizzare una versione più grande di questa figura.
3. Conduttanza TBLC
- Introdurre un broncoscopio flessibile attraverso l'ETT ed eseguire la procedura di broncoscopia.
NOTA: In alcuni centri TBLC viene utilizzato un broncoscopio rigido per intubare la trachea. Se la trachea viene intubata da un broncoscopio rigido, un broncoscopio flessibile può essere fatto passare attraverso quello rigido.- Introdurre la criosonda flessibile attraverso il canale di lavoro del broncoscopio e nel BS selezionato.
NOTA: Le sonde criogeniche si presentano sia come sonde monouso (1,1, 1,7 e 2,4 mm) che come sonde riutilizzabili (1,9 e 2,4 mm). - Utilizzare la fluoroscopia per assicurarsi che il posizionamento della punta della criosonda sia a circa 10 mm dalla parete del torace corrispondente alla BS selezionata (Figura 2).
- Introdurre un catetere bloccante bronchiale (ad es. un palloncino Fogarty) nel canale laterale dell'ETT a doppio luminale e posizionarlo sull'ostio BS selezionato (Figura 3).
- Gonfiare il catetere bronchiale bloccante per valutare l'adeguatezza del posizionamento e del blocco per potenziali sanguinamenti che si verificano distalmente rispetto al palloncino (Figura 4).
- Sgonfiare il catetere bloccante bronchiale se il palloncino è ben posizionato.
- Fissare il posizionamento del palloncino fissando il catetere bloccante bronchiale con un peano.
- Utilizzare piccole quantità di spray a base di lidocaina o soluzione salina nel rispettivo ETT e nel suo canale laterale per ridurre l'attrito dovuto all'introduzione della criosonda nell'ETT e del catetere a palloncino nel canale laterale dell'ETT.
- Quando i passaggi 3.1.1-3.1.3 vengono eseguiti in modo soddisfacente, premere il pedale di congelamento per 3-6 s, a seconda delle dimensioni della criosonda, per sfruttare la legge di Joule-Thompson per congelare il tessuto parenchimale polmonare a circa -45-79 °C per CO2 e -89 °C per NO.
- Ritrarre il broncoscopio flessibile contenente la criosonda con un movimento rapido tenendo premuto il pedale di congelamento per continuare a congelare ed evitare che la biopsia cada durante la retrazione.
- Durante la manovra descritta al punto 3.1.5, chiedere a una persona diversa dal broncoscopista di tenere il palloncino gonfiato per bloccare il sito bioptico distale dell'ostio BS selezionato per controllare il potenziale sanguinamento.
- Introdurre la criosonda flessibile attraverso il canale di lavoro del broncoscopio e nel BS selezionato.
- Continuare il passaggio 3.1.6 fino a ottenere almeno due biopsie da due BS dallo stesso lobo.
- Posizionare le biopsie in soluzione salina e, una volta ottenute tutte le biopsie, fissarle in formaldeide (4%) (Figura 5).
- Inviare le biopsie per l'esame patologico prima della MDD.
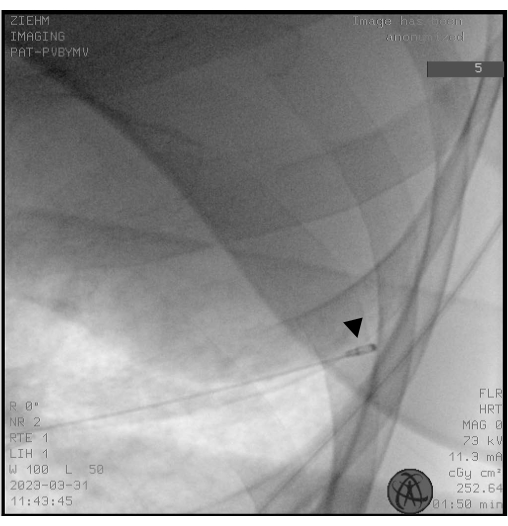
Figura 2: Fluoroscopia. La fluoroscopia viene utilizzata per garantire il corretto posizionamento della criosonda prima del congelamento. La punta della criosonda appare come la testa di una bacchetta (punta di freccia nera). Clicca qui per visualizzare una versione più grande di questa figura.
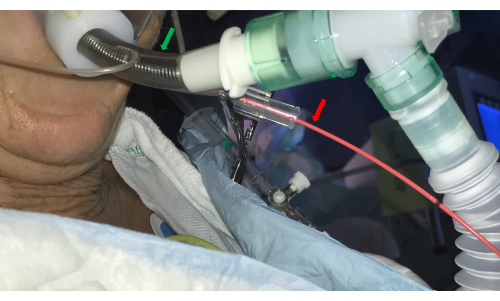
Figura 3: Tubo endotracheale. Un tubo endotracheale a doppio luminale (freccia verde) consente l'accesso alle vie aeree da parte del broncoscopio e contemporaneamente controlla il sanguinamento introducendo un catetere a palloncino nel canale laterale (freccia rossa). Clicca qui per visualizzare una versione più grande di questa figura.
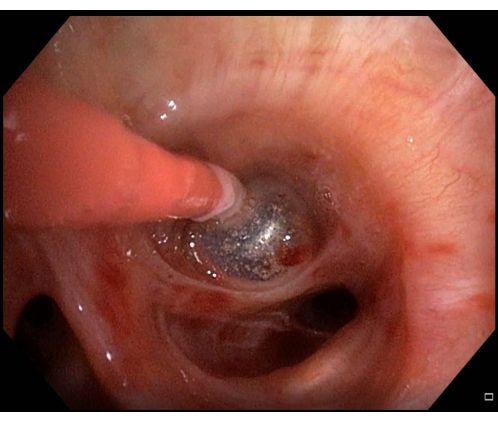
Figura 4: Gonfiaggio del catetere a palloncino. Gonfiaggio del catetere a palloncino per garantire il blocco e prevenire potenziali sanguinamenti distali del palloncino che si distribuiscono ad altre parti del lobo dopo aver eseguito una criobiopsia polmonare transbronchiale. Clicca qui per visualizzare una versione più grande di questa figura.
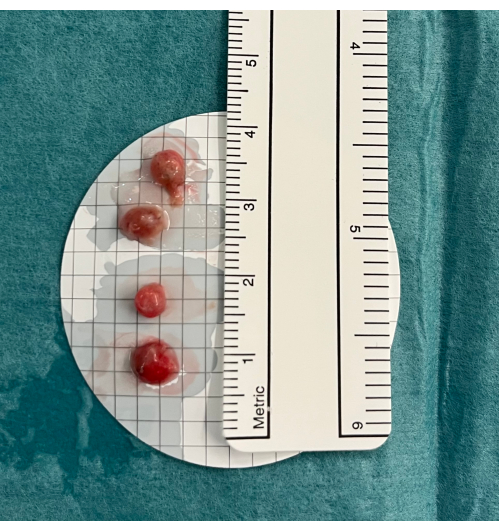
Figura 5: Biopsie. Le criobiopie polmonari transbronchiali vengono poste in soluzione salina fredda prima della fissazione in formaldeide. Clicca qui per visualizzare una versione più grande di questa figura.
4. Procedure post-TBLC
- Dopo ogni biopsia, reintrodurre il broncoscopio nel BS e sgonfiare il palloncino per osservare se si verifica sanguinamento.
- Rigonfiare il palloncino se si osserva sanguinamento (Figura 6). Se il palloncino è nella posizione corretta e blocca il BS, attendere alcuni minuti affinché l'emorragia si fermi, quindi continuare la procedura TBLC.
- Se si osserva ancora sanguinamento dopo il passaggio 4.1.1., installare una soluzione fisiologica ghiacciata distalmente al palloncino.
- In caso di sanguinamento in corso dopo il passaggio 4.1.2. o insufficienza del palloncino in cui il sangue si riversa in altre BS, utilizzare una combinazione di aspirazione, soluzione salina ghiacciata somministrata per via endobronchiale con o senza adrenalina e acido tranexamico.
- Se il sangue coagulato ostruisce le vie aeree, utilizzare la criosonda per aprire nuovamente le vie aeree congelando la punta della criosonda nel coagulo di sangue e ritraendola attraverso l'ETT.
- Se l'emorragia rimane incontrollata, cambiare l'ETT con uno che consenta sia la ventilazione del polmone non biopsia che l'ostruzione del bronco principale sul polmone sanguinante e trasferire il paziente in un'unità di terapia intensiva.
- Eseguire un'ecografia polmonare focalizzata (FLUS) dopo TBLC, mentre il paziente è ancora sedato per identificare le indicazioni di uno pneumotorace iatrogeno (PTX).
- Prendere in considerazione l'inserimento di un drenaggio pleurico guidato da FLUS con un catetere a spirale (Fr 7-16) se le osservazioni FLUS indicano un'alta probabilità di PTX. Il drenaggio pleurico è indicato se la FLUS indica un rapido aumento delle dimensioni di PTX, e soprattutto se lo stato clinico del paziente sta peggiorando.
- Posticipare l'estubazione di 5-10 minuti se la FLUS rivela un PTX piccolo e il paziente è clinicamente stabile. Se le dimensioni del PTX progrediscono in seguito o il paziente diventa clinicamente instabile, inserire un drenaggio pleurico prima dell'estubazione.
- Estubare il paziente dopo il passaggio 4.2 o il passaggio 4.2.2 se non vi è alcuna indicazione di PTX o progresso delle dimensioni del PTX e il paziente rimane clinicamente stabile.
- Osservare il paziente in una sala di risveglio dopo TBLC. Poco prima che il paziente clinicamente stabile torni a casa, assicurarsi che la PTX ad esordio tardivo non sia presente né con la FLUS ripetuta né con una radiografia del torace.
- Discutere la presentazione delle caratteristiche istologiche delle biopsie in un MDD successivo con pneumologi, radiologi e patologi insieme ad altri dettagli per concludere un sottotipo di ILD con alta probabilità diagnostica.
- Informare il paziente della conclusione della MDD dal passaggio 4.5 in ambulatorio e pianificare il potenziale trattamento e il follow-up.
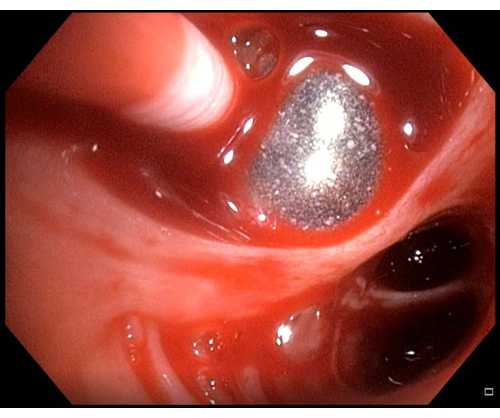
Figura 6: Sanguinamento minore. Se si osserva un sanguinamento dopo aver eseguito una criobiopsia polmonare transbronchiale, in questo caso un sanguinamento minore, il catetere a palloncino deve essere tenuto gonfiato alcuni minuti prima di ritentare lo sgonfiaggio. Clicca qui per visualizzare una versione più grande di questa figura.
5. TBLC in combinazione con R-EBUS ed ENB per la diagnostica PPL
- Navigare e confermare la posizione della lesione polmonare periferica.
- Inserire la criosonda da 1,1 mm nel canale di lavoro esteso sotto la guida della fluoroscopia.
- Far corrispondere la punta della sonda di congelamento con la posizione della sonda EBUS radiale.
- Premere il pedale di congelamento per 4-8 s.
- Ritrarre la criosonda attraverso il canale di lavoro esteso con un movimento rapido, tenendo premuto il pedale di congelamento per continuare a congelare ed evitare che la biopsia cada durante la retrazione.
- Tenere in posizione il broncoscopio e il canale di lavoro esteso mentre la criosonda è retratta.
- Ripetere i passaggi 5.2-5.4 fino a ottenere un numero sufficiente di biopsie.
- Gestire le biopsie come descritto nelle fasi 3.3 e 3.4.
Risultati
Sulla base delle osservazioni degli autori di due centri TBLC, la procedura graduale descritta per TBLC con un broncoscopio flessibile ha permesso il campionamento istologico in pazienti danesi ben selezionati con sottotipi di ILD non ancora diagnosticati nonostante la MDD precedente. Osservazioni dettagliate di queste coorti sono riportate in due studi di recente pubblicazione23,25 e per il centro del primo autore riassunti nell...
Discussione
Indipendentemente dall'indicazione per la TBLC, le sue proprietà diagnostiche si basano sulla qualità delle prestazioni della procedura e sui criteri selezionati per sottoporsi alla procedura. Ciò sottolinea la raccomandazione di implementare un programma di formazione formale e certificato per acquisire le competenze necessarie per eseguire una procedura TBLC standardizzata. Nonostante il fatto che attualmente non sia possibile ottenere una formazione ufficiale sulla TBLC, le recenti...
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Gli autori ringraziano il personale dei Dipartimenti di Chirurgia Toracica e Anestesiologia del Reparto di Broncoscopia dell'Ospedale Universitario di Odense, in Danimarca, per il loro aiuto nella preparazione delle figure per questo articolo.
Materiali
| Name | Company | Catalog Number | Comments |
| "Chimney" for tube | |||
| CO2 gas bottle adapter | |||
| CO2 gas tank | Erbe | ||
| Endoscopy column | |||
| Endotracheal tube, size 7.5-8.5 mm | Erbe | ||
| Erbecryo pedal footswitch | Erbe | ||
| Erbecryo2 workstation | Erbe | ||
| Flexible bronchoscope | |||
| Flexible gas hose | Mediland | ||
| Flexible single use cryoprobe, OD 1.1 mm | Erbe | ||
| Flexible single use cryoprobe, OD 1.7 mm | Erbe | ||
| Flexible single use cryoprobe, OD 2.4 mm | |||
| Fluoroscope | |||
| Fogarty balloon catheter | |||
| Formalin glasses in closed system | |||
| NaCl incl. cold NaCl | |||
| Pean for fixating Fogarty balloon | |||
| Sterile disposable cup | |||
| Sterile suction tube | |||
| Sterile tweesers | |||
| Syringe for Fogarty balloon inflation/deflation | |||
| Table bag for flouroscope | |||
| Three way tap for Fogarty balloon syringe | |||
| Tracheal suction | |||
| Ultrasound machine | Erbe | ||
| Valve for biopsy chanel | |||
| Valve to suction duct |
Riferimenti
- Travis, W. D., et al. An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. American Journal of Respiratory and Critical Care Medicine. 188 (6), 733-748 (2013).
- Ruaro, B., et al. Editorial: Pulmonary fibrosis: One manifestation, various diseases. Frontiers in Pharmacology. 13, 1027332 (2022).
- Lamas, D. J., et al. Delayed access and survival in idiopathic pulmonary fibrosis: a cohort study. American Journal of Respiratory and Critical Care Medicine. 184 (7), 842-847 (2011).
- Tomassetti, S., Piciucchi, S., Tantalocco, P., Dubini, A., Poletti, V. The multidisciplinary approach in the diagnosis of idiopathic pulmonary fibrosis: a patient case-based review. European Respiratory Review. 24 (135), 69-77 (2015).
- Walsh, S. L. F., et al. Multicentre evaluation of multidisciplinary team meeting agreement on diagnosis in diffuse parenchymal lung disease: a case-cohort study. Lancet Respiratory Medicine. 4 (7), 557-565 (2016).
- Ryerson, C. J., et al. A standardized diagnostic ontology for fibrotic interstitial lung disease. An International Working Group perspective. American Journal of Respiratory and Critical Care Medicine. 196 (10), 1249-1254 (2017).
- Cottin, V., et al. Integrating clinical probability into the diagnostic approach to idiopathic pulmonary fibrosis: An International Working Group perspective. American Journal of Respiratory and Critical Care Medicine. 206 (3), 247-259 (2022).
- Rodrigues, I., et al. Diagnostic yield and safety of transbronchial lung cryobiopsy and surgical lung biopsy in interstitial lung diseases: a systematic review and meta-analysis. European Respiratory Review. 31 (166), 210280 (2022).
- Korevaar, D. A., et al. European Respiratory Society guidelines on transbronchial lung cryobiopsy in the diagnosis of interstitial lung diseases. European Respiratory Journal. 60 (5), 2200425 (2022).
- Colella, S., Haentschel, M., Shah, P., Poletti, V., Hetzel, J. Transbronchial lung cryobiopsy in interstitial lung diseases: best practice. Respiration. 95 (6), 383-391 (2018).
- Hetzel, J., et al. Transbronchial cryobiopsies for the diagnosis of diffuse parenchymal lung diseases: expert statement from the Cryobiopsy Working Group on safety and utility and a call for standardization of the procedure. Respiration. 95 (3), 188-200 (2018).
- Ravaglia, C., Poletti, V. Transbronchial lung cryobiopsy for the diagnosis of interstitial lung diseases. Current Opinion in Pulmonary Medicine. 28 (1), 9-16 (2022).
- Troy, L. K., et al. Diagnostic accuracy of transbronchial lung cryobiopsy for interstitial lung disease diagnosis (COLDICE): a prospective, comparative study. Lancet Respiratory Medicine. 8 (2), 171-181 (2020).
- Ruaro, B., et al. Transbronchial lung cryobiopsy and pulmonary fibrosis: A never-ending story. Heliyon. 9 (4), e14768 (2023).
- Lentz, R. J., Argento, A. C., Colby, T. V., Rickman, O. B., Maldonado, F. Transbronchial cryobiopsy for diffuse parenchymal lung disease: a state-of-the-art review of procedural techniques, current evidence, and future challenges. Journal of Thoracis Disease. 9 (7), 2186-2203 (2017).
- Maldonado, F., et al. Transbronchial cryobiopsy for the diagnosis of interstitial lung diseases: CHEST Guideline and Expert Panel Report. Chest. 157 (4), 1030-1042 (2020).
- Avasarala, S. K., Wells, A. U., Colby, T. V., Maldonado, F. Transbronchial cryobiopsy in interstitial lung diseases: State-of-the-art review for the interventional pulmonologist. Journal of Bronchology Interventional Pulmonology. 28 (1), 81-92 (2021).
- Abdelghani, R., Thakore, S., Kaphle, U., Lasky, J. A., Kheir, F. Radial Endobronchial Ultrasound-guided Transbronchial Cryobiopsy. Journal of Bronchology Interventional Pulmonology. 26 (4), 245-249 (2019).
- Inomata, M., et al. Utility of radial endobronchial ultrasonography combined with transbronchial lung cryobiopsy in patients with diffuse parenchymal lung diseases: a multicentre prospective study. BMJ Open Respiratory Research. 8 (1), e000826 (2021).
- Benn, B. S., Gmehlin, C. G., Kurman, J. S., Doan, J. Does transbronchial lung cryobiopsy improve diagnostic yield of digital tomosynthesis-assisted electromagnetic navigation guided bronchoscopic biopsy of pulmonary nodules? A pilot study. Respiratory Medicine. 202, 106966 (2022).
- Ankudavicius, V., Miliauskas, S., Poskiene, L., Vajauskas, D., Zemaitis, M. Diagnostic yield of transbronchial cryobiopsy guided by radial endobronchial ultrasound and fluoroscopy in the radiologically suspected lung cancer: A single institution prospective study. Cancers. 14 (6), 1563 (2022).
- Ravaglia, C., et al. Transbronchial lung cryobiopsy in diffuse parenchymal lung disease: Comparison between biopsy from 1 segment and biopsy from 2 segments - diagnostic yield and complications. Respiration. 93 (4), 285-292 (2017).
- Davidsen, J. R., Skov, I. R., Louw, I. G., Laursen, C. B. Implementation of transbronchial lung cryobiopsy in a tertiary referral center for interstitial lung diseases: a cohort study on diagnostic yield, complications, and learning curves. BMC Pulmonary Medicine. 21 (1), 67 (2021).
- Laursen, C. B., et al. Lung ultrasound assessment for pneumothorax following transbronchial lung cryobiopsy. ERJ Open Research. 7 (3), 00045-2021 (2021).
- Kronborg-White, S., et al. Integration of cryobiopsies for interstitial lung disease diagnosis is a valid and safe diagnostic strategy-experiences based on 250 biopsy procedures. Journal of Thoracic Disease. 13 (3), 1455-1465 (2021).
- Barisione, E., et al. Competence in transbronchial cryobiopsy. Panminerva Medica. 61 (3), 290-297 (2019).
- Raghu, G., et al. Idiopathic pulmonary fibrosis (an update) and progressive pulmonary fibrosis in adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 205 (9), e18-e47 (2022).
- Ravaglia, C., et al. Diagnostic yield and risk/benefit analysis of trans-bronchial lung cryobiopsy in diffuse parenchymal lung diseases: a large cohort of 699 patients. BMC Pulmonary Medicine. 19 (1), 16 (2019).
- Hernandez-Gonzalez, F., et al. Cryobiopsy in the diagnosis of diffuse interstitial lung disease: yield and cost-effectiveness analysis. Archivos de Bronconeumología. 51 (6), 261-267 (2015).
- Cooley, J., et al. Safety of performing transbronchial lung cryobiopsy on hospitalized patients with interstitial lung disease. Respiratory Medicine. 140, 71-76 (2018).
- Hetzel, J., et al. Transbronchial cryobiopsy increases diagnostic confidence in interstitial lung disease: a prospective multicenter trial. European Respiratory Journal. 56 (6), 1901520 (2020).
- Kheir, F., et al. Transbronchial lung cryobiopsy in patients with interstitial lung disease: a systematic review. Annals of the American Thoracic Society. 19 (7), 1193-1202 (2022).
- Walscher, J., et al. Transbronchial cryobiopsies for diagnosing interstitial lung disease: real-life experience from a tertiary referral center for interstitial lung disease. Respiration. 97 (4), 348-354 (2019).
- Gnass, M., et al. Transbronchial lung cryobiopsy guided by radial mini-probe endobronchial ultrasound in interstitial lung diseases - a multicenter prospective study. Advances in Respiratory Medicine. 88 (2), 123-128 (2020).
- Ma, X., et al. Global and regional burden of interstitial lung disease and pulmonary sarcoidosis from 1990 to 2019: results from the Global Burden of Disease study 2019. Thorax. 77 (6), 596-605 (2022).
- Kronborg-White, S., et al. A pilot study on the use of the super dimension navigation system for optimal cryobiopsy location in interstitial lung disease diagnostics. Pulmonology. 29 (2), 119-123 (2021).
- Wijmans, L., et al. Confocal laser endomicroscopy as a guidance tool for transbronchial lung cryobiopsies in interstitial lung disorder. Respiration. 97 (3), 259-263 (2019).
- Kheir, F., et al. Using bronchoscopic lung cryobiopsy and a genomic classifier in the multidisciplinary diagnosis of diffuse interstitial lung diseases. Chest. 158 (5), 2015-2025 (2020).
- Renzoni, E. A., Poletti, V., Mackintosh, J. A. Disease pathology in fibrotic interstitial lung disease: is it all about usual interstitial pneumonia. Lancet. 398 (10309), 1437-1449 (2021).
- Chaudhary, S., et al. Interstitial lung disease progression after genomic usual interstitial pneumonia testing. European Respiratory Journal. 61 (4), 2201245 (2023).
- Raghu, G., et al. Use of a molecular classifier to identify usual interstitial pneumonia in conventional transbronchial lung biopsy samples: a prospective validation study. Lancet Respiratory Medicine. 7 (6), 487-496 (2019).
- Kheir, F., et al. Use of a genomic classifier in patients with interstitial lung disease: a systematic review and meta-analysis. Annals of American Thoracic Society. 19 (5), 827-832 (2022).
- Glenn, L. M., Troy, L. K., Corte, T. J. Novel diagnostic techniques in interstitial lung disease. Frontiers in Medicine. 10, 1174443 (2023).
- Kim, S. H., et al. The additive impact of transbronchial cryobiopsy using a 1.1-mm diameter cryoprobe on conventional biopsy for peripheral lung nodules. Cancer Research and Treatment. 55 (2), 506-512 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon