È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modello murino di espianto dell'arto posteriore per lo studio della meccanobiologia del conflitto del tendine d'Achille
In questo articolo
Riepilogo
Presentiamo una piattaforma sperimentale personalizzata e un protocollo di coltura tissutale che ricrea il cambiamento fibrocartilagineo guidato dall'impingement dell'inserzione del tendine d'Achille in espianti murini dell'arto posteriore con vitalità cellulare sostenuta, fornendo un modello adatto per esplorare la meccanobiologia dell'impingement tendineo.
Abstract
L'impingement del tendine sull'osso genera un ambiente di deformazione meccanica multiassiale con deformazione compressiva trasversale marcatamente elevata, che suscita un fenotipo localizzato della fibrocartilagine caratterizzato dall'accumulo di matrice ricca di glicosaminoglicani (GAG) e dal rimodellamento della rete di collagene. Mentre la fibrocartilagine è una caratteristica normale nelle regioni colpite dei tendini sani, l'eccesso di deposizione di GAG e la disorganizzazione della rete di collagene sono caratteristiche distintive della tendinopatia. Di conseguenza, l'impingement è clinicamente riconosciuto come un importante fattore estrinseco nell'inizio e nella progressione della tendinopatia. Ciononostante, la meccanobiologia alla base dell'impingement tendineo rimane poco studiata. Gli sforzi precedenti per chiarire la risposta cellulare all'impingement tendineo hanno applicato la compressione uniassiale alle cellule e asportato espianti tendinei in vitro. Tuttavia, le cellule isolate mancano di un ambiente extracellulare tridimensionale cruciale per la meccanorisposta, e sia gli studi in vitro che quelli sull'espianto asportato non riescono a ricapitolare l'ambiente di deformazione multiassiale generato dall'impingement tendineo in vivo, che dipende dalle caratteristiche anatomiche della regione impattata. Inoltre, i modelli in vivo di impingement tendineo mancano di controllo sull'ambiente di deformazione meccanica. Per superare queste limitazioni, presentiamo un nuovo modello murino di espianto dell'arto posteriore adatto allo studio della meccanobiologia dell'impingement del tendine d'Achille. Questo modello mantiene il tendine d'Achille in situ per preservare l'anatomia locale e riproduce l'ambiente di deformazione multiassiale generato dall'impatto dell'inserzione del tendine d'Achille sul calcagno durante la flessione dorsale della caviglia applicata passivamente, mantenendo le cellule all'interno del loro ambiente nativo. Descriviamo un protocollo di coltura tissutale parte integrante di questo modello e presentiamo i dati che stabiliscono la vitalità dell'espianto sostenuta per 7 giorni. I risultati rappresentativi dimostrano una migliore colorazione istologica del GAG e una diminuzione dell'allineamento delle fibre di collagene secondarie al impingement, suggerendo un'elevata formazione di fibrocartilagine. Questo modello può essere facilmente adattato per studiare diversi regimi di carico meccanico e consente la manipolazione di percorsi molecolari di interesse per identificare i meccanismi che mediano il cambiamento fenotipico nel tendine d'Achille in risposta all'impingement.
Introduzione
Una moltitudine di tendini, tra cui il tendine d'Achille e i tendini della cuffia dei rotatori, subiscono un conflitto osseo a causa del normale posizionamento anatomico1,2,3,4. L'impingement tendineo genera una deformazione di compressione diretta trasversalmente all'asse longitudinale della fibra5,6,7. Le regioni di conflitto tendineo dimostrano un fenotipo unico della fibrocartilagine in cui le cellule rotonde e rimpicciolite (fibrocondrociti) sono incorporate all'interno di una rete di collagene disorganizzata con un contenuto di glicosaminoglicani (GAG) marcatamente aumentato2,3,4,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24. Studi precedenti suggeriscono che il disparato ambiente meccanico prodotto dall'impingement tendineo sostiene questa matrice ricca di gag guidando la deposizione di grandi proteoglicani aggreganti, in particolare l'aggrecano, anche se i meccanismi sottostanti non sono chiari1,3,12,13,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39. Mentre la fibrocartilagine è una caratteristica normale nelle regioni colpite dei tendini sani, il metabolismo aberrante dei proteoglicani associato all'eccessiva formazione di fibrocartilagine è una caratteristica distintiva della tendinopatia, una malattia comune e debilitante che emerge in modo sproporzionato nei tendini cronicamente impattati1,40,41,42,43,44,45,46,47,48,49. Di conseguenza, l'impingement tendineo è clinicamente riconosciuto come un importante fattore estrinseco alla base di molte delle tendinopatie più comuni, tra cui la malattia della cuffia dei rotatori e la tendinopatia inserzionale del tendine d'Achille (IAT)50,51,52. Attualmente, il trattamento della tendinopatia è inefficiente. Ad esempio, circa il 47% dei pazienti con IAT richiede un intervento chirurgico dopo una gestione conservativa fallita, con esiti postoperatori variabili53,54,55,56. Nonostante l'apparente relazione tra impingement e tendinopatia, i meccanismi meccanobiologici attraverso i quali le cellule nel tendine impattato percepiscono e rispondono al loro ambiente meccanico sono scarsamente descritti, il che oscura la comprensione della patogenesi della tendinopatia e si traduce in un trattamento inadeguato.
I modelli di espianto sono strumenti utili nello studio della meccanobiologia tendinea57,58. Come primo passo verso la comprensione della meccanobiologia dell'impingement tendineo, diversi studi precedenti hanno esplorato la risposta cellulare in seguito all'applicazione di una semplice compressione uniassiale alle cellule o agli espianti di tendiniasportati 27,29,30,31,32,33,34,39. Tuttavia, le cellule in vitro mancano di matrici extracellulari e pericellulari che facilitano il trasferimento di ceppi, sequestrano importanti fattori di crescita e citochine rilasciate dalla deformazione meccanica e forniscono substrato per complessi di adesione focale che svolgono un ruolo nella meccanotrasduzione57,59. Inoltre, sia gli studi in vitro che quelli con espianto asportato non riescono a ricapitolare l'ambiente di deformazione meccanica multiassiale generato dall'impingement tendineo in vivo, che dipende dalle caratteristiche anatomiche della regione impattata 5,6. Nel contesto dell'inserzione del tendine d'Achille impattata, ciò include i tessuti circostanti come la borsa retrocalcaneare e il cuscinetto adiposo 60,61,62,63 di Kager. Al contrario, i modelli in vivo di impingement tendineo 25,28,36,37,38,64,65,66 consentono un controllo minimo sull'entità e sulla frequenza del carico applicato direttamente al tendine, che è una limitazione ben nota dei modelli in vivo per lo studio della meccanobiologia tendinea 57,58,67,68,69,70. Date le sfide nella misurazione della deformazione tendinea in vivo, l'ambiente di deformazione interna generato all'interno di questi modelli è spesso scarsamente caratterizzato.
In questo manoscritto, presentiamo una piattaforma sperimentale personalizzata che ricrea l'impingement dell'inserzione del tendine d'Achille sul calcagno all'interno di espianti dell'arto posteriore murino intero che, se abbinato a questo protocollo di coltura tissutale, mantiene la vitalità per 7 giorni in coltura di espianto e consente lo studio delle sequele biologiche dell'impingement tendineo. La piattaforma è costruita su una base di acido polilattico (PLA) stampata in 3D che fornisce la base per il fissaggio delle impugnature e l'inserto di riduzione del volume in PLA stampato in 3D. Le impugnature vengono utilizzate per bloccare la parte superiore della gamba e il ginocchio prossimale alla giunzione miotendinea di Achille con l'aspetto caudale dell'arto posteriore rivolto verso l'alto, consentendo di visualizzare il tendine d'Achille dall'alto utilizzando una sonda a ultrasuoni o un microscopio invertito (Figura 1A). L'inserto di riduzione del volume scorre lungo un binario sulla base e riduce il volume richiesto dei terreni di coltura tissutale. Una linea intrecciata avvolta attorno alla zampa posteriore viene instradata fuori dalla piattaforma utilizzando il design della base e una clip in PLA stampata in 3D. Tirando la corda, la zampa posteriore viene dorsiflessa e l'inserzione del tendine d'Achille viene urtata contro il calcagno, con conseguente elevata deformazione di compressione trasversale 5,6 (Figura 1A). La piattaforma è contenuta all'interno di un bagno acrilico che mantiene gli espianti dell'arto posteriore immersi nei terreni di coltura tissutale. Fissando la corda tesa all'esterno della vasca con nastro adesivo si mantiene la flessione dorsale della caviglia per produrre un impatto statico dell'inserzione del tendine d'Achille. I file CAD per i componenti stampati in 3D sono forniti in più formati (File supplementare 1), consentendo l'importazione in una gamma di software CAD commerciali e gratuiti open source per la modifica in base alle esigenze sperimentali. Se l'accesso alle stampanti 3D non è disponibile per la fabbricazione, i file CAD possono essere forniti ai servizi di stampa 3D online che stamperanno e spediranno le parti a basso costo.
È importante sottolineare che il complesso muscolotendineo tricipite surale-achille si estende su entrambe le articolazioni del ginocchio e della caviglia 71,72,73. Di conseguenza, la tensione di trazione nel tendine d'Achille è influenzata dalla flessione del ginocchio. L'estensione del ginocchio mette in tensione il tendine d'Achille, mentre la flessione del ginocchio riduce la tensione. Estendendo prima il ginocchio e poi flettendo passivamente la caviglia, le deformazioni di compressione all'inserzione impattata possono essere sovrapposte alle deformazioni di trazione. Al contrario, flettendo passivamente la caviglia con il ginocchio flesso, la tensione di trazione si riduce e la tensione di compressione rimane. L'attuale protocollo esplora tre di queste condizioni. 1) Per l'impingement statico, il piede viene piegato dorsalmente a < 110° rispetto alla tibia per ostacolare l'inserimento, con il ginocchio flesso per ridurre la tensione. 2) Per il gruppo di tensione basale, la caviglia viene estesa oltre i 145° di flessione dorsale con il ginocchio esteso, generando una tensione di trazione prevalente all'inserzione. 3) Per il gruppo scarico, gli espianti vengono coltivati in una capsula di Petri con il ginocchio e la caviglia in posizione neutra in assenza di carico applicato esternamente. Gli angoli di cui sopra sono misurati fotograficamente rispetto a un sistema di coordinate in cui il piede e la tibia sono paralleli con un angolo di 180° e perpendicolari con un angolo di 90°.
Le fasi chiave del protocollo includono: 1) la dissezione degli espianti degli arti posteriori e l'attenta rimozione della cute e del tendine plantare; 2) coltura di espianto dopo un pretrattamento di 48 ore con desametasone; 3) sezionamento tissutale e colorazione istologica; e 4) analisi dell'immagine a colori per valutare la formazione di fibrocartilagine. Dopo la dissezione, ogni espianto dell'arto posteriore viene pretrattato per 48 ore in terreni di coltura integrati con desametasone74. Gli arti controlaterali di ciascun topo vengono assegnati a gruppi sperimentali separati per il confronto a coppie, che aiuta a controllare la variabilità biologica. Dopo il pretrattamento, gli espianti vengono posizionati su piattaforme come descritto sopra e coltivati per altri 7 giorni (Figura 1B). Ulteriori confronti vengono effettuati con un gruppo pretrattato (giorno 0) in cui gli espianti vengono rimossi immediatamente dopo il pretrattamento di 48 ore.
Dopo la coltura dell'espianto, gli arti posteriori vengono tagliati, fissati in formalina, decalcificati e incorporati in paraffina. Il sezionamento seriale in orientamento sagittale fornisce la visualizzazione del tendine d'Achille dalla giunzione miotendinea all'inserzione calcaneare, consentendo al contempo di monitorare la profondità della sezione attraverso l'intero tendine. La marcatura dUTP X-nick mediata dalla deossinucleotidil transferasi terminale (TdT) (TUNEL) viene utilizzata per visualizzare il danno al DNA secondario all'apoptosi e valutare la vitalità. L'istologia del blu di toluidina e l'analisi dell'immagine a colori personalizzata vengono eseguite per quantificare i cambiamenti nella colorazione GAG. Le sezioni di tessuto colorate con blu di toluidina vengono quindi utilizzate per l'imaging SHG per caratterizzare le alterazioni nell'organizzazione delle fibre del collage (Figura 1B).
I risultati rappresentativi forniti suggeriscono un'alterata colorazione istologica della matrice ricca di gag e la disorganizzazione della rete di collagene extracellulare generata da 7 giorni di impingement statico all'interno del modello. Questo modello può essere utilizzato per esplorare i meccanismi molecolari alla base del cambiamento fibrocartilagineo guidato dall'impingement.
Protocollo
Tutto il lavoro sugli animali è stato approvato dal Comitato per le risorse animali dell'Università di Rochester.
1. Preparazione dei terreni di coltura tissutale
- Coltivare tutti gli espianti in Modified Eagle Medium di Dulbecco (1x DMEM) con penicillina-streptomicina all'1% v/v e acido L-ascorbico 200 μM in un incubatore a 37 °C e 5% di CO2 . Per il pretrattamento iniziale di 48 ore, coltura di ciascun espianto in 70 mL di terreno di coltura integrato con 100 nM di desametasone74. Dopo il pretrattamento, coltivare gli arti per altri 7 giorni senza desametasone, cambiando terreno ogni 48-72 ore.
NOTA: L'aggiunta di siero, come il siero fetale bovino, ai terreni di coltura non è consigliata in linea con le raccomandazioni fornite da Wunderli, Blache e Snedeker57. In breve, le condizioni di assenza di siero rappresentano meglio il microambiente tendineo avascolare e povero di nutrienti che esiste in vivo. Inoltre, l'integrazione sierica può promuovere la degradazione dei tessuti in determinate condizioni di coltura75 e stimolare la proliferazione e la migrazione cellulare fuori dal tessuto, entrambe caratteristiche della patologia tendinea57. - Per il gruppo scarico, coltivare ogni espianto in 70 mL di terreno. Per i gruppi di tensione basale e impingement statico, ogni piattaforma richiede circa 125 mL di terreno di coltura per mantenere l'arto sommerso. Questo volume può variare a seconda del posizionamento della gamba superiore nelle impugnature e dei parametri di stampa 3D, principalmente la densità di riempimento.
2. Dissezione dell'espianto e pretrattamento con desametasone
- Eutanasiare i topi tramite inalazione di CO2 e lussazione cervicale secondaria, o secondo le linee guida istituzionali. Questo protocollo utilizza topi C57BL/6 di età inferiore a 1 anno. Le dimensioni degli arti posteriori aumentano con l'età e possono diventare difficili da inserire nelle impugnature.
- Prima della dissezione, trasferire 70 mL di terreno di coltura preriscaldato (37 °C) in una capsula di Petri di 100 mm (diametro) x 25 mm (altezza) in una cabina di sicurezza biologica sterile (BSC). Aggiungere desametasone per raggiungere una concentrazione di lavoro di 100 nM.
- Le dissezioni possono essere eseguite sul banco di lavoro utilizzando sottocuscinetti assorbenti, lavorando rapidamente attraverso la dissezione prima di trasferire gli espianti degli arti posteriori nel BSC. Assemblare gli strumenti chirurgici necessari per questa dissezione, che includono pinze lisce, dritte e a punta fine; pinze dritte a punta fine con denti seghettati; e forbici dritte, affilate e fini.
- Per la dissezione degli espianti degli arti posteriori, posizionare il topo in posizione supina e identificare l'articolazione dell'anca. Usando delle forbici sottili, fai una piccola incisione (5-10 mm) attraverso la pelle che si sovrappone all'aspetto prossimale e anteriore (cranico) della parte superiore della gamba.
- Separare l'incisione per espanderla, pizzicare la parte superiore della gamba esposta con le dita e tirare con cautela la pelle distalmente per deglove l'arto posteriore al livello della caviglia. Inserire delicatamente una lama a forbice sotto la pelle lungo la parte dorsale del piede e praticare un'incisione che si estende fino alle dita dei piedi. Continuare a tirare la pelle distalmente per rimuoverla completamente.
- Posizionare il mouse per visualizzare l'inserzione del tendine d'Achille sulla parte posteriore (caudale) del calcagno, vicino alla caviglia. Prossimale all'inserzione del tendine d'Achille, il tendine plantare si trova direttamente adiacente al bordo mediale del tendine d'Achille e si estende distalmente verso l'aspetto plantare del piede, passando sopra l'aspetto posteriore del calcagno.
- Per rimuovere il tendine plantare, inserire con cautela una punta della pinza liscia e a punta fine tra i due tendini ed estendere la punta medialmente passando sotto il tendine plantare. Disegna la punta prossimalmente e strappa il muscolo plantare. Usando una pinza seghettata a punta fine, afferrare l'estremità prossimale staccata del tendine plantare e tirare distalmente per rimuoverlo.
- All'articolazione dell'anca, usa delle forbici sottili per tagliare il bacino e isolare l'arto posteriore. Usa le forbici per staccare il bacino rimanente ed esporre la testa del femore.
- Trasferire l'espianto dell'arto posteriore nel BSC e nella capsula contenente il terreno di coltura cellulare con desametasone. Spostare la capsula nell'incubatrice e pretrattare per 48 ore.
3. Coltura di espianto e piattaforme di carico
- Al termine del pretrattamento di 48 ore, preriscaldare volumi sufficienti di terreni di coltura (paragrafo 1). Da questo momento in poi, nessun desametasone verrà aggiunto ai terreni di coltura. A questo punto, gli arti del gruppo pretrattato (giorno 0) possono essere fissati, decalcificati e incorporati in paraffina per il sezionamento, la colorazione e l'analisi futuri.
- Per il gruppo scarico, aspirare i terreni di pretrattamento e trasferire gli espianti in piastre di Petri fresche, aggiungere 70 ml di terreno di coltura ciascuno e rimettere nell'incubatore.
- Per i gruppi di tensione di base e di impingement statico, preparare le piattaforme di espianto. Tagliare pezzi di carta vetrata di dimensioni simili alle piastre di presa. Per il gruppo di impingement statico, tagliare pezzi di filo intrecciato di circa 18 pollici di lunghezza e pre-legare un nodo a rovescio sciolto a metà della lunghezza del filo. Strappare pezzi di foglio di alluminio per coprire ogni bagno acrilico e spruzzare con etanolo al 70% (EtOH). Trasferire i preparativi al BSC.
- Ogni piattaforma include un bagno in acrilico, una base, un inserto per la riduzione del volume, una clip e impugnature. Ogni impugnatura include due piastre e tre diversi tipi di viti, tra cui una vite con filettatura M5 x 0,8 mm x 10 mm di lunghezza che fissa le impugnature alla base; due viti filettate M6 x 1 mm x lunghe 20 mm che estendono i piani per bloccare le impugnature; e quattro viti filettate M3 x 0,5 mm x lunghe 14 mm che, in combinazione con quattro molle di compressione, ritraggono i piani per aprire le impugnature.
- Collocare tutti i componenti in contenitori secondari in grado di catturare tutti i terreni di coltura in caso di perdita. Immergere in ≥ soluzione di candeggina al 10% e lasciare in ammollo per almeno 1 ora. Risciacquare la soluzione di candeggina con acqua di rubinetto (in autoclave se necessario) e spostarla nel BSC.
NOTA: Per la risoluzione dei problemi di contaminazione, prendere in considerazione la sterilizzazione in autoclave di tutta l'acqua del rubinetto o l'utilizzo di acqua purificata. Vedere la discussione per ulteriori suggerimenti su come affrontare la contaminazione. - Utilizzare le viti M3 e le molle di compressione per fissare le piastre alle impugnature, fissare le impugnature alla base utilizzando la vite M5 e inserire le viti M6 finché non si innestano nelle piastre. Utilizzare del nastro biadesivo per fissare la carta vetrata alle piastre, quindi chiudere le impugnature per favorire l'adesione della carta vetrata alle piastre. Ripetere l'operazione per tutte le piattaforme.
- Quando si è pronti a caricare una piattaforma, aprire completamente le impugnature e, utilizzando le pinze, posizionare la parte superiore della gamba e il ginocchio tra le piastre con la superficie superficiale del tendine d'Achille rivolta verso l'alto (Figura 1A). Chiudere liberamente le impugnature per tenerle delicatamente in posizione.
- Usa le pinze per afferrare la testa o il piede del femore esposto e manipola l'angolo di flessione del ginocchio mentre chiudi gradualmente le impugnature per fissarle in posizione. Per il gruppo di tensione basale, estendere l'articolazione del ginocchio come descritto in precedenza. Man mano che le impugnature si stringono con il ginocchio esteso, la caviglia dovrebbe estendersi naturalmente. Per il gruppo di impingement statico, flettere l'articolazione del ginocchio tra le impugnature come descritto in precedenza.
- Per il gruppo di impingement statico, posizionare il nodo a rovescio della corda attorno alla zampa distale e stringere. Instradare la corda attraverso una fessura nella base situata sotto l'espianto e attraverso il foro della clip. Posizionare la base nel bagno acrilico e fissare la clip al bordo superiore del bagno (Figura 1A).
- Tirare la corda per flettere dorsalmente il piede ad almeno 110° rispetto alla tibia e utilizzare un pennarello indelebile per segnare la corda mentre esce dalla clip. Scattare una fotografia dell'espianto in questa posizione per quantificare successivamente l'angolo di flessione dorsale (Figura 1A).
- Rimuovere la base e fissare l'inserto di riduzione del volume facendolo scorrere lungo un binario sulla base. Riposizionare la base (ora attaccata all'inserto di riduzione del volume) nel bagno acrilico e riposizionare la clip sul bordo superiore. Tirare la corda per tornare all'angolo di flessione dorsale originale usando la corda contrassegnata come guida e fissare la corda all'esterno della vasca con del nastro adesivo per mantenere la flessione dorsale statica.
- Per il gruppo di tensione della linea di base, è sufficiente posizionare la base con l'inserto di riduzione del volume nel bagno acrilico una volta che l'espianto è posizionato tra le impugnature e scattare una fotografia per la quantificazione dell'angolo di flessione dorsale.
- Aggiungere 125 mL di terreno di coltura preriscaldato (37 °C) a ciascuna piattaforma per immergere gli espianti. Coprire la parte superiore del bagno con un foglio di alluminio, metterlo in un contenitore secondario e spostarlo nell'incubatrice. Coltura per altri 7 giorni, cambiando terreno ogni 48-72 ore.
NOTA: Il nastro posizionato sulla parte superiore del bagno può impedire alle parti in PLA di galleggiare.
4. Fissazione, decalcificazione e inclusione della paraffina
- Dopo l'espianto, utilizzare le forbici per tagliare le unghie dei piedi/dita distali e tagliare la parte superiore della gamba prossimale alla giunzione miotendinea del tendine d'Achille. Posizionare ciascuna articolazione della caviglia tagliata in una cassetta di lavorazione rivestita con tamponi per biopsia in schiuma. Spingere la caviglia nell'angolo della cassetta per posizionare la caviglia a circa 90° di flessione dorsale e chiudere la cassetta per mantenerla in posizione.
- Fissare per 3 giorni in formalina tamponata neutra al 10% (NBF) e decalcificare per 2 settimane in acido etilendiamenetetraacetico (EDTA) al 14% disciolto in acqua distillata (diH2O) con pH regolato a 7,4-7,6 con acido acetico glaciale.
- Per rimuovere i sali, sciacquare accuratamente i campioni tre volte in soluzione salina tamponata con fosfato (PBS) 1x seguita da diH2O, 5 minuti ciascuna. Eseguire l'elaborazione di routine del campione per l'istologia della paraffina: disidratare attraverso una serie graduata di EtOH, eliminare in xilene e infiltrare con cera di paraffina. Orientare e incorporare i campioni nella paraffina per ottenere sezioni di tessuto sagittale attraverso il tendine d'Achille in progressione da mediale a laterale, come descritto nella sezione 5 di seguito (Figura 1B).
5. Sezionamento dei tessuti
- Con un microtomo, tagliare con cura il campione fino a quando le sezioni non sono parallele alla faccia del blocco. Tagliare grossolanamente la caviglia dall'aspetto mediale dell'articolazione, fermandosi prima di raggiungere il bordo mediale dell'inserzione del tendine d'Achille.
- Trasferire il campione su un blocco di ghiaccio per regolare la temperatura e l'idratazione e cambiare le lame (o passare a una nuova sezione della lama corrente). Continuare il sezionamento nel campione a 10 μm di spessore e identificare attentamente l'ingresso nell'inserzione del tendine d'Achille con un microscopio in campo chiaro. Una volta identificato, eseguire il sezionamento seriale del numero di sezione (cioè la profondità del tessuto) attraverso l'intera inserzione del tendine d'Achille.
6. Deparaffinazione/reidratazione e selezione dei vetrini
- Per ogni test riportato di seguito, selezionare sezioni di tessuto di livello corrispondente da ciascuna coppia di arti controlaterali. Prima della colorazione, posizionare su una rastrelliera per vetrini e passare attraverso 3 cambi di xilene, 2 cambi di EtOH al 100%, 2 cambi di EtOH al 95% e 1 cambio di EtOH al 70%, 5 minuti ciascuno. Terminare la reidratazione in diH2O.
7. TUNEL per valutare la vitalità del tendine d'Achille
- Per l'etichettatura TUNEL, colorare secondo il protocollo del produttore. Incubare in 20 μg/mL di proteinasi K per 20 minuti a temperatura ambiente e risciacquare in diH2O. Incubare in 50 μL di soluzione di colorante TUNEL (5 μL di soluzione enzimatica, 45 μL di soluzione di marcatura) per 1 ora a 37 °C. Risciacquare con diH2O. Montare con reagente antisbiadimento contenente DAPI e vetrino coprioggetti.
- Immagine dell'inserzione del tendine d'Achille utilizzando un microscopio a fluorescenza con un obiettivo 4x. Includere un canale DAPI (lunghezze d'onda di eccitazione/emissione = 360/460 nm) per visualizzare tutti i nuclei, un canale TUNEL (TMR Red) (lunghezze d'onda di eccitazione/emissione = 540/580 nm) per visualizzare i nuclei apoptotici e, se possibile, un canale in campo chiaro.
- Per l'analisi delle immagini, importare le immagini in un software di analisi delle immagini adatto per l'elaborazione basata sul ROI, come FIJI/ImageJ o MATLAB. Definire una regione di interesse (ROI) che delinei l'intero tendine d'Achille in vista (Figura 2A), escludendo le cellule dell'epitenon che sono altamente suscettibili alla morte indotta dalla dissezione e dall'improvviso cambiamento delle condizioni ambientali quando vengono messe in coltura.
- Per fare ciò, esegui la selezione del ROI in MATLAB importando l'immagine in campo chiaro e utilizzando la funzione drawpolygon() per tracciare e racchiudere i contorni del tendine. MATLAB crea un oggetto Polygon per il ROI, che può quindi essere applicato alle immagini dei canali DAPI e TUNEL per mascherare i dati di intensità dei pixel al di fuori del ROI utilizzando createMask() per analizzare solo i nuclei all'interno del tendine d'Achille.
- Importare le immagini dei canali DAPI e TUNEL e identificare una soglia di intensità di fluorescenza per la definizione dei nuclei apoptotici (TUNEL+) normalizzandoli alla massima intensità di fluorescenza dei nuclei apoptotici in tessuti non vitali come ossa, muscoli o grasso che vengono accidentalmente catturati nella sezione tissutale. Una volta mascherate le immagini, calcolare la frazione di nuclei apoptotici (nuclei TUNEL+/nuclei DAPI) all'interno del tendine d'Achille.
8. Istologia blu di toluidina per caratterizzare la formazione di fibrocartilagine
- Una volta reidratato (Sezione 6), trasferire il rack di vetrini con sezioni di tessuto a livello corrispondente da coppie controlaterali di espianti allo 0,4% p/v di blu di toluidina O in tampone acetato di sodio 0,1 M con pH regolato a 4,0 utilizzando acido acetico glaciale. Incubare per 10 minuti a temperatura ambiente, quindi sciacquare 3 volte in diH2O per 30 secondi ciascuna.
- Disidratare attraverso tre cambiamenti di EtOH al 95% e due cambiamenti di EtOH al 100%, 30 s ciascuno. Eliminare attraverso tre cambi di xilene, 1 minuto ciascuno. Vetrino coprioggetti con mezzo di montaggio a base di xilene.
- Ottieni immagini a colori rosso-blu-verde (RGB) a 24 bit dell'inserzione del tendine d'Achille. Ad esempio, per questo protocollo utilizzare un adattatore per interfacciare una fotocamera digitale a colori all'oculare di un semplice microscopio in campo chiaro con obiettivo 4x.
- Per quantificare le differenze nella colorazione del blu di toluidina all'interno della fibrocartilagine tendinea compressiva (CTF)16 all'inserzione del tendine d'Achille (Figura 3A,B), importare immagini RGB in un software di analisi delle immagini in grado di definire e gestire più ROI. Le opzioni includono le selezioni e gli strumenti di gestione del ROI in FIJI/ImageJ o il toolbox di elaborazione delle immagini in MATLAB. Inizia impostando la scala pixel/lunghezza.
NOTA: La scelta del software è lasciata alla discrezione del ricercatore e non è certamente limitata a MATLAB o FIJI/ImageJ. Gli autori hanno fornito il codice MATLAB (Supplementary File 2), la documentazione che descrive l'implementazione (Supplementary File 3) e un'immagine di esempio (Supplementary File 4). Incoraggiamo i ricercatori a tradurre questo codice in linguaggi di programmazione alternativi per l'uso in altri software, se necessario o preferito. - Con l'immagine visualizzata nel software scelto, identificare l'intersezione del bordo tendineo profondo con il calcagno. Da qui, tracciare prossimalmente 800 μm lungo il bordo tendineo profondo per stabilire il confine profondo del CTF. Ad esempio, utilizzare la funzione drawpolyline() in MATLAB per disegnare in modo interattivo una polilinea sull'immagine RGB. MATLAB crea un oggetto Polilinea contenente i vertici della linea, che può essere elaborato e tagliato fino a una lunghezza di 800 μm.
- Da questa posizione, creare il contorno prossimale della CTF disegnando un segmento di linea che si collega al bordo del tendine superficiale perpendicolare all'orientamento locale della fibra.
- Tornare all'intersezione tra il bordo tendineo profondo e il calcagno e definire il confine distale del CTF disegnando un segmento di linea che si collega al bordo del tendine superficiale lungo il segno di marea distinto che separa il CTF dalla fibrocartilagine della zona di attacco (AZF)16 (Figura 3A,B). Infine, generare il confine superficiale della CTF tracciando il bordo del tendine superficiale da racchiudere.
- Per descrivere le variazioni spaziali nella colorazione GAG attraverso l'inserzione, dividere il CTF totale in 4 quadranti (Figura 3A,B). Collegare il punto medio dei contorni CTF profondi e superficiali con un segmento di linea per creare un contorno distale/prossimale. Passando attraverso il punto medio di questo limite, collegare i punti medi dei confini CTF distali e prossimali lungo l'orientamento della fibra per creare un confine superficiale/profondo.
- Questi 6 confini forniscono informazioni che possono essere utilizzate per definire il ROI che rappresenta l'intera CTF, ma anche 4 quadranti che suddividono la CTF. In MATLAB, ad esempio, compila i vertici che definiscono i confini di ogni singola ROI (CTF, quadranti 1-4) in vettori e usa images.roi.Polygon() per generare oggetti Polygon racchiusi per ogni ROI.
- Una volta definiti i ROI, è possibile trasformare i dati dei pixel RGB nello spazio colore Hue-Saturation-Value (HSV) utilizzando il plug-in del trasformatore di colore in FIJI, la funzione rgb2hsv() in MATLAB o un altro software che applica le equazioni di trasformazione appropriate76. I dati HSV possono quindi essere proiettati nello spazio di saturazione della tonalità 2D, dove ogni combinazione di tonalità e saturazione codifica un colore univoco (Figura 3C).
- All'interno di ogni ROI, calcola la tonalità e la saturazione medie che descrivono il colore medio della macchia nel ROI. Ciò può essere ottenuto in MATLAB, ad esempio, utilizzando gli oggetti Polygon che definiscono ogni ROI per mascherare l'immagine utilizzando createMask() al fine di analizzare i dati dei pixel di saturazione della tonalità in modo specifico all'interno di ogni ROI.
- Definire un altro piccolo ROI all'interno della fibrocartilagine periostale (PF)16 (Figura 3A, B) e calcolare la tonalità e la saturazione medie. Quindi, calcolare la distanza euclidea che separa il colore medio in ogni ROI del CTF da quello del PF (Figura 3C).
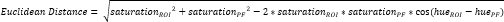
NOTA: Il calcolo della distanza euclidea descrive il grado di somiglianza tra il colore medio del ROI e quello del PF, un tessuto fibrocartilagineo per eccellenza 16,17,77. Una distanza euclidea minore indica un colore ROI dall'aspetto più fibrocartilagineo. - Utilizzare questa distanza per calcolare il punteggio della fibrocartilagine, che presuppone un valore massimo di 1 se il colore ROI è identico al colore PF e un valore minimo di -1 se il colore ROI e PF raggiungono la massima separazione all'interno dello spazio colore tonalità-saturazione.
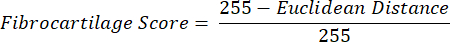
- Dati medi per la tonalità, la saturazione e il punteggio della fibrocartilagine all'interno di ciascun ROI in sezioni di tessuto di ciascun arto. Eseguire confronti statistici accoppiati tra gruppi di arti controlaterali.
9. Imaging SHG per studiare il cambiamento nell'organizzazione della rete di collagene
- Eseguire l'imaging SHG delle sezioni colorate di blu di toluidina utilizzando un sistema di microscopio capace con una lente per oggetti 20x. Acquisisci le pile z attraverso lo spessore della sezione ed esegui la scansione delle piastrelle secondo necessità per acquisire completamente l'inserimento del tendine d'Achille.
- Importare le immagini SHG in un software di analisi delle immagini preferito e definire le ROI che comprendono e suddividono la CTF all'inserzione del tendine d'Achille come descritto per l'analisi dell'immagine blu di toluidina nella sezione 8 (Figura 4A,B).
- Se le immagini SHG vengono importate in MATLAB, utilizzare l'approccio per definire le ROI CTF in MATLAB come descritto nella sezione 8 . Dopo aver definito le ROI, trasferisci le coordinate ROI nelle FIJI esportando i vertici ROI da MATLAB come file .txt e importandoli nelle FIJI utilizzando File > Import > XY Coordinates. Sovrapponi la selezione e inviala al responsabile del ROI per l'analisi.
- Per quantificare l'organizzazione del collagene, utilizza il plug-in Directionality in FIJI, che esegue l'analisi dello spettro di Fourier per calcolare le distribuzioni degli orientamenti delle fibre attraverso piccole finestre che si estendono su un ROI. La diffusione di questa distribuzione, indicata come dispersione, è inversamente correlata all'allineamento delle fibre.
NOTA: Le fibre di collagene possono assumere orientamenti variabili in diverse finestre attraverso la CTF a causa della curvatura grossolana del tendine piuttosto che dell'assenza di allineamento/organizzazione. Per distinguere meglio i cambiamenti nell'organizzazione del collagene dalla curvatura grossolana del tendine all'inserzione, è necessario definire ROI più piccoli. - Importa le immagini SHG in FIJI e imposta la scala pixel/lunghezza. Proietta i dati di massima intensità dei pixel in un'immagine composita 2D e aggiungi ROI a ROI Manager. Sovrapponi in sequenza ogni ROI CTF all'immagine e disegna 10 piccole ROI secondarie di dimensioni coerenti all'interno della ROI, aggiungendo le ROI secondarie al gestore ROI.
- All'interno di ogni sub-ROI, esegui il plug-in di direzionalità in FIJI per calcolare la dispersione della fibra. Dati di dispersione medi tra i sub-ROI all'interno di ciascun ROI CTF e dati di dispersione media all'interno di ciascun ROI CTF tra le sezioni di ciascun espianto. Eseguire confronti statistici accoppiati tra gruppi di arti controlaterali.
Risultati
Le immagini rappresentative delle sezioni di tessuto colorate con TUNEL dimostrano nuclei apoptotici minimi all'interno del corpo del tendine d'Achille dopo 7 giorni di coltura di espianto in tutti i gruppi sperimentali (Figura 2A). La quantificazione di queste immagini fornisce la prova che il protocollo di coltura tissutale mantiene in media fino al 78% di vitalità all'interno del tendine d'Achille dopo 7 giorni di coltura di espianto in tutte le condizioni di carico (
Discussione
La piattaforma sperimentale di espianto dell'arto posteriore murino abbinata al protocollo di coltura tissutale descritto in questo studio fornisce un modello adatto per studiare la meccanobiologia della formazione di fibrocartilagine guidata dal conflitto all'inserzione del tendine d'Achille. L'utilità di questo modello di espianto è dimostrata dai risultati rappresentativi, che indicano il mantenimento della vitalità cellulare in concomitanza con un cambiamento significativo e spazialmente eterogeneo nella colorazio...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori sono grati per il supporto e l'assistenza forniti da Jeff Fox e Vidya Venkatramani del Centro per la ricerca muscoloscheletrica dell'Università di Rochester per l'istologia, la biochimica e l'imaging molecolare (HBMI) Core, finanziato in parte da P30AR06965. Inoltre, gli autori desiderano ringraziare il Center for Light Microscopy and Nanoscopy (CALMN) presso l'Università di Rochester Medical Center per l'assistenza con la microscopia multifotone. Questo studio è stato finanziato da R01 AR070765 e R01 AR070765-04S1, nonché da 1R35GM147054 e 1R01AR082349.
Materiali
| Name | Company | Catalog Number | Comments |
| Absorbent underpads | VWR | 82020-845 | For benchtop dissection |
| Acrylic bath | Source One | X001G46CB1 | Contains the explant platform submerged in culture media |
| Autoclave bin | Thermo Scientific | 13-361-20 | Used as secondary containment, holds two platforms |
| Base | - | - | 3D printed from CAD files provided as Supplementary Files |
| Braided line | KastKing | 30lb test | Used to wrap around paw and apply ankle dorsiflexion |
| Clip | - | - | 3D printed from CAD files provided as Supplementary Files |
| Cover glass | Fisherbrand | 12-541-034 | Rectangular, No. 2, 50 mm x 24 mm |
| Cytoseal XYL | VWR | 8312-4 | Xylene-based mounting media for coverslipping Toluidine blue stained tissue sections |
| Dexamethasone | MP Biomedical LLC | 194561 | CAS#50-02-2 |
| Dimethyl sulfoxide (DMSO), anhydrous | Invitrogen by ThermoFisher | D12345 | CAS#67-68-5, use to solubilize dexamethasone into concentrated stock solutions |
| Double-sided tape | Scotch Brand | 34-8724-5195-9 | To attach sandpaper to Grip platens |
| Dulbecco's Modified Eagle Medium (1X DMEM) | Gibco by ThermoFisher | 11965092 | high glucose, (-) pyruvate, (+) glutamine |
| EDTA tetrasodium salt dihydrate | Thermo Scientific Chemicals | J15700.A1 | CAS#10378-23-1, used to make 14% EDTA solution for sample decalcifcation |
| Ethanol, 200 proof | Thermo Scientific | T038181000 | CAS#64-17-5, 1 L supply |
| Foam biopsy pads | Leica | 3801000 | Used with processing cassettes, help hold ankle joints in desired position during fixation and decalcification |
| Forceps, #SS Standard Inox | Dumont | 11203-23 | Straight, smooth, fine tips |
| Forceps, Micro-Adson 4.75" | Fisherbrand | 13-820-073 | Straight, fine tips with serrated teeth |
| Garnet Sandpaper, 50-D Grit | Norton | M600060 01518 | Or other coarse grit sandpaper |
| Glacial acetic acid | Fisher Chemical | A38S-500 | CAS#64-19-7, for adjusting pH of sodium acetate buffer used for Toluidine blue histology, as well as 14% EDTA decalcification solution |
| Grips | ADMET | GV-100NT-A4 | Stainless steel vice grips, screws and springs described in the protocol are included |
| Histobond Adhesive Microscope Slides | VWR | 16005-108 | Sagittal sections of hind limbs explants reliably adhere to these slides through all staining protocols |
| In situ Cell Death Detection Kit, TMR Red | Roche | 12156792910 | TUNEL assay |
| Labeling tape | Fisherbrand | 15-959 | Or any other labeling tape of preference |
| L-ascorbic acid | Sigma-Aldrich | A4544-100G | CAS#50-81-7, for culture media formulation |
| Neutral buffered formalin, 10% | Leica | 3800600 | For sample fixation, 5 gallon supply |
| Nunc petri dishes | Sigma-Aldrich | P7741-1CS | 100 mm diameter x 25 mm height, maintain explants submerged in 70 mL of culture media as described in protocol |
| Penicillin-streptomycin (100X) | Gibco by ThermoFisher | 15140122 | Add 5 mL to 500 mL 1X DMEM for 1% v/v (1X) working concentration |
| Polylactic acid (PLA) 1.75 mm filament | Hatchbox | - | Choose filament diameter compatible with your 3D printer extruder, in color of choice. |
| Processing cassettes | Leica | 3802631 | For fixation, decalcification and paraffin embedding |
| Prolong Gold Antifade Reagent with DAPI | Invitrogen by ThermoFisher | P36931 | Mounting media for coverslipping tissue sections after TUNEL |
| Proteinase K | Fisher BioReagents | BP1700-50 | CAS#39450-01-6, used for antigen retrieval in TUNEL protocol |
| Scissors, Fine | FST | 14094-11 | Straight, sharp |
| Slide Staining Set, 12-place | Mercedes Scientific | MER 1011 | Rack with 12 stain dishes and slide dippers for Toluidine blue histology |
| Sodium acetate, anhydrous | Thermo Scientific Chemicals | A1318430 | CAS#127-09-3, used to make buffer for Toluidine blue histology |
| Tissue-Tek Accu-Edge Low Profile Microtome Blades | VWR | 25608-964 | For paraffin sectioning |
| Toluidine Blue O | Thermo Scientific Chemicals | 348601000 | CAS#92-31-9 |
| Volume Reduction Insert | - | - | 3D printed from CAD files provided as Supplementary Files |
| Xylenes | Leica | 3803665 | 4 gallon supply for histological staining |
Riferimenti
- Cook, J. L., Purdam, C. Is compressive load a factor in the development of tendinopathy. Br J Sports Med. 46 (3), 163-168 (2012).
- Benjamin, M., Qin, S., Ralphs, J. R. Fibrocartilage associated with human tendons and their pulleys. J Anat. 187 (Pt 3), 625-633 (1995).
- Benjamin, M., Ralphs, J. R. Fibrocartilage in tendons and ligaments - an adaptation to compressive load. J Anat. 193 (4), 481-494 (1998).
- Benjamin, M., Theobald, P., Suzuki, D., Toumi, H. The anatomy of the Achilles tendon. The Achilles Tendon. 3, 5-16 (2007).
- Chimenti, R. L., et al. Insertional achilles tendinopathy associated with altered transverse compressive and axial tensile strain during ankle dorsiflexion. J Orthop Res. 35 (4), 910-915 (2017).
- Mora, K. E., et al. Ultrasound strain mapping of the mouse Achilles tendon during passive dorsiflexion. J Biomech. 132, 110920 (2022).
- Pringels, L., et al. Intratendinous pressure changes in the Achilles tendon during stretching and eccentric loading: Implications for Achilles tendinopathy. Scand J Med Sci Sports. 33 (5), 619-630 (2023).
- Koob, T. J., Vogel, K. G. Site-related variations in glycosaminoglycan content and swelling properties of bovine flexor tendon. J Orthop Res. 5 (3), 414-424 (1987).
- Vogel, K. G., Koob, T. J. Structural specialization in tendons under compression. Int Rev Cytol. 115, 267-293 (1989).
- Vogel, K. G., Ordög, A., Pogány, G., Oláh, J. Proteoglycans in the compressed region of human tibialis posterior tendon and in ligaments. J Orthop Res. 11 (1), 68-77 (1993).
- Vogel, K. G., Sandy, J. D., Pogány, G., Robbins, J. R. Aggrecan in bovine tendon. Matrix Biol. 14 (2), 171-179 (1994).
- Robbins, J. R., Vogel, K. G. Regional expression of mRNA for proteoglycans and collagen in tendon. Eur J Cell Biol. 64 (2), 264-270 (1994).
- Vogel, K., Gordon, S. I., Blair, S. J., Fine, L. J. . Repetitive motion disorders of the upper extremity. , (1995).
- Benjamin, M., Tyers, R. N., Ralphs, J. R. Age-related changes in tendon fibrocartilage. J Anat. 179, 127-136 (1991).
- Ralphs, J. R., Benjamin, M., Thornett, A. Cell and matrix biology of the suprapatella in the rat: a structural and immunocytochemical study of fibrocartilage in a tendon subject to compression. Anat Rec. 231 (2), 167-177 (1991).
- Rufai, A., Benjamin, M., Ralphs, J. R. Development and ageing of phenotypically distinct fibrocartilages associated with the rat Achilles tendon. Anat Embryol (Berl). 186 (6), 611-618 (1992).
- Rufai, A., Ralphs, J. R., Benjamin, M. Ultrastructure of fibrocartilages at the insertion of the rat Achilles tendon. J Anat. 189 (Pt 1), 185-191 (1996).
- Waggett, A. D., Ralphs, J. R., Kwan, A. P. L., Woodnutt, D., Benjamin, M. Characterization of collagens and proteoglycans at the insertion of the human achilles tendon. Matrix Biol. 16 (8), 457-470 (1998).
- Ralphs, J., et al. Regional differences in cell shape and gap junction expression in rat Achilles tendon: relation to fibrocartilage differentiation. J Anat. 193 (pt 2), 215-222 (1998).
- Milz, S., et al. Three-dimensional reconstructions of the Achilles tendon insertion in man. J Anat. 200 (Pt 2), 145-152 (2002).
- Tischer, T., Milz, S., Maier, M., Schieker, M., Benjamin, M. An immunohistochemical study of the rabbit suprapatella, a sesamoid fibrocartilage in the quadriceps tendon containing aggrecan. J Histochem Cytochem. 50 (7), 955-960 (2002).
- Esquisatto, M. A., Joazeiro, P. P., Pimentel, E. R., Gomes, L. The effect of age on the structure and composition of rat tendon fibrocartilage. Cell Biol Int. 31 (6), 570-577 (2007).
- Matuszewski, P. E., et al. Regional variation in human supraspinatus tendon proteoglycans: Decorin, biglycan, and aggrecan. Connect Tissue Res. 53 (5), 343-348 (2012).
- Buckley, M. R., Huffman, G. R., Iozzo, R. V., Birk, D. E., Soslowsky, L. J. The location-specific role of proteoglycans in the flexor carpi ulnaris tendon. Connect Tissue Res. 54 (6), 367-373 (2013).
- Gillard, G. C., Reilly, H. C., Bell-Booth, P. G., Flint, M. H. The influence of mechanical forces on the glycosaminoglycan content of the rabbit flexor digitorum profundus tendon. Connect Tissue Res. 7 (1), 37-46 (1979).
- Giori, N. J., Beaupre, G. S., Carter, D. R. Cellular shape and pressure may mediate mechanical control of tissue composition in tendons. J Orthop Res. 11 (4), 581-591 (1993).
- Wren, T. A., Beaupré, G. S., Carter, D. R. Mechanobiology of tendon adaptation to compressive loading through fibrocartilaginous metaplasia. J Rehabil Res Dev. 37 (2), 135-143 (2000).
- Malaviya, P., et al. An in vivo model for load-modulated remodeling in the rabbit flexor tendon. J Orthop Res. 18 (1), 116-125 (2000).
- Shim, J. W., Elder, S. H. Influence of Cyclic Hydrostatic Pressure on Fibrocartilaginous Metaplasia of Achilles Tendon Fibroblasts. Biomech Model Mechanobiol. 5 (4), 247-252 (2006).
- Koob, T. J., Clark, P. E., Hernandez, D. J., Thurmond, F. A., Vogel, K. G. Compression loading in vitro regulates proteoglycan synthesis by tendon fibrocartilage. Arch Biochem Biophys. 298 (1), 303-312 (1992).
- Evanko, S. P., Vogel, K. G. Proteoglycan Synthesis in Fetal Tendon Is Differentially Regulated by Cyclic Compression in Vitro. Arch Biochem Biophys. 307 (1), 153-164 (1993).
- Vogel, K. G. The effect of compressive loading on proteoglycan turnover in cultured fetal tendon. Connect Tissue Res. 34 (3), 227-237 (1996).
- Thornton, G. M., et al. Changes in mechanical loading lead to tendon specific alterations in MMP and TIMP expression: influence of stress deprivation and intermittent cyclic hydrostatic compression on rat supraspinatus and Achilles tendons. Br J Sports Med. 44 (10), 698-703 (2010).
- Robbins, J. R., Evanko, S. P., Vogel, K. G. Mechanical Loading and TGF-β Regulate Proteoglycan Synthesis in Tendon. Arch Biochem Biophys. 342 (2), 203-211 (1997).
- Docking, S., Samiric, T., Scase, E., Purdam, C., Cook, J. Relationship between compressive loading and ECM changes in tendons. Muscles Ligaments Tendons J. 3 (1), 7-11 (2013).
- Wang, X., et al. Aberrant TGF-β activation in bone tendon insertion induces enthesopathy-like disease. J Clin Invest. 128 (2), 846-860 (2018).
- Cong, G. T., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: Development and analysis of a novel murine model. J Orthop Res. 36 (10), 2780-2788 (2018).
- Liu, Y., et al. Evaluating the role of subacromial impingement in rotator cuff tendinopathy: development and analysis of a novel rat model. J Shoulder Elbow Surg. 31 (9), 1898-1908 (2022).
- Majima, T., et al. Compressive compared with tensile loading of medial collateral ligament scar in vitro uniquely influences mRNA levels for aggrecan, collagen type II, and collagenase. J Orthop Res. 18 (4), 524-531 (2000).
- Hopkins, C., et al. Critical review on the socio-economic impact of tendinopathy. Asia Pac J Sports Med, Arthrosc, Rehabil Technol. 4, 9-20 (2016).
- Scott, A., Ashe, M. C. Common tendinopathies in the upper and lower extremities. Curr Sports Med Rep. 5 (5), 233-241 (2006).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clin Sports Med. 22 (4), 675-692 (2003).
- Bah, I., et al. Tensile mechanical changes in the Achilles tendon due to Insertional Achilles tendinopathy. J Mech Behav Biomed Mater. 112, 104031 (2020).
- Maffulli, N., Reaper, J., Ewen, S. W. B., Waterston, S. W., Barrass, V. Chondral Metaplasia in Calcific Insertional Tendinopathy of the Achilles Tendon. Clin J Sport Med. 16 (4), 329-334 (2006).
- Corps, A. N., et al. Increased expression of aggrecan and biglycan mRNA in Achilles tendinopathy. Rheumatology (Oxford). 45 (3), 291-294 (2006).
- Scott, A., et al. Increased versican content is associated with tendinosis pathology in the patellar tendon of athletes with jumper's knee. Scand J Med Sci Sports. 18 (4), 427-435 (2008).
- Attia, M., et al. Greater glycosaminoglycan content in human patellar tendon biopsies is associated with more pain and a lower VISA score. Br J Sports Med. 48 (6), 469-475 (2014).
- Kujala, U. M., Sarna, S., Kaprio, J. Cumulative Incidence of Achilles Tendon Rupture and Tendinopathy in Male Former Elite Athletes. Clin J Sport Med. 15 (3), 133-135 (2005).
- Corps, A. N., et al. Changes in matrix protein biochemistry and the expression of mRNA encoding matrix proteins and metalloproteinases in posterior tibialis tendinopathy. Ann Rheum Dis. 71 (5), 746-752 (2012).
- Neer, C. S. Anterior acromioplasty for the chronic impingement syndrome in the shoulder: a preliminary report. J Bone Joint Surg Am. 54 (1), 41-50 (1972).
- Bigliani, L. U., Ticker, J. B., Flatow, E. L., Soslowsky, L. J., Mow, V. C. The relationship of acromial architecture to rotator cuff disease. Clin Sports Med. 10 (4), 823-838 (1991).
- Chimenti, R. L., Cychosz, C. C., Hall, M. M., Phisitkul, P. Current Concepts Review Update Insertional Achilles Tendinopathy. Foot Ankle Int. 38 (10), 1160-1169 (2017).
- Nicholson, C. W., Berlet, G. C., Lee, T. H. Prediction of the Success of Nonoperative Treatment of Insertional Achilles Tendinosis Based on MRI. Foot Ankle Int. 28 (4), 472-477 (2007).
- Lohrer, H., David, S., Nauck, T. Surgical treatment for achilles tendinopathy - a systematic review. BMC musculoskelet disord. 17 (1), 207 (2016).
- McGarvey, W. C., Palumbo, R. C., Baxter, D. E., Leibman, B. D. Insertional Achilles Tendinosis: Surgical Treatment Through a Central Tendon Splitting Approach. Foot Ankle Int. 23 (1), 19-25 (2002).
- Maffulli, N., et al. Surgery for chronic Achilles tendinopathy produces worse results in women. Disabil Rehabil. 30 (20-22), 1714-1720 (1714).
- Wunderli, S. L., Blache, U., Snedeker, J. G. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connect Tissue Res. 61 (3-4), 262-277 (2020).
- Dyment, N. A., et al. A brief history of tendon and ligament bioreactors: Impact and future prospects. J Orthop Res. 38 (11), 2318-2330 (2020).
- Screen, H. R. C., Berk, D. E., Kadler, K. E., Ramirez, F., Young, M. F. Tendon Functional Extracellular Matrix. J Orthop Res. 33 (6), 793-799 (2015).
- Theobald, P., et al. The functional anatomy of Kager's fat pad in relation to retrocalcaneal problems and other hindfoot disorders. J Anat. 208 (1), 91-97 (2006).
- Ghazzawi, A., Theobald, P., Pugh, N., Byrne, C., Nokes, L. Quantifying the motion of Kager's fat pad. J Orthop Res. 27 (11), 1457-1460 (2009).
- Malagelada, F., et al. Pressure changes in the Kager fat pad at the extremes of ankle motion suggest a potential role in Achilles tendinopathy. Knee Surg Sports Traumatol Arthrosc. 28 (1), 148-154 (2020).
- Shaw, H. M., Benjamin, M. Structure-function relationships of entheses in relation to mechanical load and exercise. Scand J Med Sci Sports. 17 (4), 303-315 (2007).
- Soslowsky, L. J., et al. Rotator cuff tendinosis in an animal model: role of extrinsic and overuse factors. Ann Biomed Eng. 30 (8), 1057-1063 (2002).
- Schneeberger, A. G., Nyffeler, R. W., Gerber, C. Structural changes of the rotator cuff caused by experimental subacromial impingement in the rat. J Shoulder Elbow Surg. 7 (4), 375-380 (1998).
- Croen, B. J., et al. Chronic subacromial impingement leads to supraspinatus muscle functional and morphological changes: Evaluation in a murine model. J Orthop Res. 39 (10), 2243-2251 (2021).
- Andarawis-Puri, N., Flatow, E. L. Tendon fatigue in response to mechanical loading. J Musculoskelet Neuronal Interact. 11 (2), 106-114 (2011).
- Gains, C. C., Giannapoulos, A., Zamboulis, D. E., Lopez-Tremoleda, J., Screen, H. R. C. Development and application of a novel in vivo overload model of the Achilles tendon in rat. J Biomech. 151, 111546 (2023).
- Williamson, P. M., et al. A passive ankle dorsiflexion testing system to assess mechanobiological and structural response to cyclic loading in rat Achilles tendon. J Biomech. 156, 111664 (2023).
- Pedaprolu, K., Szczesny, S. E. A Novel, Open-Source, Low-Cost Bioreactor for Load-Controlled Cyclic Loading of Tendon Explants. J Biomech Eng. 144 (8), 084505 (2022).
- Orishimo, K. F., et al. Effect of Knee Flexion Angle on Achilles Tendon Force and Ankle Joint Plantarflexion Moment During Passive Dorsiflexion. J Foot Ankle Surg. 47 (1), 34-39 (2008).
- Liu, C. L., et al. Influence of different knee and ankle ranges of motion on the elasticity of triceps surae muscles, Achilles tendon, and plantar fascia. Sci Rep. 10 (1), 6643 (2020).
- Cruz-Montecinos, C., et al. Soleus muscle and Achilles tendon compressive stiffness is related to knee and ankle positioning. J Electromyogr Kinesiol. 66, 102698 (2022).
- Connizzo, B. K., Grodzinsky, A. J. Lose-dose administration of dexamethasone is beneficial in preventing secondary tendon damage in a stress-deprived joint injury explant model. J Orthop Res. 38 (1), 139-149 (2020).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biol. 89, 11-26 (2020).
- Yabusaki, K., et al. A Novel Quantitative Approach for Eliminating Sample-To-Sample Variation Using a Hue Saturation Value Analysis Program. PloS one. 9 (3), e89627 (2014).
- Gao, J., Messner, K., Ralphs, J. R., Benjamin, M. An immunohistochemical study of enthesis development in the medial collateral ligament of the rat knee joint. Anat Embryol. 194 (4), 399-406 (1996).
- Han, S. K., Wouters, W. A. J., Clark, A., Herzog, W. Mechanically induced calcium signaling in chondrocytes in situ. J Orthop Res. 30 (3), 475-481 (2012).
- Han, W., et al. Impact of cellular microenvironment and mechanical perturbation on calcium signalling in meniscus fibrochondrocytes. Eur Cell Mater. 27, 321-331 (2014).
- Rossetti, L., et al. The microstructure and micromechanics of the tendon-bone insertion. Nat Mater. 16 (6), 664-670 (2017).
- Sartori, J., Köhring, S., Witte, H., Fischer, M. S., Löffler, M. Three-dimensional imaging of the fibrous microstructure of Achilles tendon entheses in Mus musculus. J Anat. 233 (3), 370-380 (2018).
- Eliasberg, C. D., et al. Identification of Inflammatory Mediators in Tendinopathy Using a Murine Subacromial Impingement Model. J Orthop Res. 37 (12), 2575-2582 (2019).
- Zhang, Y., et al. Expression of alarmins in a murine rotator cuff tendinopathy model. J Orthop Res. 38 (11), 2513-2520 (2020).
- Zhang, X., et al. Assessment of Mitochondrial Dysfunction in a Murine Model of Supraspinatus Tendinopathy. J Bone Joint Surg. Am. 103 (2), 174-183 (2021).
- Liu, Y., et al. The role of Indian Hedgehog Signaling in tendon response to subacromial impingement: evaluation using a mouse model. Am J Sports Med. 50 (2), 362-370 (2022).
- Wang, T., et al. Load-induced regulation of tendon homeostasis by SPARC, a genetic predisposition factor for tendon and ligament injuries. Sci Transl Med. 13 (582), eabe5738 (2021).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nat Biomed Eng. 5 (12), 1457-1471 (2021).
- Jones, D. L., et al. Mechanoepigenetic regulation of extracellular matrix homeostasis via Yap and Taz. Proc Natl Acad Sci U S A. 120 (22), e2211947120 (2023).
- Connizzo, B. K., Grodzinsky, A. J. Release of pro-inflammatory cytokines from muscle and bone causes tenocyte death in a novel rotator cuff in vitro explant culture model. Connect Tissue Res. 59 (5), 423-436 (2018).
- Rees, S. G., et al. Catabolism of aggrecan, decorin and biglycan in tendon. Biochem J. 350 (Pt 1), 181-188 (2000).
- Samiric, T., Ilic, M. Z., Handley, C. J. Large aggregating and small leucine-rich proteoglycans are degraded by different pathways and at different rates in tendon. Eur J Biochem. 271 (17), 3612-3620 (2004).
- Rees, S. G., Curtis, C. L., Dent, C. M., Caterson, B. Catabolism of aggrecan proteoglycan aggregate components in short-term explant cultures of tendon. Matrix Biol. 24 (3), 219-231 (2005).
- Taye, N., Karoulias, S. Z., Hubmacher, D. The "other" 15-40%: The Role of Non-Collagenous Extracellular Matrix Proteins and Minor Collagens in Tendon. J Orthop Res. 38 (1), 23-35 (2020).
- Carvalho, H. F., Felisbino, S. L. The development of the pressure-bearing tendon of the bullfrog, Rana catesbeiana. Anat Embryol. 200 (1), 55-64 (1999).
- Carvalho, H. F., Felisbino, S. L., Covizi, D. Z., Della Colleta, H. H., Gomes, L. Structure and proteoglycan composition of specialized regions of the elastic tendon of the chicken wing. Cell Tissue Res. 300 (3), 435-446 (2000).
- van Sterkenburg, M. N., Kerkhoffs, G. M., Kleipool, R. P., Niek van Dijk, C. The plantaris tendon and a potential role in mid-portion Achilles tendinopathy: an observational anatomical study. J Anat. 218 (3), 336-341 (2011).
- Lee, A. H., Elliott, D. M. Comparative multi-scale hierarchical structure of the tail, plantaris, and Achilles tendons in the rat. J Anat. 234 (2), 252-262 (2019).
- Lee, A. H., Elliott, D. M. Multi-Scale Loading and Damage Mechanisms of Plantaris and Rat Tail Tendons. J Orthop Res. 37 (8), 1827-1837 (2019).
- Fan, H. M., Shrestha, L., Guo, Y., Tao, H. R., Sun, Y. L. The twisted structure of the rat Achilles tendon. J Anat. 239 (5), 1134-1140 (2021).
- Cutlip, R. G., Stauber, W. T., Willison, R. H., McIntosh, T. A., Means, K. H. Dynamometer for rat plantar flexor muscles in vivo. Med Biol Eng Comput. 35 (5), 540-543 (1997).
- Rijkelijkhuizen, J. M., Baan, G. C., de Haan, A., de Ruiter, C. J., Huijing, P. A. Extramuscular myofascial force transmission for in situ rat medial gastrocnemius and plantaris muscles in progressive stages of dissection. J Exp Biol. 208 (Pt 1), 129-140 (2005).
- Saxena, A., Bareither, D. Magnetic Resonance and Cadaveric Findings of the Incidence of Plantaris Tendon. Foot Ankle Int. 21 (7), 570-572 (2000).
- dos Santos, M. A., Bertelli, J. A., Kechele, P. R., Duarte, H. Anatomical study of the plantaris tendon: reliability as a tendo-osseous graft. Surg Radiol Anat. 31 (1), 59-61 (2009).
- Sartori, J., Köhring, S., Bruns, S., Moosmann, J., Hammel, J. U. Gaining Insight into the Deformation of Achilles Tendon Entheses in Mice. Adv Eng Mater. 23 (11), 2100085 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon