Method Article
Cristallizzazione e raccolta dati a temperatura ambiente in situ utilizzando l'impianto di cristallizzazione di Harwell e Beamline VMXi, sorgente luminosa diamantata
In questo articolo
Riepilogo
Presentiamo un protocollo per la cristallizzazione delle proteine utilizzando l'impianto di cristallizzazione nel complesso di ricerca di Harwell e la successiva raccolta di dati cristallografici a raggi X in situ dai cristalli all'interno delle piastre presso la linea di luce della cristallografia macromolecolare versatile in situ (VMXi) di Diamond. Descriviamo i requisiti dei campioni, i protocolli di cristallizzazione e le linee guida per la raccolta dei dati.
Abstract
Vengono descritti i protocolli per la cristallizzazione robotica delle proteine utilizzando l'impianto di cristallizzazione di Harwell e la raccolta di dati a temperatura ambiente in situ dalle piastre di cristallizzazione presso la linea di luce VMXi di Diamond Light Source. Questo approccio consente di determinare strutture cristalline a temperatura ambiente di alta qualità da più cristalli in modo semplice e fornisce un feedback molto rapido sui risultati delle prove di cristallizzazione, oltre a consentire la cristallografia seriale. Il valore delle strutture a temperatura ambiente nella comprensione della struttura delle proteine, del legame con i leganti e delle dinamiche sta diventando sempre più riconosciuto nella comunità della biologia strutturale. Questa pipeline è accessibile agli utenti di tutto il mondo con diverse modalità di accesso disponibili. Gli esperimenti di cristallizzazione impostati possono essere sottoposti a imaging e visualizzati in remoto con cristalli identificati automaticamente utilizzando uno strumento di apprendimento automatico. I dati vengono misurati in un sistema basato su code con set di dati con rotazione fino a 60° da cristalli selezionati dall'utente in una piastra. I dati di tutti i cristalli all'interno di un particolare pozzetto o gruppo di campioni vengono uniti automaticamente utilizzando xia2.multiplex con le uscite facilmente accessibili tramite un'interfaccia browser web.
Introduzione
La cristallografia a raggi X rimane uno strumento chiave per comprendere la struttura e la funzione delle proteine, fornendo strutture ad alta risoluzione delle proteine o dei loro complessi con, ad esempio, substrati o farmaci candidati. In molti casi, tuttavia, l'ottenimento di cristalli con proprietà desiderabili - forma cristallina altamente diffrangente, suscettibile di ammollo e senza patologie cristalline come la gemellarità - rimane un collo di bottiglia considerevole1. Poiché in generale non è possibile prevedere le condizioni chimiche adatte per produrre cristalli proteici, lo screening della cristallizzazione che esplora migliaia di potenziali miscele chimiche è standard, spesso aiutato dall'automazione/robotica nell'impostazione di schermi e hotel di cristallo per il monitoraggio, spesso a distanza, delle immagini delle gocce di cristallizzazione che vengono registrate.
Quando compaiono i cristalli, in genere devono essere raccolti dall'ambiente di cristallizzazione utilizzando un anello di nylon o Kapton e quindi trasferiti in una gocciolina contenente un agente di crioprotezione (la cui ricerca è una variabile aggiuntiva) prima del congelamento in azoto liquido. Questi passaggi aggiuntivi tra la cristallizzazione e la raccolta dei dati a raggi X possono comportare, tra gli altri fattori, la disidratazione della goccia di cristallizzazione quando il suo ambiente sigillato viene rotto, sollecitazioni meccaniche sul cristallo quando viene maneggiato e danni causati dagli agenti di crioprotezione al reticolo cristallino (in genere con conseguente aumento della diffusione del mosaico)2. Inoltre, la raccolta dei cristalli richiede molto tempo e manodopera e può portare a disomogeneità tra i campioni, soprattutto quando la pelle si forma sulle gocce durante il processo di raccolta. La linea di luce VMXi dà accesso ai dati utilizzabili dai cristalli che sono attaccati alla piastra, che altrimenti verrebbero scartati per la raccolta dei dati.
La stragrande maggioranza delle strutture cristalline a raggi X viene determinata a 100K utilizzando l'approccio di cui sopra, consentendo un trasporto e una manipolazione semplici dei cristalli e aumentando la durata dei cristalli nel fascio di raggi X di ordini di grandezza. C'è un crescente interesse, tuttavia, nel determinare le strutture in condizioni non criogeniche, cioè molto più vicine alle condizioni fisiologiche rilevanti per la funzione proteica 2,3,4. Ciò consente di apprezzare molto meglio la struttura dinamica delle proteine, evita che le conformazioni o i loop degli amminoacidi vengano congelati in stati funzionalmente non rilevanti5 e consente di esplorare il legame del ligando in condizioni molto più vicine a quelle dell'ambiente naturale della proteina all'interno della cellula e dell'organismo6.
Un approccio alternativo, implementato presso la linea di luce VMXi (Versatile Macromolecular Crystallography in situ) presso il sincrotrone Diamond Light Source, nel Regno Unito, consiste nel misurare i dati di diffrazione direttamente dai cristalli all'interno dell'ambiente in cui sono cresciuti (cioè all'interno della piastra di cristallizzazione), in condizioni ambientali e senza disturbi 7,8. Ciò consente un feedback molto rapido dalle schermate di cristallizzazione e dalle ottimizzazioni per guidare l'utente verso una forma cristallina ottimale per le proprie esigenze. Consente inoltre di produrre in modo automatizzato strutture a temperatura ambiente di alta qualità9.
Questo protocollo presuppone che un utente disponga di un campione proteico altamente puro pronto per la cristallizzazione. Descriviamo l'esperienza dell'utente che accede all'impianto di cristallizzazione di Harwell per produrre cristalli proteici e quindi utilizzare VMXi beamline per la raccolta dei dati (Figura 1).
L'impianto di cristallizzazione di Harwell
L'impianto di cristallizzazione di Harwell (CF) si trova nel complesso di ricerca di Harwell (RCaH) adiacente alla sorgente di luce di diamante. La struttura offre agli utenti un laboratorio automatizzato ad alta produttività per la cristallizzazione macromolecolare, utilizzando la robotica per lo screening della cristallizzazione, l'ottimizzazione dei cristalli, l'imaging dei cristalli e la caratterizzazione. Grazie alla stretta integrazione con la linea di luce VMXi altamente automatizzata, il ritmo di determinazione delle strutture a temperatura ambiente è notevolmente accelerato e consente la caratterizzazione di nuove strutture proteiche, complessi proteina-ligando e DNA-ligando, nonché lo screening automatizzato dei frammenti (Figura 1), il tutto in condizioni non criogeniche.
La pipeline CF è una suite di strumentazione che comprende robot di cristallizzazione di nanolitri9 per la cristallizzazione di proteine solubili e di membrana, robot per la manipolazione dei liquidi per preparare schermi di cristallizzazione commerciali e schermi di ottimizzazione personalizzati complessi e quattro strumenti di imaging (uno a 4 °C e tre a 20 °C per l'imaging di piastre di cristallizzazione (vedi la Tabella dei materiali). Un imager è in grado di eseguire l'imaging di lastre di vetro in fase cubica lipidica (LCP) e un imager è dotato di ottiche multifluorescenza (entrambe a 20 °C).
La struttura è ora ampiamente utilizzata da un ampio spettro di utenti accademici e industriali, tra cui il Membrane Protein Laboratory (MPL; https://www.diamond.ac.uk/Instruments/Mx/MPL.html), l'impianto di screening dei frammenti XChem 10, le linee di luce MX, l'hub XFEL e il Rosalind Franklin Institute (RFI). Questa pipeline consolidata e ottimizzata ha permesso di eseguire esperimenti di cristallizzazione in un ampio spettro di progetti di biologia strutturale. Questo documento descrive la pipeline per i cristalli destinati alla raccolta dei dati a VMXi, sebbene i cristalli possano anche essere raccolti e crio-raffreddati o diretti alla pipeline XChem.
L'accesso degli utenti viene assegnato tramite il sistema di proposte Diamond MX (https://www.diamond.ac.uk/Instruments/Mx/Synchrotron-Access.html) e gli utenti industriali sono supportati tramite il gruppo Diamond Industry Liaison. Tutti gli utenti possono venire sul posto con i loro campioni o piastre, che possono essere trasportati a mano. Si sconsiglia di inviare le lastre tramite corriere poiché la nostra esperienza suggerisce che le gocce possono allontanarsi dal luogo in cui sono state erogate o che le gocce possono essere danneggiate dal serbatoio di cristallizzazione. In alternativa, previo accordo, gli utenti possono inviare i loro campioni proteici al CF, dove i membri del personale organizzano esperimenti di cristallizzazione per loro conto. Gli esperimenti possono essere monitorati da remoto dall'utente collegandosi a Rock Maker Web nel caso di CF o tramite ISPyB nel caso di VMXi. L'accesso alla CF può essere effettuato in modo iterativo sulla base dei risultati della diffrazione dei raggi X raccolti presso Diamond.
Beamline VMXi presso la sorgente luminosa Diamond
Beamline VMXi (di seguito denominata "la linea di fascio") è uno strumento unico e di recente sviluppo completamente dedicato alla cristallografia a raggi X a temperatura ambiente, altamente automatizzata, con particolare attenzione alla misurazione dei dati provenienti da cristalli all'interno di piastre di cristallizzazione idonee. La linea di luce offre un micro focus (10 x 10 μm), un fascio rosa (passa banda di <5 × 10-2ΔE/E) con un flusso elevato di ~2 ×10 13 fotoni/s (a 16 KeV)7. Questo fascio ad alto flusso, abbinato a un rivelatore veloce, consente una produttività molto elevata dei campioni e la raccolta di dati da campioni di dimensioni superiori a 10 μm.
Le piastre di cristallizzazione entrano nella linea di luce memorizzandole in un sistema di conservazione dei campioni e riprodotte in base al programma fornito dall'utente durante la registrazione delle piastre utilizzando l'interfaccia ISPyB11 SynchWeb12. In genere, si consiglia agli utenti di selezionare una sequenza di Fibonacci di punti temporali per l'imaging (0, 12, 24, 36, 60... 7.320 h dall'inserimento della piastra nel sistema). L'utente viene informato via e-mail una volta che una lastra è stata acquisita. Sia l'imaging a luce visibile che quello a luce UV sono disponibili per gli utenti su richiesta. Le immagini acquisite dal sistema di conservazione dei campioni vengono analizzate da un algoritmo di machine learning; In questo modo viene individuato e definito automaticamente i punti di interesse degli oggetti che assomigliano a cristalli e vengono registrati i punti di interesse pronti per essere aggiunti dall'utente a una coda per la raccolta dei dati. Gli utenti possono anche fare clic manualmente sulle immagini a luce visibile per registrare i punti di interesse o possono fare clic e trascinare una regione da analizzare mediante scansione raster. Questi punti sono disponibili per gli utenti che possono essere aggiunti alla coda insieme ai punti individuati automaticamente.
Una volta che tutti i campioni hanno i parametri appropriati per la raccolta dei dati, la piastra entra in una coda. Quando la piastra raggiunge la parte superiore della coda, viene automaticamente erogata alla linea di fascio. Le piastre di cristallizzazione vengono caricate automaticamente dagli hotel di cristallo nella linea di luce da un braccio robotico e, dopo la corrispondenza dell'immagine, vengono misurati set di dati cristallografici con una rotazione fino a 60° da ciascun cristallo selezionato secondo le istruzioni definite dall'utente. Tutte le gocce all'interno di una piastra possono essere utilizzate per questi esperimenti sulla linea di luce. I dati vengono uniti da più cristalli per produrre set di dati isomorfi e uniti in modo ottimale in modo automatizzato 7,9. Una volta raccolti tutti i set di dati in coda, all'utente viene inviata un'e-mail con un link da seguire per visualizzare i set di dati in ISPyB11, come in altre linee di luce Diamond MX. Gli utenti vengono inoltre indirizzati alla pagina web della linea di luce (https://www.diamond.ac.uk/Instruments/Mx/VMXi.html).
Protocollo
1. Produzione di cristalli all'interno di piastre in situ utilizzando l'impianto di cristallizzazione di Harwell
NOTA: L'accesso al CF è supportato da una serie di percorsi diversi e dipende dall'applicazione del progetto e dal tipo di utente (accademico o industriale). I progetti XChem e MPL dispongono di un proprio sistema di richiesta di proposte tramite il sistema di amministrazione degli utenti (UAS) e possono essere presentati tramite il percorso di accesso standard (inclusi iNEXT Discovery e EUbOPEN) o BAG Access. Il protocollo seguente è specifico per gli utenti VMXi.
- Presentazione della proposta e preparazione della visita
- Fornire informazioni sul progetto a un'applicazione di proposta BAG o aggiungerle a una proposta BAG attiva. Di solito c'è un coordinatore BAG, che organizza le pratiche burocratiche. In alternativa, presentare una proposta di accesso rapido per l'accesso alla linea di fascio.
- Assicurarsi che il campione sia stato registrato e convalidato per la sicurezza in UAS su proposta prima dell'arrivo in loco, tramite corriere o di persona.
- Assicurarsi che l'utente sia registrato (con FedID e password).
- Assicurarsi che l'utente sia stato aggiunto a una proposta MX come associato in UAS dal coordinatore BAG.
- Compila il modulo con i dettagli del campione di cristallizzazione della linea di luce e invia il modulo a VMXi@diamond.ac.uk.
- Comunicare con il personale della linea di luce in merito ai requisiti dell'esperimento e alla disponibilità della linea di luce.
- Se vengono spediti campioni proteici, inviare i campioni solo previo accordo. Fare riferimento alla sezione 1.2 per i dettagli.
- Se l'utente deve recarsi sul sito per installare le piastre di cristallizzazione nel CF, verificare con il personale dell'impianto la disponibilità di una fascia oraria per utilizzare la strumentazione dell'impianto e seguire la sezione 1.2.1.
- Se l'utente porta le piastre sul sito, assicurarsi che il campione sia erogato nel tipo di piastra corretto e posizionare le gocce di cristallizzazione nella posizione corretta e nella quantità corretta. Seguire la sezione 1.2.2. La linea di luce accetta solo specifiche piastre di cristallizzazione in situ (Greiner CrystalQuickX e MiTeGen In Situ-1); assicurarsi che le gocce non siano superiori a 200 nL.
- Esperimento di cristallizzazione condotto in FC
NOTA: L'impianto offre una serie di metodi di cristallizzazione macromolecolare ad alto rendimento come la diffusione del vapore e la cristallizzazione batch sotto olio e LCP. Si consiglia di iniziare con 70-100 μL di proteina pura ed eseguire esperimenti di diffusione del vapore per proteine solubili con tre schermi utilizzando un rapporto di 100 nL di soluzione proteica e 100 nL di soluzione serbatoio di cristallizzazione e incubando le piastre a 20 °C. All'interno della struttura sono disponibili diversi schermi commerciali. Il controllo dell'umidità e della temperatura è disponibile con 4 °C e 20 °C più utilizzati. Gli utenti che visitano il CF ricevono una formazione standardizzata e supportano l'utilizzo della strumentazione di cristallizzazione e utilizzeranno le impostazioni qui descritte.- Spedizione di campioni per l'allestimento presso il CF
NOTA: Prima dell'arrivo in loco, il campione proteico deve essere stato convalidato su una proposta all'interno del sistema UAS. Una volta che il campione proteico è arrivato in loco, i membri del personale predisporranno gli esperimenti di cristallizzazione come indicato nelle precedenti comunicazioni con l'utente. La conferma verrà inviata via e-mail con le informazioni del codice a barre per le piastre di cristallizzazione sperimentali. All'utente verrà chiesto di aggiungere alla relativa proposta le piastre di cristallizzazione come contenitori. Una volta fatto ciò, le piastre possono essere conservate in imager automatizzati nell'impianto di cristallizzazione o sulla linea del fascio. ISPyB sarà l'interfaccia utilizzata per l'interazione sulla linea di luce.- Fornire la soluzione del campione proteico alla concentrazione per la cristallizzazione in multipli di aliquote di 25 μL. Etichettare chiaramente le provette contenenti il campione proteico.
- Se necessario, fornire una soluzione tampone proteica, una soluzione ligando o una soluzione serbatoio.
- Informare il personale della struttura su quali schermi e percentuali di caduta devono essere utilizzati.
- Impostazioni della piastra di cristallizzazione
NOTA: Richiediamo che le gocce di cristallizzazione nella piastra Greiner CrystalQuickX e MiTeGen In Situ-1 si trovino in una posizione particolare; le piastre installate altrove devono utilizzare le seguenti impostazioni di Mosquito13 descritte qui.- Per regolare la definizione della piastra per MiTeGen In Situ-1, aprire il software Mosquito SPT e fare clic sulla pagina di definizione della piastra standard MiTeGen In Situ-1 facendo clic su Setup | 96 Well | MiTeGen In Situ-1 (96 x 2 gocce) (Figura 2A). Fare clic sul pulsante di modifica e modificare i valori per la posizione del pozzetto secondario 2: Offset X a - 1,2 e Offset Y a 1,8 e per la posizione del pozzetto secondario 3: Offset X a 1,3 e Offset Y a 1,8 (Figura 2B,C).
- Per regolare la definizione della piastra per Greiner CrystalQuickX, aprire il software Mosquito SPT e fare clic sulla pagina di definizione della piastra Greiner CrystalQuickX standard facendo clic su Setup | 96 Well | Greiner CrystalQuickX (Figura 2D). Fare clic sul pulsante di modifica e modificare i valori per la posizione del pozzetto secondario 1: Offset X a - 1,95 e Offset Y a 1,45 e per la posizione del pozzetto secondario 2: Offset X a 1,95 e Offset Y a 1,45 (Figura 2E,F).
- Spedizione di campioni per l'allestimento presso il CF
2. Utilizzo della linea di luce su Diamond Light Source
NOTA: Tutta l'interazione con la linea di luce da parte degli utenti viene condotta in remoto utilizzando l'interfaccia ISPyB11 . Non è richiesta alcuna presenza fisica sulla linea di luce e i dati vengono raccolti utilizzando un sistema basato su code piuttosto che essere programmati in un momento particolare. Gli utenti avranno una proposta associata al loro accesso alla Sorgente di Luce Diamante. Alla linea di luce, ad ogni piastra di cristallizzazione viene assegnata una visita univoca ed è definita come un "contenitore" all'interno di ISPyB11 analogo a un disco contenente campioni a 100 K. Le schermate di ottimizzazione non possono essere create utilizzando l'interfaccia SynchWeb e, come tale, le informazioni vengono in genere aggiunte nella sezione dei commenti (vedere il passaggio 2.1.4.). La persona che registra la targa dovrà controllare l'indirizzo e-mail poiché il proprietario della targa riceverà e-mail relative all'imaging e alle notifiche di targa completata.
- Targhe di registrazione
- Accedi a ISPyB con un FedID Diamond appropriato e seleziona Proposte. Cerca la proposta di tuo interesse scorrendo o digitando il numero della proposta nella barra di ricerca. Seleziona Spedizione dal menu a discesa sotto il numero della proposta (Figura 3A), che aprirà la finestra Spedizioni con le spedizioni in quella proposta. Fare clic su +Aggiungi spedizione in alto a destra (Figura 3B) per aprire la finestra Aggiungi nuova spedizione , assegnare un nome alla spedizione, fare clic su Automatizzato/Imager, quindi fare clic sul pulsante Aggiungi spedizione in basso a sinistra (Figura 3C).
- Nella finestra della spedizione (Figura 3D), fare clic su +Aggiungi contenitore, per visualizzare la visualizzazione della pagina Aggiungi contenitore (Figura 3E). Scegliere nel menu a discesa Tipo di contenitore uno dei tipi di piastra pertinenti. La pagina cambierà in modo da riflettere il tipo di contenitore scelto. Immettere un codice a barre e il nome del contenitore in base alle istruzioni e-mail del personale della linea di luce specifiche per le piastre sperimentali. Si noti che fa distinzione tra maiuscole e minuscole.
- Selezionare VMXi 20 °C imager dal menu a discesa Requested Imager , Fibonacci imaging schedule (Programma di imaging) dal menu a discesa Imaging Schedule (Programma di imaging ), la schermata di cristallizzazione dal menu a discesa Crystallization Screen (Schermata di cristallizzazione ) e il nome utente dal menu a discesa Owner (Proprietario ), fare clic sul pulsante Visualizza e immettere l'indirizzo e-mail di contatto corretto nella casella E-mail (Figura 3F).
- Immettere ulteriori dettagli sulla targa nella casella Commenti . Selezionare il campione pertinente dal menu a tendina Proteine , e utilizzare l'acronimo registrato in UAS e approvato da Diamond all'interno della proposta sperimentale. Immettere lo stesso nome nella casella Nome campione ; Lascia vuote le caselle rimanenti.
- Fare clic sull'icona +Piastra per replicare il campione sull'intera piastra e popolare l'intero contenitore con quadrati verdi. Fare clic su +Aggiungi contenitore nella parte inferiore della pagina per registrare la piastra. Chiedere a un membro del personale della linea di luce di trasferire la piastra all'imager appropriato, dove verrà conservata e riprodotta. Una visita verrà generata quando il contenitore viene memorizzato negli imager e l'utente riceverà un'e-mail con un link alla lastra e alle sue immagini.
- Visualizzazione dei risultati dell'imaging
- Passare alla proposta di interesse (passaggi 2.1.1), selezionare Contenitori dal menu a discesa sotto il numero della proposta e osservare l'elenco dei contenitori disponibili per la proposta. Selezionare le piastre filtranti se sono presenti altri tipi di portacampioni. Per restringere ulteriormente la ricerca, selezionare la casella Contenitori personali per visualizzare solo i contenitori più pertinenti associati all'ID utente attualmente connesso. Fare clic sul contenitore appropriato spostando il cursore sulla singola riga e facendo clic con il pulsante sinistro del mouse.
- Dopo aver selezionato il contenitore, verrà presentata una nuova vista, che mostra una panoramica della piastra (Figura 4A). Fare clic su una goccia nella rappresentazione della lastra sul lato sinistro del display per visualizzare l'immagine più recente della rispettiva caduta. Usa i tasti freccia per navigare tra le gocce o seleziona le singole gocce usando un mouse/cursore.
- Per visualizzare le immagini storiche di una caduta, fare clic sul pulsante H e attendere che venga visualizzata una galleria popup di immagini sopra l'immagine di caduta del pozzo corrente. Passare il cursore sulle singole immagini per aggiornare l'immagine principale.
- Segna le immagini per indicare lo stato di ogni goccia premendo i pulsanti da 0 a 9 . Per vedere le singole categorie, apri il menu a tendina Punteggio in alto a sinistra dell'immagine a discesa. Cerca le croci blu in ciascuna delle immagini di rilascio, che sono il risultato di un algoritmo (CHiMP) addestrato a cercare "cristalli" all'interno delle immagini.
- Fare clic sul terzo pulsante dell'icona chiamato Misura in alto a destra dell'immagine a goccia per accedere a uno strumento di misurazione. Per utilizzare questo strumento, fai clic e trascina una linea e un righello si estenderà e darà la distanza in μm.
- Per richiedere un'ulteriore sessione di imaging, fare clic su Visibile o UV dalla casella a discesa adiacente all'intestazione Azioni nella parte inferiore della pagina. Quindi, fare clic sul pulsante Richiedi imaging piastra .
- Selezione dei cristalli/CHiMP
- Per aggiungere manualmente punti per la raccolta dei dati, premere il pulsante +Contrassegna punto . Passare il cursore sul punto di interesse desiderato e selezionare. Attendi che appaia una croce rossa.
NOTA: È possibile creare fino a 100 oggetti per drop. - Quando tutti i punti sono contrassegnati, fare clic sul pulsante +Fine . Ricordarsi di fare clic anche sul pulsante +Fine prima di provare a misurare gli oggetti. Per aggiungere aree per la raccolta dei dati tramite scansioni a griglia, fare clic sul pulsante +Contrassegna regione . Fare clic sul punto in alto a sinistra e trascinare verso il basso e verso destra per creare una regione che verrà scansionata raster sulla linea di luce. Come per i punti, fare clic sul pulsante +Fine quando sono state create tutte le regioni desiderate.
NOTA: è preferibile creare un'area più grande piuttosto che molte aree piccole. - Osservate le croci blu già presenti sulle immagini a goccia, che sono il risultato di un algoritmo progettato per localizzare automaticamente gli oggetti cristallini (CHiMP). Per visualizzare la valutazione CHiMP delle gocce di cristallizzazione, fare clic sulla casella di controllo Mostra punteggi automatici , quindi modificare il menu a discesa per Classe. In genere, l'impostazione più utile in questo caso è l'opzione cristallo (Figura 4B).
NOTA: Questa è una nuova funzionalità e non è garantito che trovi tutti i cristalli e potrebbe anche trovare altri oggetti che non sono cristalli. - Quando tutti i punti e le regioni sono stati contrassegnati nei rispettivi drop, fare clic sul pulsante Prepara per la raccolta dei dati nella parte inferiore della pagina.
- Per aggiungere manualmente punti per la raccolta dei dati, premere il pulsante +Contrassegna punto . Passare il cursore sul punto di interesse desiderato e selezionare. Attendi che appaia una croce rossa.
- Preparazione dei campioni per la raccolta dei dati
- Osservare l'elenco dei campioni contenenti i punti o le regioni selezionati nel passaggio precedente o individuati automaticamente (Figura 4C). Aggiungere singoli punti o regioni premendo il pulsante + o aggiungere tutti i campioni visualizzati facendo clic sul pulsante Aggiungi pagina corrente alla coda .
- I filtri sono disponibili per visualizzare solo i punti Punto, Regione, Punti automatici o Punti manuali . Per visualizzare solo i campioni che non sono stati ripresi (cioè esposti ai raggi X), fare clic sulle opzioni Senza dati e Non completati sopra i pulsanti del filtro.
- Seleziona i singoli campioni facendo clic sulla rispettiva linea e aggiorna l'immagine sul lato destro dello schermo per mostrare la goccia corretta e il singolo punto. Se nell'elenco sono presenti molti campioni, aumentare il numero di campioni visualizzati per pagina selezionando il menu a discesa con 10 come impostazione predefinita e fino a 100 come numero massimo di campioni visualizzati.
- Una volta che tutti i punti e le regioni sono stati aggiunti alla coda, assicurarsi che tutti i parametri di raccolta dei dati sperimentali siano associati a ogni esperimento.
- Utilizzare i filtri per Punto, Regione, Manuale e Automatico. Fare clic sul filtro Punto e fare clic sulla casella di controllo Seleziona tutto sotto i pulsanti del filtro per applicare contemporaneamente i parametri a tutti i campioni visibili nell'elenco Campioni in coda corrente.
- Selezionare i parametri sperimentali dal menu a discesa sul lato destro dello schermo sotto la foto (Figura 4D). Per le regioni, selezionare l'opzione Grid Scan DMM passi di 10 micron, trasmissione al 100%. Per tutti gli altri esperimenti puntuali , seleziona altre opzioni dal menu a discesa in base alle esigenze.
- Per le raccolte di dati di oscillazione, fare clic sull'opzione di trasmissione Omega Scan DMM 60 gradi 5 % per raccogliere la quantità massima di dati da un singolo campione. Applicare piccole rotazioni per cristalli molto piccoli o campioni sensibili alle radiazioni e variare la trasmissione in base all'esperienza precedente con una particolare forma cristallina. Una volta che tutti i parametri sperimentali sono stati applicati correttamente, fare clic sul pulsante Contenitore coda nella parte inferiore della pagina.
- Una volta che la piastra ha raggiunto la parte superiore della coda, verrà presentata alla linea di fascio, verranno raccolti i set di dati e quindi tornerà di nuovo all'archiviazione del campione all'interno della linea di fascio. Una volta completata la raccolta dei dati da una lastra, cerca un'e-mail con un link da seguire per accedere ai dati pertinenti.
- Creazione di gruppi di esempio
NOTA: È possibile creare gruppi di campioni per raggruppare campioni simili su più gocce o piastre. Tutti i set di dati all'interno di questi gruppi di campioni verranno elaborati utilizzando la pipeline xia2.multiplex14 una volta elaborati da DIALS. Questo può essere utile quando si raccolgono molti cunei molto piccoli di dati e può anche essere utile per aumentare il rapporto segnale-rumore per gli esperimenti di legame con il ligando.- Seleziona Gestione gruppi di esempio dal menu a discesa sotto il numero della proposta. Cerca un elenco di gruppi se sono già stati creati da altri utenti. Per generare un nuovo gruppo, fare clic sul pulsante +Crea gruppo di esempio . Fare clic su una spedizione dal menu a discesa nella pagina Crea gruppo di campioni per visualizzare il visualizzatore di esempi (Figura 5A). Fare clic sul contenitore contenente gli esempi pertinenti dall'elenco popolato.
- Dopo aver fatto clic su un contenitore, cercare un grafico che mostri la panoramica del piatto.
- Fare clic sulle gocce singolarmente facendo clic sulla singola goccia (Figura 5B) oppure fare clic sulle gocce nelle righe o nelle colonne facendo clic sulla lettera della riga o sul numero di colonna pertinente. Una volta selezionati tutti i pozzetti associati a un singolo gruppo, immettere un nome per il gruppo nella casella Nome gruppo campione e fare clic sul pulsante Salva gruppo campione . Fare clic sul pulsante Visualizza gruppi di esempio in questa pagina per tornare all'elenco dei gruppi di esempio già generati associati alla proposta (Figura 5C).
- Modifica dei gruppi di esempio
- Fare clic su un gruppo di esempio dall'elenco dei gruppi nella pagina Gestione gruppi di esempio .
- Fare clic sul pulsante +Modifica gruppo di esempio accanto ai contenitori visualizzati sotto le informazioni sul gruppo (Figura 5C).
- Osservare le gocce, già associate ad un gruppo campione, evidenziate nella panoramica della piastra.
- Aggiungere altre gocce al gruppo di campioni facendo clic su gocce, pozzetti o colonne come in precedenza.
NOTA: Le gocce non possono essere rimosse da un gruppo di campioni. - Una volta aggiunti altri drop, modificare il nome del gruppo di campioni e quindi salvarlo oppure salvarlo semplicemente facendo clic sul pulsante Salva gruppo di campioni .
- Visualizzazione e analisi dell'output dei gruppi campione
- Fare clic su un singolo gruppo dall'elenco dei gruppi di campioni per visualizzare la panoramica delle piastre del contenitore o dei contenitori associati al gruppo. Le gocce incluse nel gruppo saranno evidenziate su questo display (Figura 5D).
- Cercare un elenco contenente gli ultimi tre lavori multiplex cronologici se i dati sono stati raccolti in questo gruppo.
- Fare clic sulla riga relativa a un'esecuzione multiplex per aggiornare i risultati dell'elaborazione riportati di seguito.
- Osservare il pulsante di collegamento rapido , che mostra il numero di set di dati associati al gruppo. Fare clic su questo pulsante per aprire una nuova pagina Raccolte dati in cui sono visualizzate le singole raccolte di set di dati.
3. Accesso al trattamento automatico dei dati
NOTA: Una volta che i dati sono stati raccolti, vengono passati attraverso diverse pipeline di elaborazione automatica dei dati. Anche le quattro pipeline standard utilizzate sulle linee di luce MX di Diamond vengono eseguite sui dati raccolti sulla linea di luce. Si tratta di 'fast_dp', 'xia2 dials', 'xia2 3dii' e 'autoPROC'15. 'fast_dp' fornirà una rapida riduzione dei dati per valutare rapidamente la qualità. Le altre tre pipeline richiederanno più tempo di calcolo ed eseguiranno una varietà di diversi pacchetti software di riduzione dei dati per il confronto. Di conseguenza, l'output è solitamente di qualità superiore rispetto all'output "fast_dp". I set di dati raccolti sulla linea di luce verranno anche eseguiti attraverso il software di fusione automatica multicristallina "xia2.multiplex"14, che unirà tutti i set di dati all'interno di un gruppo definito. Si noti che, sebbene le scansioni della griglia non vengano attualmente elaborate automaticamente, i dati possono essere elaborati manualmente utilizzando la pipeline 'xia2.ssx'. I risultati delle pipeline di elaborazione automatica sono disponibili in ISPyB11 utilizzando il seguente protocollo.
- Individuazione dei set di dati
- Accedi a ISPyB come descritto sopra e seleziona Proposte.
- Cerca la proposta di tuo interesse scorrendo o digitando il numero della proposta nella barra di ricerca.
- Fare clic sulla visita desiderata dall'elenco visualizzato sullo schermo per accedere alla finestra Raccolte dati per quella visita.
- Applicare i filtri desiderati.
NOTA: un filtro comune è il filtro "Auto Integrated", che visualizzerà solo i set di dati che sono stati eseguiti correttamente attraverso una o più pipeline di elaborazione. In questo modo verranno escluse le scansioni della griglia in quanto queste non vengono attualmente elaborate automaticamente tramite ISPyB. - Scorri la pagina verso il basso per trovare il set di dati di interesse.
NOTA: Ogni set di dati visualizzerà l'ID del campione, i parametri sperimentali utilizzati, un visualizzatore di immagini di diffrazione, un visualizzatore di immagini a cristallo e un grafico di analisi per immagine per una rapida osservazione della qualità dei dati.
- Per accedere ai risultati dell'elaborazione automatica
- Fare clic sulla scheda Elaborazione automatica sotto il riepilogo dei dati di un esperimento specifico per esaminare i risultati della riduzione automatica dei dati (Figura 6A).
- Fare clic sulle diverse schede corrispondenti alle diverse pipeline per visualizzare un riepilogo dettagliato di ciascun output.
NOTA: Se sono stati definiti gruppi di campioni, ci saranno due schede corrispondenti ai lavori multiplex. Uno corrisponderà all'unione di tutti i set di dati nel gruppo fino a quel punto, mentre l'altro corrisponderà all'unione dei set di dati solo all'interno di quel drop. - Fare clic sul pulsante Log e file per scaricare i file .mtz risultanti se l'elaborazione è andata a buon fine e tutti i file di log associati. Fare clic sulla scheda Elaborazione a valle sotto la sezione Elaborazione automatica per visualizzare l'output di DIMPLE.
NOTA: DIMPLE verrà eseguito solo se durante l'invio del campione è stato fornito un file PDB. - Fare clic sul pulsante Log & Files per scaricare l'output risultante da DIMPLE.
- Per accedere ai risultati del multiplex di gruppo, apri il menu a discesa nella parte superiore dello schermo con il numero della proposta scritto su di esso e fai clic su Gestione gruppi di esempio. Fare clic sulla riga corrispondente al gruppo desiderato all'interno del contenitore corretto. Scorrere verso il basso per trovare l'elenco delle uscite multiplex corrispondenti al gruppo rappresentato visivamente da un diagramma della piastra.
- Fare clic sull'uscita multiplex desiderata dall'elenco fornito. Fare clic sul pulsante xxx Set di dati , dove xxx è il numero di set di dati uniti (Figura 6B).
NOTA: Si aprirà la schermata Raccolte dati , ma verranno visualizzati solo i set di dati del lavoro multiplex selezionato. - Fai clic sulla scheda Elaborazione automatica dell'esperimento principale.
- Fare clic sulla scheda Elaborazione multiplex corrispondente al numero corretto di set di dati uniti.
- Fare clic sul pulsante Log & Files per scaricare il file .mtz e i file di log corrispondenti (come al punto 3.2.3).
- Fare clic sull'uscita multiplex desiderata dall'elenco fornito. Fare clic sul pulsante xxx Set di dati , dove xxx è il numero di set di dati uniti (Figura 6B).
- Per accedere ai risultati dell'analisi della griglia
- Passare alla schermata Raccolte dati per la visita desiderata. I risultati della scansione della griglia verranno visualizzati insieme a tutti i dati di rotazione raccolti.
NOTA: Non ci saranno risultati di elaborazione automatica. - L'immagine della goccia di cristallo avrà la griglia sovrapposta con una mappa di calore che rappresenta la presenza di diffrazione. Fare clic su un quadrato per visualizzare l'immagine di diffrazione per quella posizione nella griglia. Fai clic sul menu a discesa nella parte superiore dell'immagine del pozzo di cristallo per modificare ciò che rappresenta la mappa termica. L'impostazione predefinita è l'intensità totale della diffrazione, ma può essere modificata in punti totali, risoluzione stimata o fotogrammi senza ghiaccio.
- Passare alla schermata Raccolte dati per la visita desiderata. I risultati della scansione della griglia verranno visualizzati insieme a tutti i dati di rotazione raccolti.
4. Rielaborazione dei dati
NOTA: i set di dati selezionati possono essere rielaborati tramite l'interfaccia ISPyB11 utilizzando le stesse pipeline di elaborazione che vengono eseguite automaticamente con impostazioni modificate definite dall'utente. È possibile applicare un cut-off di risoluzione; Se la simmetria/cella del cristallo è nota, è anche possibile definirla per garantire che le pipeline di elaborazione funzionino con l'impostazione corretta. È inoltre possibile unire intervalli di immagini selezionati in set di dati specifici utilizzando le pipeline multicristalline disponibili. Ciò può rivelarsi vantaggioso se il danno sistematico da radiazioni fa sì che l'ultima porzione delle immagini di diffrazione sia di scarsa qualità. È anche un'opzione per l'utente scaricare i propri set di dati utilizzando il protocollo sopra descritto ed eseguire localmente il software di rielaborazione desiderato, i cui tutorial sono disponibili gratuitamente altrove (https://dials.github.io/documentation/tutorials/index.html# ).
- Per rielaborare più set di dati singoli
- Accedere a ISPyB e passare ai set di dati di interesse (passaggio 3.1).
- Fare clic su un set di dati e fare clic sull'icona a forma di ingranaggio nella barra del titolo del set di dati (Figura 6) per aprire la finestra di rielaborazione.
- Configurare le impostazioni desiderate e selezionare i fotogrammi da includere nella rielaborazione.
NOTA: L'intervallo di immagini può essere definito digitando un intervallo nelle caselle etichettate o facendo clic e trascinando l'area desiderata nel grafico di analisi per immagine (Figura 7A). - FACOLTATIVO: per aggiungere un altro set di dati per la rielaborazione individuale, fare clic sull'icona a forma di ingranaggio per visualizzarlo nella finestra di rielaborazione sotto il primo set di dati. Seleziona la casella Processo individualmente .
- Fare clic sul pulsante Integra .
- Per rielaborare i dati multicristallini
- Aprire la finestra di rielaborazione da qualsiasi set di dati.
- Fare clic sul pulsante Multi-Crystal per aprire una nuova schermata.
- Scorri verso il basso per trovare una serie di grafici di analisi per immagine degli esperimenti durante la visita.
- Scegliere una pipeline di elaborazione dal menu a discesa.
- FACOLTATIVO: consente di definire eventuali limiti di risoluzione o parametri noti delle celle unitarie.
- Fare clic e trascinare per definire gli intervalli di immagini da includere nella rielaborazione multicristallina (Figura 7).
NOTA: questa operazione deve essere eseguita su più grafici diversi in modo che i set di dati di più cristalli diversi vengano uniti. - Fare clic sul pulsante Integra (Integra) (Figura 7B).
- Per accedere ai dati rielaborati
- Passare alla pagina Raccolte dati per la visita specifica (passaggi 3.1.1-3.1.3).
- Fare clic sul pulsante Rielaborazione nella parte superiore dello schermo.
- Scorri verso il basso per individuare il lavoro desiderato.
- Fare clic sul percorso del file nella colonna di destra per aprire la schermata Raccolte dati per i dati rielaborati.
- Aprire la scheda Elaborazione automatica e scaricare i dati come descritto in precedenza (passaggio 3.2).
NOTA: tutti i lavori rielaborati sono identificabili dal simbolo delle frecce circolari accanto al nome della pipeline.
Risultati
L'impianto di cristallizzazione e la linea di luce VMXi sono stati utilizzati per un'ampia varietà di tipi di progetti e casi d'uso. Di seguito è riportato un piccolo numero di esempi per illustrare ciò che gli utenti potrebbero voler perseguire.
Caso di studio 1: Raccolta dati standard
La linea di luce consente una rapida determinazione delle strutture cristalline a temperatura ambiente da un piccolo numero di cristalli all'interno di una piastra di cristallizzazione. Il numero minimo di cristalli dipende dal gruppo spaziale e dall'orientamento dei cristalli, ma è spesso compreso tra 1 e 4, anche se una migliore qualità dei dati può essere ottenuta unendo i dati di diverse decine di cristalli. Un esempio recente è uno degli standard della linea di luce, la taumatina. I cristalli multipli, mostrati nella Figura 8A, sono stati marcati per la raccolta manuale dei dati come descritto nella sezione 2.3 del protocollo. Questi cristalli sono stati aggiunti alla coda come descritto nella sezione 2.4 del protocollo e i parametri sperimentali sono stati selezionati dall'elenco a discesa. Una volta applicati i parametri sperimentali, la lastra è stata accodata per la raccolta dei dati. I set di dati sono stati raccolti, ridimensionati automaticamente e uniti utilizzando la pipeline xia2.multiplex come descritto nella sezione 3 del protocollo. Un esempio di output di SynchWeb è mostrato nella Figura 8A al centro. Cinque set di dati uniti hanno dato origine a un set di dati con una risoluzione di 1,66 Å. Per la raccolta di dati standard di circa cinque cristalli in un pozzetto, i set di dati sono stati raccolti entro 2,5 minuti.
Caso di studio 2: Ligando – Esperimento di frammento utilizzando la proteina Mac1
La produzione di strutture di complessi proteina-ligando a temperatura ambiente può essere ottenuta in modo semplice utilizzando la linea di luce. I ligandi possono essere aggiunti alle gocce su piastre di cristallizzazione (manualmente o mediante iniezione acustica di gocce) e i dati possono essere misurati dopo un adeguato tempo di incubazione. Nell'esempio qui descritto, una serie di frammenti sono stati erogati in pozzetti contenenti cristalli del primo macrodominio SARS-CoV-2 della proteina nsp3 (Mac-1) in una piastra di cristallizzazione. Due dei pozzetti contenenti lo stesso frammento sono stati assegnati come gruppo, come descritto nel passaggio 2.5 del protocollo. Cristalli multipli (42) sono stati contrassegnati per la raccolta dei dati come descritto nei passaggi 2.3 e 2.4 del protocollo e i set di dati sono stati raccolti utilizzando parametri standard (rotazione di 60°, passo di 0,1°, esposizione di 0,00178 s, trasmissione del 5%, 16 KeV - per cristallo) (Figura 8B). I set di dati dei due pozzi sono stati elaborati automaticamente utilizzando la pipeline xia2.dials e, successivamente, è stata avviata la pipeline xia2.multiplex per unire automaticamente 22 di questi set di dati. DIMPLE è stato quindi eseguito sull'output di queste pipeline e ha prodotto mappe che mostravano chiaramente l'evidenza del frammento legato. Il modello del frammento è stato incorporato nella densità non occupata e ulteriormente perfezionato (Figura 8B a destra). Le strutture legate al ligando a temperatura ambiente possono essere facilmente determinate utilizzando questa serie di passaggi per fornire informazioni e feedback preziosi al processo di progettazione del farmaco basato sulla struttura. Per questa raccolta di dati di 42 cristalli in un certo numero di pozzi, i set di dati sono stati raccolti entro 10 minuti.
Caso di studio 3: Soluzione strutturale con un gruppo di spazi a bassa simmetria e orientamenti preferenziali Una pila di cristalli multipli con morfologia simile a una piastra è stata prodotta da esperimenti di cristallizzazione con un citocromo legante il gas di tipo c (Figura 8C). Selezionando diverse posizioni attorno al bordo della pila in cui c'era un solo cristallo nel fascio di raggi X, è stato possibile ottenere un set di dati di buona qualità con una risoluzione di 1,75 Å unendo i cunei di quattro cristalli, nonostante un gruppo spaziale monoclino (C2). Ciò ha permesso un rapido avanzamento del progetto senza la necessità di ottimizzare ulteriormente le condizioni di cristallizzazione. Questo risultato è stato descritto in precedenza9. Per questa raccolta di dati di quattro cristalli in un pozzo, i set di dati sono stati raccolti entro 2 minuti.
Caso di studio 4: Ottenere informazioni e struttura a temperatura ambiente da microcristalli in una piastra utilizzando la cristallografia seriale
Spesso, quando i microcristalli appaiono in una goccia o quando gli utenti cercano di ottimizzare i protocolli di microcristallizzazione in batch come precursori di esperimenti di cristallografia seriale su sorgenti di sincrotrone o XFEL, è molto utile ottenere un rapido feedback sulle proprietà di diffrazione e sulle dimensioni delle celle unitarie di diverse prove utilizzando materiale minimo. In questo caso d'uso, i microcristalli di lisozima che crescono in batch sono stati pipettati in una piastra di cristallizzazione (200 nL di volume per goccia) e i dati sono stati raccolti da otto gocce utilizzando una scansione a griglia con un passo di 10 μm (Figura 9). Le 25.906 immagini fisse risultanti sono state elaborate utilizzando un software di cristallografia seriale che ha dato vita a un set di dati, in cui 9.891 modelli di diffrazione sono stati indicizzati e fusi producendo un set di dati con una risoluzione di 2,0 Å che si è perfezionato bene rispetto alla struttura a temperatura ambiente pubblicata(lavoro R = 19,6%, Rlibero = 23,6% utilizzando PDB 8A9D) (Tabella 1). Ciò ha permesso un'analisi dettagliata della distribuzione delle celle unitarie e una determinazione della struttura della temperatura ambiente dei microcristalli che potrebbe alimentare complessi esperimenti di cristallografia seriale, compresi gli studi risolti nel tempo. Il volume totale di sospensione microcristallina richiesto era di 1,6 μL. Per questa raccolta di dati di microcristalli in otto pozzetti utilizzando scansioni a griglia, i set di dati sono stati raccolti entro 40 minuti.
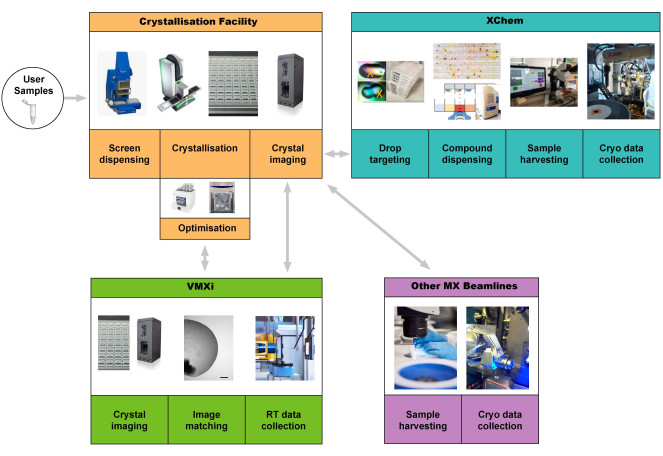
Figura 1: Schema della pipeline proteina-struttura che integra lo screening della cristallizzazione, l'ottimizzazione presso l'impianto di cristallizzazione, la raccolta e l'elaborazione automatizzata dei dati a temperatura ambiente senza raccolta del campione presso VMXi, lo screening dei frammenti XChem e la raccolta dei dati su altre linee di luce MX. Gli utenti possono avviare la pipeline fornendo un campione o portando le piastre alla linea di luce VMXi. Abbreviazione: Cristallografia macromolecolare versatile in situ. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: L'interfaccia Mosquito SPT Labtech per l'impostazione delle piastre di cristallizzazione. (A) (1) La vista di configurazione di MiTeGen In Situ-1. Scegliere la piastra standard MiTeGen 2 andando su (2) il tipo di piastra a 96 pozzetti e selezionando (3) la piastra MiTeGen 2 drop plate. Per modificare i parametri di definizione per la goccia 1 e la goccia 2, che è richiesta per VMXi, fare clic sull'icona di modifica (4). Si apre una nuova finestra (B) in cui (5) gli offset X e Y devono essere modificati come mostrato. Selezionare (B) il pozzetto secondario 2 e (C) il pozzetto secondario 3 e modificare i valori di conseguenza. (D) La vista di configurazione di CrystalQuickX. Scegliere la piastra standard CrystalQuickX 2 passando al tipo di piastra a 96 pozzetti e selezionando la piastra MiTeGen 2 placca a 2 pozzetti. Per modificare i parametri di definizione per la versione 1 e la versione 2, necessarie per VMXi, fare clic sull'icona di modifica come sopra. Si apre una nuova finestra in cui (E,F) gli offset X e Y devono essere modificati come mostrato. Fare clic qui per visualizzare una versione più grande di questa figura.
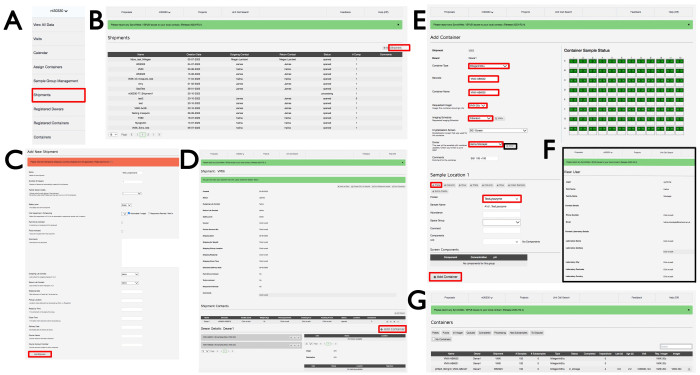
Figura 3: L'interfaccia SynchWeb che mostra come creare una spedizione VMXi, registrare una targa e controllare i dettagli di contatto. Le schermate delle varie fasi di caricamento delle informazioni nell'interfaccia SynchWeb vengono mostrate da (A) il menu a discesa, (B,C) la registrazione di una nuova spedizione, (D) la registrazione di un nuovo container, (E) l'inserimento delle informazioni sulla targa, (F) il controllo dei dettagli di contatto e (G) un elenco di contenitori registrati all'interno di una proposta. Fare clic qui per visualizzare una versione più grande di questa figura.
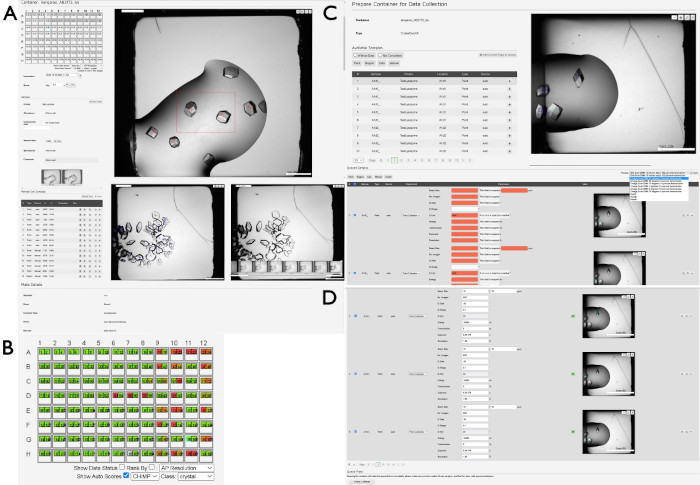
Figura 4: Selezione e preparazione dei campioni per la raccolta dei dati tramite SynchWeb. Viene visualizzata una serie di schermate che mostrano le varie fasi di preparazione dei campioni per la raccolta dei dati utilizzando l'interfaccia SynchWeb. (A) I punti e le regioni di interesse vengono selezionati dalla panoramica di rilascio. Nella parte inferiore di questo pannello, c'è una serie cronologica di fotografie di una goccia. (B) Un esempio dell'output CHiMP per una piastra che evidenzia i risultati per la categoria 'cristallo'. (C) Aggiunta di campioni alla coda dall'elenco dei punti e delle regioni selezionati e (D) applicazione dei parametri per la raccolta dei dati ai campioni in coda dall'elenco a discesa delle impostazioni dell'esperimento create dalla linea di luce. Si noti la differenza tra i campioni senza parametri sperimentali (in rosso) e quelli che hanno correttamente applicato i parametri (in alto e in basso). Nella parte inferiore di questo pannello è presente il pulsante Contenitore coda , che mette in coda la piastra da raccogliere sulla linea di fascio. Fare clic qui per visualizzare una versione più grande di questa figura.
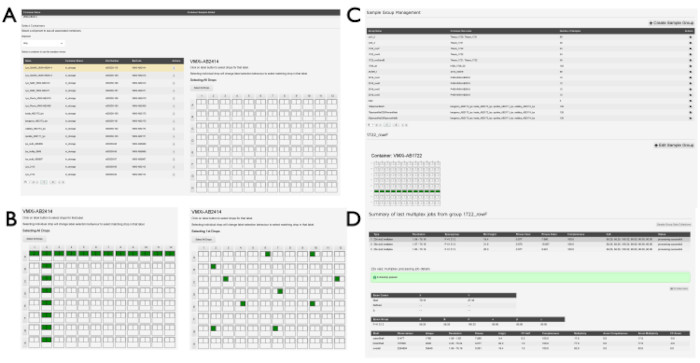
Figura 5: Creazione di gruppi di esempio in SynchWeb. Una serie di schermate che mostrano le varie fasi della creazione di gruppi di esempio. (A) La piastra o le piastre contenenti i campioni sono selezionate dalla spedizione pertinente e (B) le gocce all'interno della piastra sono selezionate. Questi possono essere singoli drop o possono essere selezionati per riga e/o colonna. (C) Un elenco di gruppi campione che sono già stati creati. (D) Gli output degli ultimi tre processi di elaborazione multiplex sono elencati e possono essere selezionati per visualizzare le statistiche dalla pipeline di elaborazione. Fare clic qui per visualizzare una versione più grande di questa figura.
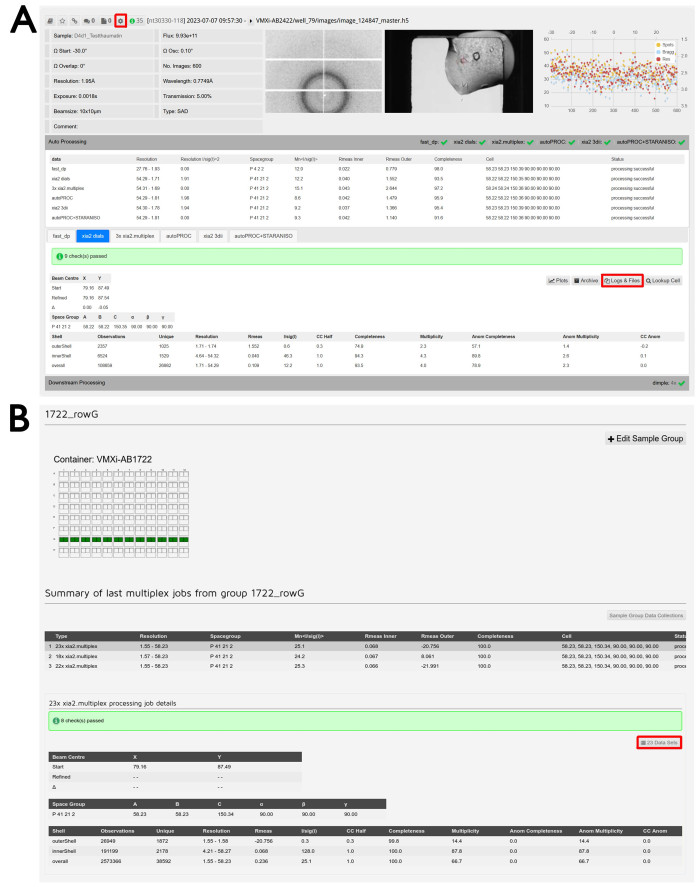
Figura 6: Elaborazione e riduzione dei dati. (A) Screenshot di un set di dati elaborato in ISPyB11. Il pulsante per accedere alle funzioni di rielaborazione è evidenziato. L'ID del campione e i parametri sperimentali sono mostrati in alto a sinistra e il visualizzatore di immagini di diffrazione al centro. Cliccando su questa immagine si aprirà una finestra interattiva per esaminare diverse immagini. Il visualizzatore di immagini di cristallo è mostrato a destra e facendo clic su questa immagine si aprirà anche una finestra interattiva per confrontare le immagini di archiviazione beamline e Formulatrix. Il grafico dell'analisi per immagine è mostrato all'estrema destra e facendo clic su questa immagine si aprirà una versione ingrandita di questo output. Facendo clic sulla scheda Elaborazione automatica si renderà visibile l'elaborazione automatica e si faciliterà il confronto tra i risultati delle diverse pipeline. Fare clic sulle schede per passare da una pipeline di elaborazione all'altra e visualizzare l'output dettagliato della pipeline selezionata. Il pulsante Log & Files per il download dei dati è evidenziato. Facendo clic sulla scheda Elaborazione a valle , si espanderanno e verranno forniti i risultati per tutti i set di dati eseguiti attraverso le pipeline di riduzione post-dati, se necessario. (B) Screenshot dalla schermata Gestione gruppo di esempio . Il nome del gruppo definito dall'utente si trova in alto e la descrizione visiva dei pozzetti inclusi può essere visualizzata di seguito. Un pozzetto verde indica che tutti i cristalli misurati da quella goccia saranno inclusi nel gruppo. È possibile visualizzare un riepilogo dei diversi lavori multiplex eseguiti su quel gruppo e sotto c'è l'output dettagliato del multiplex. Viene evidenziato il pulsante Set di dati per esaminare gli esperimenti inclusi. Fare clic qui per visualizzare una versione più grande di questa figura.
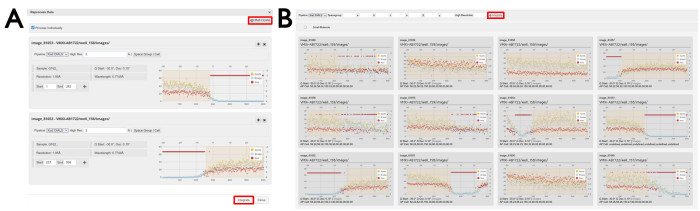
Figura 7: Finestre di rielaborazione dei dati. (A) Set di dati individuali e (B) multicristallini. Vengono visualizzati due singoli set di dati in cui sono state selezionate aree di dati. Con la casella di controllo Elabora individualmente selezionata, le immagini di diffrazione selezionate verranno elaborate singolarmente premendo il pulsante Integra . Facendo clic sul pulsante Multi-crystal si aprirà una visualizzazione dei singoli set di dati. Per rielaborare le immagini di diffrazione da più set di dati, le regioni delle immagini vengono selezionate come visualizzate e la rielaborazione viene avviata facendo clic sul pulsante Integra come evidenziato. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 8: Risultati rappresentativi della pipeline VMXi. (A) Cristalli marcati per la proteina taumatina all'interno di una goccia di cristallizzazione (pannello di sinistra), risultati dell'elaborazione dei dati (pannello centrale) e densità elettronica (pannello di destra). (B) Raccolta su cristalli multipli per determinare il legame del frammento al macrodominio SARS-CoV-2. I set di dati sono stati raccolti su più cristalli in presenza di un frammento dallo schermo dei frammenti EU-OPENSCREEN utilizzando impostazioni sperimentali standard. Esempi di queste raccolte di dati sono mostrati in questo estratto da SynchWeb. Il frammento è stato costruito nella densità corrispondente e ulteriormente raffinato, come è mostrato nell'angolo più lontano a destra. (C) Cristalli monoclini marcati in una pila da un colpo di cristallizzazione impegnativo utilizzato per la raccolta dei dati. Le croci verdi e i numeri rossi indicano dove sono stati misurati i dati utilizzando un fascio di 10 μm e una rotazione di 60°. Quattro degli zoccoli risultanti sono stati uniti per produrre un set di dati con una risoluzione di 1,75 Å. La densità elettronica attorno al gruppo di Heme è visualizzata a destra. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 9: Cristallografia seriale nella piastra di cristallizzazione. (A) Immagine ottica della goccia di cristallizzazione, con un riquadro bianco che rappresenta la regione di interesse. (B) Definizione dei punti di scansione della griglia. (C) Mappa di calore che indica la diffrazione. (D) Mappa della densità elettronica derivante da un set di dati cristallografici seriali da oltre 9.000 modelli di diffrazione statica. Fare clic qui per visualizzare una versione più grande di questa figura.
| Risoluzione (Å) | Completezza (%) | Molteplicità | I/σ(I) | R spaccato | CC1/2 | Osservazioni uniche |
| Grembiule | 100 | 95.5 | 20.8 | 0.063 | 0.998 | 8422 |
| Bassa (55.55 - 5.43) | 100 | 147.1 | 81.7 | 0.028 | 0.999 | 488 |
| Alta (2.03 -2.00) | 100 | 75.3 | 1.2 | 1.092 | 0.410 | 411 |
Tabella 1: Statistiche dei dati per il set di dati seriale VMXi RT. Abbreviazioni: I = intensità media delle osservazioni in scala; R split = una misura della discrepanza delle intensità misurate; CC 1/2 = coefficiente di correlazione tra due metà casuali del set di dati.
Discussione
Abbiamo descritto l'intera procedura dall'arrivo di un campione proteico nella FC al download dei dati finali da parte dell'utente per ulteriori applicazioni. Le fasi critiche sono la produzione di un campione proteico di alta qualità e di schermi cristallini appropriati, utilizzando schermi a matrice sparsa commerciali o schermi di ottimizzazione basati su condizioni stabilite. Questo processo può avvenire nella CF, oppure gli utenti possono eseguire le procedure di cristallizzazione nei laboratori domestici e portare le piastre di cristallizzazione adatte alla linea di luce. L'identificazione di parametri di raccolta dati adeguati può essere importante per alcuni campioni, in particolare quando il danno da radiazioni è un problema. Nella maggior parte dei casi, l'elaborazione automatizzata dei dati è pienamente sufficiente per rispondere alla domanda scientifica, sebbene gli utenti mantengano la capacità di rielaborare utilizzando gli strumenti della linea di luce, ad esempio, quando il gruppo spaziale è ambiguo o viene utilizzata solo la parte iniziale dei dati raccolti per ridurre al minimo gli effetti del danno da radiazioni.
Se non vengono prodotti cristalli idonei dalle prove iniziali di cristallizzazione, possono essere esplorati cambiamenti nella concentrazione proteica, nella purezza o negli schermi di cristallizzazione, così come l'uso della semina dei cristalli. Se i cristalli non si diffrattiscono a una risoluzione utile sulla linea di fascio, è possibile utilizzare le scansioni a griglia con un fascio non attenuato per valutare il limite di diffrazione intrinseco e la cella unitaria dei cristalli per guidare gli sforzi di ottimizzazione. I cristalli che sono troppo piccoli per la raccolta di dati all'interno delle piastre (ad esempio, <10 μm) possono invece essere adatti per la cristallografia seriale o per esperimenti di nano focalizzazione (ad esempio, alla linea di luce Diamond VMXm). Risolvere le strutture utilizzando i dati VMXi è generalmente semplice per sostituzione molecolare, in particolare dopo l'avvento di Alphafold16 per fornire modelli di ricerca efficaci. Se ciò non ha successo, i cristalli possono essere raccolti e crioraffreddati dalle piastre per consentire esperimenti convenzionali di diffrazione anomala a lunghezza d'onda singola, diffrazione anomala a più lunghezze d'onda o fasatura a lunghezza d'onda lunga.
I vantaggi di questo metodo includono la possibilità di ottenere set di dati e feedback rapidi e di alta qualità direttamente dalle piastre di cristallizzazione senza la necessità di disturbare i cristalli dagli ambienti in cui sono cresciuti. Il cosiddetto "Rinascimento a temperatura ambiente" in biologia strutturale pone un premio sulle strutture ottenute in condizioni non criogeniche per consentire una maggiore rilevanza fisiologica e la dinamica delle proteineda esplorare 2. Di solito, si ottiene una risoluzione leggermente inferiore rispetto a un cristallo crioraffreddato ottimizzato, ma solo quando sono state stabilite condizioni criogeniche adeguate e se i cristalli sono resistenti alla manipolazione meccanica e all'apertura della goccia di cristallizzazione3. Un'applicazione imminente per la quale questa pipeline è molto adatta è uno screening su larga scala di complessi proteina-ligando o campagne di frammenti a temperatura ambiente nella scoperta di farmaci. I ligandi o i frammenti possono essere cocristallizzati o aggiunti mediante pipetta o espulsione acustica di gocce prima della raccolta dei dati a temperatura ambiente. Un'altra applicazione è quella di misurare rapidamente i dati di molte centinaia o migliaia di cristalli in modo altamente efficiente e quindi di utilizzare il software DIALS17 multiplex14 per estrarre cluster isomorfi che possono rappresentare diverse entità biologiche o per stabilire differenze statisticamente significative tra popolazioni di cristalli che sono stati trattati in modo diverso o esposti a leganti o segnali diversi.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Riconosciamo i numerosi scienziati di Diamond Light Source e i membri del team di supporto che hanno contribuito alla progettazione, alla costruzione e al funzionamento della linea di luce VMXi. Siamo grati agli utenti di beamline, che hanno contribuito con idee in seguito allo sviluppo delle pipeline di cristallizzazione e raccolta dati. L'impianto di cristallizzazione di Harwell è supportato dalla Diamond Light Source Ltd, dal Rosalind Franklin Institute e dal Medical Research Council.
Materiali
| Name | Company | Catalog Number | Comments |
| Formulator | Formulatrix | on request | Liquid handling robot |
| Formulatrix imager | Formulatrix | on request | Crystallisation plate imager |
| Greiner CrystalQuick X | Greiner | Z617644 | Crystallisation plate |
| Gryphon | Art Robbins Instruments | 620-1000-10 | Crystalisation robot |
| MiTeGen Insitu-1 | Mitegen | InSitu-01CL-40 | Crystallisation plate |
| Mosquito LCP | (SPT Labtech) | on request | Crystallisation robot |
| Rock Imager & Maker | Formualtrix | on request | Software for Imager [1] https://formulatrix.com/protein-crystallization-systems/rock-maker-crystallization-software/ |
| Scorpion | Art Robbins Instruments | 640-1000-10 | Liquid handling robot https://www.artrobbins.com/scorpion |
Riferimenti
- Lynch, M. L., Snell, M. E., Potter, S. A., Snell, E. H., Bowman, S. E. J. 20 years of crystal hits: Progress and promise in ultrahigh-throughput crystallization screening. Acta Crystallographica Section D Structural Biology. 79 (Pt 3), 198-205 (2023).
- Fischer, M. Macromolecular room temperature crystallography. Quarterly Reviews of Biophysics. 54, 1 (2021).
- Helliwell, J. R. What is the structural chemistry of the living organism at its temperature and pressure. Acta Crystallographica Section D Structural Biology. 76 (Pt 2), 87-93 (2020).
- Thorne, R. E. Determining biomolecular structures near room temperature using x-ray crystallography: Concepts, methods and future optimization. Acta Crystallographica Section D Structural Biology. 79 (Pt 1), 78-94 (2023).
- Keedy, D. A., et al. Crystal cryocooling distorts conformational heterogeneity in a model michaelis complex of dhfr. Structure. 22 (6), 899-910 (2014).
- Huang, C. Y., et al. Probing ligand binding of endothiapepsin by 'temperature-resolved' macromolecular crystallography. Acta Crystallographica Section D Structural Biology. 78 (Pt 8), 964-974 (2022).
- Sanchez-Weatherby, J., et al. Vmxi: A fully automated, fully remote, high-flux in situ macromolecular crystallography beamline. Journal of Synchrotron Radiation. 26 (Pt 1), 291-301 (2019).
- Jacquamet, L., et al. Automated analysis of vapor diffusion crystallization drops with an x-ray beam. Structure. 12 (7), 1219-1225 (2004).
- Mikolajek, H., et al. Protein-to-structure pipeline for ambient-temperature in situ crystallography at vmxi. IUCrJ. 10, 420-429 (2023).
- Douangamath, A., et al. Achieving efficient fragment screening at xchem facility at diamond light source. Journal of Visualised Experiments. (171), (2021).
- Delageniere, S., et al. Ispyb: An information management system for synchrotron macromolecular crystallography. Bioinformatics. 27 (22), 3186-3192 (2011).
- Fisher, S. J., Levik, K. E., Williams, M. A., Ashton, A. W., Mcauley, K. E. Synchweb: A modern interface for ispyb. Journal of Applied Crystallography. 48 (Pt 3), 927-932 (2015).
- Jenkins, J., Cook, M. Mosquito®: An accurate nanoliter dispensing technology. JALA: Journal of the Association for Laboratory Automation. 9 (4), 257-261 (2016).
- Gildea, R. J., et al. Xia2.Multiplex: A multi-crystal data-analysis pipeline. Acta Crystallographica Section D Structural Biology. 78 (Pt 6), 752-769 (2022).
- Winter, G., Mcauley, K. E. Automated data collection for macromolecular crystallography. Methods. 55 (1), 81-93 (2011).
- Jumper, J., et al. Highly accurate protein structure prediction with alphafold. Nature. 596 (7873), 583-589 (2021).
- Winter, G., et al. Dials as a toolkit. Protein Science. 31 (1), 232-250 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon