È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sintesi, caratterizzazione, incapsulamento e misurazione del potenziale di rilascio di nuove particelle micro/submicroniche di lignina alcalina
In questo articolo
Riepilogo
Descriviamo nuove e semplici metodologie di sintesi e caratterizzazione di particelle biocompatibili di lignina micro e submicronica. Queste formulazioni forniscono un approccio facile per l'utilizzo dell'eteropolimero, nonché un'alternativa per la progettazione razionale di matrici carrier multifunzionali con potenziale applicabilità in biomedicina, tecnologia farmaceutica e industria alimentare.
Abstract
L'applicabilità della micro/nanotecnologia dei biopolimeri nella medicina umana, veterinaria, farmaceutica e alimentare è in rapida crescita grazie al grande potenziale delle particelle a base di biopolimeri come efficaci sistemi di trasporto. L'utilizzo della lignina come biomatrice eteropolimerica di base per la progettazione di formulazioni innovative micro/submicroniche consente il raggiungimento di una maggiore biocompatibilità e offre vari gruppi funzionali attivi presentando opportunità di personalizzazione delle proprietà fisico-chimiche e delle bioattività delle formulazioni per diverse applicazioni. Lo scopo del presente studio è stato quello di sviluppare una metodologia semplice ed ecologica per la sintesi di particelle di lignina di dimensioni micro e submicroniche; valutarne le caratteristiche fisico-chimiche, spettrali e strutturali; ed esaminare la loro capacità di incapsulamento di molecole biologicamente attive e il potenziale per il rilascio in vitro di bioflavonoidi in terreni gastrointestinali simulati. Le metodologie presentate applicano solventi economici e verdi; processi facili, diretti, rapidi e sensibili che richiedono poche attrezzature, sostanze non tossiche e metodi semplici per la loro caratterizzazione, la determinazione della capacità di incapsulamento nei confronti dei composti bioattivi scarsamente solubili in acqua Morin e Quercetina e il potenziale di rilascio in vitro delle matrici di lignina.
Introduzione
Al giorno d'oggi l'inclinazione verso biopolimeri come cellulosa, chitosano, collagene, destrano, gelatina e lignina come precursori per la progettazione di vettori micro/submicronici con dimensioni, proprietà fisico-chimiche e biofunzionalità personalizzabili è aumentata nelle industrie biomediche, farmaceutiche e della tecnologia alimentare grazie alla loro applicabilità nell'ingegneria tissutale, nel bioprinting 3D, nella vitro piattaforme di modellazione delle malattie, industria dell'imballaggio, preparazione di emulsioni e somministrazione di nutrienti tra gli altri 1,2,3.
Nuovi studi evidenziano gli aspetti degli idrogel a base di lignina e delle micro e nanoformulazioni4 come veicoli vantaggiosi utilizzati per i materiali di imballaggio alimentare5, l'accumulo di energia6, i cosmetici7, gli stabilizzanti termici/fotoelettrici, i materiali rinforzati e le matrici di vettori di farmaci8 per la somministrazione di molecole idrofobiche, il miglioramento delle barriere UV9, come agenti di rinforzo nei nanocompositi e come alternativa alle nanoparticelle inorganiche a causa di alcuni recenti problemi di sicurezza 10,11,12. La ragione alla base di questa tendenza è la biocompatibilità, la biodegradabilità e la non tossicità del biopolimero etero naturale, nonché le sue comprovate bioattività di potenziale antiossidante della lignina e attività antimicrobiche, antiproliferative e antimicrobiche 13,14,15,16,17.
La letteratura scientifica riporta vari metodi per la sintesi (autoassemblaggio, precipitazione anti-solvente, precipitazione acida e spostamento del solvente)18 e la caratterizzazione di formulazioni su micro/nanoscala a base di lignina, inclusa l'applicazione di solventi costosi o dannosi come tetraidrofurano (THF), dimetilsolfossido (DMSO), N,N-dimetilformammide (DMF) e acetone e processi complicati, indiretti e noiosi che utilizzano molte apparecchiature e sostanze tossiche 12,19,20.
Per superare questi ultimi svantaggi, i seguenti protocolli presentano nuove metodologie per la sintesi di particelle micro-/submicroniche a base di lignina utilizzando solventi economici e verdi; Processi facili, diretti, rapidi e sensibili che richiedono poche attrezzature, sostanze non tossiche e metodi semplici per la loro caratterizzazione e la determinazione della capacità di incapsulamento verso composti bioattivi scarsamente solubili in acqua e potenziale di rilascio in vitro delle matrici di lignina. I metodi di produzione su scala di laboratorio presentati sono vantaggiosi per la produzione di vettori funzionali di lignina con dimensioni regolabili, elevata capacità di incapsulamento e comportamento di rilascio in vitro sostenibile utilizzando semplici procedure di caratterizzazione e sostanze chimiche ecologiche che possono trovare applicazione in varie aree delle scienze biomediche e della tecnologia alimentare. Due flavonoidi sono stati applicati come molecole bersaglio incapsulate nelle particelle di lignina: morin nelle microparticelle e quercetina nelle particelle submicroniche. La differenza nelle strutture di entrambi i flavonoidi è solo la posizione del secondo gruppo -OH nell'anello aromatico B: il gruppo -OH è in posizione 2' nella morina e in posizione 3' nella quercetina, quindi entrambi i composti organici sono isomeri posizionali. Quest'ultimo fatto presuppone un comportamento simile di entrambi i composti naturali bioattivi nei processi di incapsulamento e/o rilascio.
Protocollo
1. Sintesi di microparticelle di lignina
- Preparare una soluzione acquosa di lignina alcalina 50 mg/mL sciogliendo 2,5 g di lignina alcalina in 50 mL di acqua ultrapura su un agitatore magnetico.
- Preparare la soluzione Tween 80 all'1% sciogliendo 1 mL di Tween 80 in 100 mL di acqua ultrapura.
- Preparare una soluzione 2 M di HNO3 diluendo 6,65 mL di HNO3 al 67% (densità = 1,413 g/mL) con acqua ultrapura fino a un volume finale di 50 mL.
- Aggiungere lentamente 15 mL della soluzione Tween 80 all'1% a 50 mL della soluzione di lignina alcalina da 50 mg/mL.
- Agitare la miscela su un agitatore magnetico a 500 giri/min per 10 minuti in modo che il tensioattivo si disperda bene.
- Aggiungere alla miscela 20 mL di 2 M HNO3 goccia a goccia con una siringa a una velocità di flusso di circa 150 μL/s.
- Continuare a mescolare la miscela per 30 minuti quando la soluzione marrone scuro si trasforma in una sospensione marrone chiaro di microparticelle.
- Trasferire la sospensione in provette da 1,5-2 mL e centrifugare per 30 minuti a 15.000 × g in un'ultracentrifuga a 10 °C.
- Raccogliere il surnatante per ulteriori analisi e sciacquare le microparticelle con acqua ultrapura.
- Ripetere le procedure di risciacquo/ultracentrifugazione 3 volte.
- Immergere il contenitore con le microparticelle in un bagno di ghiaccio prima dell'omogeneizzazione a ultrasuoni.
- Omogeneizzare le microparticelle per 4 minuti a un'intensità del 93% su un omogeneizzatore a ultrasuoni.
- Liofilizzare le microparticelle a una temperatura di -64 °C in un liofilizzatore e conservarle in un ecciatore per un ulteriore utilizzo.
2. Sintesi di particelle submicroniche di lignina
- Preparare una soluzione acquosa di lignina alcalina da 5 mg/mL sciogliendo 125 mg di lignina alcalina in 25 mL di acqua ultrapura su un agitatore magnetico.
- Aggiungere lentamente 1 mL di EtOH al 96% alla soluzione di lignina alcalina.
- Agitare la miscela su un agitatore magnetico a 500 giri/min per 3 minuti.
- Preparare 50 mL di una soluzione all'1% di acido citrico sciogliendo 0,5 g di acido citrico in acqua ultrapura fino a un volume finale di 50 mL.
- Aggiungere alla miscela 7 mL di acido citrico all'1% per via gocciolina con una siringa a una velocità di flusso di circa 4 mL/min.
- Continua a mescolare la miscela per 10 minuti quando la soluzione marrone trasparente si trasformerà in una sospensione torbida marrone chiaro di particelle submicroniche.
- Trasferire la sospensione in provette e centrifugare per 30 minuti a 15.000 × g in un'ultracentrifuga a 10 °C.
- Raccogliere il surnatante per ulteriori analisi e sciacquare le microparticelle con acqua ultrapura.
- Ripetere le procedure di risciacquo/ultracentrifugazione 3 volte.
- Immergere il contenitore con le microparticelle in un bagno di ghiaccio prima dell'omogeneizzazione a ultrasuoni.
- Omogeneizzare le microparticelle ad ultrasuoni per due cicli di 4 minuti ciascuno ad un'intensità del 96% in un omogeneizzatore ad ultrasuoni.
- Raffreddare i contenitori per 1 minuto dopo il primo ciclo.
- Liofilizzare le microparticelle a una temperatura di -64 °C in un liofilizzatore e conservarle in un ecciatore per un ulteriore utilizzo.
3. Sintesi di particelle di lignina micro/submicronica incapsulate da flavonoidi naturali
- Ripetere i passaggi 1.1-1.5 per le microparticelle.
- Pesare 0,08 g di morin, scioglierlo in 1 mL di EtOH e aggiungere questa soluzione etanolica alla miscela.
- Agitare la miscela su un agitatore magnetico a 500 giri/min per 20 minuti.
- Aggiungere alla miscela 20 mL di 2 N HNO3 goccia a goccia con una siringa a una velocità di flusso di circa 150 μL/s.
- Continuare a mescolare il composto per 60 minuti.
- Ripetere i passaggi 1.8-1.13.
- Ripetere il passaggio 2.1 per le particelle submicroniche.
- Pesare 0,04 g di quercetina, scioglierla in 1 mL di EtOH e aggiungere questa soluzione etanolica alla soluzione acquosa di lignina alcalina.
- Agitare la miscela su un agitatore magnetico a 500 giri/min per 10 minuti.
- Ripetere i passaggi 2.4-2.13.
4. Determinazione dell'efficienza di incapsulamento delle micro-/sumicro- particelle di lignina
- Calcolare il contenuto della sostanza bioattiva aggiunta durante la procedura per la sintesi di entrambi i tipi di particelle di lignina incapsulate da flavonoidi.
- Determinare spettrofotometricamente l'assorbimento del flavonoide nel surnatante ottenuto durante le fasi 1.9 e 2.8 dopo averlo diluito con EtOH al 96%.
- Calcolare la concentrazione della morin/quercetina non intrappolata utilizzando le curve di calibrazione dei flavonoidi.
- Calcolare l'efficienza di incapsulamento (EE, %) delle microparticelle di lignina verso i flavonoidi naturali utilizzando l'equazione (1):
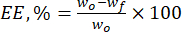 (1)
(1)
Dove wo è la quantità totale della sostanza bioattiva aggiunta (mg) e wf è la quantità del flavonoide libero non intrappolato (mg). - Calcolare la capacità di carico del farmaco (DLC, %) - un parametro importante che rappresenta la quantità di farmaco nelle particelle per unità di peso del sistema di trasporto - utilizzando l'eq. (2):
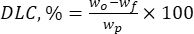 (2)
(2)
Dove wp è la quantità totale (resa) di particelle micro/submicroniche di lignina ottenute dopo liofilizzazione (mg).
5. Caratterizzazione di particelle di lignina micro e submicronica
- Determinazione del numero, della dimensione e della distribuzione granulometrica delle particelle
- Valutare la dimensione delle particelle e la distribuzione granulometrica dei campioni utilizzando un contatore automatico di celle con l'opzione per il conteggio delle microsfere. Aggiungere con una micropipetta 1 μL di particelle di lignina/flavonoidi micro/submicroniche in sospensione in acqua ultrapura nel pozzetto del vetrino di conteggio necessario per l'operazione.
- Attendere che il numero di particelle in 1 mL della sospensione, nonché il loro numero e la loro distribuzione per dimensione vengano visualizzati sul display del contatore automatico di cellule.
NOTA: L'apparecchio consente la memorizzazione dei dati su una chiavetta USB. Il software speciale del contatore automatico delle celle consente un'ulteriore elaborazione dei file digitali e fotografici salvati.
- Determinazione del contenuto di gruppi acidi/basici superficiali di particelle di lignina mediante titolazione potenziometrica
- Peso 0,04 g di particelle di lignina scaricate/incapsulate con flavonoidi.
- Trasferirli in un matraccio di Erlenmeyer, aggiungere 10 ml di HCl 0,1 M e posizionare il matraccio su un agitatore magnetico a 250 giri/min.
- Riempire una buretta da 50 ml con una soluzione standard 0,1 M del titolante NaOH.
- Misurare il pH iniziale della soluzione nel pallone di Erlenmeyer con un pHmetro da banco prima di iniziare la titolazione.
- Avviare la titolazione e misurare il pH della soluzione analizzata dopo ogni porzione aggiunta di 0,5 mL del titolante.
- Memorizzare i dati sperimentali in una tabella contenente il volume del titolante applicato e il corrispondente valore di pH.
- Interrompere la titolazione quando viene raggiunto un valore approssimativamente costante del pH aumentando il volume della soluzione titolante.
- Tracciare i dati sperimentali sotto forma di curve di titolazione differenziale zero, prima e derivata seconda.
- Determinare i punti equivalenti e i corrispondenti volumi equivalenti dei titolanti utilizzati.
- Calcolare il contenuto dei gruppi basici acidi Aae Absulla superficie delle particelle di lignina scaricate e caricate con flavonoidi utilizzando le equazioni (3) e (4):
 , mgeq/g (3)
, mgeq/g (3)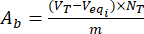 MGEQ/G (4)
MGEQ/G (4)
dove Veqi è il volume equivalente (mL); NT la normalità del titolante (mgeqv/mL); VT il volume del titolante utilizzato per la procedura di determinazione (mL); m il peso del campione analizzato (g).
- Determinazione del punto di pH a carica zero (pHPZC) di particelle a base di lignina con il metodo dell'addizione solida.
- Preparare 60 mL di soluzione acquosa 0,1 M di NaCl.
- Aggiungere 9 mL della soluzione di NaCl 0,1 M in ciascuno dei cinque matracci conici con tappo e regolare il pH a pHi = 2, 4, 7, 10 e 12 (dove i = 1-5 indica il numero della soluzione corrispondente), rispettivamente aggiungendo 0,1 M HCl o 0,1 M NaOH. Regolare il volume totale della soluzione in ciascun matraccio a 10 mL esattamente aggiungendo una soluzione di NaCl dello stesso dosaggio.
- Aggiungere 40 mg di particelle di lignina secche (micro/submicroniche caricate con flavonoidi non carichi) in ciascun matraccio e tappare bene i palloni con un tappo sicuro.
- Fissare i palloni in posizione verticale su uno shaker orbitale e tenerli agitati per 24 ore.
- Lasciare equilibrare per 30 minuti e successivamente misurare il pH finale (pHf) dei surnatanti in ciascun matrasso.
- Tracciare i valori di pHf rispetto ai corrispondenti valori di pH iniziale (pHi).
- Il punto di carica zero (pHPZC) è definito come il valore di pH al quale la curva ΔpH rispetto a pHi interseca la retta con le coordinate (pHi; pHi).
- Determinazione del contenuto fenolico totale (TPC) delle particelle di lignina
NOTA: Il contenuto fenolico totale (TPC) delle particelle di lignina micro/submicronica viene determinato mediante un metodo colorimetrico Folin-Ciocalteu modificato.- Miscelare 200 μl di una sospensione acquosa di particelle con una concentrazione di 500 μg/mL con 600 μl di acqua ultrapura e 200 μl di reagente Folin-Ciocalteu (1:1, v/v).
- Dopo 5 minuti, aggiungere 1,0 mL di 8% Na2CO3 e 1,0 mL di acqua Milli-Q alla miscela e incubarla al buio a 40 °C per 30 minuti a bagnomaria con agitazione intermittente.
- Centrifugare la sospensione a 5.300 × g per 2 min.
- Prepara uno spazio vuoto senza particelle.
- Trasferire 3,5 mL di surnatante in una cuvetta di quarzo da 10 mm e misurare l'assorbanza su uno spettrofotometro UV/Vis nella regione visibile a 760 nm rispetto al bianco.
- Preparare una curva di taratura dell'acido gallico standard seguendo i punti 5.3.1-5.3.5; solo invece di 200 μL della sospensione di particelle di lignina, utilizzare la soluzione etanolica di acido gallico con concentrazioni iniziali di 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150 e 200 μg/mL.
- Esprimere i dati sperimentali delle microparticelle come mg di equivalenti di acido gallico in milligrammi per grammo di campione secco (mg GAE/g).
- Calcola TPC usando l'equazione (5):
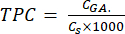 mg di GAE/g (5)
mg di GAE/g (5)
dove CGA è la concentrazione del campione equivalente alla concentrazione dell'acido gallico standard ottenuta dal piano di taratura dell'acido (μg GA/mL); Cs è la concentrazione del campione, che è uguale alla massa del campione secco divisa per il volume del solvente (μg/mL).
6. Determinazione della capacità di rilascio in vitro di particelle di lignina
- Preparare 250 ml di terreno gastrico simulato privo di enzimi regolando il pH della soluzione PBS standard con 0,1 M HCl a pH = 1,2.
- Preparare 250 ml di ciascuna delle due soluzioni fluide intestinali simulate regolando il pH della soluzione PBS standard con 0,1 M NaOH/0,1 M HCl a pH = 6,8 e 7,4, rispettivamente.
- Aggiungere 25 mg di particelle micro/submicroniche incapsulate con flavonoidi a 50 mL di terreno gastrico simulato privo di enzimi in un reattore batch di vetro fornito con un agitatore meccanico e metterlo in un bagno d'acqua termale a una temperatura costante di T = 37 ± 0,2 oC.
- Immergere l'agitatore a una profondità di 2/3 del volume del liquido per garantire la completa miscelazione delle fasi solida e liquida e garantire il massimo trasferimento di massa senza zone stagnanti.
- Prelevare 1 mL di campione dal reattore ogni 10 minuti fino al 90° minuto e pipettare immediatamente 1 mL di soluzione fluida simulata fresca nel reattore per evitare la variazione del volume totale e garantire le condizioni di assorbimento.
- Ripetere la stessa procedura compresi i passaggi 6.3-6.6 con entrambe le soluzioni di fluido intestinale simulate con pH = 6.8 e 7.4, rispettivamente, per 200 minuti.
- Eseguire esperimenti analoghi con particelle di lignina scaricate nei tre mezzi simulati e utilizzare i campioni come spazi vuoti per azzerare lo spettrofotometro.
- Determinare l'assorbimento dei campioni spettrofotometricamente dopo aver filtrato i campioni e averli diluiti con EtOH al 96% rispetto ai campioni bianchi del passaggio 6.7 e calcolare la corrispondente concentrazione di flavonoidi utilizzando le corrispondenti curve di calibrazione della morina ottenute rispettivamente a pH = 1,2, 6,8 e 7,4.
- Calcolare il rilascio cumulativo (CR) dei bioflavonoidi utilizzando l'equazione (6) in μg/mL e la percentuale di rilascio cumulativo (CRP) mediante l'equazione (7):
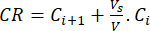 (6)
(6)
dove Ci e Ci+1 sono le concentrazioni di morina/quercetina nell'ie (i+1)esimo campione (μg/mL); Vs il volume di campione prelevato dal reattore discontinuo (mL); V il volume totale del terreno simulato (mL).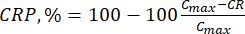 (7)
(7)
Dove Cmax è la concentrazione massima del composto biologicamente attivo nel vettore (μg/mL).
7. Analisi statistiche
- Esprimere i dati sperimentali come medie ± deviazioni standard (SD) di tre misurazioni indipendenti.
- Determinare la significatività statistica dei risultati sperimentali eseguendo il test ANOVA come test post hoc. Si consideri un valore di p < 0,05 statisticamente significativo.
Risultati
È stata eseguita una tecnica di precipitazione anti-solvente per produrre particelle di micro/submicron di lignina alcalina. Una soluzione acquosa di acido inorganico diluito-acido nitrico/acido organico-acido citrico è stata dispersa in una soluzione acquosa di lignina alcalina, arricchita con un tensioattivo/etanolo ecologico, che ha provocato la graduale precipitazione del soluto biopolimerico e, dopo la sonicazione, è stata infine prodotta una sospensione di particelle micro/submicroniche compatte (
Discussione
Tra le principali criticità delle moderne metodologie di sintesi per la progettazione di formulazioni di vettori di farmaci a base di biopolimeri c'è l'applicazione di reagenti organici pericolosi - solventi volatili e infiammabili, come tetraidrofurano, acetone, metanolo e persino DMSO in alte concentrazioni - che ne limita l'applicabilità in biomedicina, industria farmaceutica e tecnologia alimentare a causa della manifestazione di possibili effetti tossici20,
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo studio è stato sostenuto dal Fondo scientifico bulgaro nell'ambito del contratto n. KΠ-06 H59/3 e dal progetto scientifico n. 07/2023 FVM, Università di Trakia.
Materiali
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
Riferimenti
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -. A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041 (2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -. T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592 (2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573 (2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070 (2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793 (2023).
- Gala Morena, A., Tzanov, T. z. Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705 (2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067 (2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650 (2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -. L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487 (2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), 2471 (2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367 (2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52 (2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31 (2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031 (2020).
- Yaneva, Z., Georgieva, N., Grumezescu, A. M. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. , 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon