È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un modello murino tumorale della camera della finestra delle pliche cutanee dorsali per la microscopia intravitale combinata e la risonanza magnetica nella ricerca traslazionale sul cancro
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La traduzione dei risultati della microscopia intravitale è messa a dura prova dalla sua penetrazione a bassa profondità nei tessuti. Qui descriviamo un modello murino a camera a finestra dorsale che consente la co-registrazione della microscopia intravitale e delle modalità di imaging clinicamente applicabili (ad es. TC, MRI) per la correlazione spaziale diretta, semplificando potenzialmente la traduzione clinica dei risultati della microscopia intravitale.
Abstract
L'imaging intravitale preclinico come la microscopia e la tomografia a coerenza ottica si sono dimostrati strumenti preziosi nella ricerca sul cancro per visualizzare il microambiente tumorale e la sua risposta alla terapia. Queste modalità di imaging hanno una risoluzione su scala micron, ma hanno un uso limitato in clinica a causa della loro ridotta profondità di penetrazione nei tessuti. Le modalità di imaging più clinicamente applicabili come TC, risonanza magnetica e PET hanno una profondità di penetrazione molto maggiore, ma hanno una risoluzione spaziale relativamente inferiore (scala mm).
Per tradurre i risultati dell'imaging intravitale preclinico nella clinica, è necessario sviluppare nuovi metodi per colmare questo divario di risoluzione da micro a macro . Qui descriviamo un modello murino di tumore con camera a finestra dorsale della plica cutanea progettato per consentire l'imaging preclinico intravitale e clinicamente applicabile (TC e RM) nello stesso animale e la piattaforma di analisi delle immagini che collega questi due diversi metodi di visualizzazione. È importante sottolineare che l'approccio della camera a finestra descritto consente di co-registrare le diverse modalità di imaging in 3D utilizzando marcatori fiduciali sulla camera a finestra per una concordanza spaziale diretta. Questo modello può essere utilizzato per la convalida dei metodi di imaging clinico esistenti, nonché per lo sviluppo di nuovi metodi attraverso la correlazione diretta con i risultati intravitali ad alta risoluzione "ground truth".
Infine, la risposta tumorale a vari trattamenti - chemioterapia, radioterapia, terapia fotodinamica - può essere monitorata longitudinalmente con questa metodologia utilizzando modalità di imaging precliniche e clinicamente applicabili. Il modello murino tumorale della camera della finestra della plica dorsale e le piattaforme di imaging qui descritte possono quindi essere utilizzati in una varietà di studi di ricerca sul cancro, ad esempio nella traduzione dei risultati della microscopia intravitale preclinica in modalità di imaging più clinicamente applicabili come la TC o la risonanza magnetica.
Introduzione
La microvascolarizzazione tumorale è una componente importante del microambiente tumorale che può essere un bersaglio per la terapia e un determinante della risposta al trattamento. In ambito preclinico, la microvascolarizzazione viene tipicamente studiata utilizzando la microscopia intravitale in modelli animali ortotopici o eterotopici con camera a finestra 1,2. Ciò ha diversi vantaggi rispetto agli studi istologici poiché l'imaging viene eseguito su tessuti vivi e il tumore può essere monitorato longitudinalmente per diverse settimane o addirittura mesi 2,3. Questi studi possono sfruttare le capacità di imaging ad alta risoluzione della microscopia intravitale per studiare la somministrazione di terapie al tumore 4,5, le cause della resistenza al trattamento6 e la risposta dei micro vasi a terapie come il trattamento antiangiogenico 7,8 e la radioterapia 2,9.
La microscopia intravitale svolge chiaramente un ruolo importante nella ricerca preclinica sul cancro; Tuttavia, come si possono misurare le caratteristiche microambientali del tumore in clinica? Le informazioni microvascolari sarebbero utili in clinica per misurare l'afflusso di sangue e l'ipossia delle cellule tumorali, che è importante per determinare la resistenza al trattamento in radioterapia10, nonché la capacità della microvascolarizzazione di fornire agenti chemioterapici alle cellule tumorali circostanti11. Ad esempio, in radioterapia, le informazioni spaziali sulla struttura e la funzione della microvascolarizzazione tumorale possono aiutare a personalizzare il piano di trattamento di un paziente regolando il programma di frazionamento o aumentando preferenzialmente la dose alle regioni avascolari e probabilmente ipossiche12.
La microscopia intravitale è in grado di misurare queste importanti caratteristiche microvascolari poiché ha una risoluzione molto elevata (scala di μm); Tuttavia, la sua penetrazione in profondità nel tessuto è limitata a diverse centinaia di micron o pochi millimetri, rendendo al massimo difficile l'implementazione clinica. In effetti, ci sono alcune nuove applicazioni della microscopia intravitale in clinica13; Tuttavia, questi sono ancora limitati agli esami di tessuti vicini alla superficie come la pelle14 o i rivestimenti mucosi/endoteliali di varie cavità corporee tramite cateteri/endoscopi flessibili15,16.
Più comunemente, la microvascolarizzazione viene studiata utilizzando modalità di imaging come la TC17 o la risonanza magnetica18. Queste modalità di imaging clinico possono visualizzare a qualsiasi profondità all'interno del corpo, ma hanno una risoluzione spaziale molto più bassa (scala in mm). Pertanto, è necessario colmare questo divario di risoluzione tra la microscopia intravitale preclinica e le modalità di imaging clinico per portare in clinica informazioni microvascolari dettagliate e ad alta risoluzione19. Sono stati sviluppati diversi metodi di imaging funzionale per migliorare le capacità di imaging microvascolare delle modalità di imaging clinico, come la risonanza magnetica con mezzo di contrasto dinamico (DCE) e la risonanza magnetica con movimento incoerente intravoxel (IVIM)21. Tuttavia, si tratta di metodi basati su modelli che forniscono misurazioni indirette della microvascolarizzazione e quindi devono essere convalidati con appropriate misurazioni "ground truth" della microvascolarizzazione 19,22.
Abbiamo sviluppato un modello murino di tumore con camera a finestra dorsale della plica cutanea (DSFC) per colmare questo divario tra la microscopia intravitale preclinica e le modalità di imaging clinicamente applicabili come la TC e la risonanza magnetica. Il DSFC fornisce l'accesso diretto al tumore per l'imaging di microscopia intravitale ad alta risoluzione attraverso una finestra di vetro, ma anche per l'imaging clinicamente applicabile come la risonanza magnetica, poiché è realizzato con materiali compatibili con la risonanza magnetica (plastica e vetro). Inoltre, un codice MATLAB incluso esegue la co-registrazione 3D multimodale per correlazioni spaziali dirette tra la microscopia intravitale preclinica e le modalità di imaging clinicamente applicabili. Qui descriveremo la progettazione e l'intervento chirurgico per installare il DSFC, nonché la procedura per la co-registrazione della microscopia intravitale e le modalità di imaging clinicamente applicabili.
Protocollo
Tutte le procedure sugli animali sono state eseguite in conformità con la Guida alla cura e all'uso degli animali da esperimento, stabilita dal Canadian Council on Animal Care. Gli esperimenti sono stati eseguiti secondo un protocollo approvato dall'University Health Network Institutional Animal Care and Use Committee di Toronto, in Canada.
1. Punto di riferimento per l'inoculazione del tumore
NOTA: "Landmarking" si riferisce al processo di marcatura della pelle del topo per indicare dove devono essere iniettate le cellule tumorali per ottimizzare il posizionamento del DSFC. Questa procedura di landmark deve essere eseguita lo stesso giorno o 1 giorno prima dell'inoculazione. Il NOD immunocompromesso. Per questo lavoro è stato utilizzato il topo femmina Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ (NRG).
- Anestetizzare il topo utilizzando isoflurano al 5% per l'induzione e isoflurano al 2% per il mantenimento (portata di ossigeno impostata a 0,5 L/min). Mantenere la temperatura corporea posizionando il mouse su un termoforo avvolto in un tappetino chirurgico autoclavato.
- Preparare il topo per l'inoculazione delle cellule tumorali mediante rasatura seguita dall'applicazione di una crema depilatoria medica. Rimuovere accuratamente la crema depilatoria dopo 30-60 s utilizzando un tovagliolo di carta sterilizzato bagnato. Applicare un lubrificante veterinario per gli occhi per prevenire la secchezza.
- Disinfettare la pelle con un tampone imbevuto di alcol.
- Raddrizza delicatamente il corpo del mouse e solleva la pelle lungo la colonna vertebrale del mouse. Usando un pennarello chirurgico, disegna un singolo punto su un lato del topo al centro della pelle a tenda. Il punto dovrebbe essere situato approssimativamente al centro della colonna vertebrale toracica del topo.
NOTA: Questa sarà la posizione desiderata del tumore.
2. Inoculazione del tumore
NOTA: In questo studio, stiamo utilizzando una linea cellulare di cancro al pancreas umano (BxPC3). Possono essere utilizzate anche altre linee cellulari; Tuttavia, le fasi specifiche della coltura cellulare possono variare tra le diverse linee cellulari. Fare riferimento alle istruzioni fornite con le celle per le modifiche alla procedura seguente.
- Far crescere le cellule a partire da 2 settimane prima dell'inoculazione utilizzando un terreno di coltura completo (terreno 1640 del Roswell Park Memorial Institute con il 10% di siero fetale bovino e l'1% di penicillina/streptomicina) in un pallone da 75 ml a 37 °C e 5% di CO2. Assicurarsi che le cellule siano mantenute nella fase di crescita esponenziale.
NOTA: Il numero di passaggi deve essere limitato a 10-15x e il pallone da 75 ml deve contenere circa 6 milioni di cellule (~70% di confluenza) al momento dell'inoculazione. - Aspirare il terreno e lavare le cellule con 5 mL di soluzione salina tamponata con fosfato (PBS) senza calcio o magnesio.
- Aggiungere 5 mL di agente di dissociazione cellulare e incubare a 37 °C e 5% di CO2 per 6-7 minuti. Confermare che le cellule si sono staccate utilizzando un microscopio e aggiungere 5 ml di terreno di coltura completo.
NOTA: Picchiettare delicatamente il lato del pallone può aiutare a staccare le cellule. - Trasferire la sospensione in una provetta da centrifuga da 15 ml e centrifugare a 500 × g per 5 minuti per pellettare le cellule. Aspirare il terreno e risospendere le cellule in 5 mL di terreno di crescita completo.
- Determinare la concentrazione cellulare e la conta totale delle cellule utilizzando un emocitometro.
- Centrifugare a 500 × g per 5 minuti per pellettare le celle e aspirare il terreno.
- Sulla base della conta cellulare totale ottenuta dal passaggio 2.5, aggiungere la quantità appropriata di terreno di coltura completo per raggiungere una concentrazione di
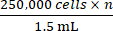 dove n è il numero totale di topi da inoculare. Risospendere le cellule.
dove n è il numero totale di topi da inoculare. Risospendere le cellule.
NOTA: Il numero target di cellule da inoculare per topo è 250.000. - Trasferire 1,5 mL contenenti 250.000 cellule × n in una provetta da microcentrifuga da 1,5 mL. Centrifugare la provetta da microcentrifuga da 1,5 ml a 500 × g per 5 minuti e aspirare il terreno.
NOTA: L'eventuale sospensione cellulare in eccesso può essere conservata in un bagno di acqua calda riscaldata a 37 °C per essere utilizzata per ulteriori inoculazioni, se necessario. - Risospendere le cellule in 10 μl × n di PBS. Posizionare le celle sul ghiaccio per raffreddare la sospensione.
NOTA: Una volta che le cellule sono state raffreddate con ghiaccio, devono essere iniettate nel topo entro 20 minuti. - Aggiungere 10 μl × n di membrana basale solubilizzata utilizzando puntali per pipette refrigerati. Caricare aghi da insulina refrigerati calibro 29 con 20 μl di ciascuna delle sospensioni cellulari. Tenere le siringhe sul ghiaccio.
- Anestetizzare il topo utilizzando isoflurano al 5% per l'induzione e isoflurano al 2% per il mantenimento (portata di ossigeno impostata a 0,5 L/min).
- Posiziona il mouse su un termoforo avvolto in un tappetino chirurgico sterilizzato.
- Disinfettare la pelle nel sito di iniezione con un tampone imbevuto di alcol.
- Inserire l'ago ~1 cm prima del punto di riferimento e spostare l'ago sotto la pelle fino a raggiungere il punto di riferimento. Posizionare il lato smussato dell'ago verso l'alto e iniettare i 20 μL di sospensione cellulare.
- Attendere 45 s per consentire alla membrana basale solubilizzata di solidificarsi prima di rimuovere la siringa.
- Togliete il topo dall'anestesia, aspettate che il topo diventi deambulante e rimettetelo nella sua gabbia con gli altri topi.
- Monitorare il tumore quotidianamente mediante palpazione e lasciare che il tumore cresca per 4 settimane o fino a quando il tumore non ha un diametro di 4-8 mm. Sopprimere il topo se è soddisfatta una delle seguenti condizioni: dimensioni del tumore superiori a 1,5 cm, tumore ulcerato o qualsiasi segno di malattia sistemica (letargico, perdita di peso superiore al 20% del peso corporeo normale, deambulazione compromessa, incapacità di regolare la temperatura corporea, anoressia, postura curva, segni visibili di dolore (espressioni facciali, ecc.) o disidratazione).
3. Chirurgia della camera finestra
NOTA: Il DSFC è costituito da quattro parti stampate in 3D, come mostrato nella Figura 1. Gli schemi di ogni parte sono inclusi nel file supplementare 1. Tutte le parti sono stampate con una resina plastica trasparente biocompatibile. Il gruppo della camera della finestra principale è costituito da tre parti (Figura 1A-C) con un anello di riferimento fiduciale aggiuntivo (Figura 1D) che può essere apposto durante la risonanza magnetica o la TC.
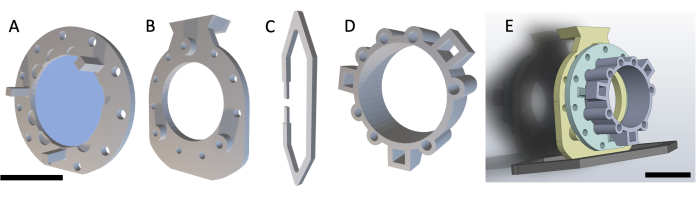
Figura 1: Schema della camera della finestra della plica dorsale. La camera della finestra principale contiene tre parti. Innanzitutto, (A) il telaio anteriore è suturato sotto la pelle del mouse e contiene un vetrino coprioggetti in vetro fissato con colla polimerizzata UV. (B) Il telaio posteriore è suturato al telaio anteriore all'esterno della pelle. (C) La clip di supporto si fissa alla parte inferiore del telaio posteriore e mantiene il DSFC in posizione verticale sul corpo del mouse. (D) L'anello fiduciale contiene sette "pozzetti" in cui possono essere inseriti i fiducial marker. L'anello di riferimento fiduciale può essere fissato al telaio anteriore del DSFC utilizzando i tre montanti di supporto. (E) Viene mostrato il gruppo DSFC completo con un anello di marcatura fiduciale. Barre della scala = 1 cm (A-D, in basso a sinistra; E). Abbreviazione: DSFC = camera della finestra della plica cutanea dorsale. Clicca qui per visualizzare una versione più grande di questa figura.
- Somministrare 1 mg/kg di 0,6 mg/mL di buprenorfina a rilascio prolungato per via sottocutanea 1-3 ore prima dell'intervento chirurgico. Assicurarsi che il mouse abbia dimensioni e peso corporei sufficienti per tollerare il DSFC senza costrizione toracica.
- Sterilizzare le parti della camera della finestra principale (Figura 1A-C) in un disinfettante liquido di alto livello per 12 minuti, quindi immergerle in alcol isopropilico per almeno 5 minuti.
- Anestetizzare il topo utilizzando isoflurano al 5% per l'induzione e isoflurano al 2% per il mantenimento (portata di ossigeno impostata a 0,5 L/min).
- Trasferisci il mouse su un tappetino chirurgico sterile con un termoforo sottostante.
- Radere il topo e applicare una crema depilatoria medica se sono presenti peli. Dopo 30-60 s, rimuovere la crema depilatoria utilizzando salviette di carta bagnate sterili.
- Applicare un lubrificante veterinario per gli occhi per prevenire la secchezza. Riapplicare ogni 30 minuti o secondo necessità durante l'intervento.
- Disinfettare la pelle applicando uno scrub allo iodio povidone al 7,5% e risciacquando con alcol isopropilico al 70%. Lasciare asciugare la pelle all'aria.
- Applicare la soluzione di iodio povidone al 10% sulla pelle e lasciarla asciugare all'aria (Figura 2A).
- Sostituire il tappetino chirurgico con un nuovo tappetino sterilizzato.
- Assicurarsi che il topo abbia raggiunto il piano chirurgico dell'anestesia utilizzando un pizzico per le dita dei piedi.
- Solleva la pelle del topo lungo la colonna vertebrale e cerca il tumore che cresce su una delle due pieghe cutanee laterali. Posizionare il telaio posteriore del DSFC (Figura 2B) sullo stesso lato della pelle su cui sta crescendo il tumore, assicurandosi di centrare il tumore nel telaio.
- Aggiungere tre punti di sutura a ciascuno dei tre fori superiori del DSFC e della guida chirurgica per fissare la posizione del telaio posteriore (Figura 2B).
- Inserire tre aghi attraverso il telaio posteriore del DSFC nei fori contenenti i distanziatori (Figura 2B).
NOTA: Ci sono tre "distanziatori" sul telaio posteriore del DSFC per mantenere uno spazio tra i telai anteriore e posteriore per garantire che il flusso sanguigno non sia limitato al tessuto all'interno del DSFC. I distanziatori sono visibili nella Figura 1B. - Utilizzando un pennarello chirurgico, segnare i sei punti in cui si troveranno i distanziatori del telaio posteriore DSFC su entrambi i lati della pelle (punti 1-6 nella Figura 2C, D).
NOTA: Gli aghi inseriti devono essere utilizzati come guida per la posizione precisa di questi punti. - Disegna un cerchio di 1 cm di diametro per indicare la pelle che verrà rimossa sul lato opposto al telaio posteriore (Figura 2D).
- Rimuovere gli aghi e il telaio posteriore dalla pelle tagliando i punti di sutura.
- Tagliare il foro di 1 cm di diametro nella pelle che è stato segnato al passaggio 3.15 utilizzando micro forbici chirurgiche (Figura 2E).
- Posizionare la sutura temporanea per fissare tutte le parti della camera della finestra alla pelle. Inserire una sutura attraverso il punto 4, attraverso il foro superiore del telaio anteriore del DSFC e quindi attraverso il punto 1 sul lato opposto del mouse (Figura 2F e passaggi 1-2 nella Figura S1 supplementare).
- Infilare la sutura attraverso il perno di supporto superiore del telaio posteriore e quindi di nuovo attraverso il perno di supporto sul telaio posteriore più vicino alla testa del topo (Figura 2F).
- Inserire la sutura attraverso il punto 2. Quindi, infilare la sutura attraverso il foro corrispondente nel telaio anteriore (Figura 2G e passaggio 3 nella Figura supplementare S1).
- Dall'interno della pelle, infilare la sutura attraverso il punto 6 come indicato nella Figura 2H e i passaggi 3-4 nella Figura S1 supplementare.
- Infilare la sutura attraverso il punto 5 come indicato nella Figura 2I e il passaggio 4 nella Figura supplementare S1.
- Far passare la sutura attraverso il telaio anteriore, punto 3, e poi attraverso il telaio posteriore come indicato nella Figura 2J e nel passaggio 5 nella Figura S1 supplementare.
- Riportare la sutura indietro attraverso il punto 1, il telaio anteriore del DSFC, e poi fuori attraverso il punto 4 come indicato nella Figura 2K e nel passaggio 6 nella Figura S1 supplementare.
- Stringere l'intero gruppo con questa sutura e infilare il telaio anteriore sotto la pelle attraverso il foro che è stato creato nel passaggio 3.17 (Figura 2L, M).
- Lega insieme le due estremità di questa sutura e taglia lo spago in eccesso.
- Eseguire suture permanenti attraverso i fori attorno al perimetro dei telai anteriore e posteriore del DSFC. Sutura i due telai insieme nello schema mostrato nella Figura 2N e nella Figura S2 supplementare.
- Tagliare e rimuovere la sutura temporanea.
- Fissare la clip di supporto al telaio posteriore del DSFC facendola scorrere nella sporgenza dal telaio posteriore (Figura 2O).
NOTA: Un'immagine del topo 2 settimane dopo l'intervento è mostrata nella Figura 2P, Q. La clip di supporto viene utilizzata per mantenere il DSFC in posizione verticale sul mouse per ridurre la tensione e il disagio della pelle. - Somministrare 5 mg/kg di peso corporeo Meloxicam, un farmaco antinfiammatorio non steroideo, per via sottocutanea per ridurre il dolore e l'infiammazione.
- Togliete il topo dall'anestesia, aspettate che il topo diventi deambulante e rimettetelo nella sua gabbia.
- Controllare il topo 2-3 ore dopo l'intervento chirurgico e poi ogni giorno per almeno 1 settimana. Considerare l'endpoint raggiunto 2 mesi dopo l'intervento chirurgico in camera finestra o se una qualsiasi delle condizioni del passaggio 2.17 è soddisfatta (a seconda di quale evento si verifichi per primo).
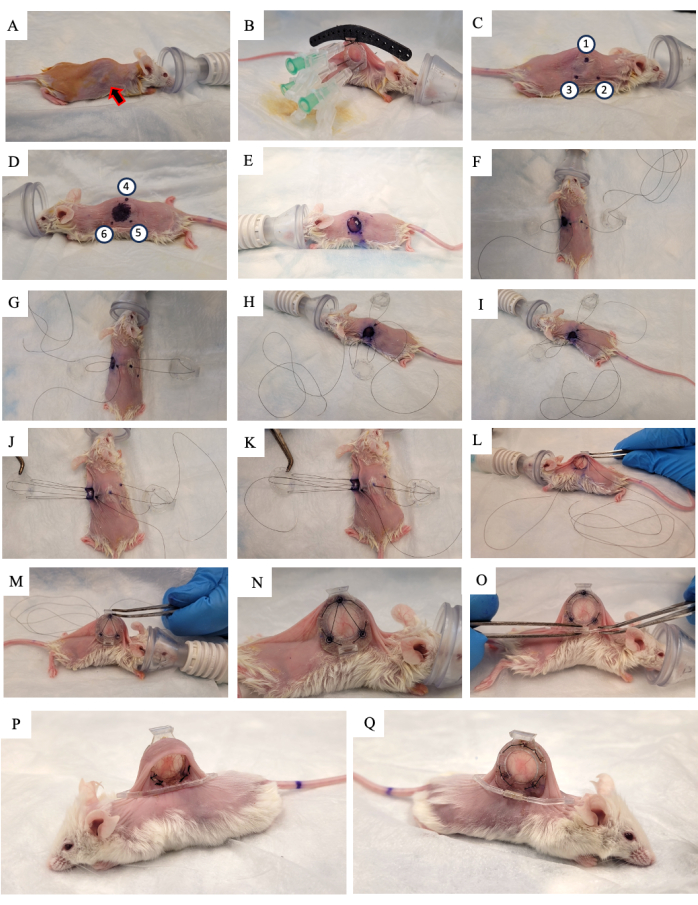
Figura 2: Procedura chirurgica DSFC. (A) Il topo viene preparato per l'intervento chirurgico rimuovendo i peli e disinfettando la pelle. Il tumore sottocutaneo è indicato dalla freccia. (B) Il telaio posteriore è posizionato nella posizione appropriata e fissato da tre siringhe e da suture temporanee fissate alla guida chirurgica nera. (C, D) Le posizioni dei distanziatori (punti 1-6) e il foro sono contrassegnati su entrambi i lati della pelle. (E) La pelle viene rimossa. (F-K) Una sutura temporanea viene infilata attraverso i due strati di pelle, i telai anteriore e posteriore del DSFC per fissare insieme tutte le parti. (L,M) La sutura temporanea viene serrata e il telaio anteriore viene inserito sotto la pelle. (N) Vengono posizionate otto suture permanenti per fissare il DSFC. (O) Infine, la sutura temporanea viene rimossa e la clip di supporto viene fissata. (P,Q) Lo stesso topo viene mostrato 2 settimane dopo l'intervento chirurgico da entrambi i lati. Abbreviazione: DSFC = camera della finestra dorsale della plica cutanea. Clicca qui per visualizzare una versione più grande di questa figura.
4. Imaging ottico
- Lasciare che il topo guarisca e che l'infiammazione diminuisca per almeno 5 giorni dopo l'intervento chirurgico prima dell'imaging.
- Anestetizzare il topo utilizzando isoflurano al 5% per l'induzione e isoflurano al 2% per il mantenimento (portata di ossigeno impostata a 0,5 L/min).
- Applicare un lubrificante veterinario per gli occhi per prevenire la secchezza. Riapplicare ogni 30 minuti o secondo necessità.
- Fissare il mouse in una fase di imaging con un attacco per anestesia gassosa come mostrato nella Figura S3 supplementare.
- Ottieni un'immagine al microscopio a campo chiaro con un ampio campo visivo (>1,5 cm di larghezza). Assicurarsi che le fessure del fiducial marker sul telaio anteriore del DSFC siano visibili.
NOTA: Ci sono sette fessure attorno al perimetro del vetro sul telaio anteriore che si allineano con i sette pozzetti del marcatore fiduciale sull'attacco dell'anello del marcatore fiduciale. Questi avvallamenti sono visibili nella Figura 1A. - Lo stesso giorno, ottenere un'immagine microvascolare utilizzando la modalità di microscopia intravitale di scelta. A tale scopo, utilizzare lo stesso stadio di imaging del passaggio 4.4 (Figura supplementare S3). Togliete il topo dall'anestesia, aspettate che il topo diventi deambulante e rimettetelo nella sua gabbia.
NOTA: Utilizziamo la tomografia a coerenza ottica speckle variance (svOCT) per immagini microvascolari 3D ad alta risoluzione.
5. Risonanza magnetica
- Posiziona la gabbia del mouse sotto una lampada riscaldante per riscaldare i topi per circa 15 minuti prima di anestetizzare il topo.
NOTA: Il riscaldamento favorisce la vasodilatazione, che aiuterà nel posizionamento del catetere della vena caudale. - Anestetizzare il topo utilizzando isoflurano al 5% per l'induzione e isoflurano al 2% per il mantenimento (portata di ossigeno impostata a 0,5 L/min).
- Registrare il peso del mouse utilizzando una bilancia elettronica per il corretto dosaggio del farmaco.
NOTA: Per misurazioni accurate del peso corporeo, assicurarsi di sottrarre il peso del gruppo DSFC (0.83 g). - Posiziona il mouse sul lettino per la risonanza magnetica e applica un lubrificante veterinario per gli occhi per prevenire la secchezza.
- Mantenere la temperatura corporea del mouse utilizzando uno scaldabagno e un sistema di pompaggio.
- Posizionare un cuscino per il monitoraggio respiratorio sotto il diaframma del mouse e mantenerlo a 30 ± 5 respiri/min.
- Se si utilizza un mezzo di contrasto, inserire un ago a farfalla da 27 G nella vena caudale con microtubo attaccato (30 μL di volume morto preriempito con soluzione salina di erapina all'1%). Fissare l'ago e il microtubo al letto della risonanza magnetica con del nastro chirurgico.
- Fissare la camera della finestra in un "dispositivo di immobilizzazione" stampato in 3D come mostrato nella Figura 3.
- Utilizzando un ago da 18 G, iniettare il lubrificante veterinario per gli occhi nei sette tubi del fiducial marker MRI.
- Fissare il fiducial marker al DSFC allineando i tre connettori quadrati ai tre montanti che sporgono dal telaio anteriore (Figura 3).
- Collegare il catetere della vena caudale alla linea di erogazione del farmaco e alla siringa nella pompa automatica. Inserire il letto in uno scanner MRI preclinico da 7 tesla.
- Acquisizione di set di immagini coronali e assiali pesate in T2 (T2w) per visualizzare il piano della camera della finestra (tempo di eco TE = 25 ms; tempo di ripetizione TR = 2.500 ms; campo visivo di 40 x 40 mm con una matrice 64 x 64 per una risoluzione in piano di 0,5 x 0,5 mm; spessore della fetta di 0,5 mm; 25 s). Prescrivere un set sagittale pesato in T2 (TE = 25 ms; TR = 2.500 ms; campo visivo di 32 x 32 mm con matrice 128 x 128 per una risoluzione in piano di 0,25 x 0,25 mm; almeno 11 fette di imaging; 0,5 mm di spessore della fetta; 87 s), che viene poi ruotata nel piano del DSFC e dei marcatori fiduciali, in base alle viste coronali e assiali, come mostrato nella Figura 4. Riorientare e posizionare iterativamente il set sagittale fino a quando le fette di imaging non sono completamente allineate in modo che la fetta 5 contenga completamente il segnale tissutale nel DSFC e la fetta 6 non contenga alcun segnale tissutale nel DSFC.
- Eseguire l'imaging microvascolare utilizzando il metodo di risonanza magnetica microvascolare di scelta.
NOTA: Per le acquisizioni RM microvascolari, non è necessario eseguire l'imaging delle fette del marcatore fiduciale poiché le immagini vengono acquisite nello stesso quadro di riferimento dell'imaging delle immagini di registrazione T2w.- Acquisisci tutte le acquisizioni descritte nei passaggi 5.12 e 5.13 su un campo visivo di 32 x 32 mm con una matrice di 64 x 64 per una risoluzione in piano di 0,5 x 0,5 mm. Per tutte le acquisizioni MRI, utilizzare impulsi RF coerenti per migliorare la coerenza geometrica attraverso il piano (eccitazione sinc, rifocalizzazione sinc3, larghezza di banda di 2.484 Hz).
- Per l'imaging DCE:
- Se si desidera misurare la concentrazione di gadolinio, ottenere mappe T1 utilizzando immagini 2D-RARE acquisite a tempi di ripetizione variabili (TE = 7 ms; fattore RARE = 2; TR = 350, 500, 750, 1.000, 1.500, 2.500 e 4.000 ms; 8 min 28 s).
- Esecuzione di imaging di serie temporali utilizzando immagini RARE 2D (TE = 8,1 ms; fattore RARE = 2; TR = 200 ms; angolo di ribaltamento = 90°; risoluzione temporale = 12,8 s; 188 ripetizioni; tempo totale di monitoraggio = 40 min 6 s).
- Iniettare 0,75 mmol/kg di peso corporeo di Gadobutrolo per 10 s attraverso la vena caudale dopo aver completato cinque ripetizioni di immagini utilizzando una pompa a siringa automatizzata compatibile con la risonanza magnetica.
- Per la risonanza magnetica IVIM:
- Eseguire l'imaging pesato in diffusione con i seguenti valori B: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1.000 s/mm2 con tre medie di B = 0 s/mm2 e campionamento isotropo (TE = 16 ms; TR = 800 ms; durata del gradiente = 2,2 ms; separazione del gradiente = 9 ms; 61 min).
NOTA: L'imaging pesato in diffusione viene acquisito utilizzando una lettura della trasformata di Fourier 2D, piuttosto che con l'imaging ecoplanare soggetto a distorsione, per garantire la coerenza geometrica del tumore e dei segnali tissutali circostanti all'interno del DSFC attraverso i set di immagini e con le immagini di microscopia intravitale.
- Eseguire l'imaging pesato in diffusione con i seguenti valori B: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1.000 s/mm2 con tre medie di B = 0 s/mm2 e campionamento isotropo (TE = 16 ms; TR = 800 ms; durata del gradiente = 2,2 ms; separazione del gradiente = 9 ms; 61 min).
- Togliete il topo dall'anestesia, aspettate che il topo diventi deambulante e rimettetelo nella sua gabbia.
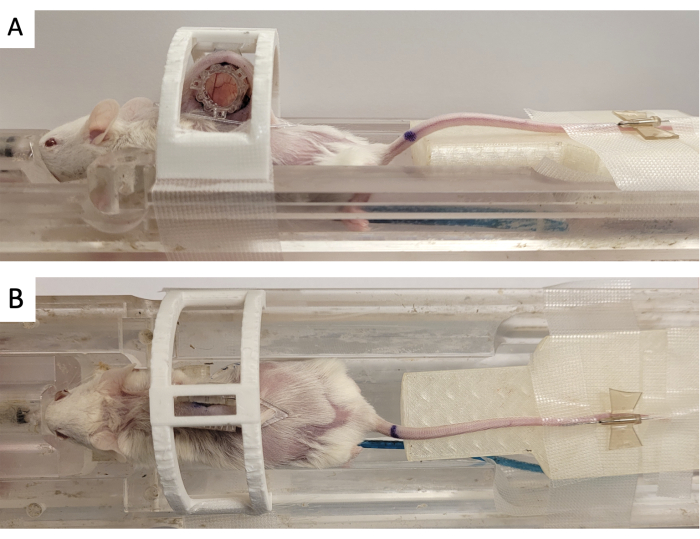
Figura 3: Configurazione dell'imaging RM DSFC. (A) Viste laterali e (B) dall'alto del mouse posizionato sul letto MRI con DSFC fissato e immobilizzato. Il topo è dotato di un catetere della vena caudale per l'iniezione di mezzo di contrasto e l'anello fiducial maker è fissato al telaio anteriore del DSFC. Abbreviazioni: DSFC = camera della finestra dorsale della plica cutanea; RM = risonanza magnetica. Clicca qui per visualizzare una versione più grande di questa figura.
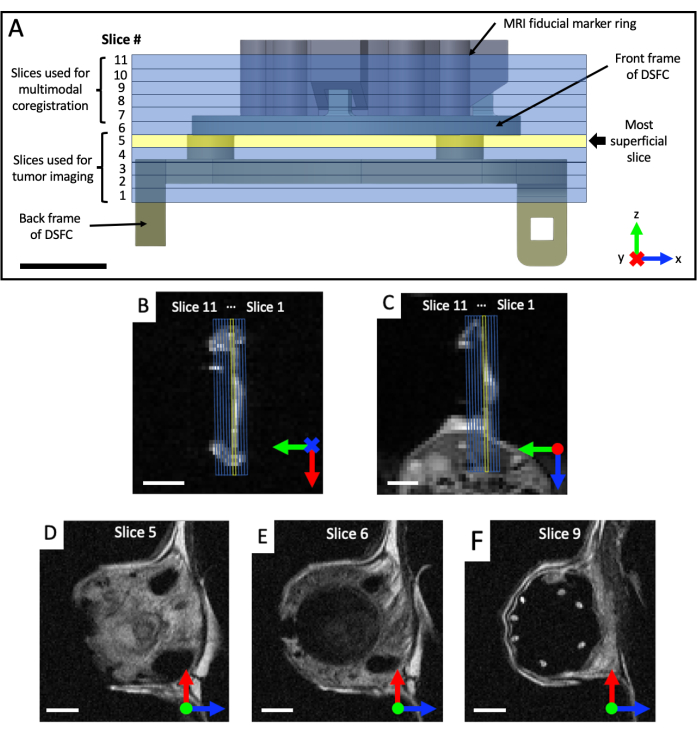
Figura 4: Posizioni delle fette di risonanza magnetica rispetto ai marcatori fiduciali e alla camera della finestra. (A) Un diagramma del DSFC con l'attacco dell'anello del marcatore fiduciale con le 11 sezioni di risonanza magnetica sovrapposte. È necessario acquisire diverse immagini pesate in T2 per garantire che le fette siano correttamente allineate con il DSFC e il tessuto. (B,C) Posizionamento corretto delle 11 fette rispetto al tessuto nel DSFC da diversi orientamenti. (D) La fetta 5 è la fetta più superficiale in cui verrà eseguita l'analisi della correlazione intermodale. (E) La fetta 6 non contiene alcun segnale tissutale che indichi che è correttamente allineata con il DSFC. (F) Infine, i 7 marcatori fiduciali sono chiaramente visibili nella fetta 9. Barre della scala = 5 mm. Una "X" sull'asse indica che l'asse sta entrando nella pagina e un cerchio indica che l'asse sta uscendo dalla pagina. Abbreviazioni: DSFC = camera della finestra dorsale della plica cutanea; MRI = risonanza magnetica. Clicca qui per visualizzare una versione più grande di questa figura.
6. Co-registrazione da risonanza magnetica a microscopia intravitale
- In MATLAB, aprire il file Multimodal_Image_Register.m contenuto nel File supplementare 2.
- Nell'area di lavoro, caricare l'immagine microvascolare (Figura 5A), l'immagine di microscopia in campo chiaro (Figura 5B) e i dati di risonanza magnetica microvascolare (mappe dei parametri di risonanza magnetica IVIM e/o DCE).
- Fare clic sul pulsante Esegui .
- Utilizzando il cercatore di file pop-up, vai al file contenente le sezioni di risonanza magnetica T2w.
- Selezionare fino a quattro sezioni di risonanza magnetica T2w che mostrino chiaramente i marcatori fiduciali (Figura 5C).
- Verrà visualizzata un'interfaccia utente che mostra l'immagine al microscopio (Figura 5B) e le sezioni di risonanza magnetica T2w con media della profondità (Figura 5C). Posizionare un punto su ciascuno dei sette marcatori fiduciali nell'immagine MRI e abbinarli al punto corrispondente sull'immagine al microscopio (punti di riferimento fiduciali attorno al perimetro del vetro sul telaio anteriore del DSFC) come indicato dai punti verdi nella Figura 5B, C.
- Chiudi la finestra.
- Apparirà una figura contenente le immagini MRI e microscopiche sovrapposte per aiutare a valutare la qualità della registrazione tra i due set di dati. Se la registrazione è adeguata, continuare il codice digitando y, quindi premendo invio nella finestra di comando. In caso contrario, riprovare questo passaggio digitando n nella finestra di comando e premendo invio.
NOTA: La co-registrazione riuscita del set di dati MRI con l'immagine microscopica significa che i sette marcatori fiduciali luminosi del set di dati MRI sono centrati e completamente contenuti all'interno dei loro divot corrispondenti sul frame frontale del DSFC. - Verrà visualizzata un'interfaccia utente che mostra l'immagine al microscopio (Figura 5B) e il set di dati di imaging microvascolare svOCT (Figura 5A). Selezionare almeno tre punti di riferimento microvascolari sull'immagine microvascolare svOCT e i punti corrispondenti nell'immagine microscopica come indicato dai punti blu nella Figura 5A, B.
- Chiudi la finestra.
- Apparirà una figura contenente le immagini svOCT e di microscopia sovrapposte per aiutare a valutare la qualità della co-registrazione tra i due set di dati. Se la registrazione è adeguata, continuare il codice digitando y, quindi premendo invio nella finestra di comando. In caso contrario, riprovare questo passaggio digitando n nella finestra di comando e premendo invio.
NOTA: La riuscita co-registrazione del set di dati svOCT con l'immagine al microscopio significa che i vasi di entrambi i set di dati sono perfettamente sovrapposti l'uno all'altro. - Chiudi la finestra.
- Apparirà quindi l'immagine in microcopia co-registrata. Contorna il tumore in questa immagine.
- Chiudi la finestra.
- Verranno quindi visualizzate diverse figure: il set di dati microvascolari svOCT (Figura 5D), l'immagine al microscopio co-registrata (Figura 5E) e le mappe dei parametri MRI co-registrate (Figura 5F). Salvare le mappe per un'analisi successiva.
NOTA: Le mappe MRI visualizzate sono limitate al contorno del tumore disegnato dall'utente (Figura 5F).
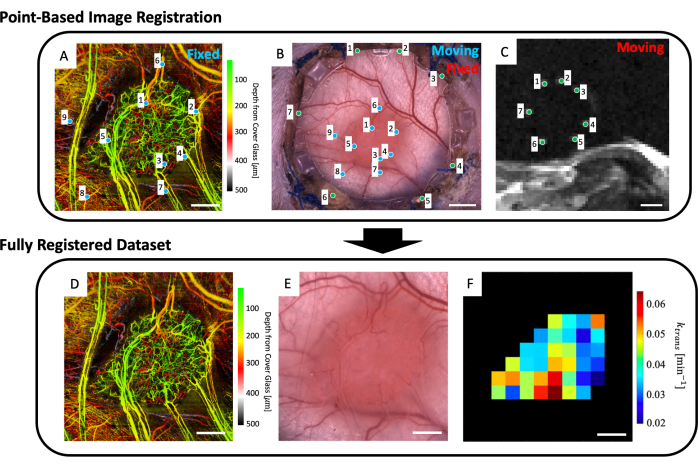
Figura 5: Co-registrazione multimodale basata su punti. (A) Set di dati svOCT microvascolari codificati in profondità di colore; barra graduata = 1 mm. (B) Immagine al microscopio in campo chiaro della camera della finestra; barra della scala = 2 mm. (C) Media delle sezioni di risonanza magnetica T2w 8-11 che mostrano i sette marcatori fiduciali contenuti nell'anello del marcatore fiduciale; barra della scala = 5 mm. (C) In primo luogo, il set di dati MRI T2w "in movimento" viene co-registrato sull'immagine di microscopia a campo chiaro "fissa" utilizzando i marcatori verdi inseriti dall'utente su entrambi i set di immagini. Successivamente, l'immagine di microscopia in campo chiaro "in movimento" e l'immagine MRI co-registrata vengono co-registrate nel "set di dati svOCT fisso" utilizzando i marcatori blu in A e B. Il set di dati finale co-registrato include lo svOCT (D), l'immagine di microscopia in campo chiaro (E) e la mappa dei parametri MRI funzionale (F). I voxel neri in F sono al di fuori del tumore e quindi non sono considerati nell'analisi. Per D-F, barra graduata = 1 mm. Abbreviazioni: svOCT = tomografia a coerenza ottica con varianza speckle; MRI = risonanza magnetica. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
La tomografia a coerenza ottica con varianza speckle (svOCT) è stata eseguita per ottenere immagini microvascolari 3D ad ampio campo visivo (FOV) (6 x 6 mm,2 laterali x 1 mm di profondità). Per ottenere queste immagini, è stato utilizzato un sistema OCT a sorgente spazzata precedentemente descritto basato su un interferometro in quadratura23. Le immagini OCT sono state acquisite unendo due scansioni 3 x 6 mm2 FOV adiacenti lateralmente. Ogni B-scan consisteva in 400 A-scan...
Discussione
In questo lavoro, abbiamo sviluppato un flusso di lavoro per eseguire sia la microscopia intravitale che l'imaging clinicamente applicabile (TC, MRI e PET) nello stesso animale. Ciò è stato fatto con l'obiettivo di tradurre i risultati della microscopia preclinica alla clinica mediante la correlazione diretta della microscopia intravitale con le modalità di imaging clinico come la risonanza magnetica. Sebbene i design DSFC convenzionali siano realizzati in metallo 2,3
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Ringraziamo la Dott.ssa Carla Calçada (Postdoctoral Fellow, Princess Margaret Cancer Centre) e il Dr. Timothy Samuel (Ph.D. Student, Princess Margaret Cancer Centre) per l'aiuto nella coltura delle cellule tumorali e nello sviluppo del protocollo di inoculazione. La dottoressa Kathleen Ma, la dottoressa Anna Pietraszek e la dottoressa Alyssa Goldstein (Animal Research Centre, Princess Margaret Cancer Centre) hanno contribuito allo sviluppo del protocollo chirurgico. Jacob Broske (tecnologo di ingegneria medica, Princess Margaret Cancer Center) e Wayne Keller (Hardware Client Executive, Javelin Technologies - A TriMech Group Company) hanno stampato in 3D le camere delle finestre. James Jonkman (Advanced Optical Microscopy Facility, University Health Network) ha fornito una guida preziosa per l'acquisizione di immagini al microscopio in campo chiaro e a fluorescenza.
Materiali
| Name | Company | Catalog Number | Comments |
| Cell Culture Materials | |||
| BxPC-3 Human Pancreatic Cancer Cells | ATCC (American Type Culture Collection) | CRL-1687 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354234 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 07-202-350 | |
| Dulbecco Phospphate buffered saline without Calcium, Magnesium, or phenol red, 500 mL | Gibco | 14190144 | |
| Fetal Bovine Serum (Canada), 500 mL | Sigma-Aldrich | F1051-500ML | |
| Penicillin-Streptomycin 100x (liquid,stabilized, sterile-filtered, cell culture tested) | Sigma-Aldrich | P4333-100ML | |
| RPMI Medium 1640 (1x), liquid; with L-Glutamine, 500 mL | Gibco | 11875093 | |
| TrypLE Express Enzyme, 500 mL | Gibco | 12605028 | |
| Window Chamber Materials | |||
| 12 mm Glass Coverslip | Harvard Apparatus | CS-12R No. 1.5 | |
| Connex 500 3D Printer | Stratasys | N/A | |
| Biocompatible clear MED610 resin | Stratasys | RGD810 | |
| Loctite AA 3105 UV curable glue | Loctite | LCT1214249 | |
| Window chamber back frame | Trimech Inc | N/A | |
| Window chamber fiducial marker | Trimech Inc | N/A | |
| Window Chamber front frame | Trimech Inc | N/A | |
| Window chamber support clip | Trimech Inc | N/A | |
| inoculation and Surgery Materials | |||
| BD SafetyGlide Insulin Syringes with Permanently Attached Needles, 0.5 mL, 29 G x 1/2" | BD | CABD305932 | |
| Betadine Solution | Betadine | AP-B002C2R98U | |
| Cidex OPA 14 Day Solution 3.8 L | ASP | JOH20394 | |
| Disposable Surgical Underpads 23 inch x 24 inch | Kendall | 7134 | |
| Eye lubricant | Optixcare | 50-218-8442 | |
| Hair removal cream | Nair | 061700222611 | |
| Halstead Hemostatic Forceps | Almedic | 7742-A12-150 | |
| Heating pad | Sunbeam | B086MCN59R | |
| Iris Scissors | Almedic | 7601-A8-690 | |
| Isoflurane | Sigma | 792632 | |
| Metacam | Boehringer Ingelheim Animal Health USA Inc | NDC 0010-6015-03 | |
| NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ mouse | the Jackson laboratory | 7799 | |
| Peanut Clipper & Trimmer | Wahl | 8655-200 | |
| SOFSILK Nonabsorbable Surgical Suture #5-0 with 3/8" Taper point needle (17 mm) (Wax Coated,Braided Black Silk, Sterile) | Syneture | VS880 | |
| Splinter Forceps | Almedic | 7725-A10-634 | |
| MR Imaging | |||
| 3D printed window chamber immobilization device. | custom 3D printed, refer to figure 3 for details. | ||
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Gadovist 1.0 | Bayer | 2241089 | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals. |
| Tail vein catheter (27 G 0.5" ) | Terumo Medical Corp | 15253 | |
| Optical Imaging | |||
| 3D printed imaging stage | Custom 3D printed, refer to supplementary figure 3 for details. | ||
| 12 V 7 W Flexible Polyimide Heater Plate Thin Adhesive PI Heating Film 25 mm x 50 mm | BANRIA | B09X16XCVS | Heating element used for mouse body temeprature regulation. |
| DC power supply | BK Precission | 1761 | Used to power the heating element. |
| Leica MZ FLIII | Leica Microsystems | 15209 | |
| svOCT imaging system | In-house made imaging system. Details can be found in reference 23. | ||
| Software | |||
| MATLAB Software | MathWorks | R2020A |
Riferimenti
- Fukumura, D., Duda, D. G., Munn, L. L., Jain, R. K. Tumor microvasculature and microenvironment: Novel insights through intravital imaging in pre-clinical models. Microcirculation. 17 (3), 206-225 (2010).
- Demidov, V., et al. Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography. Sci Rep. 8 (1), 38 (2018).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging. IntraVital. 3 (2), e29917 (2014).
- Dreher, M. R., et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst. 98 (5), 335-344 (2006).
- Momiyama, M., et al. Subcellular real-time imaging of the efficacy of temozolomide on cancer cells in the brain of live mice. Anticancer Res. 33 (1), 103-106 (2013).
- Dadgar, S., Rajaram, N. Optical imaging approaches to investigating radiation resistance. Front Oncol. 9, 1152 (2019).
- Fukumura, D., Jain, R. K. Tumor microvasculature and microenvironment: Targets for anti-angiogenesis and normalization. Microvasc Res. 74 (2-3), 72-84 (2007).
- Dirkx, A. E. M., et al. Anti-angiogenesis therapy can overcome endothelial cell anergy and promote leukocyte-endothelium interactions and infiltration in tumors. FASEB J. 20 (6), 621-630 (2006).
- Allam, N., et al. Longitudinal in-vivo quantification of tumour microvascular heterogeneity by optical coherence angiography in pre-clinical radiation therapy. Sci Rep. 12, 6140 (2022).
- Stadlbauer, A., et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans. Clin Cancer Res. 27 (6), 1641-1649 (2021).
- Danquah, M. K., Zhang, X. A., Mahato, R. I. Extravasation of polymeric nanomedicines across tumor vasculature. Adv Drug Deliv Rev. 63 (8), 623-639 (2011).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin Radiat Oncol. 21 (2), 101-110 (2011).
- Gabriel, E. M., Fisher, D. T., Evans, S., Takabe, K., Skitzki, J. J. Intravital microscopy in the study of the tumor microenvironment: from bench to human application. Oncotarget. 9 (28), 20165-20178 (2018).
- Demidov, V., et al. Preclinical quantitative in-vivo assessment of skin tissue vascularity in radiation-induced fibrosis with optical coherence tomography. J Biomed Opt. 23 (10), 1-9 (2018).
- Wallace, M. B., et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharmacol Ther. 31 (5), 548-552 (2010).
- Standish, B. A., et al. In vivo endoscopic multi-beam optical coherence tomography. Phys Med Biol. 55 (3), 615-622 (2010).
- Wang, J. H., et al. Dynamic CT evaluation of tumor vascularity in renal cell carcinoma. AJR Am J Roentgenol. 186 (5), 1423-1430 (2006).
- Tropres, I., et al. Imaging the microvessel caliber and density: Principles and applications of microvascular MRI. Magn Reson Med. 73 (1), 325-341 (2014).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9, 713-725 (2003).
- O'Connor, J. P. B., et al. Dynamic contrast-enhanced imaging techniques: CT and MRI. Brit J Radiol. 84, S112-S120 (2011).
- Lima, M., Le Bihan, D. Clinical intravoxel incoherent motion and diffusion MR imaging: past, present, and future. Radiology. 278 (1), 13-32 (2015).
- Zabel, W. J., et al. Bridging the macro to micro resolution gap with angiographic optical coherence tomography and dynamic contrast enhanced MRI. Sci Rep. 12 (1), 3159 (2022).
- Mao, Y., Flueraru, C., Chang, S., Popescu, D. P., Sowa, M. G. High-quality tissue imaging using a catheter-based swept-source optical coherence tomography systems with an integrated semiconductor optical amplifier. IEEE Trans Instrum Meas. 60 (10), 3376-3383 (2011).
- Mariampillai, A., et al. Optimized speckle variance OCT imaging of microvasculature. Opt Lett. 35 (8), 1257-1259 (2010).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusible tracer: standardized quantities and symbols. J Magn Res Imaging. 10 (3), 223-232 (1999).
- Khalifa, F., et al. Models and methods for analyzing DCE-MRI: a review. Med Phys. 41 (12), 124301 (2014).
- Reitan, N. K., Thuen, M., Goa, P. E., de Lange Davies, C. Characterization of tumor microvascular structure and permeability: comparison between magnetic resonance imaging and intravital confocal imaging. J Biomed Opt. 15 (3), 036004 (2010).
- Dhani, N. C., et al. Analysis of the intra- and intertumoral heterogeneity of hypoxia in pancreatic cancer patients receiving the nitroimidazole tracer pimonidazole. Br J Cancer. 113 (6), 864-871 (2015).
- Gaustad, J. V., Brurberg, K. G., Simonsen, T. G., Mollatt, C. S., Rofstad, E. K. Tumor vascularity assessed by magnetic resonance imaging and intravital microscopy imaging. Neoplasia. 10 (4), 354-362 (2008).
- Rouffiac, V., et al. Multimodal imaging for tumour characterization from micro to macroscopic level using a newly developed dorsal chamber designed for long-term follow-up. J Biophotonics. 13 (1), 201900217 (2020).
- Leung, H. M., Schafer, R., Pagel, M. M., Robey, I. F., Gmitro, A. F. Multimodality pH imaging in a mouse dorsal skin fold window chamber model. Proc SPIE Int Soc Opt Eng. 8574, 85740L (2013).
- Erten, A., et al. Magnetic resonance and fluorescence imaging of doxorubicin-loaded nanoparticles using a novel in vivo model. Nanomed. 6 (6), 797-807 (2010).
- Maeda, A., DaCosta, R. S. Optimization of the dorsal skinfold window chamber model and multi-parametric characterization of tumor-associated vasculature. Intravital. 3 (1), e27935 (2014).
- Allam, N., Taylor, E., Vitkin, I. A. Low-cost 3D-printed tools towards robust longitudinal multi-modal pre-clinical imaging. bioRxiv. , (2023).
- Alexander, S., Weigelin, B., Winkler, F., Friedl, P. Preclinical intravital microscopy of the tumour-stroma interface: invasion, metastasis, and therapy response. Curr Opin Cell Biol. 25 (5), 659-671 (2013).
- Steven, A. J., Zhuo, J., Melhem, E. R. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain.Am. J Roentgenol. 202 (1), W26-W33 (2014).
- Mayer, P., et al. Diffusion kurtosis imaging-a superior approach to assess tumor-stroma ratio in pancreatic ductal adenocarcinoma. Cancers (Basel). 12 (6), 1656 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon