È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Iniezione intracamerale nei ratti con basso rischio di effetti avversi
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive una tecnica per l'iniezione intracamerale nei ratti utilizzando un'incisione corneale centrale e un lungo tunnel nella camera anteriore. Questo metodo di iniezione riduce al minimo il rischio di indurre danni involontari ai tessuti, migliorando così la precisione e la riproducibilità.
Abstract
L'iniezione intracamerale è una routine di somministrazione standard in oftalmologia. L'applicazione dell'iniezione intracamerale nei roditori per la ricerca è impegnativa a causa delle dimensioni e dell'anatomia limitanti dell'occhio, tra cui il piccolo volume dell'umor acqueo, la curvatura della lente e lo spessore della lente. Il potenziale danno durante le iniezioni intracamerali introduce effetti avversi e variabilità sperimentale. Questo protocollo descrive una procedura per l'iniezione intracamerale nei ratti, che consente precisione e riproducibilità.
I ratti Sprague-Dawley sono stati utilizzati come modelli sperimentali. Poiché la posizione della lente nei ratti sporge nella camera anteriore, l'iniezione dalla periferia, come fatto negli esseri umani, è sfavorevole. Pertanto, viene creata un'incisione nella regione corneale centrale utilizzando una lama a spillo da 31 gauge 0,8 mm per formare un tunnel autosigillante nella camera anteriore. Un'incisione ad angolo vicino al piano permette di creare un lungo tunnel, che riduce al minimo la perdita di umore acqueo e la superficialità della camera anteriore. Un nanoago calibro 34 viene inserito nel tunnel per l'iniezione. Ciò consente la penetrazione con una resistenza all'attrito minima ed evita di toccare l'obiettivo. L'iniezione di tripano-blu consente di visualizzare al microscopio a fessura la presenza del colorante nella camera anteriore ed escludere perdite. La biodisponibilità dello strato endoteliale corneale è dimostrata dall'iniezione del colorante di Hoechst, che ha colorato i nuclei delle cellule endoteliali corneali dopo l'iniezione.
In conclusione, questo protocollo implementa una procedura per un'accurata iniezione intracamerale nei ratti. Questa procedura può essere utilizzata per la somministrazione intracamerale di vari farmaci e composti in modelli sperimentali di ratto, aumentando l'efficienza e la riproducibilità della ricerca oftalmica.
Introduzione
La biodisponibilità dei composti somministrati per via topica sulla superficie dell'occhio è notevolmente limitata, in genere <5%1. I composti somministrati sotto forma di collirio vengono eliminati principalmente attraverso il drenaggio, la lacrimazione indotta, il ricambio del liquido lacrimale e l'assorbimento congiuntivale. Inoltre, la permeazione dei composti attraverso la superficie oculare è fortemente limitata dalla barriera cornea-congiuntiva 1,2,3. La cornea è composta da tre strati principali: l'epitelio più esterno, lo stroma intermedio e l'endotelio più interno. L'epitelio corneale superficiale è interconnesso da giunzioni forti e strette e crea un'elevata resistenza paracellulare, che è la principale barriera alla permeabilità della sostanza. Strati multipli di epitelio limitano ulteriormente la permeazione di molecole idrofile e di grandi dimensioni attraverso gli spazi intercellulari dell'epitelio corneale. Succedendo all'epitelio, lo stroma è composto da fibre di collagene e contiene pori acquosi. A differenza dell'epitelio corneale, lo stroma consente il movimento dei farmaci idrofili; Tuttavia, è molto impermeabile ai composti lipofili 1,2,3. Insieme, l'epitelio corneale e gli strati stromali presentano importanti barriere tissutali che limitano l'assorbimento dei farmaci. L'endotelio corneale non è considerato in grado di limitare il trasporto del farmaco.
Un'alternativa alla via di consegna corneale è la via congiuntivale. La congiuntiva è uno strato multiepitelio che copre il lato interno delle palpebre e la parte anteriore della sclera. La congiuntiva è caratterizzata da un minor numero di giunzioni strette rispetto all'epitelio corneale, consentendo una migliore permeabilità dei farmaci idrofili. Tuttavia, la vascolarizzazione della congiuntiva provoca l'assorbimento sistemico di una grande frazione delle molecole somministrate, limitando ancora una volta notevolmente la biodisponibilità dei composti veicolati nella camera anteriore 1,2. Un modo efficiente per aggirare le barriere esterne di permeabilità oculare consiste nel somministrare il farmaco direttamente nella regione di interesse. Ad esempio, l'iniezione intravitreale è comune per la somministrazione nell'umor vitreo4. Allo stesso modo, l'iniezione intracamerale viene utilizzata per la consegna nella camera anteriore5. Stabilire una concentrazione efficiente nella camera anteriore è fondamentale per varie situazioni cliniche, come il trattamento dell'infezione mediante iniezione intracamerale di antibiotici e i trattamenti antinfiammatori postoperatori negli interventi di cataratta. Nonostante il vantaggio di una migliore biodisponibilità della sostanza garantito dall'iniezione intracamerale, ci sono importanti problemi di sicurezza che dovrebbero essere considerati. Ad esempio, l'iniezione intracamerale di farmaci può indurre un aumento della pressione intraoculare, la sindrome del segmento anteriore tossico e la sindrome tossica da distruzione delle cellule endoteliali 5,6. È quindi essenziale valutare attentamente negli studi preclinici l'efficacia e la sicurezza dei farmaci somministrati mediante iniezioni intracamerali per massimizzare l'efficienza del trattamento e ridurre al minimo i potenziali effetti avversi nei pazienti.
I modelli animali sperimentali sono indispensabili negli studi preclinici per studiare nuovi trattamenti. I piccoli roditori, come topi e ratti, sono gli animali da laboratorio più comunemente utilizzati per tali scopi. Questi animali mostrano numerose somiglianze con l'anatomia e la fisiologia umana, fornendo preziose intuizioni. Inoltre, il loro uso è economicamente vantaggioso a causa delle loro piccole dimensioni, facilità di manutenzione, gestazione rapida e capacità di produrre un gran numero di prole7.
Nonostante l'uso diffuso di piccoli roditori nei modelli di malattie oculari, le loro dimensioni oculari e l'anatomia uniche pongono sfide significative durante le manipolazioni sperimentali. Ad esempio, procedure come le iniezioni intracamerali, che sono relativamente semplici negli esseri umani, diventano tecnicamente impegnative nei topi e nei ratti. Le sfide derivano da fattori quali il piccolo volume di umore acqueo, la lente relativamente grande e inflessibile e il posizionamento e la curvatura ostruttivi della lente all'interno degli occhi dei roditori (Figura 1)8. Queste sfide aumentano il rischio di danni durante le iniezioni intracamerali nei roditori, portando a potenziali effetti avversi e introducendo variabilità sperimentale che può influire sulla validità delle conclusioni dello studio. Nella nostra ricerca, abbiamo sviluppato con successo una procedura per l'iniezione intracamerale sicura nei ratti. La tecnica prevede la creazione di un tunnel lungo, piatto e autosigillante nella cornea nella camera anteriore. Questo metodo non solo garantisce la precisione, ma migliora anche la riproducibilità sperimentale, affrontando i problemi associati alle tecniche di iniezione nei piccoli roditori.
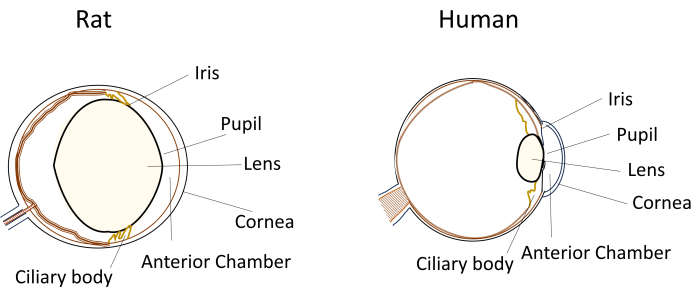
Figura 1: Rappresentazione schematica delle caratteristiche anatomiche del segmento anteriore degli occhi di ratto e umani. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
Gli esperimenti nel protocollo sono stati approvati dal Comitato Nazionale per i Permessi - per la scienza animale e sono conformi alla Dichiarazione ARVO sull'uso degli animali nella ricerca oftalmica e visiva. Per il presente studio sono state utilizzate femmine di ratti Sprague-Dawley, di età compresa tra 8 e 10 settimane, che sono state esposte a cicli luce-buio di 12/12 ore. Gli animali sono stati ottenuti da una fonte commerciale (vedi Tabella dei materiali).
1. Preparazione degli animali
- Preparare una miscela anestetica di ketamina (80 mg/kg di peso corporeo in 0,8 ml) e xilazina (4 mg/kg di peso corporeo in 0,2 ml) e iniettarla per via intraperitoneale in una singola iniezione per anestetizzare i ratti.
- Iniettare l'analgesico buprenorfina (0,03 mg/kg) per via intraperitoneale in un'unica iniezione.
- Applicare l'anestetico oftalmico topico allo 0,4% di ossibuprocaina su entrambi gli occhi.
2. Creazione di un tunnel corneale autosigillante
- Stabilizzare l'occhio tenendo la sclera superiore sulla linea mediana verticale vicino alla giunzione corneosclerale con una pinza oftalmica chirurgica.
- Sotto un microscopio operatorio, posizionare una lama a spillo sterile da 0,8 mm e 31 G nella regione corneale paracentrale nella linea mediana verticale (sopra il centro della pupilla) in posizione piatta con un angolo il più vicino possibile all'orizzontale (Figura 2).
- In questa posizione, pungere la cornea per praticare un'incisione e creare un lungo tunnel (2-3 mm) fino a quando non penetra nella zona centrale della camera anteriore. Evitare di toccare l'obiettivo (Figura 2).
NOTA: Un tunnel riuscito non indurrà la fuoriuscita dell'umore acqueo e l'abbassamento della camera anteriore. - Applicare topicamente lo 0,3% di loxacina e lo 0,1% di desametasone sull'occhio iniettato.
- Esaminare al microscopio a fessura come segue.
- Osservare la profondità della camera anteriore dell'occhio iniettato rispetto all'occhio non iniettato.
NOTA: La profondità dovrebbe essere simile. - Osservare il cristallino dell'occhio iniettato rispetto all'occhio non iniettato.
NOTA: L'obiettivo deve essere trasparente. L'opacità può riflettere il danno alla lente durante la procedura chirurgica.
- Osservare la profondità della camera anteriore dell'occhio iniettato rispetto all'occhio non iniettato.
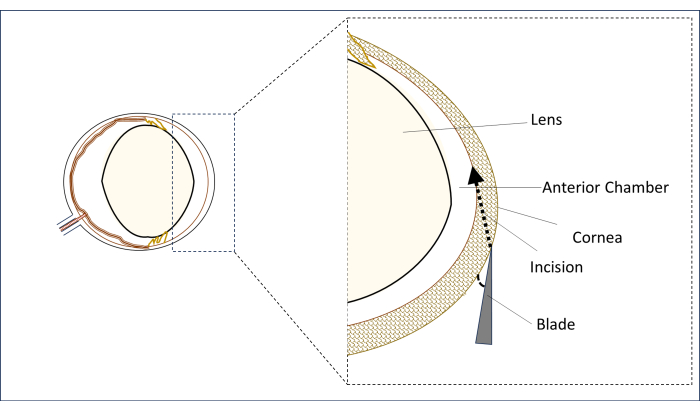
Figura 2: Rappresentazione schematica della lama e dell'angolo e della posizione dell'incisione. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Opzione 1: iniezione intracamerale di blu di tripano per valutare il successo dell'iniezione nella camera anteriore
- Caricare 5 μL di blu di tripano in una siringa Hamilton di vetro sterile da 10 μL con un ago smussato da 34 G.
NOTA: L'iniezione di blu di tripano è descritta come un mezzo per valutare il successo dell'iniezione durante le fasi di calibrazione o configurazione del modello. Nelle impostazioni sperimentali, la siringa può essere caricata con una soluzione del composto scelto. - Inserire l'ago della siringa caricato attraverso il tunnel creato nella sezione 2 nella camera anteriore.
- Iniettare e tenere l'ago in posizione dopo l'iniezione per 2-3 secondi fino a quando tutto il liquido non viene eliminato.
- Rimuovere l'ago estraendolo delicatamente e lentamente per evitare perdite dal tunnel corneale.
- Esaminare al microscopio a fessura. Valutare la profondità della camera anteriore per escludere l'abbassamento e verificare la presenza di blu di tripano nella camera anteriore.
- Ripetere l'esame della fessura dopo 24 ore, 48 ore e 72 ore.
4. Opzione 2: iniezione intracamerale di Hoechst per valutare la biodisponibilità del materiale iniettato nello strato di cellule endoteliali
- Caricare 5 μl di Hoechst in una siringa Hamilton sterile in vetro da 10 μl con un ago smussato da 34 g.
NOTA: L'iniezione di Hoechst è descritta come un mezzo per valutare la biodisponibilità del materiale iniettato mediante assorbimento nello strato di cellule endoteliali ed è utile durante le fasi di calibrazione o configurazione del modello. Nelle impostazioni sperimentali, la siringa può essere caricata con una soluzione del composto scelto. - Inserire l'ago della siringa caricato attraverso il tunnel creato nella sezione 2 nella camera anteriore.
- Iniettare e tenere l'ago in posizione dopo l'iniezione per 2-3 secondi fino a quando tutto il liquido non viene eliminato.
- Rimuovere l'ago estraendolo delicatamente e lentamente per evitare perdite dall'incisione del tunnel corneale.
- Circa 15-20 minuti dopo l'iniezione, sopprimere i ratti mediante iniezione intraperitoneale di 500 mg/kg di pentobarbitone sodico.
- Enucleare entrambi gli occhi e isolare le cornee. Raccogliere la cornea non iniettata come controllo.
- Colorare entrambe le cornee con lo 0,5% di rosso alizarina S secondo le istruzioni del produttore per identificare le cellule endoteliali.
- Esaminare al microscopio ottico per visualizzare la colorazione con rosso alizarina delle cellule endoteliali e al microscopio a fluorescenza per osservare la colorazione di Hoechst, rispetto alla cornea non iniettata come controllo.
Risultati
Ai ratti Sprague Dawley sono stati iniettati intracameralmente 5 μL di blu di tripano secondo il protocollo sopra descritto. L'esame con lampada a fessura subito dopo l'iniezione ha dimostrato che la camera era colorata con blu tripano, indicando che il materiale iniettato ha raggiunto la camera anteriore (Figura 3). Inoltre, la profondità della camera anteriore era intatta, suggerendo che l'iniezione non ha causato perdite di umore acqueo e superficialit?...
Discussione
I modelli di ricerca preclinica dovrebbero fornire un ambiente controllato e riproducibile per garantire l'affidabilità e l'applicabilità dei risultati. Nella ricerca oftalmologica, i modelli di iniezione oculare sono comunemente utilizzati in diversi aspetti della ricerca che vanno dalla creazione di modelli di malattia, alla sperimentazione di nuovi trattamenti e alla valutazione delle reazioni tissutali e dei potenziali effetti avversi.
Le iniezioni intra...
Divulgazioni
Marcovich A. L. detiene brevetti presso Steba Biotech, Yeda Weizmann, EyeYon Medical e Mor Isum ed è consulente per EyeYon Medical e Johnson & Johnson. Tutti gli altri autori non hanno interessi concorrenti.
Riconoscimenti
Questa ricerca è stata supportata dalle sovvenzioni 2670/23 e 1304/20 della Israel Science Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| Alizarin Red | Alpha Aesar | 042040.5 | |
| Buprenorphine | Richter pharma | 102047 | |
| Dexamethasone 0.1% | Fisher Pharmaceutical | 393102-0413 | |
| Hamilton glass syringe 10 μL | Hamilton Co. | 721711 | |
| Hoeschst | Merck | B2261 | |
| Ketamine | Bremer pharma GMBH (medimarket) | 17889 | |
| Ofloxacin 0.3% eye drops | Allergan | E92170 | |
| Oxybuprocaine Hydrochloride 0.4% | Fisher Pharmaceutical | N/A | |
| Pentobarbital sodium 200 mg/mL | CTS | N/A | |
| Slit microscope | Haag-streit bern | b-90019115 | |
| Sprague-Dawley Rats | Envigo | N/A | |
| Stiletto blade 31 G 0.8 mm | Tecfen medical (skymed) | QKN2808 | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Trypan Blue | Sartorius | 03-102-1B | |
| Xylazine | Eurovet Animal Health | 615648 |
Riferimenti
- Ramsay, E., et al. Corneal and conjunctival drug permeability: Systematic comparison and pharmacokinetic impact in the eye. Eur J Pharm Sci. 119, 83-89 (2018).
- Cholkar, K., Dasari, S. R., Pal, D., Mitra, A. K. . Eye: Anatomy, Physiology and Barriers to Drug Delivery. Ocular Transporters and Receptors. , (2013).
- Prausnitz, M. R. Permeability of cornea, sclera, and conjunctiva: A literature analysis for drug delivery to the eye. J Pharm Sci. 87 (12), 1479-1488 (1998).
- Varela-Fernández, R., et al. Drug delivery to the posterior segment of the Eye: Biopharmaceutic and pharmacokinetic considerations. Pharmaceutics. 12 (3), 269 (2020).
- Gautam, M., et al. Intracameral drug delivery: A Review of agents, indications, and outcomes. J Ocul Pharmacol Ther. 39 (2), 102-116 (2023).
- Shah, T. J., Conway, M. D., Peyman, G. A. Intracameral dexamethasone injection in the treatment of cataract surgery induced inflammation: design, development, and place in therapy. Clin Ophthalmol. 12, 2223-2235 (2018).
- Perlman, R. L. Mouse models of human disease: An evolutionary perspective. Evol Med Public Health. 2016 (1), 170-176 (2016).
- Chawla, S., Jena, S. . The Anatomy and Physiology of Laboratory Rat.Essentials of Laboratory Animal Science: Principles and Practices. , (2021).
- Lundström, M., Wejde, G., Stenevi, U., Thorburn, W., Montan, P. Endophthalmitis after cataract surgery: a nationwide prospective study evaluating incidence in relation to incision type and location. Ophthalmology. 114 (5), 866-870 (2007).
- Fine, I. H. Clear corneal incisions. Int Ophthalmol Clin. 34 (2), 59-72 (1994).
- Herretes, S., Stark, W. J., Pirouzmanesh, A., Reyes, J. M. G., McDonnell, P. J., Behrens, A. Inflow of ocular surface fluid into the anterior chamber after phacoemulsification through sutureless corneal cataract wounds. Am J Ophthalmol. 140 (4), 737-740 (2005).
- Masket, S., Belani, S. Proper wound construction to prevent short-term ocular hypotony after clear corneal incision cataract surgery. J Cataract Refract Surg. 33 (3), 383-386 (2007).
- Taban, M., Rao, B., Reznik, J., Zhang, J., Chen, Z., McDonnell, P. J. Dynamic morphology of sutureless cataract wounds - Effect of incision angle and location. Surv Ophthalmol. 49, S62-S72 (2004).
- Belforte, N., Sande, P. H., de Zavalía, N., Dorfman, D., Rosenstein, R. E. Therapeutic benefit of radial optic neurotomy in a rat model of glaucoma. PLoS One. 7 (3), e34574 (2012).
- Moreno, M. C., et al. A new experimental model of glaucoma in rats through intracameral injections of hyaluronic acid. Exp Eye Res. 81 (1), 71-80 (2005).
- Belforte, N., Sande, P., de Zavalía, N., Knepper, P., Rosenstein, R. Effect of chondroitin sulfate on intraocular pressure in rats. Invest Ophthalmol Vis Sci. 51 (11), 5768-5775 (2010).
- Matsumoto, Y., Kanamori, A., Nakamura, M., Negi, A. Rat chronic glaucoma model induced by intracameral injection of microbeads suspended in sodium sulfate-sodium hyaluronate. Jpn J Ophthalmol. 58 (3), 290-297 (2014).
- Liu, Y., et al. A novel rat model of ocular hypertension by a single intracameral injection of cross-linked hyaluronic acid hydrogel (Healaflow® ). Basic Clin Pharmacol Toxicol. 127 (5), 361-370 (2020).
- Bowen, R. C., et al. Comparative analysis of the safety and efficacy of intracameral cefuroxime, moxifloxacin and vancomycin at the end of cataract surgery: a meta-analysis. Br J Ophthalmol. 102 (9), 1268-1276 (2018).
- Kato, A., et al. Prophylactic antibiotics for postcataract surgery endophthalmitis: a systematic review and network meta-analysis of 6.8 million eyes. Sci Rep. 12 (1), 17416 (2022).
- Wang, M., Liu, Y., Dong, H. Effect of cefuroxime intracameral injection antibiotic prophylactic on postoperative endophthalmitis wound post-cataract: A meta-analysis. Int Wound J. 20 (5), 1376-1383 (2023).
- Katz, G., et al. Intracameral cefuroxime and the incidence of post-cataract endophthalmitis: an Israeli experience. Graefes Arch Clin Exp Ophthalmol. 253 (10), 1729-1733 (2015).
- Lipnitzki, I., Ben Eliahu, S., Marcovitz, A. L., Ezov, N., Kleinmann, G. Intraocular concentration of moxifloxacin after intracameral injection combined with presoaked intraocular lenses. J Cataract Refract Surg. 40 (4), 639-643 (2014).
- Colleaux, K. M., Hamilton, W. K., Morgan, R. A. Effect of prophylactic antibiotics and incision type on the incidence of endophthalmitis after cataract surgery. Can J Ophthalmol. 35 (7), 373-378 (2000).
- Libre, P. E., Della-Latta, P., Chin, N. X. Intracameral antibiotic agents for endophthalmitis prophylaxis: A pharmacokinetic model. J Cataract Refract Surg. 29 (9), 1791-1794 (2003).
- Carino, N. S., Slomovic, A. R., Chung, F., Marcovich, A. L. Topical tetracaine versus topical tetracaine plus intracameral lidocaine for cataract surgery. J Cataract Refract Surg. 24 (12), 1602-1608 (1998).
- Minakaran, N., Ezra, D. G., Allan, B. D. Topical anaesthesia plus intracameral lidocaine versus topical anaesthesia alone for phacoemulsification cataract surgery in adults. Cochrane Database Syst Rev. 7 (7), (2020).
- Dan-Ni, W., Li-Dian, H., Zhi-Guo, P., Qiang, W., Lei, S. Intracameral anti-VEGF injection for advanced neovascular glaucoma after vitrectomy with silicone oil tamponade. Int J Ophthalmol. 14 (3), 129-135 (2021).
- Bhagat, P. R., Agrawal, K. U., Tandel, D. Study of the effect of injection bevacizumab through various routes in neovascular glaucoma. J Curr Glaucoma Pract. 10 (2), 39-48 (2016).
- Al-Qaysi, Z. K., Beadham, I. G., Schwikkard, S. L., Bear, J. C., Al-Kinani, A. A., Alany, R. G. Sustained release ocular drug delivery systems for glaucoma therapy. Expert Opin Drug Deliv. 20 (7), 905-919 (2023).
- Eghrari, A. O., Gottsch, J. D. Fuchs' corneal dystrophy. Expert Rev Ophthalmol. 5 (2), 147-159 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon