È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sviluppo di un elettrodo per elettromiografia epimisiale a basso costo: un flusso di lavoro semplificato per la fabbricazione e il collaudo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il nostro scopo era quello di fornire una guida aggiornata e facile da seguire sulla fabbricazione e il collaudo degli elettrodi per elettromiografia epimisiaca. A tal fine, forniamo istruzioni per l'approvvigionamento dei materiali e una panoramica dettagliata del processo di fabbricazione e test.
Abstract
L'elettromiografia (EMG) è un prezioso strumento diagnostico per rilevare le anomalie neuromuscolari. Gli elettrodi epimisiali impiantabili sono comunemente usati per misurare i segnali EMG nei modelli preclinici. Sebbene esistano risorse classiche che descrivono i principi della fabbricazione di elettrodi epimisiali, c'è una scarsità di informazioni illustrative che traducono la teoria degli elettrodi in pratica. Per rimediare a questo problema, forniamo una guida aggiornata e facile da seguire sulla fabbricazione e il test di un elettrodo epimisiale a basso costo.
Gli elettrodi sono stati realizzati piegando e inserendo due lamine di platino-iridio in una base di silicone pretagliata per formare le superfici di contatto. Successivamente, i fili di acciaio inossidabile rivestiti sono stati saldati su ciascuna superficie di contatto per formare i cavi degli elettrodi. Infine, è stata utilizzata una miscela di silicone per sigillare l'elettrodo. Sono stati condotti test ex vivo per confrontare il nostro elettrodo fabbricato su misura con un elettrodo standard del settore in un bagno salino, dove sono stati riscontrati alti livelli di concordanza del segnale (seno [correlazione intraclasse - ICC= 0,993], quadrato [ICC = 0,995], triangolo [ICC = 0,958]) e sincronia temporale (seno [r = 0,987], quadrato [r = 0,990], triangolo [r = 0,931]) in tutte le forme d'onda. Bassi livelli di impedenza degli elettrodi sono stati quantificati anche tramite spettroscopia di impedenza elettrochimica.
È stata inoltre condotta una valutazione delle prestazioni in vivo in cui il muscolo vasto laterale di un ratto è stato strumentato chirurgicamente con l'elettrodo fabbricato su misura e la segnalazione è stata acquisita durante la camminata in salita e in discesa. Come previsto, il picco di attività EMG è stato significativamente inferiore durante la camminata in discesa (0,008 ± 0,005 mV) rispetto alla salita (0,031 ± 0,180 mV, p = 0,005), supportando la validità del dispositivo. L'affidabilità e la biocompatibilità del dispositivo sono state supportate anche da una segnalazione costante durante la camminata a livello a 14 giorni e 56 giorni dopo l'impianto (0,01 ± 0,007 mV, 0,012 ± 0,007 mV rispettivamente; p > 0,05) e dall'assenza di infiammazione istologica. Collettivamente, forniamo un flusso di lavoro aggiornato per la fabbricazione e il collaudo di elettrodi epimisici a basso costo.
Introduzione
L'elettromiografia (EMG) è un potente strumento per studiare l'attività elettrica del muscolo. Le registrazioni EMG possono essere particolarmente utili nei modelli animali preclinici per valutare l'efficacia degli interventi per il trattamento della disfunzione neuromuscolare. In questi modelli, gli elettrodi biocompatibili impiantabili sono comunemente usati per valutare l'interfaccia neurofisiologica tra motoneuroni e fibre muscolari. Questi elettrodi impiantabili possono fornire misurazioni localizzate dell'eccitazione muscolare e possono essere diversi in termini di configurazione, forma e materiale, con il design ottimale dettato in ultima analisi dalla posizione e dall'uso previsto.
Nonostante la loro idoneità per valutare l'eccitazione muscolare nei modelli preclinici, l'uso di elettrodi epimisiali può essere limitato dal costo. Di conseguenza, molti ricercatori utilizzano elettrodi epimisici fabbricati su misura che vengono prodotti internamente. Sebbene esistano risorse che descrivono in dettaglio le considerazioni fondamentali della fabbricazione, del test e dell'uso degli elettrodi 1,2, è necessaria una guida didattica aggiornata che descriva in dettaglio l'approvvigionamento, la fabbricazione e la convalida degli elettrodi epimisici utilizzando metodi moderni. Sulla base dei lavori fondamentali di Loeb e Gans3 e di altri nella teoria degli elettrodi, presentiamo istruzioni moderne sull'approvvigionamento e la fabbricazione di elettrodi epimisici a basso costo e testiamo le loro prestazioni in una serie di esperimenti ex vivo e in vivo. L'obiettivo è quello di offrire una guida di facile utilizzo per gli altri membri della comunità scientifica per reperire, fabbricare e testare internamente elettrodi epimisici a basso costo per uso animale, consentendo la più ampia quantificazione dell'eccitazione muscolare nei modelli preclinici.
In questo protocollo, forniamo una guida didattica per l'approvvigionamento, la fabbricazione e il test di elettrodi epimisiali per uso animale nel moderno laboratorio di elettrofisiologia. I parametri dell'elettrodo scelti per la fabbricazione, come la forma, le dimensioni, l'area della superficie di contatto, la distanza tra gli elettrodi, la lunghezza dell'elettrocatetere e così via, sono stati selezionati per soddisfare le nostre esigenze sperimentali ed erano paragonabili a un elettrodo epimisiale standard del settore disponibile in commercio (vedere la Tabella dei materiali). Incoraggiamo altri gruppi a modificare questi parametri in base alle loro esigenze, oltre a selezionare un elettrodo standard del settore affidabile che corrisponda al loro caso d'uso.
Nel tentativo di dare ai lettori un'idea relativamente rapida delle prestazioni dell'elettrodo, forniamo anche un esempio di un protocollo di test ex vivo con l'opzione di misurare l'impedenza dell'elettrodo. Inoltre, forniamo un esempio di valutazione delle prestazioni degli elettrodi in vivo. L'esperimento ex vivo ha confrontato l'elettrodo fabbricato su misura con uno standard industriale in un bagno salino per imitare condizioni fisiologiche stabili. L'impedenza è stata valutata anche ex vivo tramite spettroscopia di impedenza elettrochimica (EIS). L'esperimento in vivo consisteva nell'impianto chirurgico dell'elettrodo fabbricato su misura nel muscolo vasto laterale (VL) di una femmina di ratto Long Evans di 16 settimane (HsdBlu: LE, Envigo) per misurare il segnale EMG durante condizioni note per suscitare un segnale alto o basso (camminata in salita, in discesa). Per valutare l'affidabilità dell'elettrodo fabbricato su misura, la segnalazione EMG è stata acquisita durante la camminata a livello dopo il completo recupero chirurgico e prima del sacrificio (rispettivamente 14 giorni e 56 giorni dopo l'impianto). La colorazione con ematossilina-eosina (H&E) è stata condotta sul muscolo strumentato per valutare la biocompatibilità dell'elettrodo fabbricato su misura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
La procedura in vivo è stata condotta sotto l'approvazione dell'Institutional Animal Care & Use Committee dell'Università del Michigan (IACUC approval #PRO00010765) e in conformità con le linee guida del National Institutes of Health sulla cura e l'uso degli animali da laboratorio.
1. Approvvigionamento e fabbricazione di elettrodi
NOTA: La Figura 1 fornisce un riepilogo di alto livello di tutte le fasi chiave della fabbricazione con un collegamento QR che fornisce ulteriori istruzioni visive.
- Procuratevi materiali biocompatibili per elettrodi direttamente dal produttore per la fabbricazione. Vedere la tabella dei materiali, che contiene tutti i componenti degli elettrodi e i dettagli sull'approvvigionamento.
NOTA: Assicurarsi che la base in silicone, il sigillante siliconico e le lamine di contatto in platino-iridio siano biocompatibili per evitare una risposta immunitaria avversa e consentire l'impianto cronico. Per supportare i vantaggi economici della fabbricazione interna, presentiamo un'analisi dettagliata dei costi dell'elettrodo epimisiale realizzato su misura rispetto allo standard del settore (Tabella dei materiali). - Preparare la maschera di taglio e piegatura (File supplementare 1, File supplementare 2). Utilizza un software di stampa 3D selezionato per progettare maschere di taglio e piegatura per la produzione in batch di elettrodi epimisiali identici.
- Progettare la dima di taglio in modo da garantire perforazioni di dimensioni e spaziature costanti della base in silicone per un'area di contatto e una distanza tra gli elettrodi uguali su tutti gli elettrodi.
- Crea la dima di piegatura per piegare le superfici di contatto platino-iridio e semplificare il posizionamento delle lamine nella base in silicone.
NOTA: Vengono forniti file Gcode; Modificare le dimensioni e le specifiche della dima di taglio e piegatura in base alle esigenze sperimentali.
- Forare la base in silicone. Posizionare la base in silicone sulla maschera di taglio e fissarla con del nastro adesivo. Forare il silicone utilizzando le guide nella maschera di taglio utilizzando un coltello X-acto per il posizionamento delle lamine di contatto.
- Inserire le lamine nella base in silicone per formare le superfici di contatto. Piegare le lamine di contatto biocompatibili e pretagliate in platino-iridio (1,25 mm x 5 mm) a forma di U utilizzando la maschera di piegatura. Quindi, guidare i bracci delle lamine piegate nelle fessure perforate nella base in silicone per costruire le superfici di contatto dell'elettrodo. In questo modo, inserire tutte e 12 le lamine nella base in silicone; Lasciare una singola colonna aperta tra gli elettrodi per garantire una spaziatura adeguata.
NOTA: Questa configurazione consentirà la fabbricazione di 6 elettrodi epimisiali bipolari; La modifica della maschera di taglio può espandere la capacità, se necessario. - Rimuovere la base in silicone dalla maschera di taglio. Posiziona un pezzo di nastro chirurgico sulle superfici di contatto per tenere le lamine in posizione. Quindi, rimuovere la base in silicone dalla maschera di taglio, capovolgerla in modo che i bracci della pellicola a forma di U siano esposti e piegare un braccio della lamina a forma di U a filo con la base in silicone.
- Collegare i cavi degli elettrodi. Preparare un filo di acciaio inossidabile rivestito di perfluoroalcossi (PFA) tagliandolo alla lunghezza desiderata. Quindi, denudare un'estremità del filo di acciaio inossidabile di ~ 1 cm utilizzando un accendino disponibile in commercio. Posizionare l'estremità denudata del filo di acciaio inossidabile all'interno del braccio aperto della pellicola. Saldare il filo di acciaio inossidabile al braccio della lamina utilizzando una saldatrice Micro TIG (larghezza dell'impulso = 0, energia di saldatura = 25).
- Ispezionare l'interfaccia piombo-lamina. Testare il collegamento in lamina di filo applicando tensione al filo di acciaio inossidabile. Se la connessione regge, piegare il braccio della pellicola verso il basso a filo con la base in silicone e rimuovere il nastro che delimita il foglio di silicone.
NOTA: Applicare una tensione rappresentativa della tensione applicata nel caso d'uso specificato. - Sigillare l'elettrodo. Per ottenere una consistenza più sottile, mescolare 1 g di silicone liquido biocompatibile con 0,75 ml di toluene. Prelevare la miscela con una siringa a punta smussata da 18 G e applicarla sul lato saldato di ciascun elettrodo per sigillare la parte posteriore degli elettrodi.
ATTENZIONE: Il toluene è infiammabile, può essere fatale se ingerito o entra nelle vie respiratorie e provoca irritazione della pelle. Lavorare sotto la cappa aspirante e tenerli lontani da fiamme libere. - Separare il lotto in singoli elettrodi. Lasciare agire il silicone-toluene per 72 ore prima di maneggiare l'elettrodo. Quindi, usa le forbici per tagliare la base in silicone in singoli elettrodi con una dimensione di 10 x 5 mm.
NOTA: Le dimensioni dell'elettrodo dipendono dalle dimensioni della maschera di taglio e dal caso d'uso specifico. Autoclavare e/o pulire gli elettrodi in un bagno ad ultrasuoni.
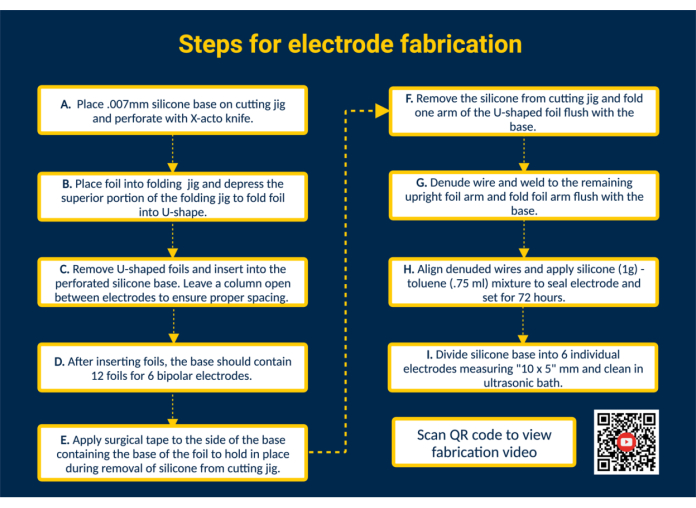
Figura 1. Fasi per la fabbricazione degli elettrodi. (A) Perforare la base in silicone. (B) Formare lamine a forma di U utilizzando la dima di piegatura. (C) Inserire le lamine a forma di U nella base in silicone perforato. (D) La base in silicone contiene 12 lamine per formare 6 elettrodi bipolari. (E) Applicare del nastro chirurgico alla base per fissare le lamine durante la rimozione dalla maschera di taglio. (F) Rimuovere la base in silicone dalla maschera di taglio. (G) Denudare il filo di acciaio inossidabile rivestito in PFA e saldarlo al braccio verticale utilizzando una saldatrice Micro TIG. (H) Allineare i fili denudati, applicare il sigillante siliconico-toluene e lasciare solidificare. (I) Dividere la base in silicone in singoli elettrodi e pulirla in un bagno a ultrasuoni. Clicca qui per visualizzare una versione più grande di questa figura.
2. Test ex vivo
- Collegare gli elettrodi a un dispositivo di registrazione. Fissare ciascun filo conduttore dell'elettrodo a un canale su una scheda di interfaccia dell'elettrodo (EIB). Ripetere questo passaggio (utilizzando lo stesso EIB) per un elettrodo standard del settore selezionato per il confronto. Collegare l'EIB a una piattaforma di acquisizione dati tramite un sistema di cavi magnetici legati.
NOTA: L'elettrodo standard del settore può essere qualsiasi elettrodo ritenuto affidabile e adatto alle esigenze sperimentali. - Mettere a terra la BEI. Denudare un'estremità di un acciaio inossidabile rivestito in PFA e saldare a punti a una fonte di messa a terra (ad esempio, una vite in acciaio inossidabile). Fissare il cavo di terra alla stessa scheda di interfaccia dell'elettrodo nella posizione di "terra" designata.
- Prepara il bagno salino. Riempire un becher di vetro (250 mL) con 180 mL di soluzione salina fisiologica (soluzione salina sterile allo 0,9%)4. Immergere gli elettrodi epimisici fabbricati su misura e standard del settore nel bagno salino e fissarli in una posizione stabile. Quindi, immergere la fonte di messa a terra nel bagno salino e fissarne la posizione. Infine, immergere e fissare due elettrodi ad ago stimolanti nel bagno salino e collegare gli elettrodi stimolanti al generatore di segnale.
- Utilizzare un generatore di segnali per valutare l'accordo del segnale e la sincronia temporale. Utilizzare un generatore di segnali per erogare forme d'onda ripetute a una tensione e frequenza selezionate (0,1 V e 5 Hz) nel bagno salino tramite gli elettrodi stimolanti (Figura 2). Fornisci varie forme d'onda (sinusoidale, quadrata e triangolare) per confrontare i segnali registrati tra l'elettrodo epimisiale fabbricato su misura rispetto allo standard del settore.
- Valuta le prestazioni in modo informale e visivo in tempo reale per valutare il grado di variazione dei segnali tra gli elettrodi. Eseguire correlazioni intra-classe (ICC) e correlazioni di Pearson per valutare rispettivamente l'accordo del segnale e la sincronia temporale.
NOTA: Ai fini della nostra analisi, sono stati acquisiti 8.000 campioni a 4.000 Hz e filtrati in tempo reale con un filtro Butterworth passa-alto e passa-basso (passa-alto = 75 Hz; passa-basso = 2 kHz). - Misurare l'impedenza dell'elettrodo. Per misurare l'impedenza dell'elettrodo, raccogliere l'EIS sugli elettrodi fabbricati su misura (ad esempio, 10 elettrodi) su frequenze 10 Hz-31 kHz5 con un potenziostato utilizzando la procedura descritta di seguito da Richie et al.6. Vedere Sarolic et al. per ulteriori informazioni sulla misurazione dell'impedenza degli elettrodi su elettrodi bipolari7.
- Seguendo la procedura di Richie et al., immergere l'elettrodo epimisiale di 1 mm in 1x soluzione salina tamponata con fosfato (PBS). Utilizzare un cloruro d'argento-argento (Ag|AgCl) e un'asta in acciaio inox come controelettrodo per completare il circuito.
- Sospendi l'Ag|L'elettrodo di riferimento AgCl e l'asta in acciaio inossidabile nel PBS 1x utilizzando un morsetto a bicchiere. Collegare l'elettrodo di riferimento al riferimento del sistema di impedenza in uso e collegarlo all'ingresso del controelettrodo del sistema di impedenza in uso.
- Utilizzare un potenziostato per eseguire una scansione di impedenza a 1 kHz. Impostare su una frequenza di scansione di 1 kHz a 0,01 Vrms in una singola forma d'onda sinusoidale. Durante i primi 5 secondi della scansione, impostare il potenziostato su 0 V per stabilizzare il segnale registrato. Utilizzare il software associato al potenziostato per registrare le misurazioni.
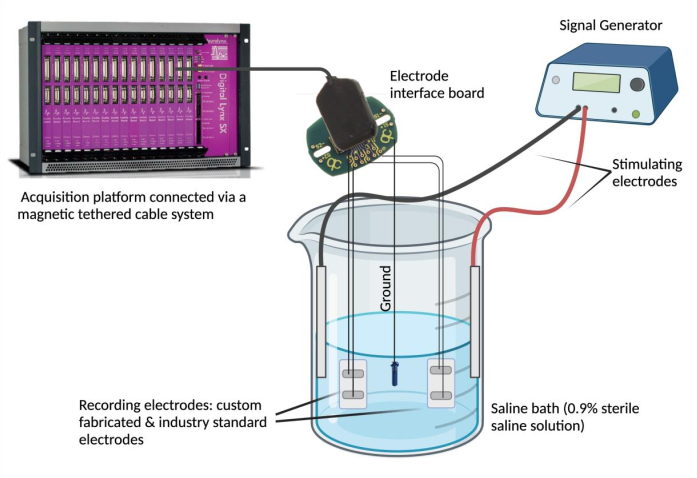
Figura 2: Test ex vivo : bagno salino contenente l'elettrodo fabbricato su misura, elettrodi standard industriali, due elettrodi stimolanti e una sorgente di terra. L'accordo del segnale e la sincronia temporale sono state valutate erogando onde sinusoidali, quadrate e triangolari nel bagno salino dal generatore di segnale e registrando le forme d'onda rilevate dai rispettivi elettrodi utilizzando una piattaforma di acquisizione dati. NOTA: La spettroscopia di impedenza elettrochimica non è raffigurata. Clicca qui per visualizzare una versione più grande di questa figura.
3. Test in vivo
NOTA: La procedura di test in vivo descrive il nostro caso d'uso sperimentale. Si raccomanda di testare in vivo gli elettrodi epimisici fabbricati su misura in modo che corrispondano alle condizioni sperimentali previste dall'utente.
- Rivedere le informazioni chirurgiche; Consultare le informazioni per i chirurghi che stanno imparando il processo di impianto di elettrodi di registrazione neurale cronica utilizzando le seguenti risorse 8,9.
NOTA: Dato che l'obiettivo del nostro manoscritto è la fabbricazione e il test degli elettrodi, qui forniamo solo una breve panoramica delle tecniche chirurgiche utilizzate nel nostro laboratorio per i test degli elettrodi in vivo . - Selezionare un ratto da strumentare (ad esempio, una femmina di ratto Long Evans a 16 settimane di età). Sottoporre il ratto a un periodo di acclimatazione di laboratorio di 1 settimana prima dell'acclimatazione al tapis roulant. Dopo l'acclimatazione in laboratorio, esporre gradualmente il ratto a un tapis roulant per roditori a velocità crescenti fino a 16 m/min.
- Preparare l'EIB collegando prima un elettrodo epimisiale fabbricato su misura all'EIB fissando ciascun elettrodo a un canale sull'EIB. Per mettere a terra l'EIB, denudare un'estremità di un filo di acciaio inossidabile rivestito in PFA e saldare a punti su una messa a terra selezionata (ad es. vite in acciaio inossidabile). Quindi, fissare il cavo di terra allo stesso EIB nella posizione di "terra" designata.
NOTA: Per proteggere l'elettrodo durante la strumentazione, avvolgerlo con una copertura protettiva (ad es. parafilm). - Disinfettare tutti gli strumenti chirurgici e l'area chirurgica prima di iniziare. Utilizzare forniture chirurgiche sigillate e asettiche e sterilizzare in autoclave tutti gli strumenti chirurgici che non sono in confezione sterile. Crea un campo chirurgico sterile utilizzando un telo chirurgico.
- Anestetizzare l'animale utilizzando una camera di induzione con isoflurano al 3-5% e 1 L/min di ossigeno e mantenere il sistema attraverso un cono nasale con isoflurano al 2% e 500 ml di ossigeno durante la preparazione del ratto. Dopo aver raggiunto il piano chirurgico dell'anestesia, valutare tramite pizzicamento delle dita, applicare un unguento oculare, monitorare la frequenza respiratoria (70-110 respiri/min) e valutare la temperatura interna utilizzando una sonda rettale.
- Quindi, radere il sito chirurgico con un tagliaunghie per animali e rimuovere i detriti dal sito chirurgico. Una volta rasata l'area chirurgica, disinfettare il sito chirurgico con clorexidina, alcol isopropilico e iodio povidone strofinando dal centro verso l'esterno dell'area chirurgica. Somministrare analgesici appropriati e approvati e fornire calore per mantenere la temperatura corporea interna (37,5-38,5 °C). Dopo la preparazione, posizionare il ratto in un quadro stereotassico e stabilire il campo sterile.
- Per una corretta preparazione chirurgica del chirurgo, lavare accuratamente le mani con sapone e/o un disinfettante (clorexidina). Indossa DPI adeguati: maschera, guanti sterili e un camice/top monouso. Indossare nuovi guanti sterili se la tecnica asettica viene violata per qualsiasi motivo.
- Per instrumentare il VL destro, utilizzare un bisturi per praticare un'incisione di 3-5 cm sulla porzione anterolaterale dell'arto posteriore destro e utilizzare la dissezione smussata per identificare il muscolo VL.
- Praticare un'incisione sul piano sagittale di 1 cm lungo la sutura coronale ed esporre il cranio. Usando un paio di pinze sottili, crea un tunnel sottocutaneo dall'arto posteriore destro alla base del cranio. Usa la pinza per afferrare l'elettrodo e instradare l'elettrodo verso il VL.
- Utilizzare un trapano per ossa per creare un foro nella calvaria (assicurarsi che le specifiche del trapano corrispondano a quelle della vite di messa a terra). Fissare la vite di messa a terra e fissare l'EIB al cranio utilizzando del cemento dentale.
NOTA: Piccole quantità di perossido di idrogeno possono essere applicate per aumentare la porosità del cranio e migliorare l'aderenza del cemento dentale. - Dopo aver identificato il muscolo VL, impiantare l'elettrodo epimisiale fabbricato su misura impiantato in linea con le fibre muscolari utilizzando un monofilamento 4-0 non assorbibile. Chiudere l'incisione utilizzando clip per ferite o sutura.
- Dopo la chiusura, rimuovere l'animale dall'anestesia e riporlo individualmente in una gabbia per animali pulita e asciutta. Consenti al ratto di riprendersi su un tappetino riscaldato e monitora la temperatura e la frequenza respiratoria del ratto ogni 15 minuti fino a quando l'animale non è deambulante. Trattare il dolore post-chirurgico somministrando un analgesico approvato nei giorni successivi alla strumentazione.
NOTA: il ratto deve essere alloggiato individualmente fino a quando non si riprende completamente. - Dopo un periodo di 14 giorni, eseguire il test degli elettrodi in vivo per valutare la validità dell'elettrodo epimisiale fabbricato su misura per catturare le alterazioni fisiologiche dell'attività muscolare. Posiziona il ratto strumentato su un tapis roulant per roditori ed esponilo in modo casuale a condizioni di camminata in salita e in discesa che provocano un aumento o una riduzione della segnalazione VL EMG (inclinazione di 16°, declino di 16° a 16 metri/minuto). Raccogli dati longitudinali (ad esempio, 14 giorni e 56 giorni dopo la strumentazione) per garantire l'affidabilità nel tempo.
NOTA: Le valutazioni di 14 e 56 giorni sono state selezionate in quanto un periodo di 14 giorni consente il completo recupero chirurgico e quello di 56 giorni supera la nostra tempistica sperimentale. Incoraggiamo gli altri a testare le prestazioni e l'affidabilità degli elettrodi utilizzando un lasso di tempo che replichi la loro sequenza temporale sperimentale prima dell'uso. La velocità (16 m/min) e le condizioni di camminata (16° di inclinazione, 16° di discesa) sono state selezionate per corrispondere alle condizioni stabilite di aumento e diminuzione dell'eccitazione VL in questo modello10. - Modificare i parametri di acquisizione in base alle esigenze sperimentali. Acquisisci la segnalazione EMG durante la camminata a una velocità di 2.000 Hz utilizzando la piattaforma di acquisizione dati e sincronizza con un sistema di acquisizione del movimento.
NOTA: Se si utilizza un dispositivo di acquisizione diverso, raccogliere EMG e motion capture secondo le istruzioni del produttore e per soddisfare le esigenze sperimentali. - Estrai 25 secondi di dati sull'andatura da ogni condizione di camminata ed esportali in uno script Python personalizzato per un'ulteriore elaborazione e analisi del segnale. Regolazione della linea di base (zero), rettifica e uniformazione utilizzando un algoritmo quadratico medio radice con una larghezza del contenitore di 50 ms. Applica un algoritmo di rilevamento dei picchi per selezionare i picchi RMS-EMG da utilizzare per le successive analisi dei dati.
NOTA: Abbiamo brevemente descritto i metodi per pre-elaborare e analizzare i dati EMG, poiché questo passaggio varia notevolmente a causa dei linguaggi di programmazione e del software e dell'hardware di acquisizione EMG. Incoraggiamo gli autori a consultare le seguenti risorse per ulteriori informazioni 3,11,12,13.
4. Test di biocompatibilità
- Dopo la fine delle raccolte EMG longitudinali (o in un momento selezionato), sopprimere il ratto utilizzando metodi appropriati e approvati (ad esempio, asfissia con CO2 seguita da toracotomia bilaterale).
- Dopo l'eutanasia, estrarre i muscoli VL bilaterali creando un'incisione sugli arti posteriori destro e sinistro anterolaterale. Congelare in azoto liquido e conservare a -80 °C.
NOTA: Fare attenzione a mantenere l'elettrodo in posizione sul muscolo strumentato (ad esempio, il VL destro) durante l'estrazione. In alternativa, contrassegnare la regione del sottoelettrodo o estrarre solo il muscolo dalla regione del sottoelettrodo. Questo non si applica al muscolo controlaterale/di controllo. - Utilizzare un criostato per tagliare sezioni trasversali muscolari seriali (7 μm) dalla regione direttamente sotto l'interfaccia elettrodo-fasciale. Tagliare sezioni dal ventre muscolare del VL controlaterale per fungere da controllo. Vedi Kumar et al. per i dettagli sulla criosezione14.
- Colorazione con ematossilina ed eosina (H&E); vedi Wang et al. per i dettagli riguardanti la colorazione H&E sulle sezioni trasversali del muscolo scheletrico15.
- Esaminare le sezioni colorate (strumentate e di controllo) utilizzando un microscopio ottico con ingrandimento 20x. Analizza i cambiamenti istologici alla cieca dell'origine dei campioni. Valutare la salute dei tessuti valutata utilizzando le seguenti caratteristiche patologiche: infiltrazione di cellule immunitarie, accumulo mionucleare interno, fibrogenesi e frammentazione del sarcolemma.
5. Analisi statistiche suggerite
- Per valutare le prestazioni dell'elettrodo epimisale realizzato su misura rispetto allo standard del settore, importare i dati ex vivo in un pacchetto statistico selezionato. Applicare i seguenti test statistici ai dati ex vivo raccolti dagli elettrodi standard industriali e fabbricati su misura (ad esempio, 8.000 campioni rappresentativi dalle forme d'onda sinusoidale, triangolare e quadra). Imposta il livello alfa a priori a p ≤ 0,05.
- Per testare il livello di concordanza del segnale tra gli elettrodi, utilizzare le correlazioni intraclasse (ICC) e i grafici di Bland-Altman. Calcola le stime ICC e i loro intervalli di confidenza al 95% sulla base di un modello a effetti casuali a 2 vie a punteggio singolo (k = 2), accordo assoluto.
- Per testare il grado di covarianza della registrazione delle forme d'onda nel tempo, nota anche come sincronia temporale, eseguire la correlazione di Pearson sui valori raccolti con gli elettrodi standard industriali e fabbricati su misura.
- Confrontare l'impedenza media dell'elettrodo per entrambe le superfici di contatto (misurata a 1 kHz) da elettrodi selezionati e fabbricati su misura (ad esempio, 10 elettrodi) con l'impedenza dell'elettrodo standard del settore.
NOTA: I valori di impedenza dell'elettrodo variano in base al caso d'uso e ai materiali utilizzati durante la fabbricazione dell'elettrodo.
- Per valutare la qualità delle registrazioni in vivo , importare i dati raccolti durante la camminata sul tapis roulant in un pacchetto statistico selezionato.
- Per valutare la validità dell'elettrodo fabbricato su misura durante i test in vivo (in cui l'andatura del ratto è stata perturbata attraverso la camminata in salita e in discesa per indurre alterazioni fisiologiche nell'attività muscolare), eseguire il t-test di Welch per confrontare i valori medi di picco per le condizioni di camminata in salita e in discesa.
NOTA: I lettori sono incoraggiati a eseguire ulteriori test e analisi (ad esempio, valutazioni del rapporto segnale/rumore (SNR); vedere Delysys Fundamental Concepts in EMG Signal Acquisition) che non sono presentati qui per brevità16. - Per valutare l'affidabilità della segnalazione dell'elettrodo nel tempo, valutare i dati longitudinali raccolti in condizioni costanti (camminata livellata a 16 m/min a intervalli di 14 e 56 giorni dopo l'impianto) tramite test t accoppiati.
- Per valutare la validità dell'elettrodo fabbricato su misura durante i test in vivo (in cui l'andatura del ratto è stata perturbata attraverso la camminata in salita e in discesa per indurre alterazioni fisiologiche nell'attività muscolare), eseguire il t-test di Welch per confrontare i valori medi di picco per le condizioni di camminata in salita e in discesa.
Access restricted. Please log in or start a trial to view this content.
Risultati
Prestazioni ex vivo
Gli ICC hanno rivelato alti livelli di accordo tra gli elettrodi fabbricati su misura e quelli standard del settore in tutte le forme d'onda (seno [ICC = 0,993], quadrato [ICC = 0,995], triangolo [ICC = 0,958]; p < 0,001). I grafici di Bland-Altman hanno anche rivelato un alto grado di accordo del segnale tra gli elettrodi. I grafici di Bland Altman e le correlazioni di Pearson sono riassunte nella Figura 3 co...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il nostro obiettivo era quello di semplificare il processo di fabbricazione EMG, consentendo una più ampia adozione e implementazione di design di elettrodi epimisiali, promuovendo così l'accessibilità e facendo progredire la ricerca neuromuscolare. A tal fine, presentiamo una guida di facile utilizzo per l'approvvigionamento, la fabbricazione e il test di elettrodi epimisici a basso costo in-house. Nella speranza di supportare altri gruppi di ricerca, forniamo anche modelli di stampa...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti noti o relazioni personali che possano aver influenzato il lavoro riportato in questo articolo.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institute of Arthritis and Musculoskeletal and Skin Diseases Grant R01AR081235 (a L. K. Lepley). Gli autori ringraziano le seguenti persone per il loro contributo alla fabbricazione e al collaudo del nostro elettrodo biocompatibile: Joel Pingel, Grant Gueller, Akhil Ramesh, Joe Letner, Jacky Tian e Ross Brancati.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
Riferimenti
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), discussion 799 794-799 (2014).
- Loeb, G. E., Gans, C. Electromyography for Experimentalists. , University of Chicago Press. Chicago, IL. (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009(2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099(2021).
- Impedance measurement of bipolar stimulation electrodes immersed in medium. Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. 2018 EMF-Med 1st World Conf. Biomed. Appl. Electromagn. Fields EMF-Med, , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586(2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345(2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793(2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279(2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010(2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694(2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. Koch, K. P., Leinenbach, C., Stieglitz, T. IFESS 5th Conf, , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33(2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon