È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Hellgrammite come biomonitor non convenzionale per la valutazione delle acque superficiali e della salute ambientale
In questo articolo
Riepilogo
Questo protocollo descrive l'uso di biomarcatori per l'individuazione precoce di impatti deleteri negli ecosistemi acquatici. I biomarcatori sono strettamente correlati ai tratti sentinella e i loro cambiamenti aiutano a rilevare i danni precoci.
Abstract
Le larve di dobsonflies del genere Corydalus, comunemente note come Hellgrammites, sono caratterizzate da dimensioni notevoli, ampia gamma di occorrenza e prolungato periodo di immaturità, che può durare fino a un anno. Le Hellgrammiti sono chiaramente note per mostrare sensibilità all'inquinamento e agli impatti sulla struttura dell'habitat. Date queste caratteristiche uniche, l'utilizzo di larve di Corydalus texanus è altamente adatto come agenti di biomonitoraggio affidabili per valutare l'integrità ecologica degli ecosistemi acquatici. Questo protocollo mira a fornire gli strumenti necessari per la valutazione di C. texanus e a dimostrarne l'efficacia attraverso un caso di studio. I risultati della ricerca hanno implicazioni pratiche, indicando che le larve di C. texanus mostrano risposte di allerta precoce all'inquinamento minerario, bioaccumulando elevate quantità di metalli pesanti come Zn, Fe e Al. La presenza o l'assenza di popolazioni di C. texanus può fungere da indicatore utile per identificare potenziali problemi legati alla salute dell'ecosistema. L'approccio non convenzionale ha dimostrato di essere allarmo precoce dell'inquinamento nei siti colpiti dalle attività minerarie, evidenziando la necessità di un'azione tempestiva per proteggere l'ambiente. Date le loro caratteristiche uniche, l'uso di larve di C. texanus è altamente raccomandato come bioindicatore non convenzionale affidabile.
Introduzione
Le Hellgramites sono larve di insetti dell'ordine Megaloptera (Latreille, 1802), chiamate dobsonflies o fishflies nella loro fase adulta. Una bassa diversità ma diffusa caratterizza questo gruppo di larve di insetti predatori provenienti dagli ecosistemi acquatici1. Le specie di Hellgramite si trovano in regioni biogeografiche ben definite; Pertanto, è relativamente facile identificare le specie senza un'elevata conoscenza tassonomica. In particolare, le larve di Corydalidae possiedono le specie più importanti dell'ordine dei Megaloptera (20-90 mm di lunghezza del corpo)2, rendendo l'hellgramite visibile ad occhio nudo.
Gli Hellgrammites svolgono un ruolo cruciale negli ecosistemi acquatici come predatori, con una presenza potente dovuta a grandi masticatori che denotano la loro impressionante forma predatoria. Un corpo appiattito dorsoventralmente si unisce anche con 7-8 paia di branchie filamentose lungo il corpo, e una capsula della testa con sei stemmi per lato rende le hellgrammites organismi affascinanti per entomologi e appassionati3. Gli adulti di Corydalidae sorprendono e creano un'immagine d'impressione per le persone grazie alle loro dimensioni prominenti; Tuttavia, sono del tutto innocui. È interessante notare che le hellgrammites hanno la capacità di persistere negli ambienti acquatici nel loro stadio larvale per una durata significativa.
Le caratteristiche fenotipiche delle hellgrammites consentono una particolare possibilità di evidenziare il loro ruolo negli ecosistemi acquatici; Tuttavia, il loro potenziale indicatore è la caratteristica più ricercata dagli ecologi acquatici. La vasta conoscenza del loro potenziale bioindicatore è evidenziata negli ecosistemi acquatici perché la loro presenza è correlata a buone condizioni di salute nei loro habitat a causa della loro intolleranza all'inquinamento organico nelle acque superficiali 4,5,6,7,8.
La maggior parte dei Corydalidae megalopteri vive in acque correnti ad alta velocità come rivoli e substrati predominati da ciottoli e ciottoli, ma le hellgrammites si trovano anche in corsi d'acqua a basso gradiente con strappi e substrati sabbiosi, così come in habitat lentici come i laghi 3,9,10. La loro vasta gamma di occorrenze rispecchia i tratti critici di un predatore superiore e la loro capacità di colonizzare diversi habitat mirati dalle loro efficaci strategie di storia della vita11. Gli Hellgramiti collegavano i loro tratti con le dinamiche degli ecosistemi acquatici; quindi, strategie come l'adattamento alla respirazione aerea da parte degli spiracoli (oltre ai loro ciuffi ventrali di branchie tracheali) sono proprie delle strategie dei Corydalidae10.
Gli Hellgrammiti abitano particolari ecosistemi e mostrano risposte rapide alle deviazioni dai modelli stabiliti, fungendo così da sistema di allerta precoce7. Le reazioni di questi organismi selvatici possono essere utilizzate come strumento prezioso per valutare l'impatto dell'inquinamento sugli ecosistemi acquatici, in particolare nel caso di miscele di inquinanti non bersaglio. Alcuni effetti deleteri sugli organismi viventi sono stati riconosciuti negli ecosistemi a causa della tossicità individuale delle sostanze chimiche, ma l'effetto delle miscele di inquinanti deve essere identificato. Le risposte di allerta precoce degli hellgrammites possono rendere possibile l'identificazione degli effetti deleteri fornendo un riferimento agli impatti di una miscela di inquinanti o anche quando i singoli effetti degli inquinanti riconoscono la concentrazione di nessun effetto osservabile (NOEC)12.
Diversi organismi modello sono stati utilizzati per test sperimentali acuti e cronici; tuttavia, vengono allevati e mantenuti in condizioni controllate13. Le condizioni controllate li rendono incapaci di identificare gli effetti non bersaglio di diversi inquinanti a cui sono esposti. Inoltre, la NOEC è spesso riconosciuta a causa della complessità della miscela dell'inquinante. Per questo motivo, negli ultimi decenni, le specie autoctone non modello con effetti non bersaglio sono state riconosciute per lo screening dei sistemi, che sono essenziali per condurre ricerche ecotossicologiche14. Di conseguenza, gli hellgrammiti sembrano in grado di valutare gli effetti deleteri dell'inquinamento negli ecosistemi acquatici. Tratti come la loro biologia, genetica e fisiologia, tra gli altri, rendono gli organismi non modello adatti alla valutazione dell'impatto negli ecosistemi14.
Questo protocollo mira a stabilire un nuovo strumento di biomonitoraggio utilizzando un organismo non modello in grado di rilevare segnali di allarme precoce in risposta a miscele di inquinamento non bersaglio. Per ottenere i migliori risultati, i caratteri esibiti dalle larve della specie modello, C. texanus, sono stati considerati in modo completo e integrati nell'analisi15.
Protocollo
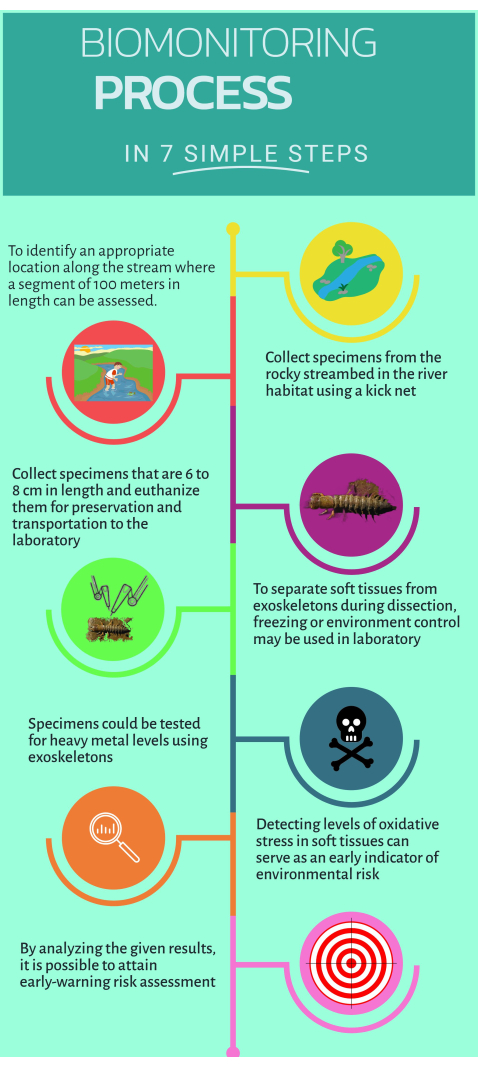
Figura 1: Guida rapida passo passo su come utilizzare il biomonitor non convenzionale Corydalus texanus per l'implementazione negli ecosistemi acquatici. Fare clic qui per visualizzare una versione più grande di questa figura.
1. Lavoro sul campo
- Identificare i siti di studio situati a monte e a valle della fonte di inquinamento dove vengono riconosciuti impatti sospetti o evidenti (i.e., emissioni puntuali o diffuse).
NOTA: Il presente protocollo comprendeva 15 siti di studio in quattro fiumi principali: 1) Fiume Extoraz (siti PB, EZ, RQ, BC); 2) Fiume Escanela-Jalpan (ES, EN, AH, JL, PI, PA); 3) Fiume Ayutla (AY); e 4) Fiume Santa María (SM, AT). - Ricercare e localizzare almeno un sito di riferimento (un luogo con impatti minori o privi di impatti) e definirlo come sito di studio.
NOTA: Per gli attuali siti di studio BC, ES, SM, AY e AT sono stati considerati come siti di riferimento. - Riconoscere alcuni attributi degli habitat che aumentano la probabilità di trovare individui di C. texanus. Questi includono substrato ghiaioso, habitat rocciosi con pendenze più ripide, flussi ad alta velocità, acque ben ossigenate, alta densità di chioma e habitat in altopiani e pianure.
- Racchiudere un tratto di 100 m del torrente per identificare gli habitat appropriati per il biomonitoraggio16.
- Entra nel flusso per raccogliere campioni.
- Campiona almeno sei individui di C. texanus in habitat come riffles, ciottoli, acque limpide e detriti utilizzando una rete a calcio con una dimensione delle maglie di 500 μm.
- Rimuovere le rocce nella direzione del flusso d'acqua e trasferire le larve nella rete.
- Maneggiare la rete con le larve campionate e trasferirle in bottiglie designate per la sistemazione temporanea. Maneggiare la rete con cautela e piegare i bordi verso l'interno per evitare la perdita di larve.
- Misurare la larghezza della testa delle larve campionate utilizzando un calibro per identificare gli stadi da IX a XI (nell'intervallo da 6 mm a 10 mm).
- Spurgare le larve immergendole in una bottiglia contenente acqua di ruscello per 30 minuti.
- Collocare i campioni in bottiglie di plastica con un'etichettatura chiara e quindi sopprimerli mediante immersione in azoto liquido (-75 °C) in un serbatoio criogenico.
- Trasportare e conservare i campioni in modo sicuro a -45 °C nell'ultracongelatore del laboratorio.
- Utilizzando una bottiglia di polietilene, prelevare un campione di acqua di flusso di 200 ml, aggiungere 1 ml di acido nitrico e conservare il campione a 4 °C per la successiva quantificazione dei metalli pesanti in laboratorio.
2. Dissezione delle larve campionate e separazione dei tessuti
- Mettere la vaschetta di dissezione in plastica sul ghiaccio e attendere che raggiunga i 4 °C, utilizzando un termometro per controllare.
- Prelevare i campioni dall'ultracongelatore e metterli sul vassoio di dissezione per iniziare la dissezione.
- Seleziona i tessuti bersaglio: muscolo, rami, tubo neurale ed esoscheletro.
- Usa un coltello di ceramica per rimuovere la testa e separare accuratamente i tessuti. Aprire il corpo longitudinalmente e rimuovere le branchie su ciascun lato.
- Separare gli esoscheletri con un coltello di ceramica più piccolo e pulire il tessuto in eccesso. Mettere gli esoscheletri in forno e asciugarli a 80 °C per 48 h.
- Trascorso il tempo, conservare gli esoscheletri asciutti per ulteriori analisi.
- Continuare a pulire i tessuti molli in condizioni di freddo per ulteriori analisi mediante microdosaggi.
- Usa un piccolo coltello di ceramica per estrarre i tessuti molli dal grasso. Separare e raggruppare ogni tessuto target da individui provenienti dallo stesso punto di campionamento.
- Conservare ogni tipo di tessuto in una microprovetta da 2 mL, mantenendo le condizioni di freddo durante tutto il processo.
- Per preparare ciascun tessuto bersaglio, pesare 100 mg di tessuto e aggiungere 1 mL di soluzione di PBS con un pH di 7,4. Utilizzare uno strappo di tessuto con una sola mano per omogeneizzare ogni tessuto. In genere, i tessuti molli richiedono tre cicli di 10 s ciascuno.
- Centrifugare il campione a 1.000 x g per 5 minuti a 4 °C. Trasferire il surnatante in una microprovetta da 1 mL.
- Esegui saggi di micromarcatori biomarcatori.
3. Quantificazione dei metalli pesanti
- Pesare 250 mg di esoscheletri essiccati da almeno sei campioni nello stadio di sviluppo specificato utilizzando una bilancia analitica.
- Macinare gli esoscheletri in un mortaio di vetro fino a quando non diventano finemente polverizzati. Aggiungere 250 mL di acido nitrico ultrapuro ai recipienti di reazione della polvere.
- Per digerire i campioni, trasferirli in un forno a microonde per digestione a 180 °C per 30-45 minuti.
NOTA: Utilizzare il contenitore adatto al microonde adatto alla marca del microonde per riscaldare i campioni in modo sicuro ed efficace. Il tempo di digestione per i campioni di tessuto varia a seconda della marca del microonde, impiegando 30-45 minuti. Alcuni marchi offrono metodi standardizzati. - Eseguire un metodo di digestione a microonde per campioni d'acqua seguendo il metodo EPA3015A, utilizzando 45 mL del campione d'acqua e aggiungendo 5 mL di acido nitrico.
- Misura di metalli pesanti e metalloidi in campioni digeriti (acqua e tessuti) utilizzando la spettroscopia di emissione ottica al plasma accoppiato induttivamente (ICP-OES), tra cui Hg, Cu, Pb, Zn, Fe, Cr, Cd, Mn, Ba e As.
NOTA: Utilizzare argon di grado 5 e soluzioni standard di ciascun metallo e metalloide per costruire una curva di calibrazione.
4. Microsaggi per la valutazione dello stress ossidativo e biomarcatori
- Preparazione dei reagenti
- Mescolare 6 g di NaH2PO4 con 1000 mL di acqua ultrapura per ottenere un tampone fosfato monobasico da 50 mM. Conservare in un matraccio a 2-8 °C a tempo indeterminato.
- Per ottenere l'8,1% di SDS, sciogliere 450 mg di sodio dodecil solfato (SDS) in 5 ml di acqua ultrapura. Preparare poco prima dell'uso.
- Diluire 2 mL di acido tricloroetanoico (TCA) in 8 mL di acqua ultrapura (preparare un reagente fresco quando necessario).
- Sciogliere 100 mg di tetrabutilammonio (TBA) in 10 ml di acqua ultrapura (preparare un reagente fresco quando necessario).
- Per ottenere 50 mM di PBS pH 7,8, sciogliere 97 mg di Na2HPO4 e 59 mg di NaH2PO4 in 10 mL di acqua ultrapura. Quindi, regolare il pH a 7,8 utilizzando NaOH per aumentare o HCl per diminuire.
- Preparare una soluzione di 200 μg/mL di catalasi bovina sciogliendo 8 mg di catalasi in 40 μL di acqua ultrapura (preparare un reagente fresco quando necessario).
- Per preparare una soluzione di acido etilendiamminicominacetico (EDTA) da 50 mM TRIS/5 mM, aggiungere 6,05 g di tris (idrossimetil)amminometano (TRIS) e 0,073 g di EDTA a 45 mL di acqua ultrapura. Regolare il pH a 7,6 con HCl e conservare a 4 °C fino al momento dell'uso.
- Per 0,1 M di glutatione ridotto (GSH) (per 45 campioni duplicati), pesare 0,0184 g di GSH e scioglierlo in 600 μL di 10 mM di HCl.
- Per preparare 10 mM di HCl, aggiungere 0,5 μL di HCl concentrato a 599,5 μL di acqua ultrapura.
- Aggiungere 28,5 μL di glutatione reduttasi a 1,4 mL di 0,1 M TRIS/HCl 0,5 mM EDTA pH 8,0.
- Miscelare 1,211 g di TRIS e 0,0146 g di EDTA con 90 mL di acqua ultrapura per preparare una soluzione di TRIS/HCl 0,1 M e EDTA 0,5 mM a pH 8,0. Aggiungere HCl per regolare il pH, se necessario. La soluzione può essere conservata indefinitamente a 2-8 °C.
- Pesare 0,075 g di NADPH e aggiungerlo a 2,25 mL di NaHCO3 1 mM EDTA all'1%.
- Mescolare 1 g di NaHCO3 e 0,0282 g di EDTA in 100 mL di acqua ultrapura per preparare una soluzione di NaHCO3 all'1% e 1 mM di EDTA. Conservare la soluzione a 4-8 °C per un tempo indeterminato.
- Mescolare 2 μL di t-butilidroossido con 2 mL di acqua ultrapura per ottenere una soluzione da 7 mM. Mescolare immediatamente prima dell'uso.
- Mescolare 1 g di albumina sierica bovina (BSA) con 1 mL di acqua ultrapura per creare una soluzione madre da 1 μg/μL.
- Sostanze reattive dell'acido tiobarbiturico (TBARS) (perossidazione lipidica, LPO)17
- Aggiungere 5 μL di surnatante tissutale in una microprovetta da 1 mL. Aggiungere 45 μl di 50 mM di PBS (soluzione fresca e madre).
- Aggiungere 12,5 μl di SDS all'8,1% (appena preparato). Aggiungere 93,5 μl di TCA al 20% pH 3,5 (preparato al momento).
- Aggiungere 93,5 μl di TBA all'1% (preparato al momento). Completare il volume aggiungendo 50,5 μl di acqua ultrapura. Chiudere il coperchio del tubo e agitarlo per 30 s.
- Forare il coperchio della microprovetta con un ago e incubare in acqua bollente per 10 minuti.
- Raffreddare la provetta a temperatura ambiente (RT), quindi centrifugarla a 1000 x g per 10 minuti.
- Aggiungere 150 μl di surnatante a un pozzetto in una micropiastra a 96 pozzetti e misurare l'assorbanza a 530 nm utilizzando uno spettrofotometro per micropiastre.
- Per quantificare i perossidi lipidici, creare una curva di calibrazione TBARS a 8 punti (0-160 μM) utilizzando malondialdeide bis (dimetilacetale) come descritto nella Tabella 1. Regolare la curva della malondialdeide (MDA) in base al tipo di tessuto o al livello di danno sospetto.
- Esprimere i risultati come nmol MDA eq·mg−1 proteina.
- Dosaggio enzimatico antiossidante (SOD) con superossido dismutasi18
- Utilizzare una piastra a 96 pozzetti. Aggiungere 147 μl di 1 M TRIS/5 mM HCl EDTA pH 8 in due pozzetti come spazi vuoti. Aggiungere 144 μL di 1 M TRIS/5 mM HCl EDTA pH 8 in altri pozzetti per duplicato.
- Prelevare 3 μl dal surnatante e aggiungerlo ai pozzetti del campione. Mescolare delicatamente il contenuto sul piatto più volte.
- Aggiungere 3 μL di acido pirogallico 10 mM a ciascun pozzetto entro 30 s. Mescolare delicatamente e subito.
- Misurare l'assorbanza a T0 (tempo = 0 s) e T10 (tempo = 10 s), a 420 nm e 25 °C.
- Determinare la SOD calcolando la percentuale di inibizione del pirogallolo nel campione utilizzando la seguente equazione:
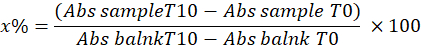
Dove
x% = percentuale di ossidazione del pirogallolo da parte della SOD nel campione; Pertanto, l'ossidazione del pirogallolo è pari al 100 - x%
NOTA: Calcolo dell'attività SOD considerando 1 UI è il volume che inibisce il 50% dell'ossidazione del pirogallolo come descritto di seguito:
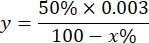
Dove
y = volume del campione in millilitro (inibisce il 50% del pirogallone)
50% = percentuale di inibizione del pirogallolo uguale a 1U di SOD
0,003 = volume in millilitri del campione
100 - x% = inibizione del pirogallolo in percentuale da parte del campione - Infine, determinare l'attività SOD con l'equazione:
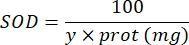
SOD = attività della SOD in unità internazionali per microgrammo di proteina
Y = volume del campione in quanto inibisce il 50% del pirogallolo
100 = fattore di conversione da decilitro a millilitro.
proteina = la concentrazione proteica ottenuta dalla quantificazione di Bradford è espressa in microgrammi per millilitro; È necessario dividere per 10 per convertire in grammi per decilitro
- Dosaggio dell'enzima antiossidante catalasi (CAT)19,20
- Utilizzare una micropiastra a 96 pozzetti. Aggiungere 20 μl di surnatante del campione nei pozzetti (in duplicato).
- Aggiungere 20 μL di catalasi fresca (200 μg/mL) nei pozzetti come standard (in duplicato). Aggiungere 100 μl di 50 mM PBS pH 7.8 al campione e ai pozzetti bianchi.
- Aggiungere 100 μL di 90 mM (30%) H2O2 nei pozzetti per avviare la reazione. Dopo aver aggiunto H2O2, leggere l'assorbanza ogni 15 s per 2,5 min a 240 nm.
- Calcola l'attività usando l'equazione:
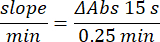
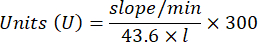
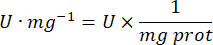
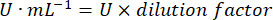
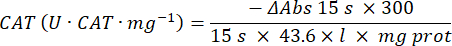
- Dosaggio dell'enzima glutatione perossidasi (GPx)21
- Utilizzare una micropiastra a 96 pozzetti.
- Miscelare 240 μl di soluzione 0,1 M GSH, 1 200 μl di soluzione 10 U/mL di GSH-Rd e 1 200 μl di 4 mM NADPH. Mantenere la soluzione in ghiaccio.
- Aggiungere nei pozzetti 100 μl di 50 mM TRIS/HCl 5 mM EDTA pH 7,6. Aggiungere 1 μL di campione surnatante in duplicato. Picchiettare la micropiastra e mescolare delicatamente.
- Aggiungere 50 μl della soluzione di miscelazione (passaggio 4.5.2) e mescolare delicatamente.
- Aggiungere 20 μl della soluzione di t-butilidroossido da 7 mM nei pozzetti per avviare la reazione (sono necessari circa 15 s per avviare la reazione in 16 campioni duplicati). Mescolare rapidamente la micropiastra.
- Monitorare l'assorbanza a intervalli di 1 minuto per 5 minuti a 25 °C a 340 nm.
- Calcola l'attività GPx con l'equazione:
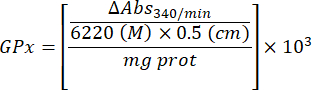
Dove
GPx = attività in millimolari al minuto per microgrammo di proteina
ΔAbs340/min= Assorbanza media in delta
103 = conversione da molare a millimolare
- mg prot = concentrazione proteica dalla determinazione di Bradford espressa in microgrammi per microlitro
- Quantificazione delle proteine mediante analisi di Bradford22
- Eseguire una curva standard da soluzioni di albumina sierica bovina (BSA), impostate dalla soluzione madre di 1 μg/μL come mostrato nella Tabella 2.
- Utilizzare una micropiastra a 96 pozzetti. Aggiungere 190 μl di reagente Bradford nel campione e nei pozzetti standard.
- Aggiungere 10 μL di BSA in pozzetti standard per duplicato. Aggiungere 10 μl di surnatante nei pozzetti del campione per duplicato.
- Mescolare delicatamente con il puntale della pipetta.
- Leggere l'assorbanza a 595 nm. Quantificare la concentrazione proteica con la curva standard.
Risultati
I risultati dello studio rivelano che i metalli pesanti, in particolare l'alluminio (Al), il ferro (Fe) e lo zinco (Zn), hanno un impatto dannoso sull'ambiente, come evidenziato dalla Figura 2. Il rilevamento di alti livelli di metalli pesanti nei campioni di tessuto e acqua raccolti da tutti i siti ha portato a un risultato sfavorevole. Sono stati rilevati valori anomali, con un fattore di bioaccumulo (BAF) di 600, in particolare nelle aree ad alta intensit...
Discussione
Sebbene l'uso di C. texanus sia ottimale per la valutazione, è necessario considerare diversi aspetti del suo uso e della sua raccolta. I siti di studio scelti si rivelano impegnativi, a causa di diversi fattori come condizioni meteorologiche sfavorevoli, inaccessibilità geografica, alti livelli di aridità o protocolli di sicurezza insufficienti in regioni selezionate. I vincoli e le limitazioni dichiarati possono spesso rappresentare una sfida quando si conduce il lavoro sul...
Divulgazioni
Gli autori non hanno rivelato conflitti di interesse presenti nel loro lavoro.
Riconoscimenti
Gli autori desiderano esprimere la loro sincera gratitudine a CONAHCyT per aver fornito la sovvenzione FONINS P 1931, che ha notevolmente facilitato i loro sforzi di ricerca. Ringraziano inoltre la Secretaría de Investigación y Posgrado dell'Instituto Politécnico Nacional per il prezioso sostegno fornito attraverso la sovvenzione del progetto SIP (20200577). Inoltre, il primo autore desidera riconoscere la generosa borsa di studio post-laurea assegnata da CONAHCyT, che ha permesso al team di condurre viaggi sul campo e raccogliere dati essenziali. Infine, gli autori desiderano esprimere il loro apprezzamento per la preziosa assistenza di María Teresa García Camacho in laboratorio, senza la quale questo progetto non sarebbe stato possibile.
Materiali
| Name | Company | Catalog Number | Comments |
| Analytical balance of 220 g | Ohaus | PR224/E | This balance is useful for weighing the extracted tissue from specimens. |
| Chest waders | LaCrosse | 700152M | We recommend using waders for sample collection. Alternatively, you can also use boots with rubber hip boots for sampling. |
| Cutting board | True | TRUE915121 | It is recommended to use white and plastic boards. |
| Forceps | DR Instruments | 112 | It is recommended to use a 12 pul forceps made of stainless steel. |
| Inductively Coupled Plasma-Optical Emission Spectroscopy System | Perkin Elmer | 7300 DV | A device for quantifying heavy metals using spectroscopy. |
| Kick net | LaMotte | 0021-P | An alternative method for making a kick net involves manually crafting one using a mesh with a thickness of 500 micrometers. |
| Liquid Nitrogen | NA | NA | NA |
| Liquid Nitrogen Dewar Static Cryogenic Container | BestEquip | DF0504 | It is recommended to use an aluminum tank with canisters. |
| Mortar and Pestle Set | Cole-Parmer | EW-63100-54 | This is a porcelain mortar and pestle used for grinding dry tissues. |
| Multiwave GO Plus | Anton Paar | C93IP001EN-E | Multiwave is a useful tool for digesting multiple samples. |
| Oven for drying | Fisher scientific | 506G | An incubator oven, also known as a dry tissue oven, is essential for drying tissues at temperatures of at least 80°C. |
| Precision scalpel | Xcelite by Weller | 037103-48768 | It is recommended to use a scalpel made of aluminum. |
| Tissue Homogenizer (tearer) | Kopro | K110000 | It is recommended to use a tissue tearer with a base. Some companies offer ultrasonic tearers, which may be the optimal choice. |
| Ultra-Low Temperature Chest Freezer | REVCO | CA89200-384 | Many companies provide freezers, but it is recommended to choose one with a storage temperature of at least -40°C. |
| Wide mouth plastic bottles | United Scientific | 81900 | Using polypropylene bottles with wide caps and mouths is strongly recommended. |
Riferimenti
- Rivera-Gasperín, S. L., Ardila-Camacho, A., Contreras-Ramos, A. Bionomics and ecological services of Megaloptera larvae (Dobsonflies, Fishflies, Alderflies). Insects. 10 (4), 86 (2019).
- Cover, M. R., Seo, J. H., Resh, V. H. Life history, burrowing behavior, and distribution of Neohermes filicornis (Megaloptera: Corydalidae), a long-lived aquatic insect in intermittent streams. Western North Ame. Nat. 75 (4), 474 (2016).
- Martins, C. C., Ardila-Camacho, A., Rivera-Gasperín, S. L., Oswald, J. D., Liu, X., Contreras-Ramos, A. A world checklist of extant and extinct species of Megaloptera (Insecta: Neuropterida). Euro J of Tax. 812 (1), 1-93 (2022).
- Knight, A. W., Siegfried, C. A. The distribution of Corydalus Cornutus (Linnaeus) and Nigronia Serricornis (Say) (Megaloptera: Corydalidae) in Michigan. The Great Lakes Entomol. 10 (2), 1 (2017).
- . Water quality of Quebrada Cuecha: effects of the effluent from the Monteverde cheese factory Available from: https://digitalcommons.usf.edu/cgi/viewcontent.cgi?article=1662&context=tropical_ecology (2018)
- Cao, C. -. Q., Liu, Z., Chen, S. -. Z., Tong, C. The swimming behavior of the aquatic larva of Neoneuromus ignobilis (Megaloptera: Corydalidae: Corydalinae). Acta Entomol Sin. 55 (1), 133-138 (2012).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E. Assessment of seasonal and spatial variations of biochemical markers in Corydalus sp. (Megaloptera: Corydalidae), a non-conventional biomonitor, in a mountain cloud forest in Mexico. Environ Sci Pollut Res Int. 27 (24), 30755-30766 (2020).
- Galindo-Pérez, E. J., et al. Cave macroinvertebrates as bioindicators of water quality. Water Sci Technol. 8 (5), 5-17 (2017).
- Dolin, P. S. The life history and ecology of Chauliodes Rastricornis Rambur and C. Pectinicornis. (Linnaeus)(Megaloptera: Corydalidae) in Greenbottom swamp, Cabell County, West Virginia. Marshall University. , (1980).
- Cover, M. R., Resh, V. H. Global diversity of dobsonflies, fishflies, and alderflies (Megaloptera; Insecta) and spongillaflies, nevrorthids, and osmylids (Neuroptera; Insecta) in freshwater. Hydrobiologia. 595 (1), 409-417 (2008).
- Barba-Álvarez, R., De la Lanza-Espino, G., Contreras-Ramos, A., González-Mora, I. Aquatic insects indicators of water quality in Mexico: case studies, Copalita, Zimatán and Coyula rivers, Oaxaca. Mexican Biodiversity Magazine. 84 (1), 381-383 (2013).
- Beyer, J., et al. Environmental risk assessment of combined effects in aquatic ecotoxicology: A discussion paper. Mar Env Res. 96, 81-91 (2014).
- Tišler, T., Zagorc-Končan, J. Comparative assessment of toxicity of phenol, formaldehyde, and industrial wastewater to aquatic organisms. Water Air Soil Pollut. 97, 315-322 (1997).
- Larramendy, M. Ecotoxicology and Genotoxicology: Non-traditional Aquatic Models. Royal Society of Chemistry. , (2017).
- Contreras-Ramos, A., Rosas, M. V. Biodiversity of Megaloptera and Raphidioptera in Mexico. Biodiversity Supplement of Mexico. 85, 257-263 (2014).
- Villamarín, C., Rieradevall, M., Paul, M. J., Barbour, M. T., Prat, N. A tool to assess the ecological condition of tropical high Andean streams in Ecuador and Peru: The IMEERA index. Ecol Indic. 29, 79-92 (2013).
- Uchiyama, M., Mihara, M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem. 86 (1), 271-278 (1978).
- Marklund, S., Marklund, G. Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem. 47 (3), 469-474 (1974).
- Aebi, H. Catalase. Methods Enzymol. 105, 121-126 (1984).
- Li, Y., Schellhorn, H. E. Rapid kinetic microassay for catalase activity. J Biomol Tech. 18 (4), 185-187 (2007).
- Kumar, P., Maurya, P. K. L-Cysteine efflux in erythrocytes as a function of human age: Correlation with reduced glutathione and total anti-oxidant potential. Rejuvenation Res. 16 (3), 179-184 (2013).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72 (1-2), 248-254 (1976).
- Barbour, M. T., Stribling, J. B., Verdonschot, P. F. M. The multihabitat approach of USEPA's rapid bioassessment protocols: benthic macroinvertebrates. Limnetica. 25 (3), 839-850 (2006).
- Allan, J. D. . Stream Ecology: Structure and Function of Running Waters. , (2007).
- Barbour, M. T., Gerritsen, J., Snyder, B. D., Stribling, J. B. Rapid Bioassessment Protocols for Use in Streams and Wadeable Rivers: Periphyton, Benthic Macroinvertebrates and Fish. United States Environmental Protection Agency. , (1999).
- Wright, J. F., Armitage, P. D., Furse, M. T., Moss, D. The classification of sites on British rivers using macroinvertebrates. SIL Proceed, 1922-2010. 22 (3), 1939-1943 (1984).
- Rico-Sánchez, A. E., Rodríguez-Romero, A. J., Sedeño-Díaz, J. E., López-López, E., Sundermann, A. Aquatic macroinvertebrate assemblages in rivers influenced by mining activities. Sci Rep. 12 (1), 3209 (2022).
- Ramírez, A., Pringle, C. M., Wantzen, K. M. . Tropical Stream Conservation. Tropical Stream Ecology. , (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon