Method Article
Acquisizione del segnale, interpretazione del punteggio ed economia di un test point-of-care non invasivo per la malattia coronarica
In questo articolo
Riepilogo
Viene presentata la metodologia per acquisire il segnale fisiologico per un test di Coronaropatia (CAD). Viene proposto un metodo per interpretare il punteggio CAD relativo alla positività e alla negatività del test, comprese le granularità di ciascuno. Gli aspetti economici del test sono discussi nel contesto dell'attuale standard di cura.
Abstract
Un test non invasivo point-of-care per la malattia coronarica (CAD) (POC-CAD) è stato precedentemente sviluppato e convalidato. Il test richiede l'acquisizione simultanea di segnali di gradiente di tensione ortogonale (OVG) e fotopletismogramma, che è la metodologia principale descritta in questo articolo. L'acquisizione dell'OVG, un segnale biopotenziale, richiede il posizionamento di elettrodi sulla pelle preparata del torace del paziente (disposti in modo simile alla configurazione dell'elettrocatetere Frank, comprendente sei elettrodi bipolari e un elettrodo di riferimento) e di un sensore emodinamico sul dito (utilizzando una modalità di trasmissione standard). Il segnale viene caricato su un sistema basato su cloud, in cui le caratteristiche ingegneristiche vengono estratte dal segnale e fornite a un algoritmo di apprendimento automatico per produrre il punteggio CAD. Il medico deve quindi interpretare il valore del punteggio CAD nel contesto della probabilità di CAD pre-test del paziente, con conseguente probabilità di CAD post-test. Questa interpretazione può essere eseguita a livello di positività e negatività del test o a un livello più fine di granularità; Le metodologie per ciascuno di essi sono qui proposte sulla base di rapporti di verosimiglianza. Utilizzando la probabilità post-test, il medico deve determinare il passo successivo appropriato nel trattamento del proprio paziente; Per illustrare questo processo vengono utilizzati diversi scenari. L'adozione dei test è fattibile solo se economicamente sostenibile; viene fornita una discussione sull'integrazione del test nel flusso diagnostico CAD e sui conseguenti risparmi sui costi per il sistema sanitario. Il modello economico dimostra che i risparmi sui costi per il sistema sanitario possono essere ottenuti prevenendo il ritardo nel trattamento che, se non affrontato, si traduce in una progressione della malattia che richiede cure più avanzate (e costose).
Introduzione
La cardiopatia ischemica (IHD) è attualmente la principale causa di morte a livello globale1. La malattia coronarica (CAD) è il precursore anatomico della IHD, caratterizzata dalla presenza di lesioni significative all'interno delle arterie coronarie. La significatività può essere definita anatomicamente da un'occlusione di almeno il 70% o del 50% nell'arteria principale sinistra2. La significatività può anche essere definita in base all'impatto funzionale della lesione, misurandone l'effetto sul flusso sanguigno. In particolare, la riserva di flusso frazionario (FFR) e la riserva di flusso istantaneo (iFR) valutano la variazione di flusso causata dalla lesione e le lesioni sono definite come significative a FFR < 0,80 o iFR < 0,892. Il gold standard per confermare la presenza di CAD significativa è l'angiografia coronarica invasiva (ICA) mediante cateterismo cardiaco sinistro (LHC). Una CAD significativa giustifica la rivascolarizzazione attraverso il posizionamento di uno stent o di un innesto di bypass coronarico, che allevia l'ischemia miocardica e i corrispondenti sintomi anginosi e stabilizza la placca (nel caso di stenting).
Gli attuali test non invasivi per la CAD richiedono spesso l'esposizione alle radiazioni, lo stress e l'iniezione di mezzo di contrasto (con impatti renali)1. I test diagnostici più comunemente utilizzati sono l'imaging di perfusione miocardica (MPI), noto anche come tomografia computerizzata a emissione di fotoni singoli (SPECT), e l'angiografia tomografica computerizzata coronarica (CCTA). La SPECT prevede l'iniezione di un radioisotopo per monitorare la perfusione durante il riposo e lo stress (esercizio fisico o farmacologico). Il CCTA visualizza le arterie coronarie utilizzando più raggi X. La tomografia a emissione di positroni (PET) e la risonanza magnetica cardiaca (CMR) sono occasionalmente utilizzate per i test CAD1. Tutte queste modalità richiedono un notevole investimento di capitale in attrezzature, personale addestrato per eseguire i test e, in alcuni casi, la disponibilità di isotopi medici. A causa di questi requisiti, queste modalità spesso non sono ampiamente disponibili, soprattutto in contesti rurali, il che introduce ritardi nella cura dei pazienti e aggrava i rischi associati.
Pertanto, l'obiettivo era quello di progettare un test point-of-care non invasivo per CAD (POC-CAD): il sistema CorVista3. Questo sistema è un test approvato dalla FDA per CAD funzionalmente significativi, con prestazioni paragonabili a CCTA4. Il test può essere utilizzato senza stress da parte del paziente e senza la necessità di investimenti di capitale in attrezzature o personale specializzato. È ideale per l'uso in ambienti rurali e con risorse limitate, dove l'accesso alle attuali tecnologie di imaging spesso non è disponibile.
Lo sviluppo3 e la validazione4 di POC-CAD sono stati pubblicati in precedenza. In breve, POC-CAD inizia con l'acquisizione simultanea di segnali di gradiente di tensione ortogonale e fotopletismogramma utilizzando il dispositivo di acquisizione, come descritto nella fase 1 del protocollo. Il gradiente di tensione ortogonale è un segnale biopotenziale acquisito utilizzando un posizionamento dell'elettrocatetere simile alla configurazione dell'elettrocatetere di Frank5, comprendente sei elettrodi bipolari e un elettrodo di riferimento attaccato al tronco. Il fotopletismogramma si ottiene utilizzando la modalità di trasmissione standard, in cui la luce rossa e infrarossa viene trasmessa attraverso la punta del dito e colpisce un sensore6. Una volta acquisito, il segnale viene caricato automaticamente sul sistema basato su cloud, dove le caratteristiche ingegneristiche vengono estratte dal segnale e fornite a un algoritmo di apprendimento automatico per produrre il punteggio CAD, che viene presentato nel portale web. Nelle fasi 2 e 3 del protocollo, viene descritta la metodologia per interpretare il punteggio CAD restituito dal test. In particolare, i dati pubblicati o altre fonti rilevanti per il medico possono essere utilizzati per stimare la probabilità di CAD prima che il paziente si sottoponga al test. I rapporti di verosimiglianza possono essere calcolati dalle prestazioni del test e utilizzati per aggiornare la probabilità di CAD da pre-test a post-test, utilizzando il risultato del test binario (passaggio 2) o valori più granulari del punteggio CAD (passaggio 3). Infine, viene discussa la modellazione dell'economia del POC-CAD rispetto all'attuale standard di cura.
Protocollo
Lo studio è stato approvato dal Western Institutional Review Board e condotto in conformità con la Dichiarazione di Helsinki. Il consenso informato scritto è stato ottenuto da tutti i soggetti per la partecipazione. In breve, per essere inclusi, i soggetti devono avere almeno 18 anni di età con sintomi cardiovascolari ma senza malattia coronarica nota e programmati per sottoporsi a ICA o CCTA. I criteri di esclusione includevano, tra gli altri, una precedente storia documentata di infarto del miocardio, un precedente innesto di bypass coronarico e una precedente sostituzione della valvola cardiaca. I criteri completi di inclusione ed esclusione dello studio sono disponibili su clinicaltrials.gov, sotto il National Clinical Trial (NCT) numero NCT03864081. Le attrezzature e i software utilizzati sono elencati nella Tabella dei Materiali.
1. Acquisizione del segnale
- Preparare la pelle radendo i peli dal sito dell'elettrodo. Assicurarsi che non vi siano residui sulla pelle pulendo con acqua e sapone e utilizzando una garza pulita e asciutta o una salvietta analcolica, se necessario.
- Collegare gli elettrodi agli elettrodi e posizionarli secondo la Tabella 1.
NOTA: La qualità dell'elettrodo può influire sulla qualità del segnale; Si consiglia di utilizzare elettrodi di qualità diagnostica o ad alte prestazioni. - Posizionare il sensore emodinamico (fotopletismogramma, PPG) sul dito del soggetto, assicurandosi che il dito sia il più lontano possibile nel sensore, con il cavo del sensore posizionato lungo la parte superiore della mano.
- Utilizzare il dito indice a meno che una ferita o un altro motivo clinicamente rilevante non ne precluda l'uso. Consigliare al paziente di non spostare il sensore una volta posizionato.
- Posizionare il paziente sulla schiena in una comoda posizione di riposo. Assicurarsi che il cavo del sensore PPG e i cavi dell'elettrodo non si sovrappongano.
- Se necessario, utilizzare un'imbottitura (ad es. una coperta arrotolata o un asciugamano, insieme a un cuscino) per evitare che il paziente eserciti una pressione diretta sull'elettrodo blu sulla schiena.
- Per limitare il rumore del segnale e massimizzare la qualità del segnale, per quanto possibile, spegnere tutti i dispositivi elettronici (monitor, televisori, telefoni cellulari, ecc.) o rimuoverli dalla stanza. Spegni l'illuminazione della stanza.
- Inserisci le informazioni sul paziente e conferma la correttezza: nome del paziente, cognome del paziente, sesso alla nascita, altezza in pollici, peso in libbre, data di nascita e numero di cartella clinica (tutti obbligatori, possono essere inseriti in qualsiasi ordine).
- Assicurarsi che il paziente sia a proprio agio e ricordargli di stare fermo e silenzioso (ad esempio, non parlare durante l'acquisizione).
- Posizionare il dispositivo su una superficie piana e confermare il posizionamento nell'applicazione. Premere Start per avviare l'acquisizione del segnale.
- Monitorare il dispositivo per eventuali messaggi di errore e, se vengono visualizzati, seguire le istruzioni sullo schermo per risolverli.
- Al termine dell'acquisizione del segnale, che richiede 3 minuti e 35 secondi, il dispositivo trasmetterà automaticamente i dati al cloud per la valutazione della qualità del segnale. Tenere il paziente attaccato al dispositivo fino alla ricezione della conferma della qualità del segnale di passaggio.
- Staccare gli elettrodi dal paziente e rimuovere il sensore PPG.
- Accedi al portale per visualizzare i risultati del test (sarà disponibile circa 10 minuti dopo che il segnale è stato caricato sul cloud).
Tabella 1: Posizionamento dell'elettrocatetere. Descrizione delle posizioni anatomiche in cui ciascuno dei sette elettrodi deve essere posizionato. Clicca qui per scaricare questa tabella.
2. Interpretazione dei risultati del test dati positivi al test rispetto a . test negativo
- Determinare la probabilità di malattia pre-test del paziente (ad esempio, utilizzando le linee guida7 della Società Europea di Cardiologia (ESC)).
- Determinare se il test del paziente è positivo o negativo confrontando il punteggio CAD con 0: se maggiore o uguale a zero, il risultato del paziente è positivo al test, o se inferiore a zero, il risultato è negativo.
- Leggi il valore del punteggio CAD dal report e confrontalo con le distribuzioni di pazienti negativi e positivi nella coorte di convalida mostrata in fondo al report.
- Calcola la sensibilità e la specificità8, quindi i rapporti di verosimiglianza (LR) utilizzando l'equazione 1 e l'equazione 29.
NOTA: Viene mostrato un esempio pratico, dato che la sensibilità del test è dell'88% (calcolata utilizzando soggetti positivi da ICA, che è l'unico gruppo di soggetti con malattia) e la specificità è del 51% (calcolata utilizzando soggetti negativi da CCTA con un peso del 94% e soggetti negativi da ICA con un peso del 6%, per rappresentare la popolazione complessiva tramite lo studio PROMISE10).
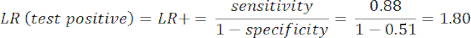 (eqn 1)
(eqn 1)
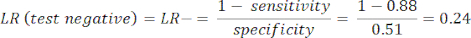 (EQN 2)
(EQN 2) - Calcolare la probabilità post-test del paziente date le seguenti equazioni 3-511, dove LR+ è usato in caso di test positivo e LR- è usato in caso di test negativo:
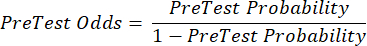 (eqn 3)
(eqn 3)
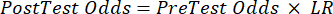 (eqn 4)
(eqn 4)
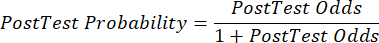 (EQN 5)
(EQN 5) - Con la probabilità aggiornata di CAD, dati i risultati del test, determinare il passo successivo appropriato nella cura del paziente (ad esempio, utilizzando le raccomandazioni della linea guida ESC7 mostrate nella Tabella 2).
Tabella 2: Linee guida ESC per probabilità di CAD. Per quattro livelli di probabilità di CAD, le linee guida della Società Europea di Cardiologia sono per l'interpretazione appropriata di tale probabilità, incluso il test successivo (se necessario). Clicca qui per scaricare questa tabella.
3. Interpretazione dei risultati dei test forniti con una granularità più fine
- Aumentare la granularità dei risultati positivi e negativi del test considerando gli intervalli del punteggio CAD osservati nella popolazione utilizzata per convalidare il test, in particolare la divisione in terzili (numero uguale di soggetti in tre contenitori) negli intervalli positivi e negativi al test, come mostrato nella Tabella 3.
NOTA: Per semplificare i calcoli, è escluso da questa analisi il contributo del 6% dei soggetti negativi al cateterismo, la cui inclusione non modificherà significativamente i risultati. - All'interno di ciascun terzile nell'intervallo dei test negativi, calcola il numero di Veri Negativi (TN), che sono soggetti che realmente non hanno la malattia, e il numero di Falsi Negativi (FN), soggetti che hanno veramente la malattia.
- Applicare le seguenti equazioni 6-811 per determinare il LR- di ciascun terzile negativo al test (LR+ da terzili negativi non rilevante).
NOTA: Le equazioni presuppongono che il profilo di prestazione del terzile rappresenti l'intero intervallo negativo del test per calcolare le statistiche di prestazione (che richiede il fattore di correzione di tre, corrispondente al numero di terzili, per raggiungere la frequenza di negatività del test originale rispetto alla positività del test).
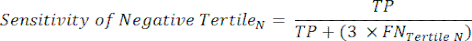 (eqn 6)
(eqn 6)
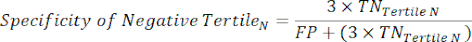 (eqn 7)
(eqn 7)
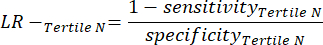 (eqn 8)
(eqn 8)
- Applicare le seguenti equazioni 6-811 per determinare il LR- di ciascun terzile negativo al test (LR+ da terzili negativi non rilevante).
- All'interno di ciascun terzile nell'intervallo di positività al test, calcola il numero di veri positivi (TP), che sono soggetti che hanno veramente la malattia, e il numero di falsi positivi (FP), soggetti che non hanno veramente la malattia.
- Applicare le equazioni 9-11 per determinare il LR+ di ciascun terzile positivo al test (LR- da terzili positivi non rilevante)11.
NOTA: Le equazioni presuppongono che il profilo delle prestazioni del terzile rappresenti l'intero intervallo di positività al test ai fini del calcolo delle statistiche sulle prestazioni (che richiede il fattore di correzione di tre, corrispondente al numero di terzili, per raggiungere la frequenza di positività del test originale rispetto alla negatività del test).
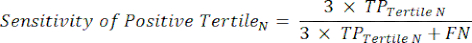 (Eqn 9)
(Eqn 9)
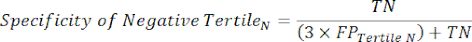 (EQN 10)
(EQN 10)
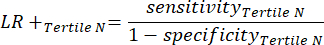 (eqn 11)
(eqn 11)
- Applicare le equazioni 9-11 per determinare il LR+ di ciascun terzile positivo al test (LR- da terzili positivi non rilevante)11.
- Determinare entro quale terzile si trova il punteggio CAD del paziente e, dati i LR nella Tabella 3, calcolare la probabilità post-test data la procedura mostrata nel passaggio 2.
NOTA: Come ci si può aspettare, i valori LR- diminuiscono con punteggi CAD più negativi e i valori LR+ aumentano con punteggi CAD più positivi, il che significa che un punteggio CAD più negativo riduce più efficacemente la probabilità pre-test e un punteggio CAD più positivo aumenta più efficacemente la probabilità pre-test. - In alternativa all'esecuzione dei calcoli elencati nei passaggi 2.4-3.4, utilizzare la Tabella 4 per tradurre la probabilità pre-test in una probabilità post-test utilizzando il punteggio CAD7 del paziente.
Tabella 3: Indici di verosimiglianza. Per tre intervalli di punteggi all'interno del test positivo e del test negativo, i corrispondenti rapporti di verosimiglianza positivi e negativi, rispettivamente. Clicca qui per scaricare questa tabella.
Tabella 4: Mappatura delle probabilità pre-test e post-test. Per 10 livelli di probabilità pre-test, la corrispondente probabilità post-test ha dato un punteggio CAD in ciascuno dei tre terzili negativi e in ciascuno dei terzili positivi. La colorazione verde corrisponde al <15% di probabilità di malattia (le linee guida ESC affermano che la CAD può essere esclusa); la colorazione gialla corrisponde al 15%-65% di probabilità di malattia (le linee guida ESC affermano che è preferibile un test non invasivo basato sull'imaging); l'arancione corrisponde al 66%-85% di probabilità di malattia (le linee guida ESC affermano che dovrebbero essere eseguiti test non invasivi basati sull'imaging); il rosso corrisponde al >85% di probabilità di malattia (le linee guida ESC affermano che la CAD può essere esclusa). Vedere la Tabella 2 per ulteriori informazioni sulle linee guida. Si noti che un punteggio CAD pari a 0 è considerato positivo al test. Clicca qui per scaricare questa tabella.
Risultati
Un segnale di esempio può essere visto nella Figura 1 e riportato nella Figura 2, come apparirebbe a un medico che utilizza il test. Di seguito sono riportati diversi casi di pazienti forniti per dimostrare l'applicazione della metodologia nell'interpretazione del significato del punteggio CAD.
Caso 1
Un uomo di 67 anni si è presentato lamentando sintomi di dolore toracico a riposo, con dolore al braccio irradiato, insieme a diaforesi e nausea. Sulla base delle linee guida ESC7, la sua età, il sesso e i sintomi sono coerenti con una probabilità iniziale di malattia dell'84%. Le linee guida ESC suggeriscono che un tale paziente richiede test non invasivi per formulare una diagnosi di CAD per giustificare il rinvio al cateterismo cardiaco e qualsiasi intervento necessario (Tabella 2). È stato eseguito il POC-CAD, restituendo un punteggio CAD di 0,32, che è un risultato positivo al test e rientra nel terzile più alto dei punteggi CAD positivi, con un LR+ di 2,888 (Tabella 3). Pertanto, la probabilità post-test del paziente è del 94% e, secondo le linee guida ESC (Tabella 2), si può tranquillamente presumere che il paziente sia affetto da CAD e il cateterismo cardiaco invasivo è una linea d'azione appropriata.
Caso 2
Una donna di 39 anni si presenta con dolore toracico a riposo, che si irradia sia al lato sinistro che a quello destro. Sulla base delle linee guida ESC7, l'età, il sesso e i sintomi sono coerenti con una probabilità iniziale di malattia del 28% e le linee guida suggeriscono che un test non invasivo sarebbe il passo successivo preferibile per ottenere una maggiore comprensione della probabilità di CAD. Tuttavia, le linee guida affermano anche che nei pazienti giovani (come questa donna di 39 anni), il medico dovrebbe essere consapevole dell'esposizione alle radiazioni, che è necessaria per somministrare un test come la SPECT, che richiede un radioisotopo iniettato. Un'altra opzione per un tale test è il CCTA, ma ciò richiede molte radiografie. Pertanto, il POC-CAD è una scelta logica, in quanto non richiede radiazioni. Il test è stato eseguito, restituendo un valore di -0,12, entro i limiti del primo terzile dell'intervallo negativo, con un LR- di 0,129 (Tabella 3). La probabilità post-test risultante è del 4%, che scende al livello in cui la CAD può essere tranquillamente esclusa secondo le linee guida ESC, senza che siano necessari ulteriori test per la CAD.
Caso 3
Una donna di 74 anni si presenta con dolore toracico non anginoso e dispnea. Sulla base delle linee guida ESC7, l'età, il sesso e i sintomi sono coerenti con una probabilità iniziale di malattia del 24% e le linee guida suggeriscono che un test non invasivo sarebbe il passo successivo preferibile per ottenere una maggiore comprensione della probabilità di CAD. La paziente è riluttante a spostarsi dalla clinica rurale in cui è in cura al grande centro urbano dove sono disponibili tutte le modalità di test (PET, SPECT, CCTA, CMR), quindi il medico offre POC-CAD. Il punteggio CAD è 0,07, che rientra nel primo terzile dell'intervallo positivo con un LR+ di 1,446, con una probabilità post-test del 33%. Sulla base del risultato positivo e dell'aumento della probabilità di malattia, il paziente accetta di recarsi in città per una scansione PET. Anche la PET era indicativa di malattia, con un LR+ di 6,0412, e aumenta dal 33% al 75% dopo la PET.
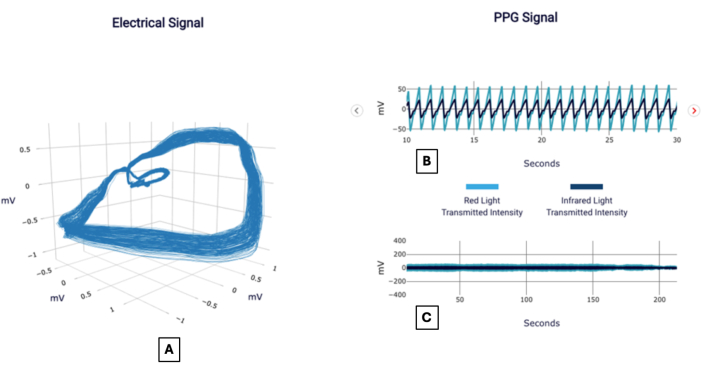
Figura 1: Segnali di esempio. Esempio di rapporto POC-CAD che mostra le visualizzazioni del gradiente di tensione ortogonale, noto anche come segnale elettrico (A), e del segnale del fotopletismogramma focalizzato su un intervallo di 20 s (B) e una durata completa (C). Clicca qui per visualizzare una versione più grande di questa figura.
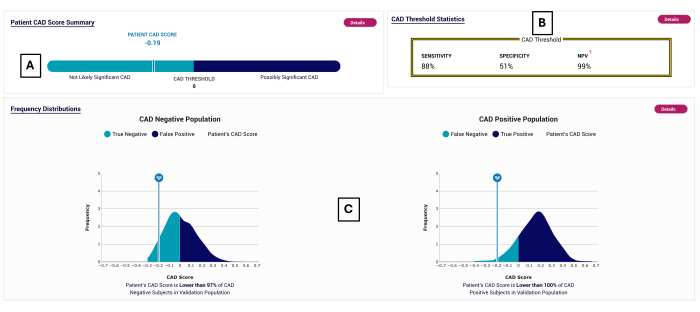
Figura 2: Esempio di report CAD. Rapporto POC-CAD esemplare, che mostra un punteggio CAD di -0,19 (A), che rientra nell'intervallo negativo del test (<0). Le prestazioni del test sono mostrate in (B). La distribuzione dei punteggi CAD viene visualizzata per i soggetti su cui è stato convalidato il POC-CAD in (C). Clicca qui per visualizzare una versione più grande di questa figura.
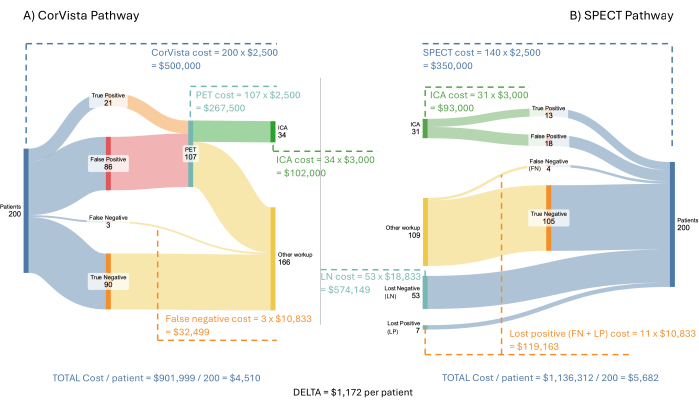
Figura 3: Flusso del modello economico dei costi. Un'ipotetica popolazione in arrivo di 200 pazienti viene analizzata attraverso la via POC-CAD>PET (A) e la via SPECT (B). I costi per il sistema sanitario sono mostrati per ogni ramo di ciascun percorso, insieme al risparmio medio per paziente quando viene implementato il percorso POC-CAD>PET. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'obiettivo principale di questa sezione è l'economia del test; tuttavia, è utile discutere prima gli aspetti della valutazione della probabilità pre-test per la CAD. Come descritto nelle fasi 2 e 3 del protocollo, la stima della probabilità di CAD pre-test è un passaggio fondamentale per contestualizzare il punteggio CAD e determinare la probabilità di CAD post-test. Abbiamo utilizzato le linee guida ESC 2013, che basano la probabilità di CAD su tre caratteristiche: sesso, età e sintomi (all'interno di gruppi di angina tipica, dolore atipico e non anginoso)7. Tuttavia, è importante notare che il medico può applicare il proprio giudizio clinico nella selezione di qualsiasi metodo quantitativo o qualitativo. Inoltre, sono disponibili altri metodi quantitativi pubblicati per tale stima, tra cui il Diamond-Forrester13, che richiede le stesse caratteristiche di input dell'ESC 2013. Sono state pubblicate anche variazioni più complete, come ad esempio che estende14 Diamond-Forrester con lo stato di estrogeni per le femmine (per compensare la variazione di età in menopausa, così come qualsiasi isterectomia), così come il diabete, l'ipertensione, l'iperlipidemia, il fumo, la storia familiare di malattia coronarica e l'obesità. Tuttavia, tieni presente che alcune metodologie possono definire la CAD al 50% di restringimento luminale, mentre il 70% rappresenta le attuali linee guida ACC (escludendo l'arteria principale sinistra al 50%).
L'economia del POC-CAD e il modo in cui il test interagisce con il percorso di cura rappresentano caratteristiche cruciali nel determinare se il test è veramente adatto all'uso clinico. Per la diagnosi di CAD, il test più utilizzato è l'MPI, spesso noto come test da sforzo nucleare o SPECT. A partire dal 2019, l'MPI è stato utilizzato in circa l'85% delle valutazioni per CAD15. Si stima che ogni anno negli Stati Uniti vengano eseguiti 7-8 milioni di studi SPECT-MPI16. In circa il 5% dei casi di pazienti, la CCTA viene utilizzata per diagnosticare la CAD. La CCTA è stata riconosciuta per le sue prestazioni diagnostiche superiori nell'escludere una significativa CAD. Altre due modalità di imaging, PET e risonanza magnetica cardiaca, costituiscono la maggior parte delle valutazioni rimanenti. Per tutti questi test, sono necessari una telecamera e un team qualificato per eseguire e interpretare il test. Tali fotocamere sono costosi pezzi di beni strumentali. Di conseguenza, la disponibilità di questi test è spesso limitata alle strutture sanitarie urbane, dove il volume è sufficiente a giustificare sia la spesa iniziale che i costi operativi.
Nel 2021, l'American College of Cardiology (ACC) ha pubblicato le sue linee guida per i pazienti senza CAD nota o test precedenti e con rischio intermedio di CAD 2,17, dove sia MPI che CCTA sono stati riconosciuti come opzioni diagnostiche di prima linea. A differenza di CCTA e MPI, POC-CAD può essere utilizzato in qualsiasi ambiente point-of-care, come uno studio medico, un ospedale ad accesso critico, un centro di assistenza tribale e centri di assistenza terziaria, piuttosto che essere limitato, come CCTA e MPI, solo a quei centri con costose apparecchiature di imaging e ai team necessari per gestirli.
In genere, i pazienti che sono sospettati di CAD a seguito di un test di prima linea saranno indirizzati per ICA; come descritto, questo è considerato il gold standard diagnostico per la CAD. L'ICA è una procedura invasiva intrapresa in un ambiente ospedaliero ambulatoriale da specialisti in cardiologia invasiva.
Un recente studio sul tasso di presenza agli appuntamenti per gli esami radiologici presso un grande centro accademico terziario ha mostrato che il 24% degli appuntamenti programmati non è stato frequentato dal paziente a causa della cancellazione o della mancata presentazione18. Le modalità radiologiche studiate includevano la diagnostica CAD. La cifra riportata in quello studio si allinea con una discussione con l'ufficiale finanziario di un sistema sanitario, che ipotizza un tasso di mancata presentazione del 20%. Inoltre, in molteplici discussioni con i medici rurali, dove potrebbe essere necessario un tempo di viaggio significativo per raggiungere il test, fino al 50% dei pazienti potrebbe non procedere sia a fissare un appuntamento che a partecipare all'appuntamento. Nel modello seguente, prudentemente per il mercato rurale, si presume che questo sia il 30% (cioè il 70% si presenta all'appuntamento).
C'è un impatto diretto sulla resa diagnostica dei test a valle in cui un numero significativo di pazienti non procede al test raccomandato. Supponendo che il tasso sia coerente tra gli individui con e senza malattia coronarica significativa, la sensibilità di rilevamento della condizione nella popolazione di riferimento sarebbe del 70% della sensibilità attesa. Nel caso della SPECT, che ha una sensibilità riportata per il rilevamento di CAD funzionalmente significativa del 73%, la sensibilità effettiva è solo del 53% (= 0,7 x 73%)12, ovvero quasi la metà di quei pazienti nella popolazione di riferimento con CAD funzionalmente significativa verrebbe persa. Questi pazienti mancati non costano zero al sistema sanitario. I pazienti positivi con CAD funzionalmente significativa saranno probabilmente visitati più tardi e incorreranno in costi aggiuntivi significativi a causa della progressione della loro malattia. Ad esempio, se il paziente si presenta successivamente al pronto soccorso, il costo medio della visita per un paziente con segni di sindrome coronarica acuta è stato calcolato in $ 30.00019.
Inoltre, anche per quei pazienti senza CAD significativa, se non seguono il rinvio del loro medico per l'imaging, è meno probabile che tornino da quel medico e, quindi, c'è un'opportunità limitata per determinare cos'altro potrebbe causare i loro sintomi. Questo può anche essere costoso sia per il paziente, in termini di progressione della condizione di base, sia per il sistema sanitario. Ad esempio, è stato dimostrato che un ritardo nella diagnosi di insufficienza cardiaca aggiunge un incremento di $ 8.000 all'anno al costo del trattamento di quel paziente20.
Il modello economico dei costi qui presentato mira a catturare questi impatti, confrontando lo scenario in cui il POC-CAD viene utilizzato come test di prima linea per CAD significativo con uno scenario in cui viene utilizzata la SPECT. Poiché il POC-CAD è un test di esclusione, ci si aspetta un numero maggiore di risultati falsi positivi rispetto alla SPECT. È irragionevole aspettarsi che tutti i positivi del test procedano all'ICA. In molti casi, l'ideale sarebbe utilizzare un secondo test. Quando si analizzano le prestazioni di rule-in e rule-out di vari test non invasivi per CAD funzionalmente significativi, Knuuti et al. raccomandano di seguire il CCTA con un test funzionale, come SPECT12. Tuttavia, anche in questo caso si corre il rischio di non riuscire a identificare una percentuale relativamente elevata di pazienti positivi. Un test funzionale migliore sarebbe la PET cardiaca, che ha una sensibilità dell'89% e una specificità dell'85%12. La PET cardiaca è sempre più utilizzata negli Stati Uniti, è attualmente più spesso prescritta dai cardiologi ed è già utilizzata più spesso della CCTA15,21. In questo modello, si presume che i positivi della PET procedano all'ICA. Poiché la sensibilità della PET è simile a quella del POC-CAD, si presume che tutti i positivi nella popolazione PET in arrivo siano correttamente classificati come positivi dalla PET. Nel modello in cui la SPECT viene utilizzata come test di prima linea, si presume che i positivi procedano all'ICA. Supponendo una prevalenza in entrata del 12%, ciò si traduce in una resa positiva all'ICA del 41%, che è vicina a quella osservata nello studio PROMISE10.
La Figura 3 illustra il modello e i risultati utilizzando un'ipotetica popolazione in arrivo di 200 pazienti con sintomi di malattia cardiovascolare. Si presume che SPECT, PET e POC-CAD siano rimborsati alla stessa tariffa: $ 2.500 per test. Si presume che l'ICA venga rimborsato a $ 3.000. Il costo di qualsiasi trattamento durante l'ICA, o successivamente, non è incluso nel modello in quanto va oltre il percorso diagnostico che il modello rappresenta. I costi dei pazienti negativi e positivi persi sono più difficili da stimare. Dato che questi pazienti sono definiti come non aver seguito le indicazioni del proprio medico per procedere con un test di imaging, si presume che la loro prossima interazione con il sistema sanitario sia quella di presentarsi al pronto soccorso con sintomi di malattia cardiovascolare. In uno studio sulle presentazioni al pronto soccorso con tali sintomi, Pope et al. hanno determinato che il 17% soddisfaceva i criteri per l'ischemia cardiaca acuta, il 6% aveva angina stabile, il 21% aveva problemi cardiaci non ischemici e il 56% aveva problemi non cardiaci22. I costi per la presentazione iniziale al pronto soccorso sono stati calcolati da O'Sullivan et al. in $ 34.200 per ischemia miocardica non fatale e $ 17.300 per angina senza rivascolarizzazione coronarica23. L'utilizzo esclusivo dei costi della presentazione iniziale è un approccio conservativo in quanto i costi della fase acuta (3 anni) sostenuti per l'evento sono sostanzialmente più elevati, rispettivamente a $ 73.300 e $ 36.000. Il costo di una visita al pronto soccorso per il 53% delle visite per il dolore toracico, ma senza l'identificazione di alcun problema cardiaco risultante, è stato stimato in $ 2.988 utilizzando le informazioni riportate da United Healthcare24. Infine, per il 21% con un problema cardiaco non ischemico, il costo è stato stimato in $ 2.988, più un costo incrementale causato dal ritardo nel trattamento della condizione cardiaca. Come detto sopra, per un paziente con insufficienza cardiaca, il costo annuale incrementale della diagnosi ritardata è stato calcolato in $ 8.00020. Pertanto, si è ipotizzato che il costo per il 21% sia di $ 10.988, supponendo che la maggior parte di questi pazienti avrà insufficienza cardiaca o ipertensione polmonare e un costo di trattamento ritardato simile per entrambi. Ancora una volta, l'utilizzo di un solo anno di costo incrementale è un approccio conservativo in quanto ciò si applicherebbe di fatto a ciascun anno successivo. Complessivamente, la media ponderata di questi costi, come utilizzato nel modello, è di $ 10.833.
Il modello economico dei costi dimostra un potenziale risparmio medio di 1.172 dollari per paziente per il sistema sanitario dovuto, in sintesi, al costo del trattamento ritardato con conseguente progressione della malattia che richiede cure più avanzate. Inoltre, l'adozione di questo percorso aumenterebbe la resa all'ICA al 62%, rispetto al 41% attualmente osservato e modellato nel percorso SPECT.
Se estrapolato alla popolazione rurale in arrivo di 2,25 milioni di pazienti che presentano ogni anno sintomi di malattie cardiovascolari negli Stati Uniti, il risparmio potenziale totale derivante dall'implementazione del POC-CAD come test di prima linea per la CAD significativa sarebbe di circa 2,64 miliardi di dollari. Come discusso in precedenza, gran parte di questi risparmi deriva dal fatto di non perdere pazienti con CAD funzionalmente significativa a causa di una maggiore sensibilità e di una maggiore resa diagnostica rispetto alla SPECT. Inoltre, la resa più elevata che potrebbe essere raggiunta presso l'ICA è un vantaggio cruciale in quanto verrebbero eseguite più ICA sotto il percorso POC-CAD>PET rispetto al percorso SPECT. Un rendimento più elevato all'ICA sarebbe vantaggioso per i pazienti, che sono spesso attualmente frustrati dai risultati negativi dell'ICA25, per il cardiologo interventista e per il sistema sanitario.
Una possibile obiezione a questo modello è che tutti dovrebbero essere indirizzati direttamente alla PET piuttosto che utilizzare prima il test POC-CAD. Questo approccio, soprattutto se si considera la popolazione rurale, potrebbe essere irto dello stesso problema che si osserva attualmente con tutti i test di imaging: quello della perdita al follow-up. Se si mantenessero le stesse ipotesi per il modello, la resa effettiva della PET avrebbe una sensibilità di appena il 62% (= 0,7 x 89%), mancando così ancora molti dei pazienti veramente positivi in questa popolazione. Al contrario, si osserva che avere un test positivo da POC-CAD può incoraggiare i pazienti a seguire il loro rinvio per i test diagnostici successivi (come l'ICA) e, quindi, non ci si aspetta che questo sia un problema nel percorso POC-CAD>PET. Si potrebbe anche sostenere che la SPECT è la via predominante e, quindi, è più probabile che sia il test utilizzato nella pratica dopo la POC-CAD. In questo caso, il risparmio del percorso POC-CAD>SPECT risultante sarebbe leggermente superiore a quelli mostrati sopra, ma la resa efficace all'ICA sarebbe leggermente inferiore (58%) in quanto ci sarebbero altri tre pazienti positivi mancati (falsi negativi) su duecento nel flusso.
In conclusione, il POC-CAD fornisce un'aggiunta promettente al percorso diagnostico. Il vantaggio principale di questo test è che può essere utilizzato presso il punto di cura, senza l'uso di radiazioni, stress o contrasto, e tuttavia fornisce risultati paragonabili a quelli del CCTA per escludere CAD26 funzionalmente significativo. Inoltre, i risultati sono disponibili all'interno della stessa visita, consentendo al medico di discutere i passaggi successivi nella cura con il paziente senza programmare un'altra visita. Poiché il test può essere somministrato presso il punto di cura e i risultati sono rapidamente disponibili, il POC-CAD affronta il problema significativo della perdita di follow-up osservata, soprattutto nelle aree rurali, che rappresentano circa un quarto della popolazione statunitense. Dato il robusto profilo di esclusione del test, con un risultato negativo, il medico può esplorare rapidamente altre spiegazioni dei sintomi del paziente. Quando vengono modellati i costi del conseguente ritardo nella diagnosi del paziente, l'uso del POC-CAD come test di prima linea fornirebbe vantaggi significativi ai pazienti, ai medici e al pagatore. Inoltre, le modalità di imaging esistenti non vedrebbero né un aumento né una diminuzione significativa del volume, il che è una preoccupazione per molti centri di imaging. I risparmi sui costi si realizzano attraverso una diagnosi e un trattamento più tempestivi della condizione del paziente.
Divulgazioni
T.B., N.N., F.F., H.G., C.B., S.R. e I.S. sono dipendenti di Analytics for Life.
Le metodologie relative all'interpretazione del punteggio CAD di CorVista rappresentano ipotesi attuali basate su un sottoinsieme della popolazione convalidata e richiedono un'ulteriore convalida. Fare riferimento alle istruzioni per l'uso del prodotto.
Riconoscimenti
Gli autori desiderano ringraziare Cody Wackerman e Hugh Dubberly di Dubberly Design Office (San Francisco) per il loro aiuto nella visualizzazione dei percorsi mostrati nella Figura 3.
Materiali
| Name | Company | Catalog Number | Comments |
| CorVista CAD | CorVista | n/a | System comprising signal acquisition, cloud processing, and delivery of a report containing the CAD Score via a web portal |
| Electrodes | Various (see comments) | Diagnostic quality or high performance electrodes are recommended. For example: Conmed ClearTrace 1700-007 Skintact FS-TB1 Vermed A10005 |
Riferimenti
- World Health Organization. The top 10 causes of death [Internet]. 2020 [cited 2024 Jun 27]. , Available from: https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death (2020).
- Lawton, J. S., et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 79 (2), e21-e129 (2022).
- Burton, T., et al. Development of a non-invasive machine-learned point-of-care rule-out test for coronary artery disease. Diagnostics. 14 (7), 719(2024).
- Stuckey, T. D., et al. Clinical validation of a machine-learned, point-of-care system to IDENTIFY functionally significant coronary artery disease. Diagnostics. 14 (10), 987(2024).
- Frank, E. An accurate, clinically practical system for spatial vectorcardiography. Circulation. 13 (5), 737-749 (1956).
- Park, J., Seok, H. S., Kim, S. S., Shin, H. Photoplethysmogram analysis and applications: An integrative review. Front Physiol. 12, 808451(2022).
- Montalescot, G., et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J. 34 (38), 2949-3003 (2013).
- Baratloo, A., Hosseini, M., Negida, A., El Ashal, G. Part 1: Simple definition and calculation of accuracy, sensitivity and specificity. Emergency. 3 (2), 48-49 (2015).
- Ranganathan, P., Aggarwal, R. Understanding the properties of diagnostic tests-Part 2: Likelihood ratios. Perspect Clin Res. 9 (2), 99-102 (2018).
- Douglas, P. S., et al. Outcomes of anatomical versus functional testing for coronary artery disease. New Eng J Med. 372 (14), 1291-1300 (2015).
- Safari, S., Baratloo, A., Elfil, M., Negida, A. Evidence based emergency medicine; part 4: Pre-test and post-test probabilities and Fagan's nomogram. Emergency. 4 (1), 48(2016).
- Knuuti, J., et al. The performance of non-invasive tests to rule-in and rule-out significant coronary artery stenosis in patients with stable angina: a meta-analysis focused on post-test disease probability. Eur Heart J. 39 (35), 3322-3330 (2018).
- Diamond, G. A., Forrester, J. S. Analysis of probability as an aid in the clinical diagnosis of coronary-artery disease. New Eng J Med. 300 (24), 1350-1358 (1979).
- Morise, A. P. Comparison of the Diamond-Forrester method and a new score to estimate the pre-test probability of coronary disease before exercise testing. Am Heart J. 138 (4), 740-745 (1999).
- Pelletier-Galarneau, M., Vandenbroucke, E., Lu, M., Li, O. Characteristics and key differences between patient populations receiving imaging modalities for coronary artery disease diagnosis in the US. BMC Cardiovasc Disord. 23 (1), 251(2023).
- Li, J., et al. Factors that impact a patient's experience when undergoing single-photon emission computed tomography myocardial perfusion imaging (SPECT-MPI) in the US: A survey of patients, imaging center staff, and physicians. J Nuclear Cardiol. 28 (4), 1507-1518 (2021).
- Lawton, J. S., et al. 2021 ACC/AHA/SCAI guideline for coronary artery revascularization: A report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 79, e21-e129 (2022).
- Aijaz, A., et al. Sociodemographic factors associated with outpatient radiology no-shows versus cancellations. Acad Radiol. S1076 - 6332 (24), 00228-00229 (2024).
- Cowper, P. A., et al. Acute and 1-year hospitalization costs for acute myocardial infarction treated with percutaneous coronary intervention: Results From the TRANSLATE-ACS registry. J Am Heart Assoc. 16 (8), 8(2019).
- Thomas, A., et al. Forgone medical care associated with increased health care costs among the U.S. heart failure population. JACC Heart Fail. 9 (10), 710-719 (2021).
- Reeves, R. A., Halpern, E. J., Rao, V. M. Cardiac imaging trends from 2010 to 2019 in the Medicare population. Radiol Cardiothorac Imaging. 3 (5), (2021).
- Pope, J. H., et al. Missed diagnoses of acute cardiac ischemia in the Emergency Department. New Eng J Med. 342 (16), 1163-1170 (2000).
- OʼSullivan, A. K., et al. Cost estimation of cardiovascular disease events in the US. Pharmacoeconomics. 29 (8), 693-704 (2011).
- Corso, A. Emergency visit cost with and without insurance in 2024. Mira. , https://www.talktomira.com/post/how-much-does-an-er-visit-cost (2024).
- Patel, M. R. Low diagnostic yield of elective coronary angiography. New Eng J Med. 362 (10), 886-895 (2010).
- Browning, S. CorVista System 510(k) Summary (K232686). , U.S. Food and Drug Administration. Retrieved from https://www.accessdata.fda.gov/cdrh_docs/pdf23/K232686.pdf (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon