È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sintesi di perle sensibili al pH caricate con olio di semi neri, a base di alginato utilizzando la tecnica dell'elettrospruzzatura
In questo articolo
Riepilogo
Viene presentata una tecnica che impiega un'alta tensione elettrica e un'emulsione mirata caricata con principio attivo per fabbricare microsfere uniformi e sensibili al pH.
Abstract
L'olio di semi neri (BSO), derivato dai semi della pianta Nigella sativa , ha attirato l'attenzione per le sue potenziali proprietà antitumorali, in particolare nel contesto del cancro del colon. Il suo composto attivo, il timochinone, può aiutare a inibire la crescita delle cellule tumorali e indurre l'apoptosi nelle cellule tumorali del colon. Inoltre, gli effetti antinfiammatori e antiossidanti dell'olio di semi neri potrebbero contribuire a un ambiente intestinale più sano, riducendo potenzialmente il rischio di cancro. Pertanto, questo studio ha sintetizzato perle di alginato sensibili al pH per fornire BSO nel colon in modo a rilascio controllato senza rilasciare il farmaco a pH 1,2 (stomaco), fornendo così un modello di rilascio ben definito a pH 6,8. L'uso della tecnologia elettrospray migliora le prestazioni del processo facilitando la formulazione di microsfere piccole e omogenee con un tasso più elevato di rigonfiamento e diffusione nel mezzo gastrointestinale.
Le perle formulate sono state caratterizzate da un test di forza mucoadesiva ex-vivo , dimensione delle perline, fattore di sfericità (SF), efficienza di incapsulamento (EE), microscopio elettronico a scansione (SEM), comportamento di rigonfiamento in vitro (SB) e rilascio di farmaci in vitro in terreni acidi e tampone. Tutte queste perle prodotte hanno dimostrato dimensioni modeste di 0,58 ± 0,01 mm e una forma sferica di 0,03 ± 0,00 mm in questo test. La formulazione ha mostrato promettenti proprietà di galleggiamento e rilascio in vitro. Con una percentuale cumulativa molto bassa di perline, l'EE dell'olio del 90,13% ± 0,93% era alto e lo studio di rilascio ha dimostrato oltre il 90% in pH 6,8 con una buona natura fluttuante nello stomaco. Inoltre, le perle erano uniformemente distanziate in tutto l'intestino. L'approccio di elettrospruzzatura utilizzato in questo protocollo può essere riproducibile, producendo risultati coerenti. Pertanto, questo protocollo può essere utilizzato per la produzione su larga scala a scopo di commercializzazione.
Introduzione
Il seme nero, e più in particolare il BSO, è stato utilizzato per secoli per curare una vasta gamma di malattie grazie alle sue proprietà medicinali ben consolidate. Il timochinone è forse una delle sostanze fitochimiche più importanti presenti nella BSO1. Negli ultimi anni, i ricercatori hanno studiato i potenziali benefici terapeutici del timochinone in vivo e in vitro, producendo prove empiriche a sostegno dell'uso della BSO. Le proprietà antipertensive, antibatteriche, antistaminiche, antimicotiche, analgesiche, antidiabetiche, ipolipemizzanti e antinfiammatorie sono state tutte dimostrate da questi studi per la BSO, che può essere utilizzata per trattare sintomi come eczema, ipertensione, asma, tosse, mal di testa, influenza, febbre, antitumorale, vertigini e attività 2,3.
L'applicazione di coperture relativamente sottili su piccole goccioline di liquidi e dispersioni, o particelle di materiale solido, è nota come microincapsulazione. Quando si tratta di olio, l'olio microincapsulato è solitamente molto prezioso perché alcune forme di olio, come il BSO, sono considerate alimenti nutrienti e offrono vantaggi medicinali4. Tuttavia, l'aggiunta di oli direttamente alla matrice dell'alimento può portare alla volatilizzazione, che può causare la rapida scomparsa delle attività a causa dell'esposizione all'ossigeno e ai raggi UV5. Inoltre, la mancanza di controllo sulla velocità di rilascio degli oli si traduce in un effetto immediato e transitorio. La creazione di un rivestimento polimerico attorno all'olio essenziale mediante microincapsulazione o microsferificazione è un metodo per superare questi inconvenienti6.
Le microcapsule, note anche come microsfere, proteggono gli oli dalle condizioni ambientali dannose7. Questo processo è stato ampiamente utilizzato per aumentare l'efficacia dei farmaci, preservare il contenuto dei farmaci, consentire compresse a rilascio prolungato, migliorare il mascheramento del gusto, ridurre la perdita di sapore durante la durata di conservazione del prodotto, prolungare la sensazione in bocca e separare gli ingredienti incompatibili in un unico dosaggio8. La microincapsulazione aiuta anche a mantenere l'assorbimento metabolico, a controllare la velocità di rilascio dell'olio e a mantenere le concentrazioni appropriate per ottenere il risultato desiderato in una particolare posizione9.
L'incapsulamento elettro-idrodinamico è un metodo semplice e adattabile. Il principio attivo è alloggiato nel nucleo interno di una microcapsula, che è composta da un guscio esterno. A questo proposito, è dotato di una matrice abbastanza forte per garantire che il componente attivo possa essere diffuso in modo più efficace piuttosto che un nucleo chiaramente definito. Prima della sfericazione, il principio attivo e la soluzione polimerica devono essere combinati per produrre le microsfere9. D'altra parte, poiché l'olio è volatile, la sua microincapsulazione può essere estremamente difficile e richiede un attento controllo della temperatura.
Esistono vari metodi per incapsulare gli oli. Ad esempio, alcuni oli devono essere incapsulati a basse temperature per evitare la rottura o la volatilizzazione dei loro componenti bioattivi. Per creare strutture di dimensioni micro e nanometriche, l'atomizzazione elettroidrodinamica (EHDA) è stata ampiamente studiata dai ricercatori10. In questo senso, le condizioni di lavorazione, che includono la portata, la tensione applicata e la dimensione dell'ugello, nonché le proprietà della distanza di raccolta della soluzione polimerica, sono i due fattori primari che devono essere presi in considerazione per produrre la dimensione o la morfologia delle particelle desiderata11,12.
In questa indagine, gli alginati, un tipo di polisaccaridi presenti in natura adatti all'ingestione orale, sono stati utilizzati per incapsulare il BSO. Le alghe brune contengono alginato, un polimero anionico che si trova in natura. È costituito da due strutture monomeriche: acido α-L-guluronico (G) e acido 1-4βD-mannuronico (M)13. Il suo polimero non è tossico14, ha un alto grado di biocompatibilità, è poco costoso e si degrada efficacemente15. È, quindi, frequentemente impiegato nei settori delle biotecnologie e dell'ingegneria.
Gli alginati sono il materiale preferito per l'incapsulamento mediante gelificazione ionica perché possono creare una struttura reticolata tra i gruppi G di varie catene di alginato formando connessioni ioniche con cationi bivalenti come ioni Sr2+, Ca2+ o Zn2+. Il processo di gelificazione può essere adeguatamente caratterizzato dal modello a scatola di uova, che limita il catione bivalente a due gruppi carbossilici sulle molecole di alginato affiancate. È stato suggerito che le caratteristiche dell'idrogel delle perle di alginato di sodio possano regolare il rilascio di macromolecole e piccole molecole. Le perle di alginato di sodio possono aderire alla mucosa intestinale per un periodo di tempo prolungato a causa delle loro qualità muco-adesive. Inoltre, l'alginato offre uno scudo che può proteggere gli oli da elementi esterni come i mezzi acidi16 e trasferisce gli oli nei canali di erogazione del tratto gastrointestinale17. Da allora è stato impiegato nella ricerca per aiutare nella somministrazione sito-specifica di farmaci ai tessuti mucosi18,19.
L'approccio elettro-idrodinamico è stato utilizzato in questo studio per studiare la fattibilità dell'emulsione di oli commerciali per creare capsule20. Qui, l'approccio elettro-idrodinamico è stato utilizzato per generare e analizzare microsfere caricate con alginato-BSO20. Questo studio ha valutato una serie di altri fattori, tra cui l'SF, ex-vivo, le proprietà muco-adesive delle microsfere, l'EE%, l'aspetto fisico, la distribuzione dimensionale e il potenziale zeta; la spettroscopia infrarossa a trasformata di Fourier a riflettanza totale attenuata (ATR-FTIR) è stata utilizzata per testare la compatibilità chimica20.
Protocollo
1. Preparazione dell'emulsione di alginato-BSO
- Disperdere il 10% p/v BSO in una soluzione di alginato di sodio all'1% p/v contenente lecitina 1, 3 e 5% p/v in un becher da 50 mL.
- Ottenere una nano-emulsione utilizzando un omogeneizzatore ad ultrasuoni. Impostare il livello di potenza al 20%. Eseguire l'omogeneizzatore per 55 s facendo clic sul pulsante di avvio per completare il processo.
2. Caratterizzazione dell'emulsione di alginato-BSO
- Analizzare il potenziale zeta e la distribuzione granulometrica
- Prelevare 0,1 mL dell'emulsione appena preparata in un becher di vetro da 25 mL e diluirla con 9,9 mL di acqua distillata.
- Prelevare 2,5 mL di questa soluzione diluita in una cuvetta di quarzo da 3 mL e collocare la cuvetta in una camera di misurazione.
- Aprire il coperchio e posizionare la cuvetta all'interno del dispositivo, assicurandosi che la cuvetta sia orientata correttamente rispetto al percorso del fascio di luce. Fare clic sull'icona di misurazione .
- Estrarre la cuvetta. Recuperare il campione o smaltirlo correttamente.
- Salva i dati come file pdf in una cartella personale per un ulteriore utilizzo.
- Determinare la stabilità dell'emulsione (ES)
- Assumere 5 ml di emulsione appena preparata in provette da centrifuga da 10 ml. Centrifugare le emulsioni (n = 3) per 5 minuti a 894 × g.
- Utilizzando l'equazione (1), determinare l'ES in base alla posizione dell'interfaccia di separazione di fase.
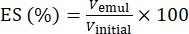 (1)
(1)
Dove Vemul è il volume dell'emulsione rimanente dopo la centrifugazione e Vinitial è il volume dell'emulsione iniziale.
- Preparazione delle perline
- Perline di alginato BSO
- Preparare le perle di alginato BSO utilizzando la tecnica elettrospray chiamata EHDA. Utilizzare un'emulsione BSO in peso/volume (p/v) composta da 10% BSO, 1% di alginato di sodio e 3% di lecitina).
- Utilizzando una pompa a siringa per regolare la portata, caricare l'emulsione in una siringa di plastica da 10 ml e spingerla attraverso un ago da 22 G. Collegare la punta dell'ago all'elettrodo positivo di un alimentatore ad alta tensione.
- Come collettore, utilizzare un becher messo a terra con 50 mL di cloruro di calcio all'1% p/p (bagno gelificante). Alternare la velocità di gocciolamento tra 1 mL/min e 3 mL/min a tensioni di 3, 5 e 7 kV mantenendo una distanza di 10 cm sopra la superficie della soluzione di cloruro di calcio.
- Per confermare la gelificazione completa, lasciare le perle nel bagno gelificante per 30 minuti mentre le si agita. Utilizzare un filtro in acciaio inossidabile per rimuovere le perle dal bagno di gelificazione e lavare le perle raccolte con acqua distillata ultrapura.
- Lasciare asciugare le perle per 16 ore a temperatura ambiente su un banco da laboratorio. Utilizzare l'equazione (2) per calcolare la resa percentuale delle perline.
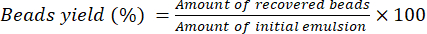 (2)
(2)
- Perle di alginato senza BSO
- Preparare una soluzione all'1% p/v di alginato di sodio. Aggiungere alla soluzione lecitina a concentrazioni dell'1%, 3% e 5% p/v. Mescolare accuratamente la soluzione fino a quando la lecitina non si sarà completamente sciolta.
- Utilizzare la soluzione del passaggio 2.3.2.1 per preparare perle di alginato prive di BSO come descritto nei passaggi 2.3.1.2-2.3.1.5. Calcolare la resa utilizzando l'equazione (2).
- Perline di alginato BSO
3. Caratterizzazione del tallone
- Determinazione delle dimensioni e della forma
- Per accertare le dimensioni e la forma delle perline, utilizzare un analizzatore di immagini. Scatta foto con una fotocamera digitale delle perline bagnate e asciugate.
- Quindi, misurare il diametro del cordone utilizzando la barra graduata preinstallata dello strumento. Utilizzando i valori del diametro, calcolare l'SF dai valori del diametro ottenuti utilizzando l'equazione (3):
SF =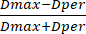 (3)
(3)
Dove Dmax rappresenta il diametro più grande che passa per il centro di un cordone (in mm), mentre Dper si riferisce al diametro che è perpendicolare a Dmax e passa per il centro del cordone (in mm).
NOTA: Un SF pari a zero denota un cordone idealmente sferico, con valori di SF crescenti che indicano una maggiore deviazione da una forma sferica. Inoltre, le perline sono considerate sferiche se il loro SF è 0,05 o inferiore.
4. Determinazione della percentuale EE
- Disintegrare le perle in soluzione salina tamponata con fosfato (PBS) per rimetterle in emulsione. Misurare l'assorbanza dell'emulsione risultante a 600 nm utilizzando uno spettrofotometro UV-vis.
- Utilizzare il valore di assorbanza per rappresentare la torbidità dell'emulsione. Create una curva standard utilizzando una quantità nota di BSO nell'emulsione.
- Calcolare l'EE% utilizzando l'equazione (4):
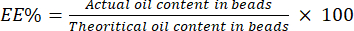 (4)
(4)
5. Microscopia elettronica a scansione (SEM)
NOTA: Utilizzare il SEM per osservare la microstruttura e la morfologia superficiale delle perle di alginato BSO.
- Per ispezionare l'interno delle perline essiccate, tagliatene alcune. Individua le perline tagliate su tronchetti di alluminio e incollale usando nastri adesivi in carbonio.
- Rivestire le perle con un modulo sputter in carbonio in un evaporatore sottovuoto in un'atmosfera di argon. Applicare uno spessore di 100 Å e 50 Å per il rivestimento in carbonio.
- Acquisire immagini delle perle rivestite ad alto vuoto con un acceleratore di tensione compreso tra 10 kV e 15 kV.
6. Determinare l'interazione farmaco-eccipiente utilizzando ATR-FTIR
- Impostare i numeri d'onda dello strumento tra 4.000 cm−1 e 400 cm−1 utilizzando l'aria ambiente come sfondo e una risoluzione di 1 cm−1. Vedere il file supplementare 1.
- Registrare separatamente gli spettri di BSO, alginato di sodio, lecitina, cloruro di calcio, perle prive di BSO, perle di alginato-BSO e miscela fisica di principio attivo ed eccipienti (alginato di sodio, lecitina, cloruro di calcio e BSO).
- Posizionare il campione (5-10 mg) sull'area di campionamento. Regola 20 scansioni, risoluzione 4, forza manometrica 80, braccio di pressione con punta piatta. Verificare che l'opzione Incremento automatico rimanga impostata sull'opzione Vuoto in modo che lo spettro venga memorizzato automaticamente nella cartella desiderata.
- Per iniziare la misurazione del campione, fare clic sul pulsante [Campione]. Dopo aver selezionato [Campione], poiché non è previsto alcun periodo di attesa, assicurarsi di avere il campione pronto e la pinza di pressione ridotta. Analizza tutti i campioni singolarmente. Analizza individualmente tutti gli spettri registrati utilizzando il software di spettroscopia.
7. Calorimetria differenziale a scansione (DSC)
NOTA: Le proprietà termiche e la compatibilità delle perle caricate con BSO sono state studiate utilizzando DSC (Supplemental File 1).
- Sigillare le perle del peso di ~3,20 mg in una normale padella di alluminio. Riscaldare i campioni a una velocità di 10 °C/min mentre vengono analizzati a una temperatura compresa tra 50 e 350 °C sotto un flusso di azoto che scorre a una velocità di 20 L/min.
8. Caratteristiche di rigonfiamento delle perle
- Preparare 100 mg di perle di alginato-BSO essiccate.
- Preparare il fluido intestinale simulato (SIF) e il liquido gastrico simulato (SGF) in un recipiente di miscelazione pulito e asciutto di dimensioni adeguate: 6 L, 10 L o 25 L. Aggiungere acqua purificata a circa il 33% del volume richiesto: 2 L, 3 L o 8 L, e trasferire il contenuto del flacone di concentrato nel recipiente. Sciacquare la bottiglia con acqua purificata e aggiungere i risciacqui e l'acqua purificata al recipiente di miscelazione per ottenere il volume richiesto; Mescolare accuratamente. Misurare il pH e procedere se entro le specifiche; regolare il pH se necessario.
- Immergere le microsfere in 50 ml di terreno contenente fluido intestinale simulato (SIF) e liquido gastrico simulato (SGF). Mantenere le condizioni per 2 ore a 37 ± 0,5 °C.
- Rimuovere le perline gonfiate e filtrarle attraverso una rete metallica a intervalli predefiniti di 0, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110 e 120 minuti o più. Usa un tovagliolo di carta per rimuovere il liquido in eccesso dalle perline gonfie.
- Misurare il peso delle perle pulite utilizzando una bilancia analitica elettronica. Determinare la percentuale di indice di rigonfiamento (%SI) utilizzando l'equazione (5):
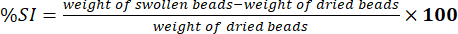 (5)
(5)
Risultati
Preparazione di microsfere di alginato caricate con BSO
La Figura 1 rappresenta la configurazione sperimentale per preparare microsfere di alginato caricate con BSO. La quantità di lecitina utilizzata ha avuto un impatto considerevole sulla stabilità dell'emulsione BSO. Le emulsioni realizzate con tutte e tre le concentrazioni di lecitina erano relativamente stabili. Il metodo di centrifugazione (894 × g, 5 min) è stato util...
Discussione
Utilizzando il processo EHDA, sono state create microsfere di alginato caricate con BSO come vettore sensibile al pH. La rete di perle mostrava un rigonfiamento pH-dipendente e un comportamento di rilascio del farmaco a causa dell'abbondante presenza di gruppi acidi carbossilici. Il forte legame idrogeno intermolecolare tra le catene polimeriche si è rivelato essere la ragione alla base della diminuzione del carattere di rigonfiamento delle perle caricate con BSO a pH 1,2. Le perle cari...
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo studio è stato supportato dai ricercatori dell'Università Princess Nourah bint Abdulrahman che sostengono il progetto numero (PNURSP2024R30), Princess Nourah bint Abdulrahman University, Riyadh, Arabia Saudita. Questa ricerca è stata finanziata dal Researchers Supporting Project number (RSPD2024R811), King Saud University, Riyadh, Arabia Saudita.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 mL Centrifuge Tubes | Globe Scientific | 22-171-624 | |
| 22 G needle | Sigma-Aldrich (St.Louis, Missouri, USA). | CAD4172 | |
| 3 mL quartz-cuvette | Sigma-Aldrich (St.Louis, Missouri, USA). | Z276669 | |
| 50 mL beaker | |||
| Aluminum stubs | |||
| An electronic analytical balance | |||
| ATR-FTIR | Bruker Malaysia Sdn Bhd, Kawasan Perindustrian Temasya, 40150 Shah Alam, Selangor, Malaysia. | ||
| Black seed oil | IKOP Pharmaceutical Ltd. (IKOP, Faculty of Pharmacy, IIUM, 25200 Kuantan, Pahang, Malaysia | B182111 | Active ingredient |
| Calcium chloride dehydrate, CaCl2 · 2H2O | Sigma-Aldrich (St.Louis, Missouri, USA). | 21074 | Gelling agent |
| Carbon adhesive tapes | |||
| Centrifuge | |||
| Differential scanning calorimetry | |||
| Digital camera | |||
| Grounded beaker | |||
| High guluronic acid content Sodium alginate (mw. 97,000) with medium viscosity (40 – 100 mPa s) | Sigma-Aldrich (St.Louis, Missouri, USA). | W201502 | Polymer |
| High voltage power supply | |||
| Isopropyl alcohol | Sigma-Aldrich (St.Louis, Missouri, USA). | W292912 | ATR-FTIR cleaning purpose |
| Lecithin | Sigma-Aldrich (St.Louis, Missouri, USA). | P7568 | Surfactant |
| Microscope | |||
| Paper towel | |||
| Scanning electron microscopy | |||
| Simulated gastric fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 1651 | Release media and swelling media |
| Simulated intestinal fluid | Sigma-Aldrich (St.Louis, Missouri, USA). | 84082-64-4 | Release media and swelling media |
| Spectroscopy software | |||
| Stainless-steel filter | |||
| Syringe pump | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Ultrapure distilled water | Supplied by institutional lab | ||
| Ultrasonic homogenizer | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| UV-vis spectrophotometer. | |||
| Vacuum evaporator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Voltage accelerator | SEN JIN SDN BHD Malaysia, Taman Desaria, 46150 Petaling Jaya, Selangor Darul Ehsan Malaysia | ||
| Zetasizer Nano-ZS | (Malvern Zetasizer Nano series Nano-S and Nano-Z, Malvern Instruments Ltd., Worcestershire, UK) |
Riferimenti
- Benavides, S., Cortés, P., Parada, J., Franco, W. Development of alginate microspheres containing thyme essential oil using ionic gelation. Food Chem. 204 (8), 77-83 (2016).
- Agbaria, R., Gabarin, A., Dahan, A., Ben-Shabat, S. Anticancer activity of Nigella sativa (black seed) and its relationship with the thermal processing and quinone composition of the seed. Drug Des Devel Ther. 9 (1), 3119 (2015).
- Wang, D., Qiao, J., Zhao, X., Chen, T., Guan, D. Thymoquinone inhibits IL-1β-induced inflammation in human osteoarthritis chondrocytes by suppressing NF-κB and MAPKs signaling pathway. Inflammation. 38 (7), 2235-2241 (2015).
- Beyki, M., et al. Encapsulation of Mentha piperita essential oils in chitosan-cinnamic acid nanogel with enhanced antimicrobial activity against Aspergillus flavus. Ind Crop Prod. 54 (3), 310-319 (2014).
- Hosseini, S. M., et al. Incorporation of essential oil in alginate microparticles by multiple emulsion/ionic gelation process. Inter J Biol Macromol. 62 (11), 582-588 (2013).
- Banerjee, S., et al. Influence of process variables on essential oil microcapsule properties by carbohydrate polymer-protein blends. Carbohydr Polym. 93 (2), 691-697 (2013).
- Sebe, I., Szabó, E., Zelkó, R. Advances in drug delivery via electrospun and electrosprayed formulations. In Emerging Drug Delivery and Biomedical Engineering Technologies. , 71-104 (2023).
- Akram, N., et al. Fabrication and characterization of PVA-WPI based nanofiber mats for improved viability of Lactobacillus rhamnosus GG. Foods. 12 (21), 3904 (2023).
- Azad, A. K., Sinan, M. A. A., John, F. K., Bappaditya, C., Hriday, B. Electro-hydrodynamic assisted synthesis of lecithin-stabilized peppermint oil-loaded alginate microbeads for intestinal drug delivery. Int J Biol Macromol. 185 (8), 861-875 (2021).
- Chan, E. S. Preparation of Ca-alginate beads containing high oil content: Influence of process variables on encapsulation efficiency and bead properties. Carbohydr Polym. 84 (4), 1267-1275 (2011).
- Xie, J., Jiang, J., Davoodi, P., Srinivasan, M. P., Wang, C. H. Electrohydrodynamic atomization: A two-decade effort to produce and process micro-/nanoparticulate materials. Chem Eng Sci. 125 (3), 32-57 (2015).
- Zamani, M., Prabhakaran, M. P., Ramakrishna, S. Advances in drug delivery via electrospun and electrosprayed nanomaterials. Int J Nanomed. 8 (8), 2997 (2013).
- Husain, O., Lau, W., Edirisinghe, M., Parhizkar, M. Investigating the particle to fibre transition threshold during electrohydrodynamic atomization of a polymer solution. Mater Sci Eng. C. 65 (8), 240-250 (2016).
- Wan, L. Q. Calcium concentration effects on the mechanical and biochemical properties of chondrocyte-alginate constructs. Cell Mol Bioeng. 1 (3), 93-102 (2008).
- Baimark, Y., Srisuwan, Y. Preparation of alginate microspheres by water-in-oil emulsion method for drug delivery: Effect of Ca2+ post-cross-linking. Adv Powder Technol. 25 (5), 1541-1546 (2014).
- Paques, J. P., Sagis, L. M. C., van Rijn, C. J. M., van der Linden, E. Nanospheres of alginate prepared through w/o emulsification and internal gelation with nanoparticles of CaCO3. Food Hydrocoll. 40 (10), 182-188 (2014).
- Suksamran, T. Biodegradable alginate microparticles developed by electrohydrodynamic spraying techniques for oral delivery of protein. J Microencapsul. 26 (7), 563-570 (2009).
- Wang, H., et al. Characterization, release, and antioxidant activity of curcumin-loaded sodium alginate/ZnO hydrogel beads. Int J Biol Macromol. 121 (1), 1118-1125 (2019).
- Bera, H., Boddupalli, S., Nayak, A. K. Mucoadhesive-floating zinc-pectinate-sterculia gum interpenetrating polymer network beads encapsulating ziprasidone HCl. Carbohydr Polym. 131 (10), 108-118 (2015).
- Azad, A. K., et al. Encapsulation of black seed oil in alginate beads as a pH-sensitive carrier for intestine-targeted drug delivery: In vitro, in vivo and ex vivo study. Pharmaceutics. 12 (3), 219 (2020).
- Azad, A. K., et al. A dataset of microstructure features of electro-hydrodynamic assisted 5-fluorouracil-grafted alginate microbeads and physicochemical properties for effective colon targeted carriers drug delivery. Data in Brief. 53 (4), 110202 (2024).
- Danaei, M., et al. Impact of particle size and polydispersity index on the clinical applications of lipidic nanocarrier systems. Pharmaceutics. 10 (2), 57 (2018).
- Piornos, J. A., Burgos-Díaz, C., Morales, E., Rubilar, M., Acevedo, F. Highly efficient encapsulation of linseed oil into alginate/lupin protein beads: Optimization of the emulsion formulation. Food Hydrocoll. 63 (2), 139-148 (2017).
- Morales, E. Alginate/Shellac beads developed by external gelation as a highly efficient model system for oil encapsulation with intestinal delivery. Food Hydrocoll. 70 (9), 321-328 (2017).
- Nikoo, A. M., Kadkhodaee, R., Ghorani, B., Razzaq, H., Tucker, N. Electrospray-assisted encapsulation of caffeine in alginate microhydrogels. Int J Biol Macromol. 116 (9), 208-216 (2018).
- Shao, L., et al. Effect of cold-spray parameters on surface roughness, thickness and adhesion of copper-based composite coating on aluminum alloy 6061 T6 substrate. Processes. 11 (3), 959 (2023).
- Li, W., et al. Effects of spraying parameters and heat treatment temperature on microstructure and properties of single-pass and single-layer cold-sprayed Cu coatings on Al alloy substrate. Surf Coat Technol. 30 (490), 131184 (2024).
- . . US Pharmacopoeia National Formulary, USP 23/NF 18. , (2000).
- Chen, Y. -. C., Ho, H. -. O., Liu, D. -. Z., Siow, W. -. S., Sheu, M. -. T. Swelling/floating capability and drug release characterizations of gastroretentive drug delivery system based on a combination of hydroxyethyl cellulose and sodium carboxymethyl cellulose. PLoS One. 10 (1), e0116914 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon