È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modello di ratto di rimodellamento cardiaco destro e aritmia mediante bande arteriose polmonari
In questo articolo
Riepilogo
L'insufficienza cardiaca destra (RHF) è caratterizzata da dilatazione cardiaca destra e ipertrofia, che porta a disfunzione ventricolare e atriale. Le condizioni cardiopolmonari associate all'RHF sono accompagnate da un aumento del rischio di aritmie cardiache. Questo articolo descrive un modello standardizzato di RHF indotta da bande arteriose polmonari associata a un aumento dell'aritmogenesi ventricolare e atriale.
Abstract
Le condizioni cliniche, tra cui la broncopneumopatia cronica ostruttiva o l'ipertensione arteriosa polmonare (PAH), possono portare a un sovraccarico cronico di pressione del ventricolo destro e a un'insufficienza cardiaca destra progressiva (RHF). L'RHF può essere identificata dall'ipertrofia cardiaca destra e dalla dilatazione associata a una funzione miocardica anomala che colpisce il ventricolo destro e l'atrio destro (AR). Recentemente abbiamo dimostrato che l'RHF grave è accompagnata da un aumento del rischio di infiammazione atriale, fibrosi atriale e fibrillazione atriale (FA), il tipo più comune di aritmia cardiaca (CA). Studi recenti hanno dimostrato che l'infiammazione del ventricolo destro e dell'artrite reumatoide svolge un ruolo importante nell'aritmogenesi dell'artrite reumatoide, compresa la fibrillazione atriale. Tuttavia, l'impatto dell'infiammazione nello sviluppo di CA e FA nell'RHF è scarsamente descritto.
Sono necessari modelli sperimentali di RHF per comprendere meglio l'associazione tra infiammazione miocardica destra e CA. Il modello di ratto di ipertensione polmonare (PH) indotta da monocrotalina (MCT) è ben noto per provocare RHF. Tuttavia, l'MCT innesca una grave pneumotossicità e infiammazione polmonare. Pertanto, l'RHF indotta da MCT non aiuta a distinguere se la successiva infiammazione miocardica ha origine dall'RHF di per sé o da segnali infiammatori circolanti secreti dal polmone danneggiato.
In questo articolo, è stato utilizzato un metodo meccanico che coinvolge il bendaggio del tronco dell'arteria polmonare (PAB) per provocare l'aritmogenesi cardiaca destra. Il PAB consiste nell'eseguire una sutura permanente del tronco dell'arteria polmonare per 3 settimane. Un tale approccio genera un aumento del sovraccarico di pressione sul lato destro. Al D21 post-PAB, la sutura provoca ipertrofia, dilatazione e infiammazione del ventricolo destro e dell'artrite reumatoide. L'RHF indotta da PAB è anche accompagnata da vulnerabilità alle aritmie ventricolari e atriali, inclusa la FA.
Introduzione
L'insufficienza cardiaca destra (RHF) è caratterizzata da ipertrofia e dilatazione del ventricolo destro (RV) e dell'atrio (AR), che porta a un malfunzionamento cardiaco destro in risposta al sovraccarico cronico di pressione del ventricolo destro dovuto alla costrizione delle arterie polmonari (PA)1. Pertanto, le condizioni che provocano il restringimento della PA possono essere responsabili di un aumento del rischio di RHF 1,2,3,4. I dati clinici hanno rivelato che l'RHF è la principale causa di ospedalizzazione (56%) nei pazienti con ipertensione PA (PAH)2. Studi clinici hanno dimostrato che, indipendentemente dalla causa della PAH, inclusa l'ipertensione polmonare tromboembolica (PH) e la PAH idiopatica, i pazienti sono spesso affetti da RHF e sono il 20% più suscettibili allo sviluppo di aritmie cardiache, tra cui tachiaritmie sopraventricolari e fibrillazione atriale (FA)2,5,6.
Per comprendere meglio l'associazione tra PAH e RHF, sono stati utilizzati studi su animali, incluso il modello di una singola dose di monocrotalina (MCT), per provocare una grave infiammazione polmonare e RHF 7,8. Recentemente abbiamo osservato che l'RHF indotta da MCT era associata all'infiammazione dell'artrite reumatoide e alla FA9. Tuttavia, a causa dell'importanza dell'infiammazione polmonare indotta da MCT e delle citochine circolanti, è stato difficile descrivere se l'infiammazione da artrite reumatoide indotta da MCT sia una conseguenza del solo RHF9. Pertanto, è stato necessario un nuovo modello di aritmia cardiaca indotta da RHF per studiare lo stato infiammatorio dell'artrite reumatoide.
Il modello sperimentale PA trunk banding (PAB) è stato utilizzato in varie specie animali per imitare le malattie ostruttive della PA e per studiare il rimodellamento cardiaco patologico associato che colpisce il lato destro del cuore10. Il PAB è stato riportato come un metodo efficace per indurre la disfunzione e il fallimento del ventricolo destro in vari studi che imitano il sovraccarico del ventricolo destro 10,11,12,13,14,15,16. Tecnicamente, il PAB è il posizionamento di una sutura permanente sul tronco PA, provocando una riduzione meccanica del diametro10 del tronco PA. Il PAB genera un aumento del sovraccarico di pressione dell'RV10. In primo luogo, come adattamento compensatorio all'improvviso aumento del postcarico del ventricolo destro, la cavità del ventricolo destro viene dilatata, portando all'ipertrofia cronica del ventricolo destro10,13. La dilatazione e l'ipertrofia del ventricolo destro colpiscono le valvole tricuspide, che diventano perdenti13. Più precisamente, la dilatazione pronunciata del ventricolo destro combinata con un elevato postcarico del ventricolo destro ha l'effetto di allungare l'anulus della valvola tricuspide situato tra il ventricolo destro e l'artrite reumatoide13,17. A causa dell'occlusione incompleta della valvola, una parte del sangue espulso dal ventricolo destro durante la sistole sarà diretta verso la cavità AR17. La perdita della valvola tricuspide può essere osservata attraverso l'ecocardiografia ed è chiamata rigurgito tricuspidale17. Quindi, l'artrite reumatoide riceve una pressione sanguigna inappropriatamente alta, contribuendo ad aumentare la dilatazione e l'ipertrofia dell'artrite reumatoide13. Il rimodellamento cronico del ventricolo destro e dell'artrite reumatoide è accompagnato da reazioni infiammatorie miocardiche locali che portano alla fibrosi del ventricolo destro e dell'artrite reumatoide e alla perdita di funzione 9,13. La fibrosi cardiaca è caratterizzata dallo sviluppo di zone a basso voltaggio che sono meno contrattili e più suscettibili a provocare il blocco della conduzione e i circuiti di rientro coinvolti nello sviluppo di aritmie cardiache, tra cui la fibrillazione ventricolare e la FA 18,19.
L'originalità di questo articolo risiede nell'utilizzo di un metodo standardizzato di rimodellamento cardiaco del lato destro indotto da PAB per provocare e studiare l'inducibilità delle aritmie cardiache in 3 settimane dopo il PAB. I principali vantaggi di questo approccio chirurgico sono: i) il controllo diretto sulla riduzione del diametro del tronco PA e ii) l'evitare l'infiammazione polmonare per concentrarsi sull'infiammazione miocardica indotta da RHF per studiare le aritmie cardiache, inclusa la FA.
L'approccio qui descritto prevede una precisa procedura microchirurgica per creare il PAB, la valutazione dell'aumento del postcarico del ventricolo destro, l'ecocardiografia per osservare il rimodellamento strutturale e funzionale del miocardio indotto dal PAB e lo studio elettrofisiologico per valutare la vulnerabilità alle aritmie cardiache, inclusa la FA.
Protocollo
Tutte le procedure descritte di seguito sono state approvate dal comitato etico del Montreal Heart Institute (numeri di protocollo: 2021-2938-2021-47-01 e 2024-3412-2024-48-01) e hanno seguito rigorosamente le linee guida del Canadian Council on Animal Care (CCAC). Per le procedure sono stati utilizzati ratti Wistar maschi (225-275 g) di età compresa tra 6 e 8 settimane. Tutti gli animali sono stati ospitati nella struttura di cura degli animali del Montreal Heart Institute, con accesso gratuito ad acqua e cibo.
1. Preparazione preoperatoria
- Sterilizzare tutti gli strumenti e i materiali chirurgici prima dell'intervento chirurgico utilizzando un'autoclave di vapore saturo ad alta pressione a temperature comprese tra 121 °C e 134 °C inferiori a 15-30 psi per 30-40 minuti seguiti da un ciclo di asciugatura di 25 minuti.
- Preparare tutti i volumi di farmaci necessari per l'intervento chirurgico. Utilizzare un approccio analgesico multimodale che prevede buprenorfina (0,05 mg/kg) e ketoprofene (5 mg/kg) iniettati per via sottocutanea 30 minuti prima dell'intervento chirurgico e ripetuti a 6 ore (buprenorfina) e 24 ore dopo l'intervento (buprenorfina e ketoprofene). Inoltre, eseguire un'analgesia locale nel sito di incisione (lidocaina 5 mg/mL).
- Eseguire un'ecocardiografia transtoracica di base prima dell'intervento chirurgico (vedere la procedura dettagliata per l'ecocardiografia transtoracica nei passaggi 6.1-6.13.) per determinare il diametro del PA e selezionare l'ago di calibro appropriato che verrà utilizzato come derivazione per generare la riduzione prevista del 60% del diametro del PA durante il PAB.
NOTA: In questo articolo, sono stati utilizzati ratti Wistar maschi di 225-275 g e l'utilizzo di un ago da 19 G è stato appropriato per generare una riduzione del 60% del diametro del PA. - Preparare un ago da 19 G (o il calibro appropriato come determinato al punto 1.3) che verrà utilizzato come guinzaglio (vedi sotto: passaggi 4.18 e 4.19) per ottenere una costrizione ottimale del tronco PA, provocando un grave rimodellamento del cuore del ratto. Usando una pinza, piegare il 19 G a 90-110° (Figura 1A).
NOTA: La flessione del 19 G facilita i) il posizionamento vicino al tronco PA e ii) l'applicazione della legatura durante la procedura. Il 19 G viene utilizzato come elettrocatetere attorno al quale verrà installata la sutura per ridurre il diametro del PA a 1,0 mm (riduzione del 60% per i ratti di peso 225-275 g), che induce un significativo sovraccarico di pressione del ventricolo destro responsabile di un grave rimodellamento del ventricolo destro in 3 settimane.
2. Induzione dell'anestesia e preparazione dell'animale
NOTA: Le analisi sono state eseguite su ratti Wistar maschi (225-275 g) di età compresa tra 6 e 8 settimane. Utilizzare un termoforo durante tutte le fasi delle seguenti procedure per mantenere la temperatura corporea dell'animale intorno ai 37 °C. Applicare una sonda rettale per monitorare la temperatura corporea.
- Anestetizzare l'animale con isoflurano al 3% inalato continuamente e ossigeno al 100% 2-3 L/min.
- Applicare un gel lubrificante per gli occhi per proteggere la cornea dall'essiccazione.
- Verificare il livello di anestesia utilizzando il riflesso di pizzicamento delle dita dei piedi.
3. Intubazione
NOTA: L'intubazione è stata eseguita come descritto in precedenza20.
- Trasferire l'animale in una stazione di intubazione inclinata in posizione supina. Tenere il ratto per gli incisivi superiori utilizzando un anello di filo per mantenere il corpo in posizione sospesa a 45° per ottenere una migliore visualizzazione della gola.
- Dirigere una sorgente luminosa flessibile sulla superficie del collo per transilluminarla attraverso la regione faringoepiglottica.
- Allungare la lingua con un batuffolo di cotone e stabilizzarla sulla mascella con una spatola curva per pesare come abbassalingua.
- Visualizza la trachea e le corde vocali.
- Utilizzare un aneteter da 16 G per eseguire l'intubazione. Utilizzare il catetere come tubo tracheale e smussare l'ago a punta smussata per utilizzarlo come introduttore.
- Far avanzare il tubo endotracheale (16 G di angiolettico) montato sull'introduttore (ago a punta smussata) nella trachea e, una volta posizionato, rimuovere l'introduttore (Figura 1B).
- Verificare la corretta posizione del tubo osservando uno schema di respirazione normale (circa 80 respiri/min per i ratti di peso 225 g e circa 70 respiri/min per i ratti di peso 275 g) e la presenza di nebbia sulla superficie della spatola metallica (o piccolo specchio) quando viene posizionata sulla flangia del mozzo della canula.
- Una volta correttamente intubato, trasferire rapidamente l'animale nella postazione chirurgica supino su un termoforo omeotermico.
- Regolare il volume corrente e la frequenza del ventilatore in base al peso corporeo del ratto. I ratti di circa 225-275 g ricevono un volume corrente di 2,0-2,5 ml e 70-80 respiri/min con il ventilatore.
- Collegare il tubo endotracheale al ventilatore per avviare la ventilazione meccanica. Posizionare la punta di deflusso del ventilatore in un cilindro dell'acqua. Le bolle d'aria che fuoriescono dal deflusso dopo ogni respirazione indicano una buona riuscita dell'intubazione.
- Una volta stabilita una respirazione costante, fissare il tubo endotracheale con del nastro chirurgico e fissare la sonda rettale lungo la coda per monitorare la temperatura corporea.
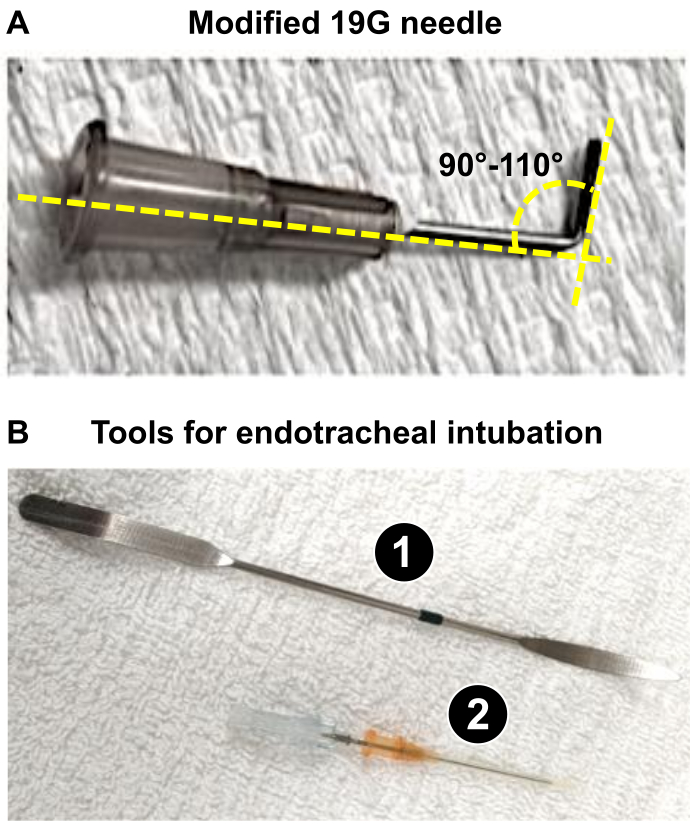
Figura 1: Strumenti chiave necessari per la preparazione della procedura microchirurgica di PAB. (A) Ago modificato da 19 G utilizzato come elettrocatetere per ottenere un diametro di 1 mm del tronco PA dopo PAB. (B) Strumenti endotracheali utilizzati o intubazione riuscita dei ratti. 1. La spatola viene utilizzata come abbassalingua sui ratti anestetizzati per esporre la trachea. 2. Il catetere 16G funge da tubo endotracheale dopo aver smussato la punta dello stilo. Clicca qui per visualizzare una versione più grande di questa figura.
4. Chirurgia PAB (Figura 2)
NOTA: Tutte le procedure devono essere eseguite secondo rigorose tecniche di chirurgia asettica.
- Radere il lato sinistro del torace utilizzando un tagliacapelli e una crema depilatoria e preparare la pelle con applicazioni di clorexidina al 2% seguite da scrub al 70% di alcol (ripetuti tre volte).
- Immobilizzare gli arti anteriori in posizione aperta con del nastro adesivo, facendo attenzione a non estendere eccessivamente gli arti per evitare di compromettere la respirazione.
- Tirare leggermente verso il basso l'arto posteriore destro e fissarlo lungo la coda.
- Estendi e adduci l'arto posteriore sinistro e fissalo al lato destro dell'animale per generare una leggera posizione laterale destra, esponendo il lato sinistro del torace.
- Utilizzare guanti sterili in questa fase per la parte rimanente dell'intervento.
- Posizionare un telo sterile sull'animale e praticare un'incisione cutanea di 2-3 cm sul lato sinistro del torace, iniziando a circa 2 cm sopra il processo xifoideo e orientata diagonalmente verso la base dell'arto anteriore sinistro del ratto.
- Sotto la pelle, separare successivamente i muscoli pettorali (piccolo pettorale e maggiore) e spostarli da parte mediante dissezione smussata con forbici a punta tonda. Utilizzare divaricatori magnetici per tenere i muscoli, per consentire una corretta visualizzazione della gabbia toracica situata al di sotto.
- Degonfiare i polmoni rimuovendo il tubo di deflusso (collegato al ventilatore) dal cilindro dell'acqua (vedere il passaggio 3.10). La rimozione del tubo di deflusso dall'acqua abbassa la pressione nei polmoni, generando la disgonfiaggio dei lobi.
- Eseguire una toracotomia sul lato sinistro con una pinza da dissezione curva. Forare un piccolo foro nella linea medio-clavicolare del muscolo situato tra la 3ae la 4a costola.
- Introdurre la pinza curva nell'apertura e farla scorrere lungo la parete interna sinistra del muscolo tra le due costole per sollevare leggermente la parete toracica sinistra ed evitare di toccare i polmoni durante il taglio del muscolo.
- Usa la pinza introdotta come guida e fai un'incisione longitudinale alle costole su circa 1 cm con le forbici dell'iride. Mantenere sollevata la parete toracica sinistra e manipolare le forbici con cautela per evitare di danneggiare i lobi polmonari sinistri direttamente sotto.
- Espandere l'incisione intercostale a 1-2 cm a sinistra dell'animale utilizzando le forbici a punta tonda.
- Riposizionare i divaricatori sotto le costole per mantenere aperta la ferita.
- Osservare la parte inferiore del timo e una parte del lobo sinistro del polmone.
- Spingere da parte il timo e i polmoni a questo livello, dato il notevole spazio occupato da questi organi. Separare i lobi del timo utilizzando una dissezione smussata con una pinza e tenere il polmone sul lato sinistro utilizzando una garza umida. Quindi, esporre la parte superiore del cuore, l'atrio sinistro (LA), il tronco polmonare e l'arco aortico.
- Sezionare con cura il sottile strato di pericardio che copre il cuore in quest'area, insieme a qualsiasi tessuto adiposo attaccato, per aiutare a localizzare la parte in cui l'aorta e il tronco polmonare sono ancora attaccati. Sezionare minimamente il pericardio ed evitare di toccare la membrana pleurica.
- Inserire la pinza curva in posizione chiusa nello spazio tra l'appendice LA e il tronco polmonare, al centro della parte visibile del vaso, per raggiungere l'altro lato del vaso (Figura 2A).
ATTENZIONE: Evitare di lavorare troppo vicino alla radice aortica del cuore per prevenire il rischio di rottura dei vasi e di emorragia. - Visualizza la punta della pinza attraverso la membrana congiuntiva cranialmente fino al tronco polmonare. Usa la seconda pinza per sezionare la punta e perfora con cura la membrana per creare una piccola apertura. Le pinze curve posizionate sotto il tronco polmonare vengono poi leggermente aperte in modo da afferrare un filo di seta 5-0. Ritrarre la pinza per portare il filo da un lato all'altro del tronco polmonare (Figura 2B, C).
- Eseguire la costrizione del tronco polmonare. Per prima cosa, esercitati con un doppio nodo sciolto del 5-0 Silk vicino all'arteria. Inserire l'ago da 19 G lungo il recipiente e sotto il filo. Stringere questo primo nodo e fissarlo con un secondo nodo semplice prima di rimuovere i 19 G (Figura 2D).
ATTENZIONE: Lavorare rapidamente e con attenzione per ridurre al minimo la durata dell'ostruzione completa del tronco polmonare. - Eseguire un ultimo nodo semplice e tagliare il restante filo di seta 5-0 a circa 0,5-1 cm dal nodo (Figura 2D).
- Riposizionare i lobi del timo e rimuovere i divaricatori toracici.
- Rigonfiare i polmoni pizzicando il deflusso del ventilatore per 2 s.
- Chiudere la gabbia toracica eseguendo un modello a punto croce con un filo di sutura sintetico assorbibile 5-0.
- Applicare alcune gocce di soluzione fisiologica allo 0,9% sulla zona della ferita e comprimere ogni lato della parete toracica per rimuovere le bolle d'aria e ristabilire la pressione negativa toracica.
- Riposizionare i muscoli pettorali e rimuovere la soluzione salina rimanente con una garza sterile.
- Usa una siringa per applicare un blocco di spruzzi di lidocaina sulla superficie e sull'area circostante la ferita.
- Chiudere la pelle utilizzando un filo di sutura sintetico riassorbibile 5-0 con ago in uno schema sottocuticolare continuo.
NOTA: I ratti fittizi ricevono la stessa procedura senza i passaggi 4.18 e 4.19.
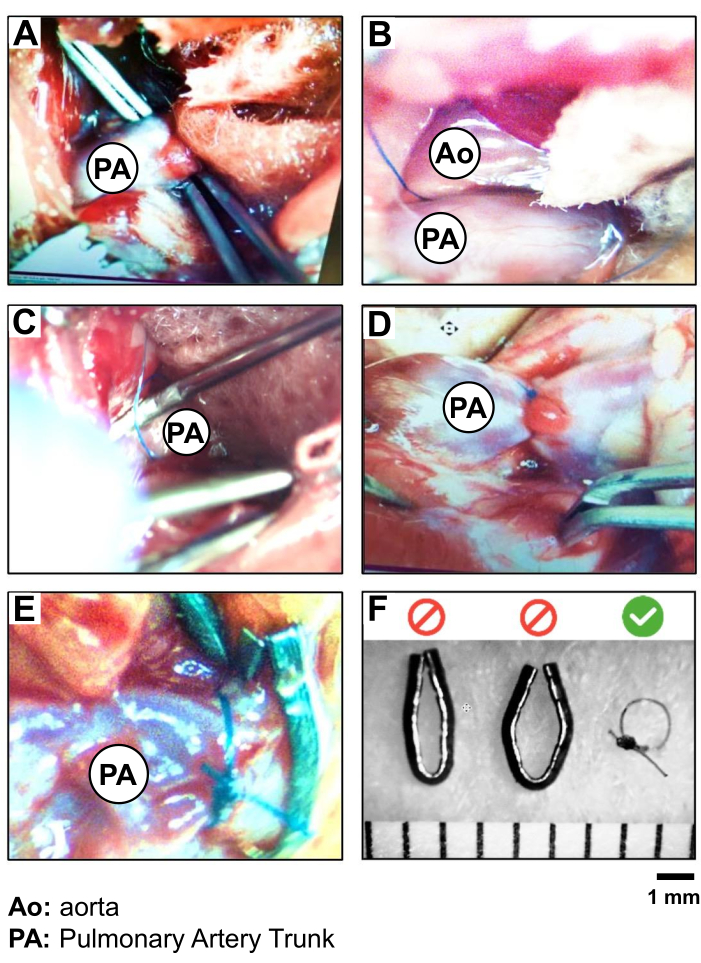
Figura 2: Procedura PAB e convalida della sutura in seta 5.0 rispetto alle clip metalliche. Fotografia dell'isolamento e della legatura passo dopo passo del tronco PA, che mostra (A) l'esposizione e l'isolamento del tronco PA, (B) il posizionamento della sutura (seta 5.0) attorno al tronco PA, (C) la legatura del PA (PAB) (utilizzando un ago da 19 G come elettrocatetere); (D) la verifica del movimento cardiaco e del sovraccarico della radice PA e del ventricolo destro a seguito di PAB; (E) un confronto tra PAB eseguito con sutura di seta e clip metallica; e (F) la convalida della scelta della sutura in seta per PAB per creare un diametro più riproducibile di 1 mm attorno al tronco PA. Clicca qui per visualizzare una versione più grande di questa figura.
5. Recupero post-operatorio
- Rimuovere l'isoflurano mantenendo il ratto sotto ventilazione meccanica con solo flusso di ossigeno. Gira il ratto sul lato destro o ventrale per facilitare la respirazione.
- Iniettare un volume di soluzione fisiologica allo 0,9% per via sottocutanea nella regione dorsale del collo per favorire il recupero dei liquidi (calcolato come 10 ml/kg/h di anestesia).
- Una volta confermata la respirazione autonoma, rimuovere dolcemente il tubo endotracheale.
- Osserva quando il ratto inizia a muoversi da solo e trasferisci l'animale dal termoforo a una nuova gabbia sterile per il recupero. Fornire acqua e cibo umido ad libitum.
- Durante il periodo post-operatorio (4-6 ore), posizionare la gabbia sopra un termoforo (metà della gabbia) per aiutare a mantenere la temperatura corporea e monitorare attentamente l'animale.
- Gestisci prontamente eventuali segni di dolore, difficoltà respiratorie o comportamenti anomali.
- Nelle cure post-operatorie, 6 ore dopo l'intervento, iniettare una seconda dose di 0,05 mg/kg di buprenorfina. Il giorno successivo, 24 ore dopo l'intervento, iniettare una terza dose di 0,05 mg/kg di buprenorfina e una seconda dose di 5 mg/kg di ketoprofene.
- Monitorare i ratti fino al loro completo recupero della salute.
6. Ecocardiografia transtoracica
NOTA: Questo articolo mostra i dati ottenuti il 21° giorno dopo l'intervento, quando i ratti sono stati sottoposti a ecocardiografia transtoracica. Tuttavia, a seconda degli obiettivi della ricerca e dei requisiti del disegno dello studio, i ricercatori possono definire altri punti temporali per l'ecocardiografia transtoracica pre e post-PAB.
- Eseguire un'ecocardiografia transtoracica di base prima dell'intervento chirurgico per determinare il diametro del PA e selezionare l'ago di calibro appropriato utilizzato come elettrocatetere per generare la riduzione prevista del 60% del diametro del PA durante il PAB.
NOTA: In questo studio, sono stati utilizzati ratti Wistar maschi di 225-275 g e l'utilizzo di un ago da 19 G è stato appropriato per generare una riduzione del 60% del diametro del PA. - Pesare e anestetizzare i ratti con isoflurano inalato continuamente (3% e 2 L/min O2).
- Eseguire l'ecocardiografia transtoracica su ciascun animale utilizzando una sonda a settore/multielemento 12S (4,5-11,5 MHz) e un sistema di acquisizione delle immagini.
- Utilizzare la mappatura dei colori in una vista bidimensionale (2D) dell'asse corto parasternale posizionando la sonda 12S a livello della valvola aortica. Fare clic sul pulsante Color Doppler sulla macchina ecografica per visualizzare il modello di flusso sanguigno che attraversa l'area del banding dell'arteria polmonare (PAB) nel tronco polmonare.
- Eseguire il Doppler a onda continua (CW) attraversando il PAB guidato dalla mappatura dei colori nella vista 2D dell'asse corto parasternale per registrare le proprietà del flusso sanguigno che attraversa l'area del PAB, inclusa la velocità di picco (cm/s) e il gradiente di pressione medio (mmHg). Per ottenere le curve Doppler, regolare il volume del campione a livello del bendaggio dell'arteria polmonare.
- Applicare una vista apicale 2D a 4 camere posizionando la sonda 12S a livello dell'apice del cuore per dimostrare l'allargamento dell'AR e del RV dopo l'intervento chirurgico e determinare la dimensione orizzontale dell'AR all'estremità della sistole cardiaca (RAD) espressa in millimetri (mm).
- Applica la mappatura dei colori nella vista apicale 2D a 4 camere per rivelare il rigurgito tricuspidale dovuto al PAB acquisendo cine-loop sulla macchina ecografica.
- Eseguire l'ecocardiografia M-Mode in vista apicale a 4 camere incrociando la congiunzione dell'anulus tricuspidale e della parete laterale del ventricolo destro per studiare l'escursione sistolica del piano dell'anulus tricuspidale (TAPSE) espressa in mm.
- Utilizzare l'imaging Doppler tissutale (TDI) nella vista apicale a 4 camere a livello della congiunzione dell'anulus tricuspidale e della parete laterale del ventricolo destro per la misurazione della contrattilità sistolica (Sr) della parete laterale del ventricolo destro espressa in centimetri al secondo (cm/s) per valutare le prestazioni sistoliche del ventricolo destro.
- Registrare il flusso diastolico trans-tricuspidale (TTF) utilizzando il Doppler a onde pulsate nella vista apicale a 4 camere per studiare le proprietà diastoliche del ventricolo destro, tra cui la velocità di picco nell'onda di riempimento precoce (E), l'onda di riempimento atriale (A) e il rapporto di E/A nel TTF.
- Eseguire l'ecocardiografia M-Mode nella vista dell'asse lungo parasternale a livello della valvola aortica per misurare il tratto di efflusso del ventricolo destro alla fine della diastole cardiaca (RVOT, espressa in millimetri) e la dimensione dell'atrio sinistro alla fine della sistole cardiaca (LADs, espressa in millimetri).
- Eseguire l'ecocardiografia 2D M-Mode in vista parasternale dell'asse corto a livello dei muscoli papillari per valutare le dimensioni del ventricolo sinistro alla fine della sistole e alla diastole (LVD e LVDd); e spessore della parete anteriore del ventricolo sinistro alla diastole terminale (LVAWd), tutti espressi in millimetri.
- Eseguire la modalità M 2D in vista parasternale ad asse corto per determinare l'accorciamento frazionario del ventricolo sinistro (LVFS, espresso in percentuale) e la frazione di eiezione ventricolare sinistra (LVEF, espressa in percentuale).
7. Studio elettrofisiologico (Figura 3)
- Mantenere i ratti in anestesia dopo l'ecocardiografia in vivo per lo studio elettrofisiologico transesofageo (EPS) in vivo .
- Inserire gli elettrodi ECG sotto la pelle dei ratti (1 vicino all'arto anteriore sinistro, 1 vicino all'arto posteriore destro e 1 vicino all'arto posteriore sinistro).
- Introdurre delicatamente nell'esofago un catetere quadripolare 4F con una distanza interpolare di 5 mm (Figura 3A).
- Regolare la posizione del catetere transesofageo vicino all'artrite reumatoide determinando con precisione quando l'onda P, che rappresenta le contrazioni atriali sull'ECG di superficie, corrisponde all'onda P ottenuta con l'ECG del catetere transesofageo (Figura 3A, B).
- Determinare la soglia di stimolazione per ogni animale. Questa soglia è la tensione minima alla quale lo stimolatore influenza direttamente la frequenza cardiaca.
- Valutare la vulnerabilità alla fibrillazione atriale applicando un burst di tensione equivalente a 4 volte la tensione di soglia seguendo un protocollo di 3 serie di 12 burst di stimolazione, ciascuna della durata di 3 s a 50 Hz, seguita da 2 s di riposo (1 min/set). Tra ogni serie, i ratti hanno avuto un periodo di riposo di 1 minuto 9,13,21.
- Identificare e quantificare, dopo ogni raffica, l'insorgenza di tachiaritmie cardiache, inclusa la FA o il flutter atriale.
NOTA: La FA è definita come battiti atriali irregolari e ultrarapidi (>800 bpm). Il flutter atriale è definito come un ritmo atriale regolare ma rapido associato all'assenza dell'onda P o alla presenza di un pattern regolare di più onde P tra intervalli R-R regolarmente consecutivi. Sono considerati solo gli episodi aritmici di durata superiore a 1 s. - Evitare di interrompere gli episodi in corso di FA o flutter atriale interrompendo la serie successiva di stimolazioni se il ritmo sinusale non viene recuperato da solo entro il periodo di riposo tra due stimolazioni consecutive.
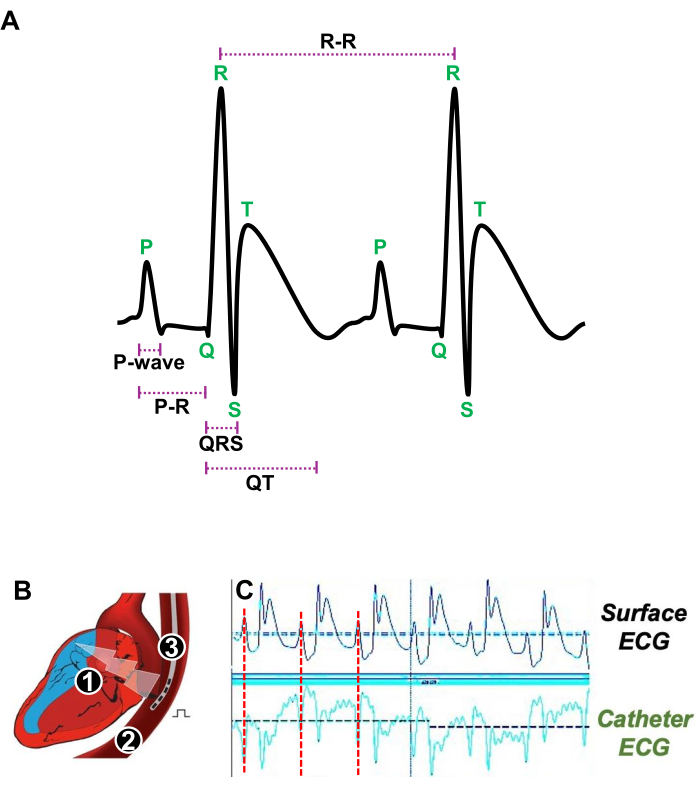
Figura 3: Illustrazione dei battiti cardiaci a riposo e della posizione appropriata di un catetere transesofageo per lo studio elettrofisiologico in vivo . (A) ECG rappresentativo di due battiti cardiaci consecutivi a riposo che mostrano l'onda P, l'intervallo PR, il complesso QRS, l'intervallo QT e l'intervallo R-R. (B) Schema di una sezione longitudinale del cuore (1) e dell'esofago (2) in cui viene introdotto un catetere quadripolare (3) per stimolare e acquisire l'ECG atriale. (C) Segnali ECG rappresentativi che mostrino la posizione preferita del catetere transesofageo quando il segnale atriale (linea rossa) dall'ECG di superficie (tracce superiori) coincide con il segnale atriale dell'ECG del catetere (tracce inferiori). Clicca qui per visualizzare una versione più grande di questa figura.
8. Analisi ECG
NOTA: Le registrazioni e le stimolazioni ECG sono state condotte utilizzando un software di acquisizione ECG. Le analisi sono state eseguite utilizzando un software di analisi ECG (Figura 3A).
- Misurare la durata dell'onda P corrispondente alla contrazione atriale espressa in millisecondi (ms).
- Determinare l'intervallo PR (espresso in millisecondi) corrispondente alla durata della conduzione elettrica attraverso il nodo atrioventricolare (AV).
- Riportare la durata del complesso QRS (espressa in millisecondi) corrispondente alla depolarizzazione ventricolare.
- Valutato l'intervallo QT (espresso in millisecondi) che riflette la durata totale della depolarizzazione e ripolarizzazione ventricolare.
- Quantifica l'intervallo RR (espresso in millisecondi) indicando la durata tra due battiti cardiaci consecutivi e determinando la frequenza cardiaca.
9. Analisi istologiche
- Eutanasia dei ratti mediante dissanguamento in anestesia con isoflurano (5%, 2 L/min O2) il giorno 21 dopo il PAB.
- Isolare l'AR e il LA per analizzare il rimodellamento istologico atriale associato o meno a RHF e aritmie cardiache.
- Eseguire una sezione trasversale dei cuori appena asportati, a 5 mm dall'apice, per valutare il rimodellamento ventricolare associato o meno a RHF e aritmie cardiache.
- Fissare i campioni miocardici in formalina e colorare i vetrini istologici con la soluzione tricromica22 di Masson per quantificare lo spessore e la dilatazione della parete ventricolare e la fibrosi atriale a D21 post-PAB.
10. Analisi statistiche
- Valutare la normalità delle distribuzioni con il test di Shapiro-Wilk. Confronta i dati normalmente distribuiti utilizzando il test t di Student.
- Se i dati sono una distribuzione non parametrica, eseguire un test di Mann-Whitney. Analizza variabili categoriali come l'inducibilità della fibrillazione atriale utilizzando il test esatto di Fisher.
- Esprimere i risultati come media ± errore standard alla media (S.E.M.). Considera le differenze statisticamente significative a valori di P a due code < 0,05.
Risultati
Conferma visiva dell'appropriata legatura del tronco PA durante l'intervento chirurgico
Durante la procedura PAB, un'indicazione di un buon posizionamento della sutura è un aumento immediato della pressione sanguigna e una dilatazione immediata del ventricolo destro e della radice del tronco PA alla giunzione con il ventricolo destro. La sutura non deve muoversi per garantire un sovraccarico di pressione costante e permanente per 3 settimane. In questo studio, l'uso ...
Discussione
Il successo delle prestazioni del PAB è la parte più cruciale di questo protocollo. È importante distinguere correttamente l'aorta e il tronco PA. L'isolamento dell'AP deve essere eseguito meticolosamente per evitare lacerazioni, sanguinamento e morte durante la procedura. L'applicazione della sutura attorno all'elettrocatetere 19G deve essere eseguita rapidamente e seguita dall'immediata rimozione dell'elettrocatetere, per evitare un'eccessiva "ostruzione completa" del PA dovuta alla...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori sono grati a Colombe Roy, YanFen Shi, Sandra Querry e Josiane Deslandes per le prestazioni tecniche dell'ecocardiografia transtoracica e a Nathalie L'Heureux per l'assistenza tecnica preliminare durante la standardizzazione del metodo PAB. Siamo grati ai membri della struttura per la cura degli animali del Montreal Heart Institute.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chlorine Injection USB (100 ml) | Baxter | JB1302P | Solution used for drugs (analgesic and anti-inflammatory) dilution and for preparing saline water syringes dedicated to rehydrating the animal after the surgery |
| 19 G x 1 1/2 PrecisionGlide Needle | BD | 305187 | Needle modified (bent and blunted) to be used as a spacer during for the partial constriction of the pulmonary trunk |
| 2" x 2" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply | AMD-Ritmed | A2101-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 4" x 4" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply (x200) | AMD-Ritmed | A2100-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 5-0 Vicryl Violet Suture RB-1 1/2 Circle Needle 17mm 27" | Ethicon | J303H | Synthetic absorbable sterile surgical suture with a taperpoint needle used for muscle and skin wounds closure. |
| Anafen (100 mg/mL) | Merial Canada, Inc. | 1938126 | Diluted injectable solution of ketoprofen administered as a nonsteroidal anti-inflammatory, analgesic and antipyretic drug. |
| AutoClip System | FST | 12020-00 | Can be used to close the skin wound. Includes a clip applier, wound clips (9 mm) and a clip remover. |
| Dumont #5/45 Forceps | FST | 11251-35 | Dumoxel forceps with tips angled at 45°. Used to tighten the knots around the spacer placed on the pulmonary trunk. |
| Fine Scissors - Sharp | FST | 14060-10 | Stainless steel iris scissors dedicated to intercostal muscles incision and suture cutting. |
| Forane (Isoflurane) 100 mL | Baxter Canada | BAXCA2L9100 | Inhalation anesthetic used for rodents during their PAB surgery. |
| IV Catheter 16 G x 1.77 " (Straight) | BD Insyte | 381257 | Catheter used as an endotracheal tube with its metal stylet blunted. |
| Light LED 130 F - DrMach | Eickemeyer | M130300 | LED wall mounted light. |
| Magnetic Fixator Retraction System: Base plate | FST | 18200-50 | Metal plate on which the associated fixtures are installed. It is placed around the heating plate. |
| Magnetic Fixator Retraction System: Elastomer (2 m Roll) | FST | 18200-07 | Used to attach the retractors to the fixators. |
| Magnetic Fixator Retraction System: Fixators | FST | 18200-02 | Movable anchors that can be placed on the base plate. |
| Magnetic Fixator Retraction System: Retractors | FST | 18200-11 | Retractors allowing to maintain the surgical wound with the desired opening |
| Metzenbaum Scissors (Curved) | FST | 14017-14 | Stainless steel blunt scissors used for blunt dissection of the skin and muscles. |
| Micro-Adson Forceps | FST | 11018-12 | Stainless steel serrated forceps used to grasp skin and other tissues. |
| Oster Golden A5 2-Speed Clipper | Oster Professional | 34264416949 | Pet grooming clipper used to prepare the surgical field. Since it's meant to be used with large animals, the user needs to be careful with rats. |
| Rodent heating plate or warming system | Custom made | N/A | Plate connected to a unit equipped with a LED screen displaying the temperature detected by the rectal probe as well as the target temperature. |
| Rodent Ventilator Model 683 | Harvard Apparatus | 74240-2 | Mechanical ventilator used for small laboratory animals (max 5 kg). |
| Semken Forceps with Serrations (Curved) | FST | 11009-13 | Stainless steel forceps used for tissue dissection. |
| Semken Forceps with Serrations (Straight) | FST | 11008-13 | Stainless steel forceps used for tissue dissection. |
| Silky Fresh Hair removal Cream | Veet | 62200825036 | Hair removal product used to prepare the surgical site after shaving. |
| Soluprep | 3M | 103.26 | Bottled antiseptic solution tinted with 2% chlorhexidine and 70 % alcohol 225 mL. |
| Stainless steel spatula 195 mm | Heathrow Scientific | HS15907 | Spatula used as a tongue depressor during rat intubation. |
| Stereomicroscope System SZ61TR | Olympus | 88-126 | Microscope equipped with binoculars and a built-in camera allowing for video filming. |
| Sterile Sodium Chloride 0.9% Irrigation Bottle (60 mL) | Saline H2O | 25-6048SA-L | Solution used to keep the wound moist throughout the surgery. |
| Surgical Scissors - Sharp-Blunt (Straight) | FST | 14001-12 | Stainless steel scissors used to make the initial skin incision. |
| Suture 5-0 Silk No Needle | Henry Schein | 102-6344 | Silk thread used to do the constriction of the pulmonary trunk |
| Systane Ointment | Alcon | 2444062 | Eyes lubricant providing a temporary relief of burning and irritation caused by the dryness of the eyes during surgery. |
| SZ2-STU2 stereomicroscope stand | Olympus | N1198900 | The arm attached to the base provides a great freedom of movement to the microscope head. |
| Tissue forceps - 1X2 Teeth | FST | 11021-15 | Stainless steel forceps allowing to grasp, hold and manipulate tissues (skin and muscles). |
| Transpore Surgical Tape | 3M | 1527-1 | Medical tape used to immobilized the rats' forelimbs and hindlimbs. |
| Vetbond Tissue Adhesive (3 mL) | 3M | 1469SB | Surgical glue that can be applied in small amounts on the skin It can be used as a complement to subcutaneous sutures. |
| Vetergesic Multidose (0.3 mg/mL) 10 mL | Ceva Canada | 2342510 | Diluted injectable solution of buprenorphine administered as an analgesic drug. |
| Veterinary anesthesia evaporator Tec 4 | Dispomed | 34001 Iso | Enables vaporization of isoflurane and concentration at 0–5%. |
Riferimenti
- Cassady, S. J., Ramani, G. V. Right heart failure in pulmonary hypertension. Cardiol Clin. 38 (2), 243-255 (2020).
- Campo, A., et al. Outcomes of hospitalization for right heart failure in pulmonary arterial hypertension. Eur Respir J. 38 (2), 359-367 (2011).
- Naeije, R., Manes, A. The right ventricle in pulmonary arterial hypertension. Eur Respir Rev. 23 (134), 476-487 (2014).
- Vonk-Noordegraaf, A., et al. Right heart adaptation to pulmonary arterial hypertension: physiology and pathobiology. J Am Coll Cardiol. 62 (25 Suppl), D22-D33 (2013).
- Olsson, K. M., Nickel, N., Tongers, J., Hoeper, M. M. Atrial flutter and fibrillation in patients with pulmonary hypertension. Int J Cardiol. 167 (5), 2300-2305 (2013).
- Mercurio, V., et al. Pulmonary arterial hypertension and atrial arrhythmias: incidence, risk factors, and clinical impact. Pulm Circ. 8 (2), 2045894018769874 (2018).
- Dignam, J. P., Scott, T., Kemp-Harper, B., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2021).
- Silva, A. L., et al. Monocrotaline induces acutely cerebrovascular lesions, astrogliosis and neuronal degeneration associated with behavior changes in rats: A model of vascular damage in perspective. Neurotoxicology. 94, 59-70 (2023).
- Hiram, R., et al. Right atrial mechanisms of atrial fibrillation in a rat model of right heart disease. J Am Coll Cardiol. 74 (10), 1332-1347 (2019).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Jalal, Z., et al. Unexpected internalization of a pulmonary artery band in a porcine model of tetralogy of Fallot. World J Pediatr Congenit Heart Surg. 8 (1), 48-54 (2017).
- Akazawa, Y., et al. Pulmonary artery banding is a relevant model to study the right ventricular remodeling and dysfunction that occurs in pulmonary arterial hypertension. J Appl Physiol. 129 (2), 238-246 (2020).
- Le Quilliec, E., et al. Atrial cardiomyocytes contribute to the inflammatory status associated with atrial fibrillation in right heart disease. Europace. 26 (4), euae082 (2024).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Cheng, T. C., Philip, J. L., Tabima, D. M., Hacker, T. A., Chesler, N. C. Multiscale structure-function relationships in right ventricular failure due to pressure overload. Am J Physiol Heart Circ Physiol. 315 (3), H699-H708 (2018).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Prihadi, E. A., et al. Morphologic types of tricuspid regurgitation. Characteristics and prognostic implications. JACC: Cardiovasc Imaging. 12 (3), 491-499 (2019).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulm Circ. 7 (3), 572-587 (2017).
- Liu, Z., et al. Low-voltage zones as the atrial fibrillation substrates: Relationship With initiation, perpetuation, and termination. Front Cardiovasc Med. 8, 705510 (2021).
- Tomasello, G., et al. Simple and fast orotracheal intubation procedure in rats. Acta Biomed. 87 (1), 13-15 (2016).
- Halațiu, V. B., Perian, M., Balan, A. I., Scridon, A. Transesophageal atrial burst pacing for atrial fibrillation induction in rats. J Vis Exp. (180), e63567 (2022).
- Prophet, E. B., Mills, B., Arrington, J. B., Sobin, L. H. . Laboratory Methods in Histotechnology. , (1992).
- Silva, J. M. A., et al. Hypertrophy of the right ventricle by pulmonary artery banding in rats: a study of structural, functional, and transcriptomics alterations in the right and left ventricles. Front Physiol. 14, 1129333 (2023).
- Camacho, P., Fan, H., Liu, Z., He, J. Q. Small mammalian animal models of heart disease. Am J Cardiovasc Dis. 6 (3), 70-80 (2016).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Ukita, R., et al. A large animal model for pulmonary hypertension and right ventricular failure: Left pulmonary artery ligation and progressive main pulmonary artery banding in sheep. J Vis Exp. (173), e62694 (2021).
- Myers, P. O., et al. Impact of age and duration of banding on left ventricular preparation before anatomic repair for congenitally corrected transposition of the great arteries. Ann Thorac Surg. 96 (2), 603-610 (2013).
- Liu, C., et al. Reverse remodeling of pulmonary arterioles after pulmonary artery banding in patients ≥ 2 years old with severe pulmonary arterial hypertension and congenital heart disease. Pediatr Cardiol. 40 (5), 958-964 (2019).
- Roy, B., Vacas, S., Ehlert, L., McCloy, K., Saggar, R., Kumar, R. Brain structural changes in patients with pulmonary arterial hypertension. J Neuroimaging. 31 (3), 524-531 (2021).
- Hiram, R. Resolution-promoting autacoids demonstrate promising cardioprotective effects against heart diseases. Mol Biol Rep. 49 (6), 5179-5197 (2022).
- Hiram, R. Cardiac cytokine therapy? Relevance of targeting inflammatory mediators to combat cardiac arrhythmogenic remodeling. Int J Cardiol Heart Vasc. 37, 100918 (2021).
- Al-U'datt, D. G. F., et al. Implications of enigmatic transglutaminase 2 (TG2) in cardiac diseases and therapeutic developments. Biochem Pharmacol. 201, 115104 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon