Method Article
Un modello murino per il deterioramento cognitivo vascolare e la demenza basato sulla stenosi dell'arteria carotide comune bilaterale asimmetrica guidata da ago
In questo articolo
Riepilogo
Il metodo dell'ago della stenosi bilaterale asimmetrica dell'arteria carotide comune è proposto per creare un modello murino per il deterioramento cognitivo vascolare e la demenza. Si traduce in risultati a lungo termine rispetto ai modelli precedentemente stabiliti ed è compatibile con la risonanza magnetica dal vivo. La rappresentazione visiva che dimostra la procedura fornisce una guida per padroneggiare l'intervento chirurgico.
Abstract
Il deterioramento cognitivo vascolare e la demenza (VCID) derivano da una lesione cerebrale vascolare. Data l'elevata incidenza di VCID, che si prevede continuerà ad aumentare con l'invecchiamento della popolazione, è fondamentale stabilire un solido modello animale per la malattia. Questo articolo presenta un nuovo metodo per creare un modello murino di VCID basato sulla stenosi bilaterale asimmetrica dell'arteria carotide comune, che imita l'ipoperfusione cerebrale cronica umana causata dall'aterosclerosi carotidea.
In breve, le arterie carotidi comuni (CCA) vengono legate ad aghi di diverso calibro (32 G per il CCA destro e 34 G per il CCA sinistro) utilizzando suture di seta 7-0 seguite dalla rimozione immediata dell'ago. Gli anelli di sutura rimanenti causano una riduzione persistente del flusso sanguigno e un deterioramento cognitivo a lungo termine associato a lesioni della sostanza bianca, microinfarti e gliosi reattiva, imitando così da vicino la patogenesi della VCID. È importante sottolineare che, in questo modello ad ago, le rappresentazioni cliniche non si invertono con il tempo, fornendo un deterioramento cognitivo affidabile a lungo termine. Inoltre, il tasso di sopravvivenza 24 settimane dopo l'intervento chirurgico è stato dell'81,6%, che è più alto rispetto agli altri modelli consolidati di VCID con un livello simile di riduzione del flusso sanguigno.
Ulteriori vantaggi includono il basso costo del materiale e la compatibilità con la risonanza magnetica per monitorare le lesioni cerebrali negli animali vivi, poiché non viene impiantato alcun metallo. La sfida principale nell'impiego del modello ad ago di VCID è la necessità di sviluppare competenze chirurgiche avanzate poiché i CCA di topo hanno un diametro inferiore a 0,6 mm e sono molto fragili. Una rappresentazione visiva di alta qualità dell'intervento chirurgico aiuterà quindi i ricercatori a padroneggiare questa tecnica e a far progredire la nostra comprensione della VCID, portando potenzialmente allo sviluppo di nuove modalità terapeutiche per ridurre il devastante declino cognitivo associato alla VCID.
Introduzione
Il deterioramento cognitivo vascolare e la demenza (VCID) sono la seconda causa principale di declino cognitivo. Nonostante gli innegabili progressi compiuti verso la comprensione della patogenesi della VCID e dei suoi fattori di rischio, il meccanismo di come la disfunzione neurovascolare contribuisce al declino delle capacità cognitive rimane vago. Un certo numero di modelli di roditori di varia complessità sono stati stabiliti per indurre l'ischemia cerebrale a imitare le rappresentazioni cliniche del VCIDumano 1. Alcuni di questi modelli si basano sulla creazione di ipoperfusione cerebrale transitoria; tuttavia, la maggior parte di essi sono generati inducendo ipoperfusione cerebrale cronica, il principale meccanismo che porta alla VCID nei pazienti umani2.
L'ipoperfusione cerebrale cronica può essere introdotta utilizzando l'occlusione bilaterale dell'arteria carotide (BCAO), che causa esiti gravi, ma spesso fatali, o la stenosi bilaterale dell'arteria carotide (BCAS). Il BCAS viene solitamente eseguito utilizzando uno dei due metodi: posizionando microbobine identiche attorno a entrambi i CCA, con conseguente stenosi simmetrica3; o impiantando un costrittore ameroide e una microbobina attorno ai CCA sinistro e destro, rispettivamente, causando un'occlusione graduale e una riduzione del flusso sanguigno del ~50% sui CCA sinistro e destro, rispettivamente4. Gli svantaggi di entrambi i metodi sono l'alto tasso di mortalità se la stenosi è troppo grave o se la CCA è occlusa e l'incompatibilità con la risonanza magnetica su animali vivi a causa della presenza di metallo nel corpo. Sono stati stabiliti anche alcuni modelli genetici murini 1,5,6,7,8. Altre opzioni includono l'arteriopatia cerebrale autosomica dominante con infarti sottocorticali e i modelli murini di leucoencefalopatia 9,10. Tuttavia, nessuno dei modelli proposti imita l'intera gamma di danni ischemici che si presentano nei pazienti umani, e quindi la ricerca di modelli VCID aggiornati continua.
Questo articolo presenta un nuovo metodo chirurgico per indurre la stenosi bilaterale asimmetrica dell'arteria carotide comune (ABCS) nei topi, in cui la stenosi CCA viene eseguita utilizzando suture di seta ed è controllata legando CCA ad aghi di vari diametri seguita da una rimozione immediata dell'ago11. Di conseguenza, gli anelli di sutura di diametri precisi vengono lasciati permanentemente sui CCA per garantire la stenosi cronica. Il vantaggio dell'utilizzo dell'ABCS rispetto a un metodo simmetrico è che l'ipoperfusione moderata a destra garantisce una migliore sopravvivenza, mentre l'ipoperfusione più pronunciata a sinistra assicura rappresentazioni neurologiche e patologiche a lungo termine. Questo modello ad ago presenta diversi vantaggi rispetto ai tradizionali modelli BCAS11 come risultati persistenti, minore mortalità, costo ultra-basso, flessibilità e la possibilità di utilizzare approcci analitici speciali.
Per approfondire questi vantaggi, tre legature causano un frammento di stenosi CCA piuttosto che una stenosi del punto focale, portando a ipoperfusione persistente, lesioni della sostanza bianca e declino cognitivo in ~90% dei topi. La mortalità dei topi ago è stata del ~17%, inferiore a quella del limitatore ameroide/microbobina modello4 di Hattori, che ha una mortalità del ~30% nell'arco di 16 settimane in base alla nostra esperienza. Ogni modello BCAS costa in genere circa $ 100 a causa delle costose microbobine o limitatori ameroidi, mentre il modello ad ago costa solo circa $ 1 per topo. Inoltre, il calibro degli aghi potrebbe essere modificato a seconda dei requisiti specifici della ricerca per la restrizione del flusso sanguigno su entrambi i lati. Nella variazione presentata nel presente articolo, il modello dell'ago imita la fisiopatologia della stenosi carotidea grave, causata da stenosi permanente unilaterale senza occlusione, che è la rappresentazione più comune della malattia nella clinica11. Inoltre, i limitatori ameroidi e le microbobine utilizzate nei modelli BCAS tradizionali sono realizzati in metallo, che può causare artefatti significativi se viene eseguita la risonanza magnetica in vivo , anche se il metallo non viene impiantato nel cervello ma nel torace. Potrebbe essere difficile prevedere in che modo esattamente la presenza di metallo influenzerà l'imaging.
Generalmente, la risonanza magnetica in vivo che viene eseguita dopo l'impianto di microbobine è solitamente una semplice imaging anatomico, non adatto per l'analisi quantitativa di insulti multipli, che è altamente desiderabile per la ricerca VCID. Al contrario, il modello di ago qui presentato utilizza solo suture di seta ed è pienamente compatibile con qualsiasi tipo di risonanza magnetica in vivo. Ciò è significativo per due motivi: (1) la risonanza magnetica è estremamente sensibile alle piccole lesioni cerebrali, ai microsanguinamenti o alla siderosi superficiale12, quindi è preferita rispetto agli altri metodi di analisi, come la TAC (2) la risonanza magnetica in vivo dovrebbe essere preferita alla risonanza magnetica ex vivo , poiché la ricerca VCID può indubbiamente trarre vantaggio dal monitoraggio delle dinamiche di progressione/guarigione della lesione, soprattutto in risposta ai nuovi trattamenti proposti. Inoltre, la risonanza magnetica funzionale (fMRI) può essere eseguita nel modello dell'ago per fornire informazioni critiche sull'integrità dell'accoppiamento neurovascolare in risposta all'ipoperfusione cerebrale. Pertanto, la possibilità di utilizzare la risonanza magnetica in vivo apre la strada per un'analisi approfondita dell'intricata correlazione tra le dimensioni e la posizione delle lesioni e la funzione cognitiva, nonché l'accoppiamento neurovascolare, soprattutto negli studi di farmacodinamica.
Protocollo
Tutti i protocolli sugli animali sono stati approvati dall'Institutional Animal Care and Use Committee dell'Università di Pittsburgh ed eseguiti in conformità con la National Institutes of Health Guide for the Care and Use of Laboratory Animals. Le tecniche sterili devono essere mantenute in tutti gli interventi chirurgici di sopravvivenza. Negli esperimenti presentati sono stati utilizzati topi maschi C57BL/6J di dodici settimane con peso corporeo di 25-30 g.
1. Preparazione dei materiali e spazio di lavoro
- Preparare i frammenti di ago (~4 mm di lunghezza; 32 G per il CCA destro e 34 G per il CCA sinistro). Smussare leggermente l'estremità affilata degli aghi picchiettando delicatamente l'estremità affilata contro una superficie dura e separare accuratamente gli aghi dai pezzi di plastica utilizzando un portaaghi. Suture di seta 7-0 pretagliate in pezzi lunghi 1-2 cm.
- Sterilizzare strumenti chirurgici, frammenti di aghi e suture mediante sterilizzazione in autoclave o qualsiasi altro metodo appropriato.
2. Esecuzione dell'intervento chirurgico
- Pesare il topo e indurre l'anestesia posizionando il topo per 2-3 minuti in una camera ventilata con isoflurano al 3% in una miscela di 25% O2 e 72% N2O.
- Posizionare il mouse (lato ventrale rivolto verso l'alto) su un termoforo coperto da un foglio chirurgico sterile per mantenere una temperatura corporea costante (37 °C) e fissare una maschera facciale per la ventilazione con isoflurano all'1% in una miscela di 25% O2 e 74% N2O. Fissare gli arti del topo con nastro adesivo.
- Radere il pelo del collo con un rasoio elettrico. Pulisci i capelli fini con nastro adesivo o un aspirapolvere per tastiera.
- Disinfettare il sito chirurgico con la soluzione di Betadine (10% di iodio). Elimina la pelle con etanolo al 70%. Ripetere l'infezione 3 volte. Assicurarsi che il livello di anestesia sia adeguato in caso di mancata risposta a un fermo pizzicamento del dito del piede (riflesso del pedale).
- Coprire l'area chirurgica. Quindi, praticare un'incisione verticale sulla linea mediana lungo la trachea e separare le ghiandole tiroidee bilaterali con una micro pinza. Estrarre la pelle e il tessuto con piccoli divaricatori cutanei sterili.
- Al microscopio, utilizzare una pinzetta angolata per esporre con cura e sezionare smussata uno dei CCA dal nervo vago e dalla guaina. Utilizzare acqua sterile o soluzione salina tamponata con fosfato (PBS) per bagnare il sito di incisione se il CCA tende ad attaccarsi alla pinza. Posizionare una piccola siringa di plastica sotto il collo per sostenere la postura, se necessario.
NOTA: Prestare particolare attenzione a non rompere il CCA. - Infilare tre frammenti di sutura di seta pretagliati (misura 7-0) sotto il CCA (a 1 mm di distanza) utilizzando una pinzetta angolata.
- Disegna un doppio nodo molto sciolto attorno al CCA su uno dei frammenti di sutura.
NOTA: Bagnare il sito chirurgico e le suture con acqua sterile o PBS potrebbe aiutare a disegnare un nodo. - Posizionare un frammento di ago (32 G per il CCA destro e 34 G per il CCA sinistro) parallelo al CCA, all'interno del nodo sciolto (Figura 1A). Stringere con cura il nodo primario attorno all'ago e al CCA fino a quando non si osserva alcun flusso sanguigno e fissarlo con un nodo secondario. Estrarre immediatamente l'ago per ripristinare il flusso sanguigno parziale e tagliare le estremità della sutura.
NOTA: Il chirurgo deve fare molta attenzione a tagliare le estremità della sutura dopo che i nodi sono stati completati. Tagliare troppo vicino al nodo potrebbe comportare l'allentamento del nodo. Inoltre, è fondamentale osservare il CCA dopo aver rimosso l'ago per assicurarsi che il flusso sanguigno sia ancora abilitato a valle del nodo. Se il CCA appare molto pallido dopo la rimozione dell'ago, significa che il CCA è sovracompresso. - Ripetere i passaggi 2.8-2.9 per il 2° e il 3° filo di sutura sullo stesso CCA, a circa 1 mm di distanza l'uno dall'altro (Figura 1B).
- Ripetere i passaggi 2.6-2.10 con il CCA opposto utilizzando un frammento di ago da 32 G.
- Esaminare attentamente se entrambi i CCA sono legati in modo efficiente: verificare che tutte e tre le bande di sutura siano saldamente annodate in posizione ma non siano così strette da bloccare completamente il flusso sanguigno (verificare che i CCA non siano pallidi a valle dei nodi). Verificare che le tre bande di sutura su ciascun CCA siano distanti circa 1 mm l'una dall'altra.
- Chiudere la pelle utilizzando suture sterili in monofilamento.
- Immediatamente dopo l'intervento, iniettare 100-150 μL di ketoprofene (1 mg/mL di stock; 5 mg/kg di peso corporeo) per via intraperitoneale per alleviare il dolore postoperatorio. Ripetere questa iniezione 24 ore e 48 ore dopo l'intervento.
- Posizionare il topo su una coperta omeotermica a 37 °C per un monitoraggio continuo per 2 ore prima di riportare l'animale nella struttura per animali.
NOTA: Per la procedura fittizia, i passaggi 2.7-2.12 devono essere omessi.
3. Validazione del modello
NOTA: La lesione cerebrale è stata analizzata con risonanza magnetica in vivo e ulteriormente verificata con la colorazione Luxol fast blue (LFB) e i test comportamentali.
- Imaging della perfusione sanguigna cerebrale.
- Anestetizzare il topo utilizzando isoflurano all'1-1,5%. Sterilizzare il sito chirurgico con la soluzione di Betadine (10% di iodio). Quindi, deiodare la pelle con etanolo al 70%.
- Fissare il cranio dell'animale in una cornice stereotassica. Praticare un'incisione sagtale sulla linea mediana nel cuoio capelluto dall'osso frontale a quello occipitale per esporre il cranio e pulire la superficie del cranio con soluzione fisiologica sterile.
- Posiziona una fotocamera del dispositivo ad accoppiamento caricato a 10 cm sopra il cranio utilizzando un sistema di macchioline laser bidimensionale. Posizionare un supporto per sonda sul sito della craniectomia e fissarlo saldamente.
- Eseguire immagini di perfusione sanguigna 5 minuti prima dell'intervento chirurgico e immediatamente dopo il rilascio dell'ago o 7, 14, 21, 28, 35 e 42 giorni dopo l'intervento.
- Chiudere la pelle utilizzando suture sterili in monofilamento. Iniettare 100-150 μl di ketoprofene (1 mg/mL di stock; 5 mg/kg di peso corporeo) per via intraperitoneale per alleviare il dolore postoperatorio. Ripetere l'iniezione per 24 ore e 48 ore.
- In vivo MRI
- Anestetizzare i topi utilizzando isoflurano all'1-1,5%, con respirazione continuamente monitorata e temperatura mantenuta a 37 °C con aria calda durante l'acquisizione dell'immagine.
- Esegui la risonanza magnetica in vivo utilizzando uno scanner da 9,4 T, una bobina Tx da 86 mm e un array di ricevitori cerebrali di topo a 4 canali, eseguendo il software associato. Dopo il posizionamento e le scansioni pilota, acquisire immagini pesate in T2 (T2WI) utilizzando una sequenza RARE (Rapid Acquisition with Relaxation Enhancement), con i seguenti parametri: Tempo di eco/Tempo di ripetizione (TE/TR) = 40/4.000 ms, medie = 8.256 × 256 matrice, 16 fette con uno spessore della fetta di 0,5 mm, un fattore RARE = 4 e un campo visivo (FOV) di 20 x 20 mm.
- Raccogli i dati DTI (Diffusion Tensor Imaging) utilizzando una sequenza di imaging EPI (Echo Planar Imaging)-DTI utilizzando la stessa geometria e gli stessi parametri del T2WI con le seguenti eccezioni: TR/TE = 2.300/22 ms, matrice di acquisizione = 128 x 128, 2 segmenti, 5 immagini A0 e 30 immagini di diffusione non colline, Δ/δ = 10/3 ms e un valore b = 1.000 s/mm2.
- Analizza i dati DTI utilizzando il software DSI Studio (http://dsistudio.labsolver.org/), alla ricerca di differenze nei parametri scalari di diffusione (anisotropia frazionaria (FA), diffusività media (MD), diffusività assiale (AD) e diffusività radiale (RD)). Disegna le regioni di interesse (ROI) per il corpo calloso (CC), la capsula esterna (EC), la capsula interna (IC), la fimbria, la commessura anteriore (AC), il cingolo (Cing), l'ippocampo (ippopotamo), la corteccia (C) e lo striato (Str) da entrambi gli emisferi.
- Colorazione blu veloce Luxol (LFB)
- Preparare le sezioni cerebrali: fissare il cervello con PFA al 4% per 24 ore e poi immergere il cervello nel saccarosio al 30% fino a quando il cervello affonda. Incorporare il cervello nel composto OCT su ghiaccio secco. Tagliare una fetta di cervello coronale spessa 20 μm su un microtomo scorrevole. Conservare le fette di cervello in una soluzione di conservazione (30% glicerolo/30% glicole etilenico in PBS).
- Immergere le sezioni cerebrali in LFB (soluzione alcolica allo 0,1%), conservare a 56 °C per una notte e lavare con acqua distillata.
- Incubare le sezioni cerebrali in carbonato di litio allo 0,05% e disidratarle attraverso alcoli graduati.
- Colorare le sezioni con violetto cresillo allo 0,5% per 5 min, differenziato con etanolo al 70%.
- Montare le sezioni del cervello colorate con il mezzo di montaggio.
- Valutazione della funzione cognitiva con un test del labirinto d'acqua di Morris modificato
- Riempire un serbatoio circolare con acqua (25 oC, profondità 33 cm) e immergere una piattaforma quadrata in plexiglass ~10 x 10 cm2 1,2 cm sotto il livello dell'acqua, a 31 cm dal bordo nord, est, sud o ovest della piscina.
NOTA: Questa piattaforma deve rimanere nella stessa posizione per l'intera durata del test. - Accendi una videocamera montata a soffitto. Posizionare un mouse nel serbatoio (non rilasciare a goccia a livello dell'acqua), rivolto verso il muro e iniziando da nord-est, sud-est, sud-ovest o nord-ovest. Consenti al mouse di nuotare per un massimo di 90 s per trovare una piattaforma sommersa.
- Lasciare che il mouse rimanga sulla piattaforma sommersa per 30 s se la piattaforma viene trovata. Se la piattaforma non viene trovata, posizionare il mouse lì per 30 s.
- Lasciare riposare il mouse per 5 minuti e ripetere la prova di nuoto (passaggi 3.4.2 - 3.4.3) 2 volte.
- Asciuga il mouse con un pezzo di stoffa e rimettilo nella sua gabbia sotto una lampadina riscaldante.
- Ripeti tre prove di nuoto ogni giorno per 5 giorni consecutivi.
- Utilizzando le riprese video, calcola la latenza per la fuga (quanto tempo ci vuole per trovare la piattaforma in ogni prova).
- L'ultimo giorno di test, rimuovere la piattaforma e registrare il tempo che il mouse trascorre nel quadrante in cui si trovava precedentemente la piattaforma.
- Riempire un serbatoio circolare con acqua (25 oC, profondità 33 cm) e immergere una piattaforma quadrata in plexiglass ~10 x 10 cm2 1,2 cm sotto il livello dell'acqua, a 31 cm dal bordo nord, est, sud o ovest della piscina.
Risultati
Ipoperfusione cerebrale asimmetrica a lungo termine
Il flusso sanguigno CCA è stato misurato prima e immediatamente dopo il rilascio dell'ago dall'ultima (terza) legatura, come descritto in precedenza11. Il flusso sanguigno è stato ridotto del ~70% nel CCA sinistro e del ~50% nel CCA destro. La perfusione sanguigna cerebrale è stata monitorata dinamicamente utilizzando una macchiolina laser bidimensionale. L'intervento chirurgico ha causato ipoperfusione cerebrale in entrambi gli emisferi, con l'emisfero sinistro più gravemente colpito (Figura 2). L'ipoperfusione cerebrale viene mantenuta per almeno 24 settimane dopo l'interventochirurgico 11.
Minore mortalità
Il tasso di sopravvivenza per i topi maschi nell'arco di 6 settimane è stato dell'81,6% (Figura 3); I topi erano più inclini alla morte nella prima settimana dopo l'intervento chirurgico.
Rilevamento con risonanza magnetica in vivo di lesioni cerebrali
Le immagini pesate in T2 hanno rivelato regioni ipo o iperintense nell'ippocampo (Hippo), nella capsula esterna (EC), nella capsula interna (IC), nel corpo calloso (CC) e nello striato (Str) nei topi sottoposti a chirurgia ABCS, indicando una lesione cerebrale (Figura 4A). Il danno strutturale è stato osservato nelle mappe a colori codificate direzionalmente (DEC) del DTI dei topi ABCS rispetto allo sham (Figura 4B).
Le analisi quantitative hanno mostrato che i topi ABCS hanno mostrato un'anisotropia frazionaria (FA) significativamente più bassa nell'ippopotamo sinistro, IC, commessura anteriore (AC), cingolo (Cg) e Fimbria (Fi) rispetto allo sham (P < 0,05 rispetto allo sham), indicando una compromissione della microstruttura della sostanza bianca nell'emisfero sinistro (pannello in alto a sinistra, Figura 4C). Anche la FA nel Cg destro e la Fi nei topi ABCS sono state ridotte (P < 0,05 rispetto allo sham). La FA nell'IC sinistro e nella Fi erano significativamente inferiori a quelle del destro nei topi ABCS (P < 0,05, sinistra contro destra).
Allo stesso modo, una diffusività assiale (AD) significativamente inferiore è stata mostrata nei topi EC, IC, Str e Fi sinistri rispetto agli sham, suggerendo una lesione assonale (pannello in alto a destra, Figura 4C (P < 0,05 rispetto a sham)). Solo lo Str sinistro ha mostrato una riduzione media della diffusività (MD) nei topi ABCS rispetto allo sham (pannello in basso a sinistra, Figura 4C). La differenza di diffusività radiale (RD) è stata osservata in CC, Str e Fi a sinistra nei topi ABCS (pannello in basso a destra, Figura 4C), suggerendo infiammazione e aumento della cellularità in queste regioni13.
Lesione cerebrale asimmetrica nei due emisferi e danno nelle regioni della sostanza bianca nell'emisfero sinistro
La lesione cerebrale è stata inoltre analizzata con la colorazione LFB utilizzando la procedura descritta in precedenza14 (Figura 5). Le immagini a bassa potenza hanno mostrato una colorazione blu più chiara in EC e Str, suggerendo demielinizzazione in queste regioni. Immagini ad alta definizione hanno mostrato che i topi fittizi mostravano assoni ben organizzati e mielinizzati con oligodendrociti orientati lineari in EC; tuttavia, gli assoni sono scomparsi e sono state osservate cellule pervasive colorate di blu nell'EC nei topi ABCS. I topi fittizi hanno mostrato strutture di fasci di fibre ben organizzate e colorate di blu profondo in Str. Tuttavia, i fasci di fibre si coloravano più chiari e più piccoli e la loro integrità era compromessa; alcuni fasci di fibre sono stati vacuolati nei topi ABCS. I fasci di fibre sono stati distorti e la matrice tra i fasci è stata significativamente ispessita in AC nei topi ABCS. In sintesi, la chirurgia ABCS provoca demielinizzazione assonale e danno; Il danno alla sostanza bianca si verifica principalmente nell'emisfero sinistro.
Disfunzione dell'apprendimento e della memoria
L'intervento chirurgico con ago ABCS ha comportato una significativa disabilità dell'apprendimento, come indicato da un aumento del tempo per trovare una piattaforma sommersa (latenza per la fuga) durante un test del labirinto d'acqua di Morris (Figura 6). Questa disabilità è rimasta per almeno 24 settimane dopo l'intervento. Anche la memoria è stata influenzata in modo significativo, come indicato da una diminuzione del tempo trascorso nel quadrante di destinazione dopo che la piattaforma è stata rimossa.
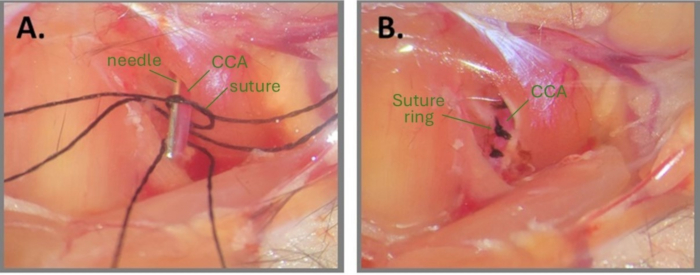
Figura 1: Fasi della chirurgia con ago per creare l'ABCS. (A) Il CCA sinistro è esposto e tre suture di seta sono infilate sotto il CCA. Viene disegnato un nodo sciolto su uno dei frammenti di sutura e l'ago viene posizionato parallelamente al CCA. (B) Tre anelli di sutura sono posizionati a circa 1 mm di distanza. Abbreviazioni: ABCS = stenosi bilaterale asimmetrica dell'arteria carotide comune; CCA = arteria carotide comune. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Ipoperfusione cerebrale asimmetrica persistente nel modello ABCS dell'ago. Monitoraggio dinamico del flusso sanguigno cerebrale dopo l'intervento chirurgico. L'ipoperfusione cerebrale persistente può essere osservata in entrambi gli emisferi, essendo più profonda a sinistra. Gli asterischi neri indicano le regioni di ipoperfusione. Abbreviazione: ABCS = stenosi bilaterale asimmetrica dell'arteria carotide comune. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Tasso di sopravvivenza dopo l'intervento chirurgico con ago ABCS. L'intervento chirurgico ha portato a un tasso di sopravvivenza dell'81,6% nell'arco di 6 settimane; Il decesso è avvenuto principalmente durante la prima settimana postoperatoria. Abbreviazione: ABCS = stenosi bilaterale asimmetrica dell'arteria carotide comune. Clicca qui per visualizzare una versione più grande di questa figura.
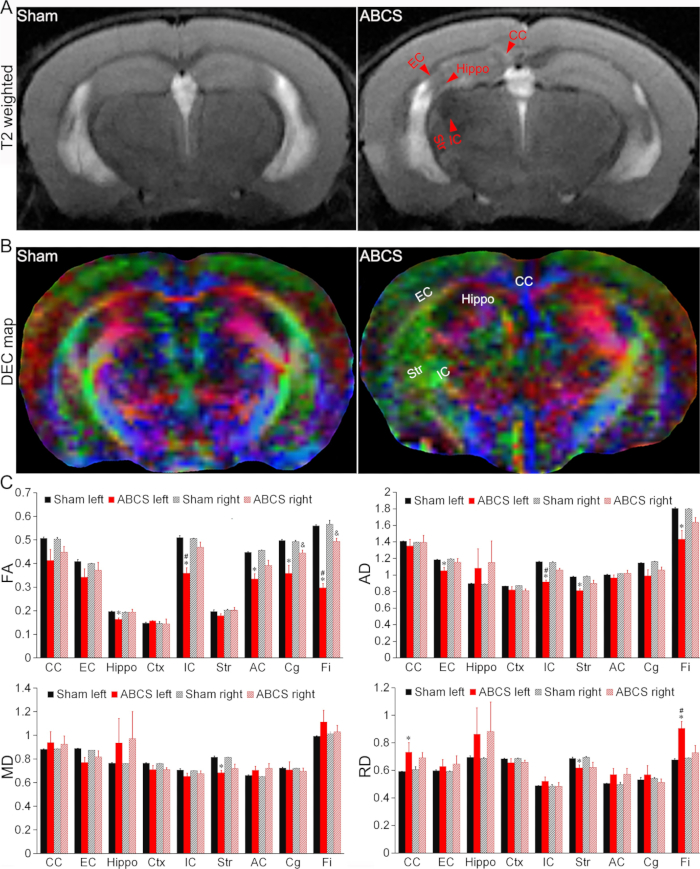
Figura 4: Rilevamento con risonanza magnetica in vivo di lesioni cerebrali nel modello ABCS con ago. (A) Immagini rappresentative pesate in T2 da topi sham e ABCS. Le punte di freccia rosse indicano regioni ipo o iperintense. (B) Mappa DEC rappresentativa del DTI in vivo 2 settimane dopo l'intervento chirurgico con ago ABCS. I colori indicano la direzionalità dell'asse principale di diffusione (rosso = sinistra/destra, verde = dorsale/ventrale e blu = rostrale/caudale). (C) Analisi quantitativa in topi sham e ABCS (ANOVA unidirezionale). * rappresenta p < 0,05 ABCS rispetto a sham (emisfero sinistro). # rappresenta p < 0,05 sinistra contro destra. & rappresenta p < 0,05 ABCS rispetto a sham (emisfero destro). I dati sono presentati come media ± SEM; n = 4 per lo sham, n = 4 per i topi ABCS. Abbreviazioni: ABCS = stenosi bilaterale asimmetrica dell'arteria carotide comune; Ippopotamo = ippocampo; EC = capsula esterna; IC = capsula interna; CC = corpo calloso; Str = striato; DEC = colore codificato direzionalmente; DTI = imaging del tensore di diffusione; FA = anisotropia frazionaria; MD = diffusività media; AD = diffusività assiale; RD = diffusività radiale. Clicca qui per visualizzare una versione più grande di questa figura.
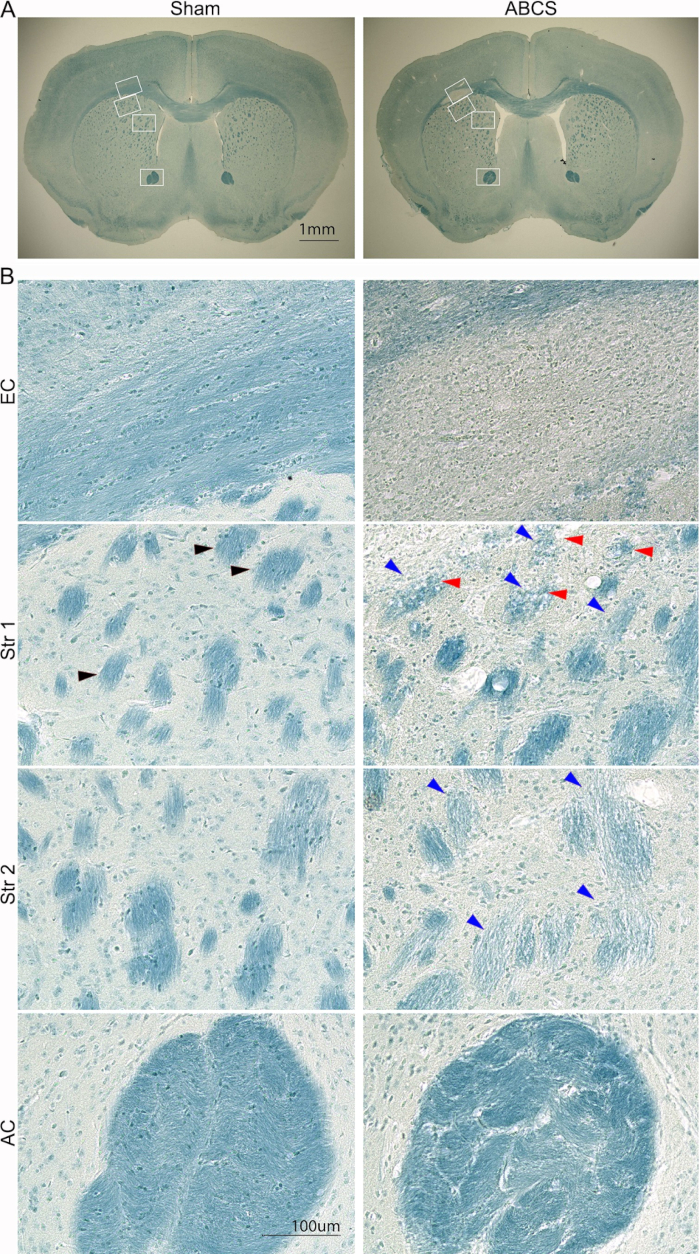
Figura 5: Colorazione LFB rappresentativa di fette di cervello 6 settimane dopo l'intervento chirurgico con ago ABCS. (A) Immagini a bassa potenza della colorazione LFB da topi sham e ABCS. Le caselle bianche indicano la posizione corrispondente alle immagini ad alta definizione in B. (B) Immagini ad alta definizione (200x) dalle posizioni EC (pannello superiore) e Str 1 e 2 (pannello centrale) e AC (pannello inferiore). La punta della freccia nera mostra un normale fascio di fibre. Le punte di freccia blu indicano un fascio di fibre danneggiato. Le punte di freccia rosse denotano fibre vacuolate. Barre della scala = 1 mm (A), 100 μm (B). Abbreviazioni: ABCS = stenosi bilaterale asimmetrica dell'arteria carotide comune; LFB = Luxol blu veloce; EC = capsula esterna; Str = striato; AC = commessura anteriore. Clicca qui per visualizzare una versione più grande di questa figura.
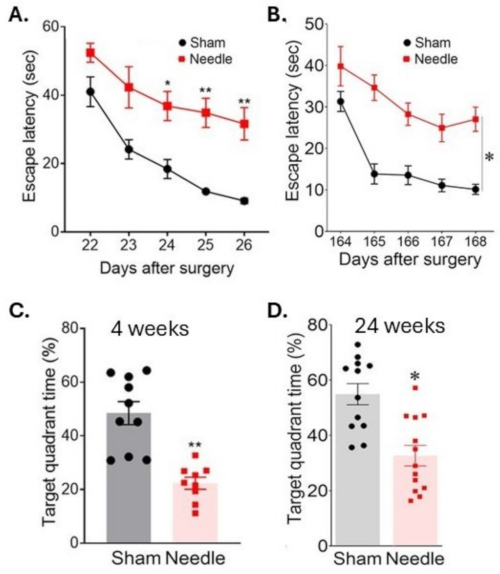
Figura 6: Apprendimento spaziale e valutazione della memoria nel test del labirinto d'acqua. L'apprendimento spaziale è stato valutato (A) 3 settimane e (B) 24 settimane dopo l'intervento misurando il tempo per localizzare la piattaforma in giorni consecutivi. La memoria è stata valutata (C) 4 settimane e (D) 24 settimane dopo l'intervento misurando il tempo trascorso nel quadrante target dopo la rimozione della piattaforma. L'intervento chirurgico ha provocato un'interruzione a lungo termine delle funzioni cognitive. I dati sono stati espressi come media ± SEM, *p < 0,05 ago rispetto a sham; **P < 0,01 rispetto a Sham; ANOVA bidirezionale e Neuman-Keuls post hoc. n = 10 per sham, n = 10 per i gruppi di aghi. Questa cifra è stata modificata da Weng et al.11. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Sono stati descritti diversi metodi di induzione del VCID utilizzando la stenosi asimmetrica del CCA, e tutti condividono un importante e critico isolamento chirurgico del CCA dal nervo vago e dalla guaina e l'esposizione del CCA per renderlo accessibile per la stenosi. Mentre forniamo una guida visiva di buona qualità sull'esposizione chirurgica dei CCA prima della legatura, vorremmo anche indirizzare i ricercatori a guardare ulteriori video sull'isolamento dei CCA che sono disponibili online nel contesto di altri interventi chirurgici su topi e ratti 15,16,17,18. Prestare particolare attenzione a non comprimere o rompere il CCA in quanto è l'arteria principale che fornisce al cervello sangue ossigenato.
Un altro passaggio critico dell'intervento chirurgico che deve essere padroneggiato è la stesura di un nodo allentato e il suo ulteriore serraggio attorno al CCA con l'ago, seguito dalla rimozione dell'ago. Si consiglia vivamente di esercitarsi con il solo ago prima di tentare di eseguirlo in un topo anestetizzato. Ciò consentirà di padroneggiare i delicati movimenti del forcipe e di perfezionare le manipolazioni con le suture senza il rischio di ferire il topo. Il nodo deve essere fissato bene senza cadere a pezzi durante la rimozione dell'ago, abbastanza stretto da tenere l'ago ma abbastanza largo da consentire di far scorrere l'ago lontano dalla sutura annodata utilizzando una pinza.
È importante sottolineare che abbiamo scoperto che una singola legatura di ciascun CCA non è sufficiente per ridurre in modo affidabile il flusso sanguigno e per mantenere l'ipoperfusione cerebrale a lungo termine11. Una potenziale spiegazione potrebbe essere che una singola legatura causi una stenosi puntiforme, che probabilmente causerà un aumento locale della pressione, portando ad un aumento della velocità del flusso sanguigno per compensare la riduzione del flusso sanguigno. Si consiglia di eseguire tre legature a ~1 mm di distanza l'una dall'altra per creare un frammento di stenosi. Un ulteriore vantaggio dell'utilizzo di tre legature è che i nodi fungono da meccanismo di prova nel caso in cui uno dei nodi si allenti durante la rimozione dell'ago aggiuntivo. Infatti, un frammento di stenosi causato da tre legature separate dello stesso CCA aumenta la coerenza del modello, portando a un'ipoperfusione cerebrale persistente in circa il 90% dei topi. Inoltre, la stenosi del frammento imita la stenosi CCA causata dall'aterosclerosi nei pazienti umani in modo più preciso rispetto alla stenosi del punto focale, aumentando così la rilevanza clinica del modello dell'ago.
Si consiglia vivamente di rimuovere rapidamente l'ago dopo aver terminato la prima legatura per assicurarsi che il flusso sanguigno CCA sia parzialmente recuperato e solo allora passare alla seconda e alla terza legatura in sequenza. Non è consigliabile terminare tutte e tre le legature con l'ago all'interno di tutti e tre i nodi, poiché ciò aumenterebbe significativamente il tempo di completa ostruzione del flusso sanguigno. In genere, non si consiglia più di 1 minuto di occlusione CCA completa prima di rimuovere l'ago. Questa raccomandazione si basa sul rapporto secondo cui i topi non hanno mostrato segni di compromissione funzionale dopo 3 sessioni di occlusione a 60 s di entrambi i CCA19. Nel nostro modello, il chirurgo lavora su un CCA alla volta, il che è più indulgente rispetto all'occlusione di entrambi i CCA contemporaneamente, ma consigliamo comunque di seguire questa sequenza temporale per escludere eventuali artefatti causati da un'occlusione prolungata piuttosto che da ipoperfusione cronica su entrambi i lati.
Sebbene questo modello di ago consenta di regolare i diametri delle suture annodate utilizzando aghi di vari diametri (in base al peso corporeo o ai requisiti specifici di restrizione del flusso sanguigno), nella nostra esperienza, i topi avevano tassi di sopravvivenza più elevati quando l'ipoperfusione nell'emisfero destro era moderata piuttosto che grave. D'altra parte, l'ipoperfusione grave persistente nell'emisfero sinistro ha prodotto esiti patologici e neurologici a lungo termine. Pertanto, si consiglia di eseguire una legatura asimmetrica utilizzando un ago più spesso per legare il CCA destro (causando una moderata ipoperfusione nell'emisfero destro) e un ago più sottile per legare il CCA sinistro (causando una grave ipoperfusione nell'emisfero sinistro).
Infine, i ricercatori dovrebbero essere consapevoli del fatto che diversi ceppi di topo possono produrre esiti diversi dall'insulto ischemico o traumatico, principalmente a causa delle differenze nell'anatomia vascolare cerebrale20,21. Poiché molti studi richiedono oggi la generazione di nuovi topi transgenici, il ceppo di fondo deve essere attentamente considerato se è necessario un intervento chirurgico con BCAO in qualsiasi fase del disegno sperimentale. Ad esempio, entrambi i ceppi C57BL/6 e SV129 sono una scelta di base comune per la generazione di animali transgenici per la ricerca sull'ictus21. Tuttavia, è stato ben documentato che i topi C57BL/6 sono molto più sensibili all'ischemia rispetto agli altri ceppi testati, inclusi i topi SV12920,21. Infatti, ci sono prove che l'effetto del ceppo murino può essere ancora più importante dell'effetto della tecnica utilizzata per indurre VCID21. Pertanto, diventa di fondamentale importanza mantenere coerenti gli sfondi dei topi durante tutti gli esperimenti che comportano l'induzione di lesioni cerebrali ischemiche nei roditori. È importante sottolineare che i ricercatori possono valutare l'efficienza dell'esito dell'intervento chirurgico negli animali vivi utilizzando sistemi di punteggio neurologico22 con un punteggio di 0,5 come criterio di inclusione. Il danno cerebrale può essere ulteriormente confermato utilizzando l'immunocolorazione Iba1, che è molto sensibile al danno cerebrale anche dopo un lieve insulto focale.
In sintesi, è importante ricordare che VCI è un termine complesso che unisce molte rappresentazioni cliniche e cause sotto lo stesso ombrello. Pertanto, i ricercatori dovrebbero sempre tenere a mente quale modello dovrebbe essere selezionato in base agli aspetti VCI che vorrebbero studiare. Non ci potrà mai essere un unico modello universale per tutte le manifestazioni VCI. I modelli di stenosi CCA limitano fortemente il flusso sanguigno dalle arterie principali, imitando così i pazienti con stenosi arteriosclerotica. Il nuovo metodo dell'ago per la creazione di BCAS asimmetrici nei topi C57BL/6J è un metodo affidabile per imitare il VCID che offre diversi vantaggi rispetto ai metodi precedentemente riportati (in particolare elevata flessibilità, bassa mortalità, risultati a lungo termine, costi minimi e monitoraggio della risonanza magnetica in tempo reale). Grazie ai suoi vantaggi rispetto agli altri modelli, può essere utilizzato per far progredire ulteriormente le nostre conoscenze sulla progressione della VCID e fungere da base per lo screening di potenziali agenti terapeutici per curare o rallentare la progressione della VCID. Simile ad altri metodi di BCAS, il modello dell'ago richiede competenze chirurgiche avanzate che possono essere padroneggiate con il tempo, utilizzando questa dimostrazione visiva come guida.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo progetto è stato sostenuto dalle sovvenzioni del National Institutes of Health/NINDS RF1NS117509 (G. Cao) e dalle sovvenzioni VA Merit Review BX003923 e BX006454 (G. Cao).
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | IP injection of ketoprofen |
| 2.5 mm blunt retractor tips | Kent Scientific Corporation | SURGI-5016-2 | 2 needed |
| Andis Ion T-Blade Pet Trimmer | Andis | BTF3 | To shave fur |
| Betadine Solution | Avrio Health L.P. | NDC 67618-150-17 | |
| Braided silk suture, 5-0 | Teleflex Medical | 106-S | For suturing skin |
| Braided silk suture, 7-0 | Teleflex Medical | 103-S | For ligating CCAs |
| Camera | Med Associates, Inc | VID-CAM-MONO-7 | For model validation |
| cover glass | Fisherbrand | 12-541-012 | For model validation |
| cresyl violet | Thermo Scientific | C581-25 | For model validation |
| Dispensing Tip, Needle, Flex, 34 Gauge, 1/4" OAL | Jensen Global | JG34-0.25HPX | For the left CCA |
| DSIStudio | https://dsi-studio.labsolver.org; for DTI data analysis | ||
| Dumont Tweezers; Pattern #1 | Roboz Surgical Instrument Co | RS-4960 | 2 needed |
| Dumont Tweezers; Pattern #5, 45 Degree Angle | Roboz Surgical Instrument Co | RS-5058 | 2 needed |
| Ethanol | Fisher Scientific | 64-17-5 | Dilute to 70% |
| ethylene glycol | Thermo Scientific | E178-4 | For model validation |
| Eye Needle, Size #4; 3/8 Circle, Cutting Edge, 11 mm Chord Length | Roboz Surgical Instrument Co | RS-7981-4 | For suturing skin |
| E-Z Anesthesia Classic System | E-Z systems | EZ-7000 | |
| glycerol | Thermo Scientific | AAA16205AP | For model validation |
| Homeothermic Monitoring System | Harvard Bioscience | K 022258 | |
| Imaging system EVOS FL Auto | Life Technologies | AMAFD2000 | For model validation |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Ketoprofen | Zoetis | 5487 | |
| Leica M320 F12 clinic and surgery microscope | Leica | M320 F12 | |
| Lidocaine and Prilocaine Cream, USP 2.5%/2.5% | Padagis | NDC 0574-2042-30 | Generic to EMLA cream |
| lithium carbonate | Thermo Scientific | L119-500 | For model validation |
| Luxol fast blue | Thermo Scientific | AC212170250 | For model validation |
| microscope slides | Fisherbrand | 12-550-403 | For model validation |
| Microtome | Leica | SM2010R | For model validation |
| Morris Water Maze with the hidden platform | Maze Engineers | https://maze.conductscience.com/portfolio/morris-water-maze/ | |
| M-Prove Portable Balance | Sartorius | AY711 | Scales for weiging the mouse |
| MRI with ParaVision 6.0.1 | Bruker | AV3HD 9.4T | For model validation |
| Multi gas flow meter | Aalborg Instruments | GMR2-010334 | for low flow rate gas blending (N2O and O2) |
| Nano Ultra Fine Pen Needles - 32G 4mm | BD | 58320883 | For the right CCA |
| O.C.T. | Thermo Scientific | 23-730-571 | For model validation |
| Paraformaldehyde, 4% | Thermo Scientific | J61899.AK | For model validation |
| PBS | Thermo Scientific | BP399500 | For model validation |
| PeriCam PSI System with Aperiflux probe holder | Perimed Inc | PeriCam PSI HR | For model validation |
| permount | Thermo Scientific | SP15-100 | For model validation |
| Round Handle Forceps; Micro Suturing With Tying Platform; Curved | Roboz Surgical Instrument Co | RS-5264 | To help with cutting and suturing the skin |
| Small Animal Heat Lamp, 75 Watt | Morganville Scientific | HL0100 | For model validation |
| Small cotton-tipped applicators | Fisher Scientific | 23-400-118 | |
| Spring Scissors - 8mm Cutting Edge | Fine Science tools | 15024-10 | |
| Student Halsey Needle Holder | Fine Science tools | 91201-13 | 3 needed: 2 for holding skin retractors and 1 for suturing the skin |
| Sucrose | Thermo Scientific | A15583.36 | For model validation |
| Universal Camera Ceiling Mount | Med Associates, Inc | ENV-598 | For model validation |
| water bath | VWR | 89032-226 | For model validation |
Riferimenti
- Tuo, Q. Z., Zou, J. J., Lei, P. Rodent models of vascular cognitive impairment. J Mol Neurosci. 71 (5), 1-12 (2021).
- Zhou, Z., et al. Deeper cerebral hypoperfusion leads to spatial cognitive impairment in mice. Stroke Vasc Neurol. 7 (6), 527-533 (2022).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Hattori, Y., et al. A novel mouse model of subcortical infarcts with dementia. J Neurosci. 35 (9), 3915-3928 (2015).
- Janson, J., et al. Increased risk of type 2 diabetes in Alzheimer disease. Diabetes. 53 (2), 474-481 (2004).
- Herzig, M. C., et al. Abeta is targeted to the vasculature in a mouse model of hereditary cerebral hemorrhage with amyloidosis. Nat Neurosci. 7 (9), 954-960 (2004).
- Miao, J., et al. Cerebral microvascular amyloid beta protein deposition induces vascular degeneration and neuroinflammation in transgenic mice expressing human vasculotropic mutant amyloid beta precursor protein. Am J Pathol. 167 (2), 505-515 (2005).
- Moechars, D., et al. Early phenotypic changes in transgenic mice that overexpress different mutants of amyloid precursor protein in brain. J Biol Chem. 274 (10), 6483-6492 (1999).
- Wallays, G., et al. Notch3 Arg170Cys knock-in mice display pathologic and clinical features of the neurovascular disorder cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy. Arterioscler Thromb Vasc Biol. 31 (12), 2881-2888 (2011).
- Cognat, E., Cleophax, S., Domenga-Denier, V., Joutel, A. Early white matter changes in CADASIL: evidence of segmental intramyelinic oedema in a pre-clinical mouse model. Acta Neuropathol Commun. 2, 49 (2014).
- Weng, Z., et al. A novel needle mouse model of vascular cognitive impairment and dementia. J Neurosci. 43 (44), 7351-7360 (2023).
- Biesbroek, J. M., Biessels, G. J. Diagnosing vascular cognitive impairment: Current challenges and future perspectives. Int J Stroke. 18 (1), 36-43 (2023).
- Winklewski, P. J., et al. Understanding the physiopathology behind axial and radial diffusivity changes-what do we know. Front Neurol. 9, 92 (2018).
- Jing, Z., et al. Neuronal NAMPT is released after cerebral ischemia and protects against white matter injury. J Cereb Blood Flow Metab. 34 (10), 1613-1621 (2014).
- Yang, S. T., et al. Adult mouse venous hypertension model: common carotid artery to external jugular vein anastomosis. J Vis Exp. (95), e50472 (2015).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Lee, D., et al. A murine model of ischemic retinal injury induced by transient bilateral common carotid artery occlusion. J Vis Exp. (165), (2020).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. J Vis Exp. (69), e4124 (2012).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Wellons, J. C., et al. A comparison of strain-related susceptibility in two murine recovery models of global cerebral ischemia. Brain Res. 868 (1), 14-21 (2000).
- Cao, G., et al. In Vivo delivery of a Bcl-xL fusion protein containing the TAT protein transduction domain protects against ischemic brain injury and neuronal apoptosis. J Neurosci. 22 (13), 5423-5431 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon