Method Article
Identificazione di cellule infette da EcoHIV in topi transgenici manipolati con microglia
In questo articolo
Riepilogo
Questo protocollo descrive come la combinazione dell'infezione da EcoHIV con topi Tmem119-EGFP offra un prezioso sistema biologico per studiare le alterazioni microgliali e i serbatoi virali in modelli di roditori di disturbi neurocognitivi associati all'HIV.
Abstract
La terapia antiretrovirale combinata (cART) ha migliorato notevolmente la qualità della vita delle persone che vivono con l'HIV (PLWH). Tuttavia, oltre 4 milioni di PLWH hanno più di cinquant'anni e hanno un'esperienza di disturbi neurocognitivi associati all'HIV (HAND). Per capire come l'HIV influisce sul sistema nervoso centrale, è necessario un modello affidabile e fattibile di HIV. In precedenza, un nuovo sistema biologico che utilizza l'inoculazione chimerica dell'HIV (EcoHIV) è stato sviluppato in un modello di ratto per studiare i disturbi neurocognitivi e la disfunzione sinaptica. Ciononostante, rimane una sfida significativa nel chiarire la distribuzione neuroanatomica di EcoHIV, in particolare la sua espressione differenziale in vari tipi di cellule nel cervello. Nel presente studio, EcoHIV con marcatura a fluorescenza mScarlet è stato modificato e iniettato retro-orbitalmente in topi knock-in Tmem119-EGFP (che esprimono la proteina di fluorescenza verde potenziata principalmente nelle microglia) per determinare se le microglia sono il principale tipo di cellula responsabile dell'espressione virale e dei serbatoi di HIV nel cervello. I dati attuali mostrano che: (1) in vitro, i segnali di fluorescenza di EcoHIV-mScarlet erano prevalentemente localizzati in cellule simili alla microglia tra le cellule cerebrali primarie dei roditori; (2) in vivo, l'iniezione di EcoHIV-mScarlet nei topi Tmem119-EGFP ha indotto una significativa espressione di HIV nel cervello del topo. La co-localizzazione dei segnali mScarlet e EGFP suggerisce che le microglia sono il principale tipo di cellula che ospita l'HIV nel cervello. Nel complesso, l'EcoHIV nei roditori offre un prezioso sistema biologico per studiare le alterazioni microgliali, i serbatoi virali nel cervello e i meccanismi neurologici dei disturbi neurocognitivi associati all'HIV.
Introduzione
Nonostante i profondi benefici derivati dalla terapia antiretrovirale, le persone che vivono con l'HIV (PLWH) soffrono ancora di disturbi neurocognitivi. Per comprendere meglio i meccanismi neuronali del disturbo neurocognitivo associato all'HIV (HAND), c'è un bisogno critico di modelli di HIV per chiarire ulteriormente il coinvolgimento specifico del tipo di cellula nel NeuroHIV.
Il ratto transgenico HIV-1, che ha un'esposizione costitutiva alle proteine virali dell'HIV-1, è un popolare modello di roditore utilizzato per studiare i disturbi neurocognitivi 1,2,3,4 e le alterazioni neuroanatomiche 5,6,7 associate alla HAND. La delezione funzionale dei domini gag e pol impedisce la replicazione virale, rendendo il ratto transgenico HIV-1 non infettivo 8,9. Recentemente, un modello chimerico di infezione da HIV (EcoHIV) nei topi è stato inizialmente riportato da Potash et al.10 e successivamente esteso ai ratti, il che potrebbe essere vantaggioso per ulteriori studi sulla HAND e sui disturbi da uso di sostanze11. In questo nuovo sistema biologico, l'infezione sistemica da HIV-1 è stata osservata insieme a molte caratteristiche cliniche dell'HIV-1 nell'uomo, tra cui il coinvolgimento di linfociti e macrofagi, le risposte immunitarie antivirali, la neuroinvasività e l'infiammazione cerebrale.
Le microglia svolgono un ruolo fondamentale come macrofagi specializzati residenti nel cervello nel mantenimento della funzione cerebrale e dell'omeostasi. Per distinguere le microglia da tipi di cellule strettamente correlate (ad esempio, monociti del sangue, macrofagi perivascolari, macrofagi meningei), l'attuale studio ha utilizzato la linea di topi knock-in Tmem119-EGFP. Studi precedenti hanno riportato che la proteina transmembrana 119 (Tmem119) mostra un modello di espressione esclusivamente specifico per la microglia nel tessuto cerebrale umano e di roditore 12,13,14,15. Il segnale EGFP nei topi knock-in Tmem119-EGFP è stato osservato in tutto il cervello e localizzato specificamente alle cellule microgliali.
Nel presente studio, i topi knock-in Tmem119-EGFP sono stati inoculati con il virus EcoHIV-mScarlet e sono state identificate cellule positive per EcoHIV nel sistema nervoso centrale. Qui, presentiamo un protocollo per l'inoculazione di EcoHIV-mScarlet in topi knock-in Tmem119-EGFP , fornendo un modello affidabile per il targeting terapeutico delle alterazioni microgliali nell'HIV.
Protocollo
Il Comitato per la cura e l'uso degli animali dell'Università della Carolina del Sud ha approvato tutti i protocolli sugli animali (numero di garanzia federale: D16-00028). Tutti gli esperimenti hanno seguito rigorosamente le linee guida stabilite dal National Institutes of Health nella Guida per la cura e l'uso degli animali da laboratorio. I topi knock-in Tmem119-EGFP (30 giorni di età, maschi, 23-26 g di peso corporeo) sono stati ottenuti da una fonte commerciale e ospitati in strutture accreditate AAALAC. Tutti gli animali sono stati alloggiati in un ciclo luce-buio di 12/12 ore con libero accesso a cibo e acqua. I dettagli degli animali, dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Imballaggio EcoHIV-mScarlet in cellule 293FT
- Incubare le 293 cellule FT in un pallone da 75 cm2 prerivestito di gelatina. Mantenere le cellule che crescono fino al 30% di confluenti durante la trasfezione.
- Eseguire la trasfezione del DNA plasmidico (15 μg) di EcoHIV-mScarlet (File supplementare 1) utilizzando Lipofectamine 3000 (22,5 μL) seguendo le istruzioni del produttore (vedere la Tabella dei materiali).
- Coltivare le cellule in terreno DMEM con siero FBS al 10% per 3 giorni a 37 °C.
- Raccogliere il terreno condizionale con sospensione virale. Centrifugare a 500 × g per 10 min a 4 °C. Trasferire il surnatante con una pipetta da 10 ml in una provetta sterile da 50 ml.
- Aggiungere una certa quantità di concentratore Lenti-x (rapporto 1:3) nella miscela virale (ad esempio, 8 ml di concentratore con 24 ml di miscela virale). Capovolgere delicatamente il tubo cinque volte.
- Mantenere la miscela concentratore virus-Lenti a 4 °C per 2 giorni. Centrifugare a 1.500 × g, 45 min, 4 °C. Rimuovere con cura il surnatante il più possibile utilizzando una pipetta.
- Risospendere il pellet con 200 μl preraffreddati di PBS da 100 mM. Conservare il virus a -80 °C.
NOTA: I dettagli dell'imballaggio di EcoHIV-mScarlet nelle cellule 293FT sono stati descritti nel nostro precedente studio16. Non vorticare o introdurre bolle d'aria nella soluzione virale.
2. EcoHIV-mInfezione scarlatta nelle cellule cerebrali primarie di ratto
- Eseguire l'isolamento delle cellule cerebrali primarie da feti di ratto (18 giorni) seguendo il rapporto precedentemente pubblicato16.
- Trasferimento di cellule dissociate su piastre a 12 pozzetti pre-rivestite di poli-L-lisina con inserti in vetro contenenti 1 mL di terreno DMEM/F12 più il 10% di FBS. Sostituire il terreno il giorno successivo con il terreno neurobasale con un integratore di B27.
- Coltura di cellule cerebrali fetali primarie in un'incubatrice al 5% di CO2 per 3 settimane.
- Aggiungere EcoHIV-mScarlet (60 μL, 1,26 × 106 TU/mL) nel terreno di coltura. Incubare le cellule cerebrali in coltura con EcoHIV-mScarlet per 6 giorni.
- Fissare le cellule con PFA al 4% ed eseguire l'immunocolorazione sulle cellule cerebrali infette utilizzando anticorpi primari specifici (CD11b/c, Iba1).
- Ottenere immagini utilizzando un obiettivo da 40× con un sistema di microscopia confocale.
3. EcoHIV-mInfezione da virus scarlatto in cellule gliali primarie di topi adulti
- Anestetizzare topi adulti con sevoflurano al 5% per 5 minuti (seguendo protocolli approvati istituzionalmente). Sterilizzare la pelle della testa con il 70% di EtOH.
- Dopo aver confermato che il mouse non risponde più agli stimoli nocivi, usa una forbice affilata sterilizzata per eseguire la decapitazione. Trasferire la testa in una nuova piastra di Petri riempita con 5 ml di HBSS.
- Aprire il cuoio capelluto e trasferire il tessuto cerebrale in un'altra capsula di Petri contenente 5 ml di HBSS sterilizzato. Staccare le meningi e trasferire la corteccia frontale in 2 ml di HBSS.
- Aggiungere 20 μl di tripsina-EDTA allo 0,25% nella miscela. Incubare per 15 minuti a temperatura ambiente; Agitare delicatamente il tubo ogni pochi minuti.
- Trasferire le cellule dissociate in un pallone da 75 cm2 prerivestito di poli-L-lisina contenente 10 mL di terreno DMEM/F12 e il 10% di FBS.
- Cellule di coltura a 37 °C, incubatore al 5% di CO2, fino al 90% di confluenza. Digerire le cellule cerebrali con 2 ml di tripsina-EDTA allo 0,25%.
- Subcoltura di cellule cerebrali in piastre con fondo di vetro da 35 mm contenenti 5 mL di terreno di crescita DMEM/F12 fino all'80% di confluenza.
- Aggiungere EcoHIV-mScarlet (8 μL, 1,26 × 106 TU/mL) nel terreno di coltura. Incubare le cellule gliali di topo per 2 giorni.
- Controllare quotidianamente i segnali di fluorescenza rossi (mScarlatti) al microscopio a fluorescenza.
4. Iniezione retroorbitale del virus EcoHIV-mScarlet nei topi Tmem119-EGFP
- Utilizzare il 3% di sevoflurano per anestetizzare i topi Tmem119-EGFP (sia maschi che femmine di età a 30 giorni di età) fino a quando non rispondono più agli stimoli nocivi.
- Fissare i topi in posizione laterale con l'occhiello per l'iniezione rivolto verso l'alto e la respirazione attraverso il cono nasale, che è collegato a un sistema di anestesia. Utilizzare un cono nasale di dimensioni adeguate per fornire un'anestesia continua.
- Scongelare l'EcoHIV-mScarlet con ghiaccio. Riempire la soluzione virale in una siringa per iniettori intraoculari con un ago smussato da 33 G.
- Posizionare il mouse nella posizione sdraiata laterale destra e tenere la testa rivolta a sinistra. Identificare la posizione del canto mediale come sito di iniezione.
- Dopo aver appoggiato l'occhio, inserire lentamente e delicatamente un ago (angolo di 45 gradi) nel canto mediale dell'occhio. Inserire con cautela l'ago in avanti nei vasi dietro il bulbo oculare (seno retroorbitale).
- Iniettare delicatamente 6,5 μL di EcoHIV-mScarlet (1,26 × 106 TU/mL, inoculazione oculare bilaterale) nel seno retro-orbitale. Rimuovere con cautela l'ago dal seno retro-orbitale e applicare delicatamente una pressione sulle palpebre per fornire l'emostasi.
- Applicare lubrificante sull'occhio per evitare che la cornea si secchi o si ferisca.
- Lascia che i topi si riprendano in una camera di recupero con un termoforo fino a quando non si sono svegliati.
NOTA: Lo smusso dell'ago non deve essere posizionato troppo in profondità in modo che le arterie non vengano rotte o le ossa fratturate. Il tempo di infusione virale dipende da molteplici fattori (ad esempio, volume di iniezione, titolo, dimensioni dell'animale). Per l'infusione virale di EcoHIV, è stata osservata un'espressione significativa una settimana dopo le iniezioni retro-orbitali 11,16,17.
5. Visualizzazione di fette di tessuto cerebrale
- Anestetizzare profondamente i topi usando il 5% di sevoflurano. Passa al passaggio 5.2 quando i topi non mostrano alcuna risposta agli stimoli nocivi e i riflessi sono assenti.
- Tenere i topi in posizione supina all'interno di una cappa chimica.
- Aprire la pelle lungo la linea mediana toracica. Separare il diaframma e aprire il torace con le forbici.
- Inserire un ago 22 G1 1/2 nel ventricolo sinistro. Apri l'atrio destro con le forbici.
- Perfondere 50 mL di PBS 100 mM pre-raffreddato. Perfondere 100 mL di tampone paraformaldeide16 pre-raffreddato al 4%.
- Rimuovere l'intero cervello del mouse16.
- Fissare per una notte con paraformaldeide al 4%.
- Fissare il tessuto cerebrale utilizzando l'adesivo tissutale sulla piattaforma metallica del Vibratome. Taglio di 50 μm di spessore delle sezioni coronali con lame in acciaio al carbonio.
- Posiziona le fette di cervello su vetrini usando un pennello. Aggiungere immediatamente 0,1 mL di terreno di montaggio anti-sbiadimento a ciascuna sezione.
- Posizionare un vetrino coprioggetti di 22 mm x 50 mm sulle sezioni del cervello. Asciugare gli scivoli super-frost al buio per 1 giorno.
- Configura il sistema di microscopio confocale su un ingrandimento di 60× (A/1,4, olio) e imposta un intervallo sul piano Z di 0,15 μm, con una dimensione del foro stenopeico di 30 μm e un raggio del foro stenopeico retroproiettato di 167 nm.
- Utilizzare le lunghezze d'onda di 488 nm e 594 nm per acquisire immagini multicanale delle regioni cerebrali di interesse.
Risultati
Un frammento di mScarlet (1858 bp) contenente siti enzimatici di "Cla1" all'estremità 3' e "Not1" all'estremità 5' è stato inserito nel vettore lentivirale pNL4-3-EcoHIV (Figura 1). Per convalidare l'espressione di EcoHIV-mScarlet, le cellule cerebrali primarie isolate dalla corteccia di embrioni E18 di ratto sono state trattate con EcoHIV-mScarlet (60 μL, 1,26 × 106 TU/mL) per 6 giorni in vitro. I dati in Figura 2 hanno mostrato che i segnali fluorescenti rossi di mScarlet erano localizzati principalmente nei tipi di cellule gliali in base alla diversa morfologia cellulare. Inoltre, la marcatura di CD11b/c e Iba1 (marcatori cellulari per la microglia) ha mostrato che i segnali mScarlet erano co-localizzati con cellule CD11b/c + e/o Iba1 +. I dati hanno indicato che le microglia erano il principale tipo di cellula di distribuzione di EcoHIV-mScarlet in vitro. Non c'è stata alcuna infezione neuronale significativa nelle cellule in coltura (Figura supplementare 1).
Successivamente, l'infezione da EcoHIV-mScarlet è stata testata su cellule gliali miste primarie di topo adulto. A tal fine, le cellule gliali miste sono state prima isolate e purificate da topi adulti (2 mesi) e infettate con EcoHIV-mScarlet (8 μL, 1,26 × 106 TU/mL) per 2 giorni. Le immagini nella Figura 3 hanno mostrato che EcoHIV-mScarlet ha infettato con successo la glia di topo adulto.
Per affrontare ulteriormente il modello di distribuzione di EcoHIV-mScarlet nel cervello del topo, in particolare per identificare il tipo di cellula infetta, EcoHIV-mScarlet è stato iniettato retro-orbitale nella linea di topo knock-in Tmem119-EGFP in cui le microglia sono state specificamente marcate con segnali EGFP senza altri tipi di conflitti macrofagici5. I risultati nella Figura 4 (anche nella Figura 2 supplementare) mostrano che i segnali di fluorescenza rosso scarlatto sono stati osservati nelle cellule EGFP-positive, suggerendo che la microglia è il principale tipo di cellula di espressione di EcoHIV nel cervello dei topi.
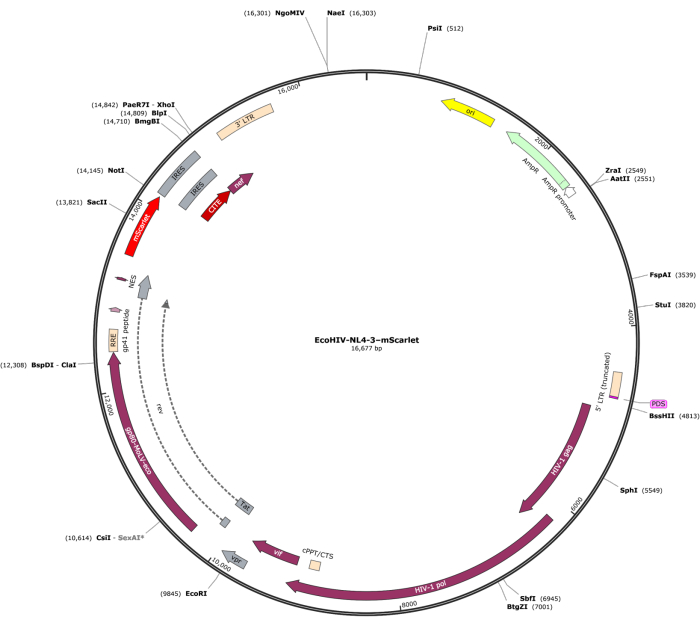
Figura 1: La mappa vettoriale di EcoHIV-NL-4-3-mScarlet. Clicca qui per visualizzare una versione più grande di questa figura.
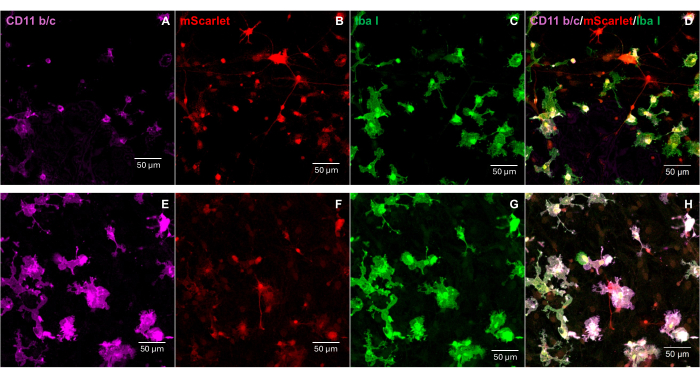
Figura 2: L'infezione da EcoHIV-mScarlet nelle cellule cerebrali primarie di ratto. (A,E) Immagini rappresentative della colorazione CD11b/c nelle cellule cerebrali primarie. Le cellule cerebrali sono state isolate da embrioni di ratto E18 e infettate con il virus EcoHIV-mScarlet per 6 giorni. (B,F) Immagini rappresentative dei segnali fluorescenti mScarlet da cellule cerebrali in vitro . (C,G) Immagini rappresentative della colorazione Iba1 nelle cellule cerebrali primarie. (D,H) Immagini unite della tripla etichettatura di CD11b/c, mScarlet e Iba1. Barre della scala: 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
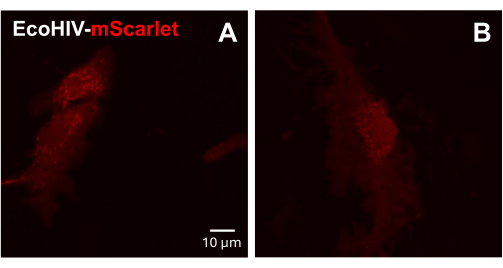
Figura 3: Infezione da EcoHIV-mScarlet in cellule gliali primarie miste di topo. (A,B) Immagini confocali rappresentative della distribuzione di mScarlet in vitro. Le cellule gliali miste primarie sono state isolate da topi adulti C57BL6 (di 2 mesi) e coltivate per 2 settimane prima dell'infezione virale. EcoHIV-mScarlet è stato aggiunto al terreno di coltura per due giorni e ha catturato le immagini sotto l'obiettivo del 60× del microscopio confocale. Barra della scala: 10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
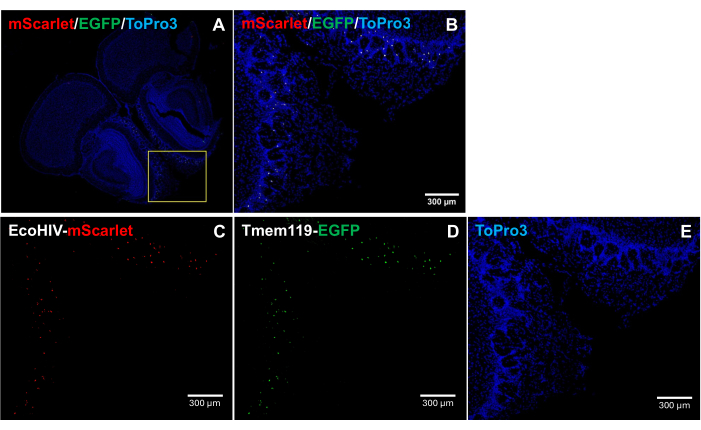
Figura 4: Distribuzione di EcoHIV-mScarlet nella linea di topi knock-in Tmem119-EGFP . (A,B) Immagini unite dei segnali mScarlet/EGFP/ToPro3 nelle sezioni cerebrali. Il riquadro giallo indica l'area target di (B). Barra della scala: 300 μm. (C) Immagine rappresentativa della distribuzione di mScarlet nello strato plessiforme esterno della regione olfattiva della linea murina knock-in Tmem119-EGFP . (D) Immagine rappresentativa della distribuzione del EGFP. I segnali fluorescenti sono stati localizzati nelle cellule della microglia nella linea di topi knock-in Tmem119-EGFP . (E) Immagine rappresentativa della colorazione del nucleo di TO-PRO-3. Barre della scala: 300 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura 1 supplementare: Colorazione MAP2 e MOG di cellule cerebrali primarie di ratto infettate con il virus EcoHIV-mScarlet. Barre di scala: 50 μm. Clicca qui per scaricare questo file.
Figura 2 supplementare: Immagini confocali dell'infezione da EcoHIV-mScarlet nella linea murina knock-in Tmem119-EGFP . Barre di scala: 75 μm. Clicca qui per scaricare questo file.
File supplementare 1: EcoHIV-mSequenza di DNA plasmidico scarlatto. Clicca qui per scaricare questo file.
Discussione
Nel presente studio, è stato riscontrato che (1) il nuovo EcoHIV-mScarlet ha infettato con successo le cellule cerebrali primarie di ratto in vitro; (2) la tripla marcatura di mScarlet, CD11b/c e Iba1 ha identificato la microglia come il tipo di cellula predominante per l'espressione di EcoHIV nelle cellule cerebrali di ratto in vitro; (3) le cellule cerebrali primarie di topo provenienti da adulti in vitro evidenziano ulteriormente l'infezione da EcoHIV-mScarlet; (4) la distribuzione di EcoHIV-mScarlet nella linea murina knock-in Tmem119-EGFP ha dimostrato un pattern di distribuzione specifico per la microglia dell'infezione da EcoHIV.
Studi emergenti hanno suggerito che vari tipi di cellule cerebrali identificate all'interno del sistema nervoso centrale (neuroni, astrociti, microglia, oligodendrociti, ecc.) mostrano alterazioni funzionali e trascrittomiche durante l'HIV e i disturbi neurocognitivi associati all'HIV18,19. Ad esempio, gli astrociti contribuiscono al 30%-70% del cervello ed eseguono la sorveglianza per mantenere l'omeostasi cerebrale20. Gli astrociti modulano anche la funzione immunitaria e regolano la secrezione di multi-citochine e chemochine, specialmente nella situazione di infiammazione cerebrale e neurodegenerazione nell'HIV21,22. L'infezione da HIV della microglia non solo provoca un rilascio continuo di proteine virali e citochine e chemochine proinfiammatorie, ma fornisce anche fonti predominanti per i serbatoi virali dell'HIV 23,24,25,26. Inoltre, le microglia attivate contribuiscono a una funzione immunologica critica nel SNC; tuttavia, l'attivazione prolungata può anche esacerbare la neurodegenerazione nella progressione dell'HIV10,27. Gli oligodendrociti svolgono anche una funzione importante, incluso il rilascio di diverse neurotrofine (come il fattore di crescita nervoso, il fattore neurotrofico derivato dal cervello, ecc.)28. Uno studio precedente ha rilevato che il numero di oligodendrociti è diminuito significativamente nel cervello dei pazienti con AIDS, il che può indicare un danno diretto agli oligodendrociti dalle proteine virali dell'HIV29. Pertanto, un tipo specifico di modello di infezione da HIV manipolato da cellule dovrebbe fornire mezzi fondamentali per identificare le funzioni differenziali di varie cellule cerebrali dopo l'infezione. Nel presente studio, è stato sviluppato un sistema biologico per imitare le caratteristiche dell'HIV-1 mediante inoculazione chimerica dell'HIV (EcoHIV). Questa inoculazione dell'HIV è stata anche combinata con la linea di topi knock-in Tmem119-EGFP per generare e convalidare un modello di roditore dell'HIV manipolato con microglia.
Tuttavia, i limiti del presente studio devono essere riconosciuti. C'erano alcune cellule Iba1/CD11b/c negative che presentavano segnali fluorescenti mScarlet in vitro. Altri tipi di cellule cerebrali, come i macrofagi cerebrali o i periciti, possono essere coinvolti nell'infezione da EcoHIV o, in alternativa, l'ambiente di coltura cellulare può promuovere modelli di infezione aberranti rispetto all'inoculazione in vivo . I futuri studi su animali interi dovrebbero chiarire ulteriormente la funzione della microglia mScarlet+ nel processo di infezione da EcoHIV e definire ulteriormente la distribuzione regionale della microglia mScarlet+EcoHIV nel cervello. Inoltre, in questo modello di roditore possono essere affrontate anche le alterazioni neurocognitive che si verificano a seguito di infezioni microgliali. Nel complesso, l'inoculazione di EcoHIV-mScarlet di topi knock-in Tmem119-EGFP fornisce un nuovo modello e una strategia di ricerca per studiare i meccanismi microgliali dei disturbi neurocognitivi associati all'HIV.
Divulgazioni
Nessuno degli autori ha conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato finanziato dalle sovvenzioni NIH DA059310, DA058586, AG082539 e GM109091. Apprezziamo il generoso dono dell'EcoHIV-NL4-3-EGFP da parte del Dr. Potash della Icahn School of Medicine del Mount Sinai.
Materiali
| Name | Company | Catalog Number | Comments |
| 293FT cells | ThermoFisher Scientific | R70007 | |
| 33 G, Small Hub RN Needle, (Point Style: 3, Needle Length: 19.25 mm) | Hamilton | 7803-05 | |
| Antibiotic-Antimycotic solution | Cellgro | 30004CI | 100x |
| C57BL/6-Tmem119em2Gfng/J | The Jackson Laboratory | Strain #:031823 | |
| Corning BioCoat Gelatin 75cm² Rectangular Canted Neck Cell Culture Flask with Vented Cap | Life Technologies | 354488 | |
| Corning DMEM with L-Glutamine, 4.5 g/L Glucose and Sodium Pyruvate | Life Technologies | 10013CV | |
| Cover glass | VWR | 637-137 | |
| Dumont #5 Forceps | World Precision Instruments | 14095 | |
| Dumont #7 Forceps | World Precision Instruments | 14097 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Life Technologies | 22600028 | |
| Feather Double Edge Carbon Steel Blades | Ted Pella, inc. | 121-9 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Human recombinant anti-CD11b antibody | Miltenyi Biotec | 130-120-214 | 1:50 dilution |
| Intraocular Injector Syringe (6.5 µL), Removable Needle | Hamilton | 6609071-01 | |
| Invitrogen Lipofectamine 3000 Transfection Reagent | Life Technologies | L3000015 | |
| Invitrogen One Shot TOP10 Electrocomp E. coli | Fisher Scientific | C404052 | |
| Iris Forceps | World Precision Instruments | 15914 | |
| Iris Scissors | World Precision Instruments | 500216 | |
| Lentivirus-Associated p24 ELISA Kit | Cell Biolabs, inc. | VPK-107-5 | |
| Lenti-X Concentrator | Takara | PT4421-2 | |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 11058021 | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Paraformaldehyde | Sigma | P6148 | |
| PELCO easiSlicer Vibratory Tissue Slicer | Ted Pella, inc. | 11000 | |
| PELCO Pro CA44 Tissue Adhesive | Ted Pella, inc. | 10033 | |
| PELCO Pro Specimen Retrievers | Ted Pella, inc. | 101-33 | |
| ProLong Gold | Fisher Scientific | P36930 | |
| Rabbit monoclonal anti-Iba1 antibody | Abcam | ab178847 | 1:500 dilution |
| RN Compression Fitting 1 mm | Hamilton | 55750-01 | |
| Sevoflurane | Merritt Veterinary Supply | 347075 | |
| Sprague Dawley pregnant rat | Inotiv | ||
| SuperFrost Plus Slides | Fisher Scientific | 12-550-154% | |
| To-Pro-3 | ThermoFisher Scientific | T3605 | Nucleus staining kit |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200-056 | |
| Vannas Scissors | World Precision Instruments | 500086 |
Riferimenti
- Vigorito, M., Lashomb, A. L., Chang, S. L. Spatial learning and memory in HIV-1 transgenic rats. J Neuroimmune Pharmacol. 2, 319-328 (2007).
- Moran, L. M., Booze, R. M., Mactutus, C. F. Time and time again: Temporal processing demands implicate perceptual and gating deficits in the HIV-1 transgenic rat. J. Neuroimmune Pharmacol. 8 (4), 988-997 (2013).
- Repunte-Canonigo,, et al. Gene expression changes consistent with neuroAIDS and impaired working memory in HIV-1 transgenic rats. Mol Neurodegener. 9, 26(2014).
- Reid, W., et al. An HIV-1 transgenic rat that develops HIV-related pathology and immunologic dysfunction. Proc Natl Acad Sci USA. 98 (16), 9271-9276 (2001).
- McLaurin, K. A., Li, H., Booze, R. M., Mactutus, C. F. Disruption of timing: NeuroHIV progression in the post-cART era. Sci Rep. 9, 827(2019).
- Roscoe, R. F., Mactutus, C. F., Booze, R. M. HIV-1 transgenic female rat: Synaptodendritic alterations of medium spiny neurons in the nucleus accumbens. J Neuroimmune Pharmacol. 9 (5), 642-653 (2014).
- Denton, A. R., et al. Selective monoaminergic and histaminergic circuit dysregulation following long-term HIV-1 protein exposure. J NeuroVirol. 25 (4), 540-550 (2019).
- Peng, J., et al. The HIV-1 transgenic rat as a model for HIV-1 infected individuals on HAART. J Neuroimmunol. 218 (1-2), 94-101 (2010).
- Abbondanzo, S. J., Chang, S. L. HIV-1 transgenic rats display alterations in immunophenotype and cellular responses associated with aging. PLoS ONE. 9, e105256(2014).
- Potash, M. J., et al. A mouse model for study of systemic HIV-1 infection, antiviral immune responses, and neuroinvasiveness. Proc Natl Acad Sci USA. 102 (10), 3760-3765 (2005).
- Li, H., McLaurin, K. A., Illenberger, J. M., Mactutus, C. F., Booze, R. M. Microglial HIV-1 expression: Role in HIV-1 associated neurocognitive disorders. Viruses. 13 (5), 924(2021).
- Kaiser, T., Feng, G. Tmem119-EGFP and Tmem119-CreERT2 transgenic mice for labeling and manipulating microglia. eNeuro. 6 (4), (2019).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proc Natl Acad Sci. USA. 113 (12), E1738-E1746 (2016).
- Satoh, J., et al. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36 (1), 39-49 (2016).
- Li, H., Aksenova, M., Bertrand, S. J., Mactutus, C. F., Booze, R. M. Quantification of filamentous actin (F-actin) puncta in rat cortical neurons. J Vis Exp. (108), e53697(2016).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. A rat model of EcoHIV brain infection. J Vis Exp. (167), e62137(2021).
- Alfar, H. R., et al. Protocol for optimizing production and quality control of infective EcoHIV virions. STAR Protoc. 4 (3), 102368(2023).
- Malatesta, P., Hartfuss, E., Götz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development. 127 (24), 5253-5263 (2000).
- Parpura, V., et al. Glutamate-mediated astrocyte-neuron signaling. Nature. 369 (6483), 744-747 (1994).
- Wahl, A., Al-Harthi, L. HIV infection of non-classical cells in the brain. Retrovirology. 20 (1), 1(2023).
- Pandey, H. S., Seth, P. Friends turn foe-astrocytes contribute to neuronal damage in NeuroAIDS. J. Mol. Neurosci. 69 (2), 286-297 (2019).
- Minagar, A., et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer's disease, and multiple sclerosis. J Neurol Sci. 202 (1-2), 13-23 (2002).
- Borrajo, A., Spuch, C., Penedo, M. A., Olivares, J. M., Agís-Balboa, R. C. Important role of microglia in HIV-1 associated neurocognitive disorders and the molecular pathways implicated in its pathogenesis. Ann Med. 53 (1), 43-69 (2021).
- González-Scarano, F., Martín-García, J. The neuropathogenesis of AIDS. Nat Rev Immunol. 5 (1), 69-81 (2005).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. Microglia proliferation underlies synaptic dysfunction in the prefrontal cortex: Implications for the pathogenesis of HIV-1-associated neurocognitive and affective alterations. J. Neurovirol. 29 (4), 460-471 (2023).
- Kim, B. H., et al. EcoHIV infection of primary murine brain cell cultures to model HIV replication and neuropathogenesis. Viruses. 16 (5), 693(2024).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Jones, J. D. Potential of glial cell modulators in the management of substance use disorders. CNS Drugs. 34 (7), 697-722 (2020).
- Kaalund, S. S., Johansen, A., Fabricius, K., Pakkenberg, B. Untreated patients dying with aids have loss of neocortical neurons and glial cells. Front Neurosci. 13, 1398(2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon