Method Article
Caratterizzazione del trasferimento di elettroni extracellulari mediato nei batteri dell'acido lattico con un sistema bioelettrochimico a tre elettrodi e due camere
In questo articolo
Riepilogo
Qui presentiamo un protocollo per caratterizzare il trasferimento di elettroni extracellulari mediato (EET) nei batteri lattici utilizzando un sistema bioelettrochimico a tre elettrodi e due camere. Illustriamo questo metodo con il Lactiplantibacillus plantarum e il mediatore redox acido 1,4-diidrossi-2-naftoico e forniamo una descrizione approfondita delle tecniche elettrochimiche utilizzate per valutare l'EET mediata.
Abstract
Molti batteri eseguono il trasferimento di elettroni extracellulari (EET), per cui gli elettroni vengono trasferiti dalla cellula a un accettore di elettroni terminale extracellulare. Questo accettore di elettroni può essere un elettrodo e gli elettroni possono essere erogati indirettamente tramite una molecola mediatore redox-attiva. Qui, presentiamo un protocollo per studiare l'EET mediata in Lactiplantibacillus plantarum, un batterio probiotico dell'acido lattico ampiamente utilizzato nell'industria alimentare, utilizzando un sistema bioelettrochimico. Descriviamo in dettaglio come assemblare un sistema bioelettrochimico a tre elettrodi e due camere e forniamo indicazioni sulla caratterizzazione dell'EET in presenza di un mediatore solubile utilizzando tecniche di cronoamperometria e voltammetria ciclica. Utilizziamo dati rappresentativi provenienti da esperimenti EET mediati da acido 1,4-diidrossi-2-naftoico (DHNA) con L. plantarum per dimostrare l'analisi e l'interpretazione dei dati. Le tecniche descritte in questo protocollo possono aprire nuove opportunità per l'elettrofermentazione e la bioelettrocatalisi. Recenti applicazioni di questa tecnica elettrochimica con L. plantarum hanno dimostrato un'accelerazione del flusso metabolico verso la produzione di prodotti finali di fermentazione, che sono componenti aromatici critici nella fermentazione degli alimenti. In quanto tale, questo sistema ha il potenziale per essere ulteriormente sviluppato per alterare i sapori nella produzione alimentare o produrre sostanze chimiche preziose.
Introduzione
I sistemi bioelettrochimici interfacciano i microbi con gli elettrodi, consentendo lo studio dei meccanismi di trasferimento elettronico extracellulare (EET) e fornendo approcci rinnovabili alla bioelettrocatalisi 1,2,3. I microbi che eseguono naturalmente l'EET sono noti come esoelettrogeni, che trasferiscono elettroni derivati dal metabolismo agli accettori di elettroni terminali extracellulari, ad esempio ossidi di ferro (idri) ed elettrodi1. Caratterizzate per la prima volta nelle specie Geobacter e Shewanella 4,5, le vie EET sono state successivamente identificate in molti batteri. Questi esoelettrogeni svolgono un ruolo centrale in diverse tecnologie elettrochimiche microbiche, come la generazione di energia elettrica dai flussi di rifiuti, la fissazione della CO2 e la produzione di sostanze chimiche preziose tramite elettrosintesi 1,6,7,8,9,10,11,12.
Uno di questi esoelettrogeni è il Lactiplantibacillus plantarum, un batterio dell'acido lattico gram-positivo13. L. plantarum è un batterio nomade e probiotico che risiede in un'ampia gamma di ambienti, tra cui l'intestino dell'uomo e di altri vertebrati, nonché molti tipi di alimenti come carne, cereali, verdure e cibi e bevande fermentati 14,15,16,17. Il suo genoma codifica un metabolismo flessibile ed eterofermentativo, consentendo un adattamento di successo in questi ambienti diversi. È ben studiato, ampiamente utilizzato nelle industrie alimentari e sanitarie e generalmente riconosciuto come sicuro dalla Food and Drug Administration18,19. In quanto tale, L. plantarum ha il potenziale per fungere da piattaforma utile per le tecnologie basate sull'EET.
Recenti ricerche su L. plantarum hanno identificato un operone multi-gene che codifica per una complessa via EET originariamente caratterizzata in Listeria monocytogenes13,20. In L. plantarum, le proteine sintetizzate da questo operone facilitano l'EET in un sistema bioelettrochimico (BES) quando viene fornito l'acido chinone 1,4-diidrossi-2-naftoico (DHNA) come mediatore elettronico13. La prima proteina essenziale in questa via è una NADH-chinone ossidoreduttasi legata alla membrana (Ndh2), che ossida il NADH e riduce il DHNA. Il DHNA trasporta elettroni direttamente a un elettrodo o indirettamente tramite la proteina accessoria PplA (Figura 1)13,21,22. Ricerche recenti indicano che L. plantarum può anche utilizzare altri chinoni strutturalmente simili al DHNA come mediatori elettronici; tuttavia, L. plantarum non è in grado di produrre DHNA o questi chinoni alternativi, quindi i mediatori devono essere presenti esogenamente nell'ambiente affinché si verifichi EET 13,22,23.
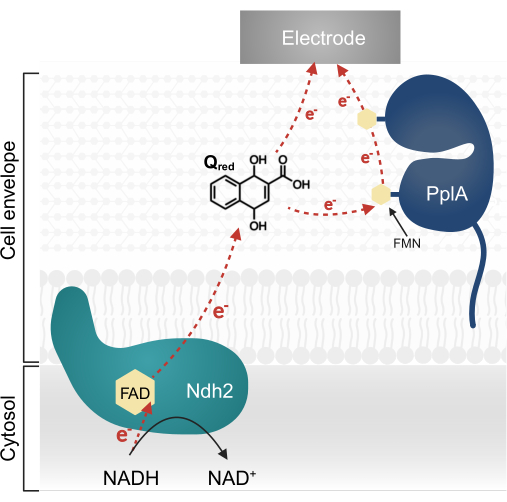
Figura 1: Flusso di elettroni in Lactiplantibacillus plantarum EET. Ndh2 passa elettroni dal NADH al chinone DHNA. Gli elettroni vengono trasportati all'elettrodo per produrre corrente, direttamente dal chinone ridotto o indirettamente attraverso la proteina accessoria PplA. Abbreviazioni: FAD = Flavina adenina dinucleotide; FMN = mononucleotide flavina; EET = trasferimento di elettroni extracellulare; NADH = nicotinammide adenina dinucleotide ridotto; Ndh2 = NADH-chinone ossidoreduttasi; DHNA = acido 1,4-diidrossi-2-naftoico; PplA = fosfolipasi A. Clicca qui per visualizzare una versione più grande di questa figura.
In questo articolo, forniamo un protocollo completo per l'utilizzo di un metodo basato su BES per caratterizzare l'EET mediata da DHNA in L. plantarum. Un sistema a tre elettrodi e due camere confina i batteri nell'elettrodo di lavoro, consentendo un controllo preciso del potenziale applicato ai batteri e prevenendo la diafonia tra l'elettrodo di lavoro e il controelettrodo. Presentiamo un protocollo completo della durata di 5 giorni, che copre la preparazione pre-esperimento, l'assemblaggio BES, l'analisi EET utilizzando la cronoamperometria (CA) e la voltammetria ciclica (CV) e l'analisi dei campioni post-esperimento. Questo protocollo può essere applicato per svelare i meccanismi delle vie EET e per costruire sistemi per l'elettrofermentazione e l'elettrocatalisi.
Protocollo
NOTA: I gruppi BES a due camere saranno indicati come "reattori" nel seguente protocollo.
1. Preparazione dei terreni
- Preparare i terreni di coltura di L. plantarum .
- Preparare i terreni MRS (de Man Rogosa Sharpe) commerciali come indicato e i terreni mMRS24 come descritto nella Tabella 1. Regolare il pH di mMRS a 6,5. Sterilizzare con filtro entrambi i mezzi facendoli passare attraverso un filtro da 0,22 μm e conservarli entrambi a 4 °C fino al momento dell'uso.
- Preparare un terreno chimicamente definito con mannitolo (mCDM)13,25 come descritto nella Tabella 2 e regolare il pH a 6,5. Preparare una quantità di terreno sufficiente a riempire la camera anodica di ciascun reattore con 110 mL di terreno. Filtrare-sterilizzare mCDM attraverso un filtro da 0,22 μm.
NOTA: mCDM deve essere preparato fresco il giorno dell'uso previsto. Le soluzioni dei componenti possono essere preparate in anticipo. Sterilizzare con filtro tutte le soluzioni componenti attraverso un filtro da 0,22 μm e conservare a 4 °C. Quando si preparano le vitamine di Wolfe, regolare il pH a 11 prima della sterilizzazione e conservare al buio o avvolte in un foglio. Quando si preparano i minerali di Wolfe, regolare il pH a 8 dopo aver aggiunto l'acido nitrilotriacetico (NTA). Quindi, aggiungere i componenti rimanenti, sterilizzare e conservare al buio o avvolti in un foglio.
- Preparare 1x PBS e autoclave per sterilizzare. Conservare a 4 °C per l'uso in questo protocollo.
- Preparare i terreni M9 commerciali come indicato (Tabella 3) e sterilizzare in autoclave. Preparare una quantità sufficiente di terreno per riempire la camera catodica di ciascun reattore con 110 mL. Conservare a temperatura ambiente.
2. Giorno 1: Assemblaggio del reattore BES e coltura inizialediL. plantarum
NOTA: Fare riferimento alla Figura 2 per uno schema di un reattore BES e uno schema che descrive in dettaglio i pezzi di assemblaggio indicati nel protocollo.
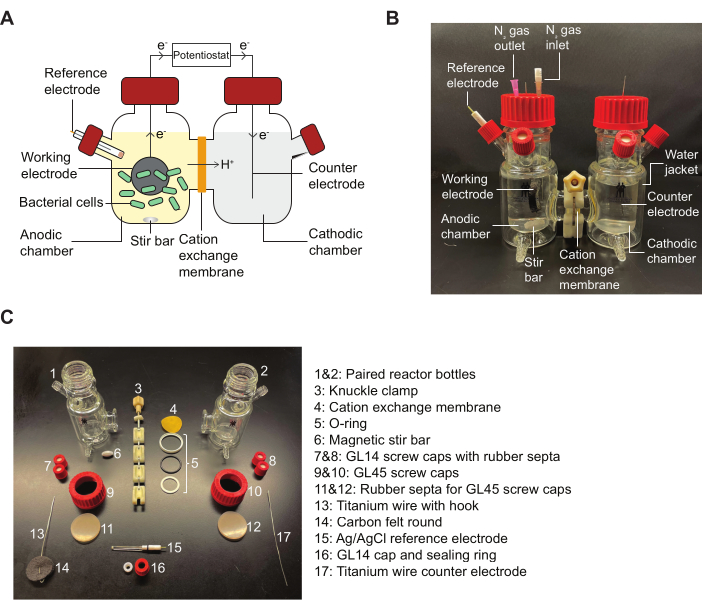
Figura 2: Componenti BES e schema per l'assemblaggio. (A) Uno schema di un reattore BES a due camere. I batteri (verde) nella camera anodica trasferiscono elettroni a un elettrodo funzionante (cerchio nero) in presenza di un mediatore chinone. Gli elettroni fluiscono attraverso il circuito fino alla camera catodica, consentendo di effettuare misurazioni di corrente tra l'anodo e il catodo da un potenziostato. (B) Un'immagine raffigurante un reattore BES completamente assemblato, compresi N2 aghi di ingresso e uscita nella camera anodica. (C) Un'immagine che ritrae tutte le parti di un reattore smontato. Abbreviazione: BES = sistema bioelettrochimico. Clicca qui per visualizzare una versione più grande di questa figura.
- Assemblare e sterilizzare i reattori.
- Preparare gli elettrodi di lavoro e i controelettrodi. Carteggiare fili di titanio pretagliati da 1,0 mm di diametro per i controelettrodi di lavoro e con carta vetrata all'ossido di alluminio fino a renderli uniformemente lucidi. Usando una pinza, piega un'estremità di ciascun filo dell'elettrodo funzionante in un piccolo gancio. Far scorrere un tondo di feltro di carbonio da 16 cm2 su ciascun filo dell'elettrodo funzionante, intrecciando il filo dentro e fuori dal tondo di feltro di carbonio una volta e tirando il tondo lungo il filo fino a fissarlo sul gancio. Fissare gli elettrodi di lavoro e i controelettrodi nei cappucci GL45 perforando il setto di gomma con il filo e tirandolo di alcuni centimetri.
- Per assemblare i reattori accoppiati, assemblare prima l'O-ring e posizionare una membrana a scambio cationico pretagliata che è stata preimbevuta di acqua nell'O-ring assemblato. Posizionare l'O-ring con la membrana tra le grandi aperture inferiori di due flaconi di reattore accoppiati. Fissare i flaconi di coppia del reattore e l'O-ring con la membrana con un morsetto a snodo per serrare a mano. Far cadere un'ancoretta magnetica in ciascuna camera anodica, quindi chiudere tutte le piccole aperture nella parte superiore di ogni bottiglia con tappi GL14 dotati di setti in gomma.
NOTA: Non serrare eccessivamente le nocche clamps o qualsiasi tappo in quanto ciò può causare crepe o rotture nelle bottiglie. - Riempire ogni flacone del reattore con 110 ml di acqua deionizzata (DI), quindi chiudere ogni flacone con l'apposito tappo GL45 montato sull'elettrodo. Inserire i cappucci dotati di un elettrodo di lavoro rotondo in feltro di carbonio premendo delicatamente verso il basso la parte superiore del tondo di feltro in modo che il tondo rimanga sul gancio.
NOTA: Il feltro di carbonio fresco è idrofobo e respinge l'acqua nel reattore durante l'assemblaggio iniziale. La sterilizzazione in autoclave farà sì che il feltro di carbonio diventi adeguatamente idrofilo per la sperimentazione. - Cappucci per elettrodi Gather GL14 dotati di anelli di tenuta in silicone.
- Allentare delicatamente tutti i tappi GL45 prima della sterilizzazione in autoclave. Autoclave reattori riempiti d'acqua e cappucci degli elettrodi per sterilizzare. Dopo la sterilizzazione in autoclave, lasciare raffreddare i reattori a temperatura ambiente.
- Coltura L. plantarum NCIMB8826. In condizioni sterili, raschiare alcuni batteri dalla parte superiore di una riserva di glicerolo e inoculare in 3 ml di terreno MRS commerciale. Coltiva la coltura durante la notte a 37 °C senza agitare.
NOTA: L. plantarum non utilizza l'ossigeno come accettore terminale di elettroni; Pertanto, non è necessario ossigenare il fluido agitando26. Tuttavia, le condizioni di coltura variano se vengono utilizzati altri microbi.
3. Giorno 2: Preparazione degli elettrodi di riferimento, preparazione dei reattori per l'inizio dell'esperimento e subcoltura di L. plantarum
- Preparare gli elettrodi di riferimento Ag/AgCl.
NOTA: Questi passaggi descrivono la preparazione degli elettrodi di riferimento Ag/AgCl indicati nella Tabella dei materiali. Gli utenti devono seguire le istruzioni del produttore se utilizzano un elettrodo di riferimento diverso.- Smontare gli elettrodi di riferimento Ag/AgCl e carteggiare i fili. Estrarre delicatamente l'elettrodo dal suo alloggiamento di vetro e muovere l'alloggiamento di vetro per svuotare la vecchia soluzione KCl. Carteggiare delicatamente i fili degli elettrodi con carta vetrata all'ossido di alluminio fino a renderli lucidi per rimuovere il materiale ossidato.
- Raccogliere tutti i fili degli elettrodi di riferimento levigati in un piccolo becher con una piccola ancoretta e riempire il becher con candeggina al 100% fino a quando i fili non sono completamente sommersi. Clorare i fili lasciandoli sbiancare su una piattaforma di agitazione per 30 minuti fino a quando gli elettrodi diventano grigio più scuro. Dopo lo sbiancamento, sciacquare accuratamente i fili degli elettrodi con acqua deionizzata.
- Per riassemblare un elettrodo di riferimento, utilizzare una siringa per riempire completamente l'alloggiamento di vetro con una soluzione di KCl 3 M satura di cloruro d'argento, picchiettando delicatamente il lato per rimuovere eventuali bolle d'aria. Utilizzando la stessa siringa, riempire il cappuccio del filo dell'elettrodo con la soluzione di KCl, quindi inserire il filo nell'alloggiamento. Posizionare la parte inferiore dell'alloggiamento in vetro contro un tovagliolo di carta sul piano di lavoro, inserire l'elettrodo nell'alloggiamento in vetro, quindi premere con decisione sul cappuccio per chiudere l'elettrodo. Conservare gli elettrodi di riferimento in un becher riempito superficialmente con la soluzione di KCl fino al momento del bisogno e ripetere l'operazione con tutti gli elettrodi di riferimento rimanenti.
- Utilizzare un multimetro digitale per misurare la tensione degli elettrodi di riferimento Ag/AgCl fatti in casa.
- Immergere le estremità degli elettrodi di riferimento Ag/AgCl (stimati a 197 mV rispetto all'elettrodo di idrogeno standard, SHE) in modo superficiale in un becher riempito con 3 M KCl. Collegare saldamente il multimetro a un elettrodo di calomelano saturo acquistato in commercio (SCE, 241 mV rispetto a SHE) anch'esso immerso negli stessi elettroliti KCl.
- Misurare la differenza di potenziale tra ciascun elettrodo di riferimento e l'SCE. Verificare che gli elettrodi di riferimento differiscano dall'SCE di 44 ± 10 mV. Smontare e rimontare qualsiasi elettrodo di riferimento che non rientri in questo intervallo.
- Sigillare la cucitura nel punto in cui il tappo incontra l'alloggiamento in vetro con parafilm.
- Preparare i reattori per la sperimentazione.
- In una cappa di biosicurezza sterile, scambiare l'acqua autoclavata nei reattori con il terreno appropriato. Versare l'acqua sterilizzata in autoclave. Riempire le camere catodiche con 110 mL di terreno M9 autoclavato. Riempire le camere anodiche con 110 ml di mCDM appena preparato.
- Installare gli elettrodi di riferimento. Rimuovere un cappuccio GL14 da ciascuna camera anodica e sostituirlo con un cappuccio per elettrodi autoclavato (cappuccio GL14 con anello di tenuta in silicone). Spruzzare gli elettrodi di riferimento con etanolo al 70% per sterilizzare, quindi posizionare un elettrodo di riferimento attraverso il cappuccio dell'elettrodo in ciascuna camera anodica.
NOTA: Assicurarsi che l'elettrodo di riferimento non entri in contatto diretto con il tondo in feltro di carbonio. - Prima di rimuovere i reattori dalla cabina di biosicurezza, serrare tutti i tappi e i morsetti in modo che siano serrati a mano per evitare perdite.
- Collegare i reattori al sistema di pompaggio dell'acqua. Posizionare ciascun reattore sulla piattaforma di ancoretta appropriata. Collegare i raccordi della camicia d'acqua di ciascun reattore all'altro con un tubo di gomma, collegando i reattori terminali ai tubi di afflusso e deflusso della pompa dell'acqua.
NOTA: Assicurarsi che tutti i collegamenti siano serrati senza perdite, utilizzando fascette per fissare i tubi, se necessario. - Riempire la pompa con acqua e aggiungere 4-6 gocce di condizionatore d'acqua. Accendere il sistema di pompaggio e impostare la temperatura a 30 °C. Avviare la pompa e osservare il flusso d'acqua attraverso tutte le camicie d'acqua del reattore, assicurandosi che non vi siano perdite in corrispondenza di nessuna connessione.
- Accendere le piattaforme di agitazione e impostarle sull'agitazione continua a 220 giri/min.
- Collegare i reattori alle tubazioni del gas che spargono azoto. Collegare un filtro dell'aria a un ago da 4 pollici e 22 G e inserire l'ago attraverso il setto superiore di una camera anodica del reattore nel mezzo per fungere da ingresso dell'azoto. Inserire un altro ago da 1 pollice e 18 G nel setto superiore della camera anodica per fungere da uscita dell'azoto. Collegare le linee del gas da una fonte di azoto al filtro dell'aria e aprire la valvola per consentire al gas di gorgogliare delicatamente attraverso il reattore. Assicurarsi che l'azoto bolle continuamente attraverso tutte le camere anodiche durante l'esperimento per mantenere le condizioni anaerobiche.
NOTA: Assicurarsi che l'ago di ingresso sia posizionato lontano dal tondo in feltro di carbonio. Il flusso di bolle non deve entrare in contatto né con il feltro di carbonio né con gli elettrodi di riferimento. - Collegare i bioreattori ai cavi del potenziostato. Collegare i cavi della clip a coccodrillo dell'elettrodo di lavoro, del contatore e di riferimento dal potenziostato agli elettrodi corrispondenti.
NOTA: Utilizzare un multimetro per controllare la resistenza tra il collettore di corrente/filo e gli elettrodi per garantire collegamenti elettrici corretti e ridurre al minimo i potenziali errori di misurazione.
- Parametri del potenziostato di ingresso per la pre-esecuzione.
NOTA: Di seguito sono riportate le impostazioni tecniche critiche. Vedere la Tabella 4 per un elenco esteso delle impostazioni software per ciascuna tecnica.- Accendere il potenziostato e inizializzare il software EC-lab sul computer. Collegare il potenziostato al computer facendo clic sul pulsante del simbolo del potenziostato nel pannello in alto a sinistra sotto Dispositivi. Una volta connesso, il nome del dispositivo apparirà con un cerchio verde nella casella di testo sottostante.
- Sincronizzare tutti i canali collegati ai bioreattori in un unico gruppo facendo clic sulla scheda Modifica , quindi selezionando Sincronizza. Fare clic sulle caselle del numero del canale appropriate | ok.
- Aggiungi la tecnica della tensione a circuito aperto (OCV) al potenziostato facendo clic sul pulsante + nel pannello Impostazioni parametri a sinistra. Nella casella blu delle impostazioni; impostarlo per misurare il potenziale dell'elettrodo di lavoro (EWE) rispetto all'elettrodo di riferimento (RE), registrando il tempo nell'intervallo dt ogni 36 s per un totale di 3 ore.
- Quindi, aggiungere la tecnica voltammetria ciclica (CV) al potenziostato. Impostare il potenziale iniziale di EWE su Ei di 0 V rispetto a RE con una velocità di scansione di 2 mV/s. Sweep a un potenziale di vertice (E1) di 0,4 V rispetto a RE che si inverte a un potenziale di vertice (E2) di -0,7 V rispetto a RE. Ripetere la scansione per un totale di due passaggi.
NOTA: Nei sistemi elettrochimici microbici, l'inoculazione microbica e la formazione di biofilm inducono capacità elevate rispetto ai materiali metallici o alle molecole inorganiche. Durante la scansione voltammetrica ciclica, il potenziale varia e una corrente di carica funge da sfondo. Per ottenere un elevato rapporto segnale/rumore, sono necessarie velocità di scansione più basse, anche se ciò aumenta la durata della scansione. Poiché scansioniamo due cicli che coprono un'ampia finestra elettrochimica di 1,1 V, una velocità di scansione di 2 mV/s si traduce in un mezzo ciclo che richiede fino a 9,1 minuti. Di conseguenza, due cicli durano complessivamente 36,4 minuti. Ridurre ulteriormente la velocità di scansione richiederebbe troppo tempo. - Aggiungi la tecnica cronoamperometria (CA). Applicare un potenziale costante EWE di 0,2 V rispetto a RE per un tempo di t = 200 h, registrando il tempo a intervalli dt ogni 25-40 s. Regolare l'intervallo di tempo in base al software del potenziostato per ottenere il livello di dettaglio desiderato.
NOTA: Il potenziale del punto medio del DHNA è di circa -0,093 V rispetto ad Ag/AgCl; quindi, un potenziale applicato di 0,2 V rispetto a RE all'elettrodo di lavoro è sufficiente per consentire il trasferimento di elettroni dal DHNA all'elettrodo. - Dopo aver inserito tutti i parametri, iniziare la corsa premendo il triangolo di avvio verde. Salvare il file come desiderato come indicato dal software, quindi fare clic su Salva. Il software inizierà la tecnica 1, "OCV". Osservare le tracce OCV per alcuni minuti per assicurarsi che tutti i reattori leggano positivamente e siano vicini tra loro con un segnale costante. Lasciare che l'esperimento venga eseguito durante la notte per completare l'OCV e il CV iniziale (vedere la Figura S1 supplementare per il CV di controllo dei supporti) e consentire l'esecuzione di CA fino a quando non si stabilizza.
- In condizioni sterili, sottocoltura la coltura MRS di L. plantarum 1:200 in 50 mL di mMRS. Far crescere le cellule per una notte a 37 °C senza agitare.
NOTA: Una coltura notturna da 50 mL produce tipicamente cellule più che sufficienti per sei reattori, assumendo un OD600 finale di 0,2 nel reattore. Regolare i volumi delle colture di conseguenza per esperimenti più grandi o più piccoli.
4. Giorno 3: Iniezione di cellule e DHNA/DMSO
- Lavare le celle e iniettarle nei reattori.
- Rimuovere la coltura mMRS L. plantarum dall'incubatrice al mattino. In condizioni sterili, trasferire la coltura in una provetta conica da 50 mL e posizionare la coltura sul ghiaccio.
- Lavare le celle 2 volte in 1 PBS sterile, freddo. A tal fine, centrifugare la coltura a 4.000 × g per 5 minuti in una centrifuga a 4 °C per pellettare le cellule. In condizioni sterili, risospendere delicatamente ma accuratamente le cellule in 50 mL di PBS, quindi centrifugare nuovamente come prima; Ripetere per un secondo lavaggio. Dopo la centrifuga finale, risospendere le celle in PBS freddo a OD600 = 11.
- In condizioni sterili, caricare 2 mL di cellule risospese in una siringa da 3 mL dotata di un ago per ciascun reattore.
- Alla stazione del reattore, dechiudere una siringa cellulare e inserire l'ago nella parte superiore di una camera anodica del reattore. Non premere lo stantuffo della siringa in questo momento; ripetere per tutti i reattori. Una volta posizionate tutte le siringhe, premere gli stantuffi per iniettare le cellule nei reattori e registrare il tempo di iniezione dalla traccia CA. Questo volume di celle produce un OD600 finale di 0,2 nei reattori. Smaltire tutte le siringhe nelle scatole per il rischio biologico e gli aghi nell'apposito contenitore per il rischio biologico per oggetti taglienti. Lasciare che la corrente si stabilizzi sulla traccia CA per 2-4 ore.
NOTA: Al momento dell'iniezione, si possono osservare fluttuazioni di corrente sulla traccia CA. Dopo 2-4 ore, queste fluttuazioni si stabilizzeranno a una corrente piatta (variazione di corrente di <2 μA nel corso di un'ora), a quel punto il DHNA può essere iniettato.
- Misurare il pH iniziale e iniettare DHNA.
- Preparare una soluzione di DHNA. In una provetta da 1,5 mL, preparare 500 μL di una soluzione di DHNA da 20 mg/mL sciogliendo il DHNA in polvere in DMSO al 100%. Riempire 3 siringhe da insulina con 110 μL di soluzione di DHNA e 3 siringhe da insulina con 110 μL di DMSO.
NOTA: Mentre il DHNA è leggermente solubile in acqua, il DMSO è un solvente migliore per le scorte di DHNA a questa concentrazione. Il solvente mediatore può variare se vengono utilizzati altri mediatori. - Alla stazione del reattore BES, etichettare i reattori sperimentali come + DHNA e i reattori di controllo del solvente come - DHNA. Schiudere una siringa di DHNA e inserire la siringa nella parte superiore di ciascuna camera anodica designata come + DHNA. Inserire una siringa solo DMSO in ciascuna camera anodica designata come - DHNA. Non premere gli stantuffi della siringa in questo momento.
- Prelevare campioni di punti temporali 0 h per l'analisi del campione. Utilizzando una siringa da 3 mL dotata di un ago da 2 pollici e 21 G, prelevare un campione di terreno da 2 mL da ciascuna camera anodica attraverso il setto a tappo piccolo inutilizzato e trasferire i campioni in una piastra a 24 pozzetti profondi per effettuare misurazioni del pH per il punto temporale 0 h (punto di iniezione del DHNA). Se lo si desidera, prelevare 1 mL di terreno esaurito da ciascuna camera anodica e filtrare attraverso un filtro da 0,2 μm in provette marcate pulite per quantificare i metaboliti utilizzando HPLC o altri saggi. Conservare i campioni di terreno esauriti a -80 °C.
- Premere gli stantuffi di tutte le siringhe DHNA e DMSO per iniettare nei reattori. Registrare l'ora dell'iniezione dalla traccia CA. Gettare tutte le siringhe e gli aghi in modo appropriato.
- Misurare e registrare i campioni di pH a 0 h per ciascun reattore.
- Preparare una soluzione di DHNA. In una provetta da 1,5 mL, preparare 500 μL di una soluzione di DHNA da 20 mg/mL sciogliendo il DHNA in polvere in DMSO al 100%. Riempire 3 siringhe da insulina con 110 μL di soluzione di DHNA e 3 siringhe da insulina con 110 μL di DMSO.
5. Giorno 4: Completamento dell'esperimento e raccolta dei campioni
- Condurre l'analisi elettrochimica 24 ore dopo l'iniezione di DHNA e prelevare i campioni finali.
- Terminare l'esecuzione del CA 24 ore dopo l'iniezione di DHNA.
- Prelevare campioni di 24 ore per l'analisi del campione secondo il passaggio 4.2.3.
- Eseguire nuovamente CV per il punto temporale di 24 ore secondo i parametri descritti al punto 3.3.4.
- Misurare e registrare il pH per i campioni di 24 ore di ciascun reattore.
- Smontare e pulire i reattori.
- Spegnere il potenziostato. Quindi, scollegare i cavi di lavoro, contatore e di riferimento da ciascun reattore. Pulire l'umidità dalle clip a coccodrillo del potenziostato.
- Chiudere il flusso di azoto gassoso. Scollegare i cavi del gas, quindi rimuovere gli aghi di afflusso e deflusso. Smaltire tutti gli aghi in modo appropriato in un contenitore per oggetti taglienti.
- Spegnere la pompa dell'acqua. Scollegare i tubi di afflusso e deflusso dalla pompa e lasciare che l'acqua defluisca in un secchio. Quando si scollega, tenere le estremità del tubo sollevate sopra la linea di galleggiamento della pompa per evitare che l'acqua si riversi sul pavimento. Uno per uno, scollegare ogni reattore dal tubo della camicia d'acqua, lavorando dal reattore di deflusso finale al reattore di afflusso iniziale.
- Svuotare tutti i mezzi dai reattori in un grande contenitore a rischio biologico. Seguire i normali metodi di sbiancamento della coltura per lo smaltimento.
- Una volta svuotato, smontare e pulire tutti i pezzi del reattore. Smaltire le membrane a scambio cationico e i tondi di feltro di carbonio in rifiuti a rischio biologico. Pulire gli elettrodi di riferimento e i fili di titanio con etanolo al 70% e conservare gli elettrodi di riferimento puliti in un becher poco profondo riempito d'acqua. Pulire delicatamente i flaconi del reattore, i tappi, gli O-ring e i morsetti in acqua tiepida con un detergente da laboratorio, sciacquare abbondantemente con acqua deionizzata e asciugare all'aria tutte le parti prima di riporle.
6. Giorno 5: Analisi elettrochimica
NOTA: Di seguito è riportata una descrizione generale del tracciato dei dati per questo protocollo. Descrizioni più dettagliate relative all'analisi e all'interpretazione dei dati saranno fornite nella sezione Risultati rappresentativi.
- Per l'analisi CA: Impostare il tempo di iniezione del DHNA come punto temporale 0 h. Tracciare la deviazione media e standard della densità di corrente misurata (j in μA/cm2) rilevata ogni 36 s per tutte le repliche dal punto di tempo 0 h in funzione del tempo (h). Calcolare la densità di corrente in funzione dell'area dell'elettrodo di lavoro (16 cm2).
- Per l'analisi CV: tracciare una traccia CV rappresentativa per ciascuna condizione sperimentale (solo terreno, DMSO o DHNA) raffigurando la densità di corrente (j in μA/cm2) in funzione del potenziale dell'elettrodo di lavoro (EWE in V). Traccia il secondo ciclo dell'esecuzione CV selezionata.
Risultati
Analisi cronoamperometrica
L'EET di L. plantarum può essere osservato attraverso i dati di cronoamperometria (CA) illustrati nella Figura 3, in cui la traccia di densità di corrente visualizza il trasferimento di elettroni da L. plantarum all'elettrodo di lavoro. Abbiamo monitorato la densità di corrente (j) in funzione del tempo, mantenendo un potenziale costante di +200 mV rispetto ad Ag/AgCl per 24 ore. Dopo l'iniezione di 20 μg/mL di DHNA nella soluzione elettrolitica di agitazione, è stato osservato un picco di ossidazione abiotica del DHNA, seguito da un rapido aumento della densità di corrente biotica con un picco di 132,0 ± 2,47 μA/cm2 a circa 8 ore. Al contrario, l'iniezione di DMSO ha comportato una densità di corrente trascurabile. Questi risultati sottolineano l'importanza del DHNA come mediatore necessario ed efficiente per facilitare il trasferimento di elettroni tra L. plantarum e l'elettrodo. Gli utenti possono regolare l'uscita di corrente regolando la concentrazione di DHNA nel BES. Ricerche precedenti indicano anche che L. plantarum risponde al DHNA in modo dose-dipendente in un'ampia gamma di concentrazioni di DHNA, producendo una corrente significativa in presenza di concentrazioni di DHNA fino a 0,01 μg/mL13,22.
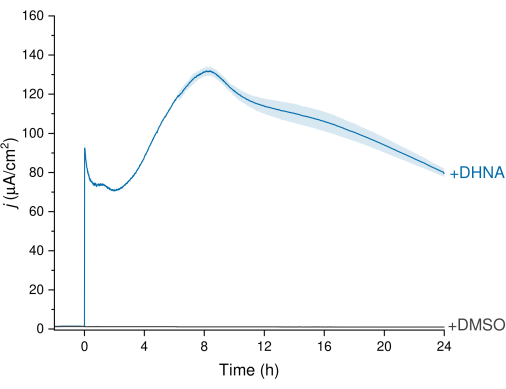
Figura 3: Analisi cronoamperometrica di Lactiplantibacillus plantarum EET mediata da DHNA. DHNA (20 μg/mL) o DMSO è stato iniettato in elettroliti mCDM (pH~ 6,5) con tempo di iniezione identificato come t = 0. j rappresenta la densità di corrente in funzione dell'area dell'elettrodo di lavoro. Gli esperimenti sono stati condotti a 200 mV rispetto ad Ag/AgCl con un elettrodo di feltro di carbonio (16cm2) e agitazione. I valori sono tracciati come media ± sd ottenuti in reattori BES triplicati. Abbreviazioni: EET = trasferimento di elettroni extracellulare; DHNA = acido 1,4-diidrossi-2-naftoico; DMSO = dimetilsolfossido; mCDM = Terreno chimicamente definito con mannitolo. Clicca qui per visualizzare una versione più grande di questa figura.
Analisi voltammetrica ciclica
Per valutare ulteriormente l'EET mediata da DHNA in L. plantarum, abbiamo condotto una voltammetria ciclica 24 ore dopo l'iniezione di DHNA. Qui mostriamo le tracce CV per tre condizioni: L. plantarum con 20 μg/mL DI DHNA, L. plantarum con DMSO e terreni con 20 μg/mL di DHNA. Come mostrato nella Figura 4A, la presenza di 20 μg/mL di DHNA nei reattori contenenti L. plantarum ha determinato un netto aumento della corrente ossidativa a 50 mV che non si è verificato in presenza del solo DMSO. Questi dati confermano che l'aggiunta del mediatore redox DHNA è necessaria per facilitare il trasferimento di elettroni tra L. plantarum e l'anodo. Sebbene siano stati osservati vari picchi redox più piccoli nella traccia di L. plantarum + DMSO, questi picchi erano simili alla traccia di controllo dei terreni e sono probabilmente attribuiti a componenti redox-attivi nella mCDM (Figura S1 supplementare). Nella Figura 4B, abbiamo confrontato le tracce di DHNA in condizioni biotiche (L. plantarum + DHNA) rispetto al DHNA in condizioni abiotiche (Media + DHNA). Mentre entrambe le tracce mostravano un distinto picco ossidativo di DHNA intorno ai 50 mV, abbiamo osservato un aumento sostenuto della corrente oltre i 50 mV solo in condizioni biotiche. Il picco catalitico ha raggiunto una densità di corrente di 129 μA/cm2 a 300 mV, con un aumento del 256% rispetto alla traccia abiotica. Questo profilo CV di turnover è caratteristico dell'EET27 microbico, indicando una ri-riduzione del DHNA da parte delle cellule di L. plantarum in presenza di una fonte di elettroni (mannitolo) dopo l'ossidazione del DHNA all'anodo. Inoltre, la traccia abiotica ha mostrato nuovi picchi ossidativi intorno a -240 mV e -180 mV. Ricerche precedenti indicano che la comparsa di questi picchi può essere dovuta alla degradazione del DHNA in ACNQ (2-ammino-3-carbossi-1,4-naftochinone)21,28. Non abbiamo osservato questi picchi nella traccia biotica, indicando che l'interazione delle cellule di L. plantarum con il DHNA può stabilizzare il DHNA e prevenire la degradazione. Un punto da notare è che il tracciato di 24 ore per terreni con 20 μg/mL di DHNA è stato condotto separatamente secondo questo protocollo senza l'aggiunta di cellule.
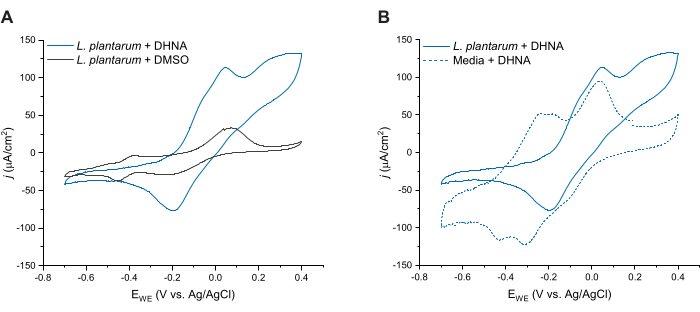
Figura 4: Tracce di voltammetria ciclica rappresentative. Tutti gli esperimenti CV sono stati eseguiti in mCDM utilizzando feltro di carbonio (16 cm2) come elettrodo di lavoro ad una velocità di scansione di 2 mV/s mentre si agitava la soluzione. (A) Tracce CV per Lactiplantibacillus plantarum con DHNA (20 μg/mL) o DMSO a t = 24 h. (B) Tracce CV di 20 μg/mL di DHNA in L. plantarum (condizioni biotiche) o solo mCDM (condizioni abiotiche) a t = 24 h. Abbreviazioni: CV = voltammetria ciclica; mCDM = Terreno Chimicamente Definito con mannitolo; DHNA = acido 1,4-diidrossi-2-naftoico; DMSO = dimetilsolfossido. Clicca qui per visualizzare una versione più grande di questa figura.
Analisi del pH
L'attività EET in L. plantarum ha provocato un notevole calo del pH nell'arco di 24 ore. Come mostrato nella Figura 5, il pH medio del campione di L. plantarum esposto al DHNA è sceso a 3,33 ± 0,01 (p = 6,85 × 10-6, n = 3), mentre il pH medio del campione di L. plantarum esposto al DMSO è sceso a 6,50 ± 0,06 (p = 0,0409, n = 3). Come dimostrato in ricerche precedenti, questo calo è attribuito a un aumento del metabolismo fermentativo che si verifica quando L. plantarum esegue EET13. L. plantarum normalmente metabolizza il mannitolo attraverso la glicolisi e le vie fermentative, che producono acetato, lattato ed etanolo come prodotti di fine fermentazione e generano ATP attraverso la fosforilazione a livello di substrato29. In condizioni EET, il flusso metabolico attraverso la fermentazione aumenta, aumentando così la produzione di prodotti di fine fermentazione nel terreno BES13. Questo cambiamento metabolico fa sì che il pH del terreno scenda più rapidamente nei reattori con DHNA rispetto ai reattori di controllo DMSO.
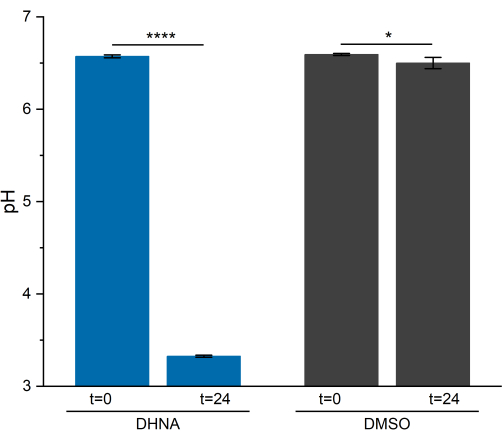
Figura 5: Analisi del pH del sistema bioelettrochimico di Lactiplantibacillus plantarum . I campioni sono stati raccolti a t = 0 e t = 24 ore durante la cronoamperometria. I valori sono tracciati come media ± sd ottenuti in reattori BES triplicati. La significatività è stata determinata da un test t a una coda. DHNA: valore P = 6,85 × 10-6. DMSO: valore P = 0,0409. Abbreviazioni: DHNA = acido 1,4-diidrossi-2-naftoico; DMSO = dimetilsolfossido. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Ingredienti per la preparazione dei terreni mMRS24. Clicca qui per scaricare questa tabella.
Tabella 2: Ingredienti per la preparazione dei terreni mCDM. Questa tabella è tratta da Tejedor-Sanz et al.13 e Aumiller et al.25. Clicca qui per scaricare questa tabella.
Tabella 3: Ingredienti per la preparazione dei terreni M9. Clicca qui per scaricare questa tabella.
Tabella 4: Impostazioni dei parametri EC-Lab per le tecniche OCV, CA e CV. Abbreviazioni: OCV = tensione a circuito aperto; CA = cronoamperometria; CV = voltammetria ciclica. Clicca qui per scaricare questa tabella.
Figura supplementare S1: Tracce rappresentative di voltammetria ciclica di Lactiplantibacillus plantarum con DMSO e mCDM da soli. Tracce CV per L. plantarum con DMSO a t = 24 h e mCDM da solo a t = 0 h. Tutti gli esperimenti CV sono stati eseguiti utilizzando feltro di carbonio (16 cm2) come elettrodo di lavoro ad una velocità di scansione di 2 mV/s mentre si agitava la soluzione. Abbreviazioni: CV = voltammetria ciclica; mCDM = Terreno Chimicamente Definito con mannitolo; DHNA = acido 1,4-diidrossi-2-naftoico; DMSO = dimetilsolfossido. Clicca qui per scaricare questo file.
Discussione
Utilizzando il sistema bioelettrochimico a tre elettrodi e due camere qui descritto, abbiamo mostrato la misurazione della generazione di corrente dall'EET mediata da DHNA in L. plantarum. Questi esperimenti BES generano dati di alta qualità; tuttavia, i BES sono sensibili. Pertanto, il successo del protocollo dipende dalla precisione dell'utente, in particolare nell'assemblaggio del reattore e dell'elettrodo di riferimento, nel posizionamento di aghi ed elettrodi all'interno della camera anodica e nella sostituzione della membrana a scambio cationico. È fondamentale assemblare i reattori con cura, garantendo l'assenza di perdite di acqua/fluido durante la sterilizzazione in autoclave o la sperimentazione. Le perdite d'acqua possono essere risolte assicurandosi che le membrane a scambio cationico siano tagliate per adattarsi con precisione all'O-ring e stringendo il morsetto a snodo a mano. È inoltre essenziale immergere completamente il feltro di carbonio in acqua durante la sterilizzazione in autoclave per consentirne l'idrofilia per la sperimentazione. Raccomandiamo ai nuovi utenti di lasciare riposare i reattori appena assemblati e riempiti d'acqua per 2 ore prima della sterilizzazione in autoclave, verificando la presenza di segni di perdite lente sotto le giunzioni principali della bottiglia. Inoltre, garantire un corretto assemblaggio dell'elettrodo di riferimento garantisce una replica coerente dei dati tra i reattori. Se la fritta di teflon all'interno dell'alloggiamento in vetro si scolorisce, si incrina o si secca, ciò può causare un'elevata resistenza dell'elettrodo di riferimento. Gli utenti possono sostituire l'alloggiamento in vetro per ripristinare le prestazioni dell'elettrodo di riferimento.
Il corretto orientamento di tutti gli aghi e gli elettrodi all'interno della camera anodica durante la sperimentazione è fondamentale per il successo dell'esperimento. L'elettrodo di riferimento non deve entrare in contatto diretto con nessuna parte dell'elettrodo di lavoro in feltro di carbonio. Gli utenti possono regolare la posizione del feltro di carbonio ruotando delicatamente il filo di titanio dell'elettrodo di lavoro da sopra il reattore. Inoltre, il posizionamento dell'ago per lo sparging di azoto non deve entrare in contatto diretto con gli elettrodi all'interno della camera o con le connessioni elettrodo/potenziostato sopra la camera. Il flusso di azoto deve essere regolato in modo da non fluire in nessuno dei due elettrodi. Infine, gli utenti devono assicurarsi che l'ancoretta non entri in contatto con l'elettrodo di lavoro posizionando l'elettrodo di lavoro a 1-2 cm sopra l'ancoretta di agitazione. Se si osserva un segnale irregolare nell'OCV, questo può essere risolto assicurandosi del corretto posizionamento degli elettrodi e del flusso di azoto all'interno del reattore e controllando che i collegamenti tra i cavi del potenziostato e gli elettrodi del reattore siano corretti e sicuri. Infine, la nostra esperienza dimostra che i mediatori elettronici come il DHNA possono essere trattenuti all'interno della membrana di scambio cationico e causare un'elevata corrente di fondo se riutilizzati troppe volte. Si consiglia di sostituire la membrana a scambio cationico dopo due o tre utilizzi, soprattutto quando si studia l'EET mediata, per garantire risultati sperimentali affidabili.
A differenza dell'EET diretta, in cui l'attaccamento microbico diretto all'elettrodo facilita il trasferimento di elettroni, l'EET mediata richiede una diffusione costante di navette di elettroni attraverso la membrana cellulare e l'elettrodo, con il risultato delle impostazioni BES uniche qui descritte. In primo luogo, abbiamo scelto un BES a doppia camera rispetto alla controparte a camera singola nel nostro protocollo per separare le reazioni anodiche e catodiche con una membrana a scambio cationico. Questa separazione impedisce ai mediatori elettronici a diffusione libera (DHNA) e ai microbi di interagire in modo incrociato con il catodo, assicurando che l'EET microbico sia la principale fonte di elettroni per ridurre i mediatori elettronici e l'anodo. La separazione consente inoltre un controllo preciso su parametri come la concentrazione/distribuzione del mediatore e il potenziale in bilico sull'anodo. Inoltre, abbiamo scelto il feltro di carbonio come materiale anodico tra le altre opzioni come barre di grafite, elettrodi metallici, carbonio vetroso o ossido di indio e stagno (ITO). Questo perché la struttura porosa 3D del feltro di carbonio fornisce una superficie molto più ampia rispetto a quegli elettrodi30, consentendo un utilizzo efficiente dei mediatori anche ad alte concentrazioni. Le nostre impostazioni BES a tre elettrodi e due camere forniscono una lettura affidabile e riproducibile dell'EET mediato anche nel monitoraggio a lungo termine; Tuttavia, questo processo ha una velocità effettiva relativamente bassa. Questo protocollo è adatto per la comprensione su scala di laboratorio dei meccanismi EET o per testare prototipi di applicazioni EET. I ricercatori possono prendere in considerazione architetture BES alternative come i BES portatili o stampati31,32, gli array di semiconduttori a ossido di metallo complementare (CMOS)33 o i BES 34 up-scalati34 per diversi scopi fondamentali o applicativi.
In questo protocollo, forniamo istruzioni dettagliate per le tecniche elettrochimiche più comunemente utilizzate: cronoamperometria (CA) e voltammetria ciclica (CV). Vale la pena notare che altre tecniche elettrochimiche, come la spettroscopia di impedenza elettrochimica (EIS) e la voltammetria a impulsi differenziali (DPV), possono fornire informazioni più approfondite sul BES analizzando la resistenza al trasferimento di carica e la capacità a doppio strato 35,36,37. Sebbene questo protocollo BES consenta le misurazioni EET, l'integrazione dei dati elettrochimici con le misurazioni dell'attività metabolica e della biomassa cellulare può essere essenziale per un'analisi completa. Microbi come L. plantarum utilizzano l'EET come uno dei pozzi di assorbimento degli elettroni insieme ad altri sottoprodotti della fermentazione come il lattato e l'etanolo. Inoltre, è interessante notare che la crescita della biomassa cellulare funge anche da pozzo di elettroni13. Pertanto, la quantificazione dei donatori di elettroni consumati (ad esempio, mannitolo), la valutazione della crescita della biomassa cellulare e il monitoraggio dei sottoprodotti della fermentazione offrono informazioni più approfondite sull'efficienza e sulle ramificazioni fisiologiche dell'EET. I metaboliti cellulari sono comunemente quantificati utilizzando la cromatografia e i saggi enzimatici, mentre la vitalità e la crescita cellulare sono valutate contando le unità formanti colonie e misurando la densità ottica dei terreni esauriti a 600 nm, rispettivamente13. È anche importante notare che le misure EET sono sensibili a piccole perturbazioni in condizioni sperimentali. Ciò include, a titolo esemplificativo ma non esaustivo, pH, temperatura, velocità di agitazione e velocità di sparging dell'azoto gassoso38. Pertanto, la normalizzazione dei livelli di EET misurati con misurazioni bioanalitiche funge da controllo interno, facilitando una valutazione coerente tra gli esperimenti condotti in giorni diversi.
Combinando tecniche elettrochimiche con altre misure bioanalitiche, l'EET mediata crea nuove opportunità per l'elettrofermentazione e la bioelettrocatalisi. L'uso convenzionale di elettrocatalizzatori organici, inorganici o enzimatici pone sfide a causa del loro costo elevato e sono soggetti a degradazione. In alternativa, l'utilizzo di microbi come elettrocatalizzatori viventi offre una soluzione meno costosa e più scalabile grazie alle capacità di autoriparazione e autoreplicazione dei microbi39. L. plantarum, generalmente riconosciuto come un batterio dell'acido lattico sicuro, è un telaio particolarmente intrigante. Utilizzando configurazioni elettrochimiche identiche descritte in questo protocollo, abbiamo precedentemente dimostrato che L. plantarum può fermentare il succo di cavolo riccio in condizioni EET e accelerare il flusso metabolico verso la produzione di più prodotti finali di fermentazione come lattato, acetato e succinato13; Questi acidi organici sono composti aromatici essenziali nella fermentazione degli alimenti. Ciò implica che, utilizzando tecniche elettrochimiche, l'EET mediata in L. plantarum può essere potenzialmente dirottata per manipolare il flusso metabolico, alterare i sapori del cibo o produrre sostanze chimiche preziose. Vale la pena notare che le tecniche elettrochimiche presentate in questo protocollo possono essere applicate non solo a L. plantarum, ma possono anche essere applicate genericamente ad altri microbi nativi o ingegnerizzati che eseguono EET40,41 mediato. Diversi mediatori elettronici, come la flavina, il ferrocene, il rosso neutro, il ferricianuro, il lawsone e il menadione possono essere selezionati in base al meccanismo di trasferimento elettronico del microbo specifico utilizzato 22,42. Inoltre, il protocollo BES stabilito in questo lavoro può essere esteso agli esoelettrogeni che svolgono EET senza mediatori, come precedentemente dimostrato con le specie Shewanella e Geobacter 43,44. Un mezzo di crescita ottimizzato dovrebbe essere utilizzato per supportare l'attività cellulare del particolare microbo per facilitare le sue prestazioni EET. Questo protocollo mette a punto i parametri per l'EET mediata da DHNA in L. plantarum, ma sono previste modifiche quando vengono applicati diversi mediatori di microbi ed elettroni.
Divulgazioni
Gli autori non hanno interessi concorrenti da dichiarare.
Riconoscimenti
Ringraziamo i membri del laboratorio Ajo-Franklin per le discussioni approfondite sull'assemblaggio BES, la manutenzione, i passaggi critici e la risoluzione dei problemi. La ricerca è stata sponsorizzata dall'Ufficio di Ricerca dell'Esercito ed è stata realizzata con il numero di sovvenzione W911NF-22-1-0239 (a C.M.A., a sostegno di R.A.) e dal Cancer Prevention and Research Institute of Texas, sovvenzione # RR190063 (a C.M.A.F., a sostegno di R.C., S.L. e B.B.K.). La Figura 1 è stata creata con BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 1,4-Dihydroxy-2-naphthoic acid (DHNA) | Sigma-Aldrich | 281255-25G | |
| 1.0 mm diameter titanium wire | Thermo Fisher Scientific | 045485.BY | Cut to size for working and counter electrodes |
| 120-C Aluminum Oxide Sheets 9" x 11" | Johnson Abrasives | 10108-15 | |
| 3 mL plastic syringes | Thermo Fisher Scientific | 14955457 | |
| 3M KCl solution saturated with silver chloride | Millipore Sigma | 60137-250ML | |
| 6.35-mm-thick carbon felt | Thermo Fisher Scientific | 043200.RF | Cut into 16 cm2 rounds |
| Ag/AgCl reference electrode | CH Instruments | CH111 | |
| Air-Tite Premium Hypodermic Needles | Thermo Fisher Scientific | 14-817-102 | |
| AlK(SO)4 * 12H2O | Sigma-Aldrich | 237086-100G | |
| Ammonium citrate tribasic | Millipore Sigma | A1332 | |
| Avanti J-15R Centrifuge | Beckman Coulter | B99517 | |
| BD Precision Glide Needle, 18 G x 1 inch | Thermo Fisher Scientific | 14-826-5G | |
| BD Precision Glide Needle, 21 G x 2 inch | Thermo Fisher Scientific | 14-821-13N | |
| Bel-Art SP Scienceware Cleanware Aqua-Clear Water Condtioner | Thermo Fisher Scientific | 23-278339 | |
| Biotin | Millipore Sigma | B4639 | |
| CaCl2 | Millipore Sigma | C4901 | |
| Calcium D-(+)-pantothenate | Millipore Sigma | 1087009 | |
| Casamino acids | Millipore Sigma | 2240-OP | |
| cation exchange membrane | Membranes International | CMI-7000 | Cut into rounds fit to the BES O-ring |
| CoCl2 * 6H2O | Millipore Sigma | C8661 | |
| CuSO4 * 5H2O | Millipore Sigma | C8027 | |
| Cysteine-HCl * H2O | Millipore Sigma | 30129 | |
| DMSO | Millipore Sigma | 5439001000 | |
| DS-11+ Spectrophotometer | Denovix | N/A | |
| EC-Lab Software | BioLogic | N/A | |
| ECO E 4 S heating circulator | Lauda-Brinkmann | Cat. No. 115 V; 60 Hz : L001191 | |
| FeSO4 * 7H2O | Millipore Sigma | 215422 | |
| Folic acid | Millipore Sigma | F8758 | |
| H3BO3 | Millipore Sigma | B6768 | |
| Insulin syringes with BD Micro-Fine IV Needle | Thermo Fisher Scientific | 14-829-1A | |
| Lactiplantibacillus plantarum NCIMB8826 | N/A | N/A | Reference: Tejedor-Sanz et al., 2022 |
| Lactobacillus MRS Broth | HiMedia | M369 | |
| M9 Broth | Milliport Sigma | 63011 | |
| Magnesium sulfate anhydrous | Millipore Sigma | 208094 | |
| Manganese sulfate monohydrate | Millipore Sigma | 221287 | |
| mannitol | Millipore Sigma | M1902-1KG | |
| Mettler Toledo FiveEasy Benchtop pH Meter | Hogentogler | F20-KIT | |
| MgCl2 * 6H2O | Millipore Sigma | M9272 | |
| MgSO4 * 7H2O | Millipore Sigma | M2773 | |
| Millex - GV 0.22 µm PVDF Membrane Filter Unit | Millipore Sigma | SLGV004SL | |
| MnCl2 * 4H2O | Millipore Sigma | 203734 | |
| MnSO4 * H2O | Millipore Sigma | 221287 | |
| MOPS | Millipore Sigma | M1442 | |
| N2 gas | Airgas | NI UHP300 | Filter before use |
| Na2MoO4 * 2H2O | Millipore Sigma | 331058 | |
| Na2SO4 | Millipore Sigma | 238597 | |
| NaCl | Millipore Sigma | S9888 | |
| NH4Cl | Millipore Sigma | A9434 | |
| Nicotinic acid | Millipore Sigma | N-0761 | |
| Nitrilotriacetic acid (NTA) | Millipore Sigma | 72560 | |
| p-Aminobenzoic acid | Millipore Sigma | P9879 | |
| Phosphate buffered saline, 10x solution | Thermo Fisher Scientific | BP399-1 | |
| Potassium phosphate dibasic | Millipore Sigma | P8281 | |
| potentiostat | BioLogic | VMP-300 | |
| Protease peptone #3 | Bacto | 211693 | |
| Pyridoxine HCl | Millipore Sigma | P6280 | |
| Riboflavin | Millipore Sigma | 555682 | |
| RO10 magnetic stir bar platform | IKA | 3691000 | |
| Sodium acetate trihydrate | Millipore Sigma | 935700 | |
| Stir bar, egg-shaped | Thermo Fisher Scientific | 14-512-121 | Place in anodic chamber of BES |
| Thiamine HCl | Millipore Sigma | V-014 | |
| Thioctic acid (α-Lipoic acid) | Millipore Sigma | T-1395 | |
| Tryptophan | Millipore Sigma | 9136 | |
| Tween80 | Millipore Sigma | P4780 | |
| Vitamin B12 | Millipore Sigma | V6629 | |
| Jacketed MCF set, 100 ml, NW25, 2 x GL14 port | Adams & Chittenden Scientific Glass | NA | Customized |
| Yeast extract | Millipore Sigma | Y1625 | |
| ZnSO4 * 7H2O | Millipore Sigma | Z0251 |
Riferimenti
- TerAvest, M. A., Ajo-Franklin, C. M. Transforming exoelectrogens for biotechnology using synthetic biology. Biotechnol Bioeng. 113 (4), 687-697 (2016).
- Chen, H., Dong, F., Minteer, S. D. The progress and outlook of bioelectrocatalysis for the production of chemicals, fuels and materials. Nat Catal. 3 (3), 225-244 (2020).
- Chen, H., et al. Fundamentals, applications, and future directions of bioelectrocatalysis. Chem Rev. 120 (23), 12903-12993 (2020).
- Lovley, D. R., Phillips, E. J. P. Novel mode of microbial energy metabolism: organic carbon oxidation coupled to dissimilatory reduction of iron or manganese. Appl Environ Microbiol. 54 (6), 1472-1480 (1988).
- Myers, C. R., Nealson, K. H. Bacterial manganese reduction and growth with manganese oxide as the sole electron acceptor. Science. 240 (4857), 1319-1321 (1988).
- Koch, C., Harnisch, F. Is there a specific ecological niche for electroactive Microorganisms. ChemElectroChem. 3 (9), 1282-1295 (2016).
- Zhao, J., et al. Microbial extracellular electron transfer and strategies for engineering electroactive microorganisms. Biotechnol Adv. 53, 107682 (2021).
- Zhang, J., Li, F., Liu, D., Liu, Q., Song, H. Engineering extracellular electron transfer pathways of electroactive microorganisms by synthetic biology for energy and chemicals production. Chem Soc Rev. 53 (3), 1375-1446 (2024).
- Logan, B. E. Exoelectrogenic bacteria that power microbial fuel cells. Nat Rev Microbiol. 7 (5), 375-381 (2009).
- Logan, B. E., Rabaey, K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies. Science. 337 (6095), 686-690 (2012).
- Gu, L., Xiao, X., Yup Lee, S., Lai, B., Solem, C. Superior anodic electro-fermentation by enhancing capacity for extracellular electron transfer. Bioresour Technol. 389, 129813 (2023).
- Boucher, D. G., et al. Bioelectrocatalytic synthesis: concepts and applications. Angew Chem Int Ed. 62 (46), e202307780 (2023).
- Tejedor-Sanz, S., et al. Extracellular electron transfer increases fermentation in lactic acid bacteria via a hybrid metabolism. eLife. 11, e70684 (2022).
- Martino, M. E., et al. Nomadic lifestyle of Lactobacillus plantarum revealed by comparative genomics of 54 strains isolated from different habitats. Environ Microbiol. 18 (12), 4974-4989 (2016).
- Fidanza, M., Panigrahi, P., Kollmann, T. R. Lactiplantibacillus plantarum-nomad and ideal probiotic. Front Microbiol. 12, 712236 (2021).
- Duar, R. M., et al. Lifestyles in transition: evolution and natural history of the genus Lactobacillus. FEMS Microbiol Rev. 41 (Suppl_1), S27-S48 (2017).
- Kaushik, J. K., et al. Functional and probiotic attributes of an indigenous isolate of Lactobacillus plantarum. PLOS ONE. 4 (12), e8099 (2009).
- Seddik, H. A., et al. Lactobacillus plantarum and its probiotic and food potentialities. Probiotics Antimicrob Proteins. 9 (2), 111-122 (2017).
- Siezen, R. J., et al. Phenotypic and genomic diversity of Lactobacillus plantarum strains isolated from various environmental niches. Environ Microbiol. 12 (3), 758-773 (2010).
- Light, S. H., et al. A flavin-based extracellular electron transfer mechanism in diverse Gram-positive bacteria. Nature. 562 (7725), 140-144 (2018).
- Tolar, J. G., Li, S., Ajo-Franklin, C. M. The differing roles of flavins and quinones in extracellular electron transfer in Lactiplantibacillus plantarum. Appl Environ Microbiol. 89 (1), e0131322 (2023).
- Li, S., De Groote Tavares, C., Tolar, J. G., Ajo-Franklin, C. M. Selective bioelectronic sensing of pharmacologically relevant quinones using extracellular electron transfer in Lactiplantibacillus plantarum. Biosens Bioelectron. 243, 115762 (2024).
- Blackburn, B., Alba, R., Hatch, A., Ajo-Franklin, C. M., Mevers, E. Understanding the Chemical Properties that Drive Extracellular Electron Shuttles. ChemRxiv. , (2024).
- De Man, J. C., Rogosa, M., Sharpe, M. E. A medium for the cultivation of Lactobacilli. J Appl Bacteriol. 23 (1), 130-135 (1960).
- Aumiller, K., et al. A chemically-defined growth medium to support Lactobacillus-Acetobacter sp. community analysis. PLOS ONE. 18 (10), e0292585 (2023).
- Brooijmans, R. J. W., de Vos, W. M., Hugenholtz, J. Lactobacillus plantarum WCFS1 electron transport chains. Appl Environ Microbiol. 75 (11), 3580-3585 (2009).
- LaBelle, E., Bond, D. R. Cyclic voltammetry for the study of microbial electron transfer at electrodes. Bio-electrochemical systems: from extracellular electron transfer to biotechnological application. , (2009).
- Mevers, E., et al. An elusive electron shuttle from a facultative anaerobe. eLife. 8, e48054 (2019).
- Dirar, H., Collins, E. B. End-products, Fermentation balances and molar growth yields of homofermentative Lactobacilli. Microbiology. 73 (2), 233-238 (1972).
- Huong Le, T. X., Bechelany, M., Cretin, M. Carbon felt based-electrodes for energy and environmental applications: A review. Carbon. 122, 564-591 (2017).
- Zhou, A. Y., Baruch, M., Ajo-Franklin, C. M., Maharbiz, M. M. A portable bioelectronic sensing system (BESSY) for environmental deployment incorporating differential microbial sensing in miniaturized reactors. PLOS ONE. 12 (9), e0184994 (2017).
- Benjamin, S. R., de Lima, F., Nascimento, V. A. d. o., de Andrade, G. M., Oriá, R. B. Advancement in paper-based electrochemical biosensing and emerging diagnostic methods. Biosensors. 13 (7), 689 (2023).
- Kumashi, S. R., et al. A CMOS multi-modal electrochemical and impedance cellular sensing array for massively paralleled exoelectrogen screening. IEEE Trans Biomed Circuits Syst. 15 (2), 221-234 (2021).
- Jadhav, D. A., et al. Scale-up of the bioelectrochemical system: Strategic perspectives and normalization of performance indices. Bioresour Technol. 363, 127935 (2022).
- Kim, J., Cestellos-Blanco, S., Shen, Y., Cai, R., Yang, P. Enhancing biohybrid CO2 to multicarbon reduction via adapted whole-cell catalysts. Nano Lett. 22 (13), 5503-5509 (2022).
- He, Z., Mansfeld, F. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies. Energy Environ Sci. 2 (2), 215-219 (2009).
- Okamoto, A., Hashimoto, K., Nealson, K. H., Nakamura, R. Rate enhancement of bacterial extracellular electron transport involves bound flavin semiquinones. Proc Natl Acad Sci U S A. 110 (19), 7856-7861 (2013).
- Zhang, X., Li, X., Zhao, X., Li, Y. Factors affecting the efficiency of a bioelectrochemical system: a review. RSC Adv. 9 (34), 19748-19761 (2019).
- Kornienko, N., Zhang, J. Z., Sakimoto, K. K., Yang, P., Reisner, E. Interfacing nature's catalytic machinery with synthetic materials for semi-artificial photosynthesis. Nat Nanotechnol. 13 (10), 890-899 (2018).
- Glasser, N. R., Saunders, S. H., Newman, D. K. The colorful world of extracellular electron shuttles. Annu Rev Microbiol. 71 (1), 731-751 (2017).
- Gemünde, A., Lai, B., Pause, L., Krömer, J., Holtmann, D. Redox mediators in microbial electrochemical systems. ChemElectroChem. 9 (13), e202200216 (2022).
- Kundu, B. B., et al. Extracellular respiration is a latent energy metabolism in Escherichia coli. bioRxiv. , (2024).
- O'Brien, J. P., Malvankar, N. S. A simple and low-cost procedure for growing Geobacter sulfurreducens cell cultures and biofilms in bioelectrochemical systems. Curr Protoc Microbiol. 43 (1), A.4K.1-A.4K.27 (2016).
- Su, L., Fukushima, T., Ajo-Franklin, C. M. A hybrid cyt c maturation system enhances the bioelectrical performance of engineered Escherichia coli by improving the rate-limiting step. Biosens Bioelectron. 165, 112312 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon