È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Impostazione di uno smistamento di successo per l'isolamento delle vescicole extracellulari
In questo articolo
Riepilogo
Questo protocollo fornisce una descrizione dettagliata dello smistamento delle vescicole extracellulari (EV) rilasciate dalle cellule stromali mesenchimali. In particolare, si concentra sul settaggio dello strumento e sull'ottimizzazione delle condizioni di smistamento. L'obiettivo è quello di ordinare le vescicole extracellulari preservandone le caratteristiche.
Abstract
Le vescicole extracellulari (EV) rilasciate dalle cellule stromali mesenchimali (MSC) contengono una serie di microRNA con ruoli rigenerativi e antinfiammatori. Pertanto, le MSC-EV purificate sono concepite come un'opzione terapeutica di nuova generazione per un'ampia gamma di malattie. In questo protocollo, riportiamo la strategia per selezionare con successo le vescicole extracellulari dal surnatante delle MSC di derivazione adiposa (ASC), spesso utilizzate nelle applicazioni di medicina rigenerativa ortopedica.
In primo luogo, abbiamo descritto la preparazione del campione, concentrandoci sull'isolamento delle vescicole extracellulari e sulle fasi di marcatura con carbossifluoresceina succinimidil estere (CFSE) per la rilevazione della fluorescenza; Successivamente, abbiamo dettagliato il processo di smistamento, che costituisce la parte principale del protocollo.
Oltre alle regole definite dalle linee guida MISEV 2023 e MIFlowCyt EV, abbiamo applicato specifiche condizioni sperimentali riguardanti le dimensioni, la frequenza e la pressione della guaina dell'ugello. I parametri morfologici sono stabiliti utilizzando perle di diametri selezionati per coprire l'intervallo teorico delle dimensioni delle EV. Dopo la selezione degli ASC-EV, abbiamo eseguito un controllo della purezza della frazione selezionata rianalizzandola con il selezionatore e verificando la distribuzione dimensionale delle EV con la tecnica di analisi del tracciamento delle nanoparticelle.
A causa della crescente importanza delle vescicole extracellulari, avere una popolazione pura da studiare e caratterizzare sta diventando fondamentale. Qui, dimostriamo una strategia vincente per impostare l'ordinamento per raggiungere questo obiettivo.
Introduzione
Le vescicole extracellulari (EV) sono un gruppo eterogeneo di vescicole strutturate a membrana rilasciate da quasi tutte le cellule, delimitate da un doppio strato lipidico, incapaci di replicarsi da sole1. Possono essere trovati in diversi biofluidi come plasma sanguigno, siero, saliva, latte materno, urina, liquido di lavaggio bronchiale, liquido amniotico, liquido cerebrospinale e ascite maligna2. Una delle funzioni principali delle vescicole extracellulari è quella di trasportare varie molecole, tra cui acidi nucleici, proteine, lipidi e carboidrati, tra una cellula donatrice e una ricevente. Ciò può avvenire attraverso vari meccanismi, come la fusione diretta della membrana, l'interazione recettore-ligando, l'endocitosi e la fagocitosi 3,4. Per questo motivo, è stato dimostrato che svolgono un ruolo importante in molti processi fisiologici e patologici, e si mostrano molto promettenti come nuovi biomarcatori di malattia, come veicoli di somministrazione di farmaci e come agenti terapeutici 5,6.
Le cellule stromali mesenchimali (MSC) sono cellule multipotenti che possono essere isolate da molti tessuti, tra cui il tessuto adiposo, la polpa dentale, il sangue del cordone ombelicale, la placenta, il liquido amniotico, la gelatina di Wharton e persino il cervello, il polmone, il timo, il pancreas, la milza, il fegato e i reni. Negli ultimi anni, hanno suscitato un notevole interesse per la medicina rigenerativa7. Le cellule staminali mesenchimali (ASC) di derivazione adiposa possono essere raccolte dal tessuto adiposo attraverso una procedura meno invasiva rispetto ad altre fonti come il midollo osseo, con conseguente riduzione dei rischi di gravi complicanze ed evitando problemi etici8.
Inoltre, il tessuto adiposo contiene una concentrazione significativamente più elevata di MSC rispetto al midollo osseo (1% rispetto a >0,01%) e ad altre fonti come il derma, la polpa dentale, il cordone ombelicale e la placenta. Le MSC sono cruciali nella rigenerazione dei tessuti e delle cellule danneggiate grazie alla loro capacità di differenziazione e alla loro secrezione di un ampio repertorio di fattori di crescita, chemochine e citochine; Questi benefici terapeutici sono attribuibili alla loro capacità di differenziazione ma anche al fatto che secernono un ampio repertorio di fattori di crescita, chemochine e citochine. Un esempio lampante è dato dal potenziale terapeutico delle MSC per le condizioni ortopediche, con il termine "Malattie muscoloscheletriche" che ha il maggior numero di studi clinici registrati nell'ambito della clinicaltrials.gov (consultato il13 maggio 2024).
Inoltre, le MSC possono anche secernere vescicole extracellulari che partecipano alla rigenerazione dei tessuti trasferendo informazioni alle cellule o ai tessuti danneggiati ed esercitano un'attività biologica simile alle cellule madri 9,10. Per questo motivo, le MSC-EV possono essere un valido sostituto della terapia cellulare per ottenere un approccio cell-free11, con due studi clinici che hanno coinvolto MSC-EV per condizioni ortopediche (NCT05261360 e NCT04998058). Tuttavia, esistono ancora diverse sfide per le applicazioni cliniche delle vescicole extracellulari. Ad esempio, ci sono alcune preoccupazioni riguardo alle tecniche di isolamento delle vescicole: la maggior parte di esse non garantisce la purezza o l'integrità delle vescicole. Inoltre, alcune tecniche di isolamento sono complesse, richiedono molto tempo e hanno una bassa ripetibilità, il che le rende inadatte all'uso clinico12.
La selezione cellulare, d'altra parte, è un metodo comunemente usato che consente l'isolamento di singole cellule da sospensioni cellulari eterogenee utilizzando specifici marcatori fluorescenti13. Può essere utilizzato per molte applicazioni e adattato a diversi tipi di campioni. Tuttavia, sebbene la selezione cellulare sia una tecnologia consolidata e ampiamente utilizzata, la selezione delle vescicole extracellulari è ancora molto impegnativa perché la maggior parte delle vescicole extracellulari è al di sotto della soglia minima di rilevamento anche per i citometri a flusso più sensibili. Ci sono alcune caratteristiche che rendono uno smistatore più adatto a questo scopo. Innanzitutto, utilizzando un sistema Jet-in-air in cui il flusso che sospende le particelle viene interrogato da laser in aria, piuttosto che all'interno di una cella di flusso; Questo sistema preserva il campione diminuendo lo stress a cui è sottoposto. Un secondo punto importante è la presenza di una barra di "oscuramento" tra il flusso e la lente di raccolta che diminuisce il rumore ottico di fondo dello strumento. Pur essendo basso, il rumore di fondo non viene completamente eliminato e costituisce un riferimento che fornisce una finestra parziale sugli eventi che rientrano sotto la soglia: è molto importante per l'analisi di eventi che si avvicinano al "limite di rilevabilità" dello strumento14. Infine, il selezionatore è dotato di un Forward Scatter (FSC) a doppio percorso con due diverse maschere che consentono una migliore discriminazione tra particelle piccole e grandi nel campione.
Sulla base di ciò, abbiamo sviluppato un protocollo volto a separare le MSC-EV marcate con carbossifluoresceina succinimidil estere (CFSE) utilizzando un selezionatore cellulare ad alta sensibilità. Per ridurre al minimo la manipolazione delle vescicole extracellulari e preservarne l'integrità e la quantità, abbiamo evitato le fasi di ultracentrifugazione durante la preparazione del campione. Inoltre, le condizioni di selezione sono state regolate per ridurre al minimo lo stress sulle vescicole, inclusa un'ulteriore ottimizzazione del nostro strumento riducendo la pressione di selezione associata alle dimensioni dell'ugello (ugello da 70 μm per una pressione di 35 psi).
Access restricted. Please log in or start a trial to view this content.
Protocollo
Il protocollo è composto da quattro parti: (1) preparazione del campione, (2) caratterizzazione degli ASC-EV, (3) smistamento degli ASC-EV e (4) analisi post-smistamento. Uno schema che rappresenta il flusso di lavoro è mostrato nella Figura 1.
Figura 1: Diagramma di flusso del protocollo. Il diagramma di flusso mostra i passaggi coinvolti nel protocollo. (1) preparazione del campione, (2) caratterizzazione delle vescicole prima della selezione, (3) selezione e (4) analisi delle vescicole dopo la selezione. Clicca qui per visualizzare una versione più grande di questa figura.
1. Preparazione del campione
- Collezione di surnatanti arricchiti con vescicole extracellulari (EV)
- Scongelare o raccogliere le MSC adipose (ASC) che sono state coltivate nel passaggio prima della raccolta delle EV (di solito passaggio da 1 a 5) e seminare per ogni ASC isolare una quantità identica di cellule (ad esempio, 1 milione di cellule per 175 cm2 di superficie del pallone si traduce in circa il 60%-70% di confluenza).
- Coltivare le ASC nel terreno di coltura appropriato (DMEM-F12 per questo protocollo) integrato con siero fetale bovino (FBS) privo di EV o lisato piastrinico umano (hPL), secondo il protocollo richiesto, per 48-72 ore.
- Per ottenere FBS o hPL privi di EV, ultracentrifugare a 120.000 x g per una notte a 4 °C e utilizzare il surnatante.
NOTA: Da questo momento in poi, la forza centrifuga indicata è sempre intesa come media per lo strumento, il rotore e i tubi utilizzati. Tieni presente che rotori o tubi diversi possono avere una forza g variabile per giri/min e fattore k. Per un modo semplice per confrontare i rotori e regolare la forza g e la velocità, fare riferimento a una delle tabelle di conversione disponibili https://www.beckman.it/centrifuges/rotors/calculator.
- Per ottenere FBS o hPL privi di EV, ultracentrifugare a 120.000 x g per una notte a 4 °C e utilizzare il surnatante.
- Al 90% di confluenza cellulare, staccare e contare le ASC e sospenderle in un volume adeguato di terreno privo di siero, idealmente 1 mL per 1 x 106 ASC. Seminare ASC in sospensione in piastre a 24 pozzetti con 1 mL per pozzetto. Senza siero, le cellule rimarranno in sospensione e formeranno uno sferoide. Dopo 96 ore, raccogliere il surnatante.
- Rimuovere le celle galleggianti e i detriti mediante centrifugazione seriale a 4 °C: 400 x g per 10 min, 1.000 x g per 10 min, 2.000 x g per 10 min e due volte 4.000 x g per 10 min.
- Filtrare il surnatante attraverso un filtro da 0,22 μm per rimuovere le particelle rimanenti di dimensioni superiori a 220 nm.
NOTA: Utilizzare immediatamente per le applicazioni a valle, oppure conservare per un massimo di una notte a 4 °C o congelare a -80 °C se non vengono eseguiti ulteriori passaggi entro 24 ore.
- Colorazione EVs per lo smistamento
- Preparare una soluzione 5 mM di 5(6)-carbossifluoresceina diacetato N-succinimidil estere (CFSE). Usalo appena preparato o congelalo a -20 °C al riparo dalla luce.
- Procedere direttamente dal passaggio 1.1.1-1.1.5 (entro 24 ore) o scongelare i surnatanti contenenti EV conservati a -80 °C a 4 °C.
- Prima della colorazione, scaldare i surnatanti a 37 °C e aggiungere CFSE per una concentrazione finale di 10 μM (diluizione 500 volte). Incubare per 1 ora a 37 °C al buio.
- Durante l'incubazione, aggiungere 2 mL di PBS a un concentratore centrifugo (membrana di cellulosa rigenerata, MWCO 100 kDa), chiudere e centrifugare a 4.000 x g per 10 minuti in un rotore a secchiello oscillante. Rimuovere il PBS non filtrato dal fondo del dispositivo di filtraggio e aspirare il filtrato dal tubo di raccolta.
NOTA: Il protocollo di ultrafiltrazione centrifuga delineato si basa sul trattamento fino a 15 mL del campione (volume massimo). - Aggiungere fino a 15 mL di campione al concentratore centrifugo e tappare il dispositivo. Centrifugare a 4.000 x g per un massimo di 30 min.
NOTA: In questo modo si otterrà un campione finale di 500 μl in media. Tuttavia, a seconda di fattori quali la natura del campione e la velocità di flusso, il tempo di centrifugazione necessario per raggiungere la concentrazione desiderata può variare. - Rimuovere il dispositivo dalla centrifuga e svuotare la provetta di raccolta. Aggiungere 14 ml di PBS al dispositivo di filtraggio. Centrifugare a 4.000 x g per un massimo di 30 min.
- Ripetere il passaggio 1.2.6.
- Recuperare il campione concentrato di EVs colorato con CFSE dal dispositivo di filtraggio, circa 500 μL, e conservare 100 μl a 4 °C al buio mentre si procede con la cernita del campione rimanente.
2. Caratterizzazione delle ASC-EVs
- Analisi Western blot dei marcatori EV
- Pellet ASC (1 x 106) a 376 x g a RT per 5 minuti e sospendere in un tampone di lisi appropriato integrato con inibitori della proteasi. Eseguire la quantificazione delle proteine con il test di scelta.
NOTA: Come sperimentato in questo studio, i migliori risultati di quantificazione si ottengono con la tecnica del saggio dell'acido bicinconninico. - Quantificare il surnatante concentrato di ASC equivalente a 1 x 106 ASC con la tecnica di Bradford o EV in pellet corrispondenti a 1 x 106 ASC a 100.000 x g a 4 °C per 1 ora e sospendere in un tampone di lisi appropriato integrato con inibitori della proteasi. Eseguire la quantificazione delle proteine con il test di scelta.
NOTA: Come sperimentato in questo studio, i migliori risultati di quantificazione per i pellet EV si ottengono con la tecnica del saggio dell'acido bicinconinnico. - Se si utilizza un surnatante concentrato al posto delle vescicole extracellulari purificate, lisare i campioni in 2-Mercaptoetanolo al 5% e 2x tampone Laemmli.
NOTA: Come sperimentato in questo studio, sia il surnatante concentrato che le vescicole extracellulari purificate danno risultati comparabili per i marcatori EV positivi e negativi. - Caricare e separare i campioni (1-10 μg) in un gel di poliacrilammide al 10% a 110 V per 90 minuti.
- Trasferire su una membrana di nitrocellulosa a 250 mA per 120 min.
- Membrana colorante con Ponceau S per visualizzare i campioni e il trasferimento a scala. Rimuovere Ponceau S con PBS agitando delicatamente.
- Bloccare le membrane con il 5% di latte scremato in polvere e lo 0,1% di Tween in PBS per 60 min.
- Sonda le membrane con anticorpi appropriati alle diluizioni di lavoro, inclusi i marcatori EV positivi (ad esempio, in questo lavoro CD9, CD81, TSG101 e Flotillin) e negativi (ad esempio, in questo lavoro Calnexin), a 4 °C durante la notte.
- Lavare con Tween allo 0,1% in PBS e incubare con anticorpi secondari coniugati con perossidasi appropriati per 45 minuti a RT prima di rivelare la banda con il sistema ECL di scelta. Acquisire immagini con un sistema di imaging disponibile (Figura 2A).
- Pellet ASC (1 x 106) a 376 x g a RT per 5 minuti e sospendere in un tampone di lisi appropriato integrato con inibitori della proteasi. Eseguire la quantificazione delle proteine con il test di scelta.
- Analisi con citometria a flusso di marcatori EV: colorazione superficiale
- Prima dell'uso, centrifugare ciascun anticorpo monoclonale (mAb) a 15.000-17.000 x g per 30 minuti a 4 °C per eliminare gli aggregati, che possono causare falsi segnali positivi. Inoltre, filtrare gli anticorpi monoclonali in provette filtranti centrifughe separate da 0,22 μm a 1.000 x g a 4 °C fino a quando tutta la miscela è passata attraverso il filtro e non rimane liquido anticorpale sulla superficie del filtro. Conservare gli anticorpi monoclonali a 4 °C.
- Preparare una diluizione 1:10 di EV colorate con CFSE (vedere i passaggi 1.2.1-1.2.8) in PBS filtrato da 0,22 μm.
- Incubare 100 μL di campioni, o PBS filtrato da 0,22 μm, con o senza anticorpi monoclonali specifici per EV (anti-CD9/63/81) o anticorpi monoclonali specifici per MSC (anti-CD44), precedentemente titolati. Eseguire l'incubazione a 4 °C al buio per 30 minuti.
NOTA: Questo protocollo, sviluppato per rilevare le vescicole extracellulari tipiche e i marcatori di lignaggio MSC, può essere esteso a tutti gli altri marcatori di superficie specifici del sottotipo di lignaggio cellulare o delle vescicole extracellulari. Non utilizzare fluorocromi che cadono nel canale dell'isotiocianato di fluoresceina (FITC) per evitare sovrapposizioni con la colorazione CFSE delle vescicole extracellulari. Eseguire una singola colorazione utilizzando ciascun mAb coniugato con un fluorocromo, ad esempio l'alloficocianina (APC). La colorazione multicolore è possibile, ma devono essere inclusi controlli per affrontare potenziali problemi di impedimento sterico degli anticorpi. È necessario testare i singoli anticorpi da soli o all'interno di una miscela e assicurarsi che il segnale sia comparabile. Inoltre, gli FMO devono essere inclusi tra i controlli. - Impostare la calibrazione della dispersione come descritto al punto 3.2.
- Creare un diagramma a punti della scala logaritmica a dispersione laterale (SSC) rispetto alla scala logaritmica FITC ed eseguire una provetta di PBS filtrato da 0,22 μm o EV non colorate; impostare la soglia sul canale FITC e regolarla sui valori più alti che escludono la maggior parte del rumore di fondo. Disegna una regione che identifichi gli eventi positivi della CFSE.
- Crea un grafico dell'istogramma APC con gate sulla regione degli eventi positivi CFSE ed esegui una provetta di PBS filtrato da 0,22 μm o EV non colorate.
NOTA: Per il guadagno APC, utilizzare il guadagno stabilito con il QC dello strumento, anche se si consiglia di eseguire una gaintration specifica per ottimizzare le prestazioni dello strumento. - Aggiungere 200 μl di PBS filtrato da 0,22 μm ai campioni colorati e acquisire. Utilizzare una bassa portata (10 μl al minuto) per l'acquisizione e la registrazione. Se possibile, registrare almeno 5.000 eventi nel cancello positivo FITC.
- Utilizzare il controllo PBS colorato con mAb per rilevare possibili segnali aspecifici degli anticorpi monoclonali. Leggere tutte le provette del campione alla stessa velocità di flusso per garantire la coerenza tra le esecuzioni.
- Per evitare la contaminazione incrociata del campione, far scorrere un detergente per 10 s tra una provetta analizzata e l'altra per 10 s con acqua deionizzata (DI) (Figura 2B).
NOTA: Per evitare qualsiasi instabilità dello strumento fluidico, acquisire il campione per 10 s, quindi avviare la registrazione.
- Analisi con citometria a flusso del marcatore EV: Colorazione intracellulare
NOTA: Per la colorazione intracellulare, utilizzare un kit specifico contenente reagenti di fissazione e permeabilizzazione. L'anticorpo monoclonale anti-caveolina è coniugato con Alexa 488. La colorazione IC è stata eseguita in assenza di CFSE.- Prima dell'uso, centrifugare l'anticorpo monoclonale come descritto in precedenza (passaggio 2.2.1).
- Per la colorazione intracellulare, seguire le istruzioni del produttore (Figura 2C).
- Caratterizzazione della concentrazione e delle dimensioni delle EV mediante analisi di tracciamento delle nanoparticelle (NTA)
- Effettuare le opportune diluizioni dei campioni per ottenere 20-120 eventi nel riquadro di visualizzazione del display dello strumento NTA.
- Iniettare i campioni nella camera del campione dello strumento NTA utilizzando una siringa da insulina da 1 mL.
- Impostare il software NTA per la registrazione come segue: 5 misurazioni standard, 60 s ciascuna, e una pompa di flusso impostata su 30.
- Impostare l'intensità della luce su un valore appropriato che consenta di distinguere chiaramente le particelle dallo sfondo ed eseguire lo script di acquisizione sul software NTA.
NOTA: L'impostazione del livello della fotocamera può influenzare il rilevamento delle particelle. Se il valore è troppo alto, emerge un fondo lattiginoso e una forte diffusione della luce delle particelle, che copre la maggior parte dei segnali delle particelle. Se il valore è troppo basso, anche se si ottiene uno sfondo più scuro, è possibile che la maggior parte degli eventi meno luminosi vadano persi. Ogni campione deve essere monitorato per verificarne l'impostazione ottimale. - Regolare il fattore di diluizione se le particelle per fotogramma sono inferiori a 20 o superiori a 80.
- Impostare la soglia su 4 per analizzare la dimensione modale media e la concentrazione di particelle del surnatante. Prendere in considerazione i fattori di diluizione iniziale.
- Pulire la camera dello strumento con acqua deionizzata dopo ogni campione per evitare contaminazioni incrociate.
- Aprire il software di analisi NTA ed eseguire l'analisi sui campioni acquisiti, tenendo conto del fattore di diluizione (Figura 2D).
- Caratterizzazione della morfologia delle vescicole extracellulari mediante microscopia elettronica a trasmissione (TEM)
- Raccogliere il surnatante concentrato di ASC o isolare le vescicole extracellulari mediante ultracentrifugazione (100.000 x g a 4 °C per 1 ora) seguita da sospensione di pellet nello stesso volume di PBS.
- Lasciare assorbire 5 μl del surnatante concentrato o delle EV su griglie rivestite di carbonio per 10 minuti. Tamponare le gocce di liquido in eccesso con carta da filtro.
- Eseguire la colorazione negativa con acetato di uranile al 2% in sospensione acquosa per 10 minuti utilizzando un volume identico della goccia del campione (5 μL). Rimuovere l'acetato di uranile in eccesso toccando la griglia con carta da filtro.
- Asciugare la griglia a temperatura ambiente (RT) ed esaminarla con un microscopio elettronico a trasmissione a 120 kV (Figura 2E).
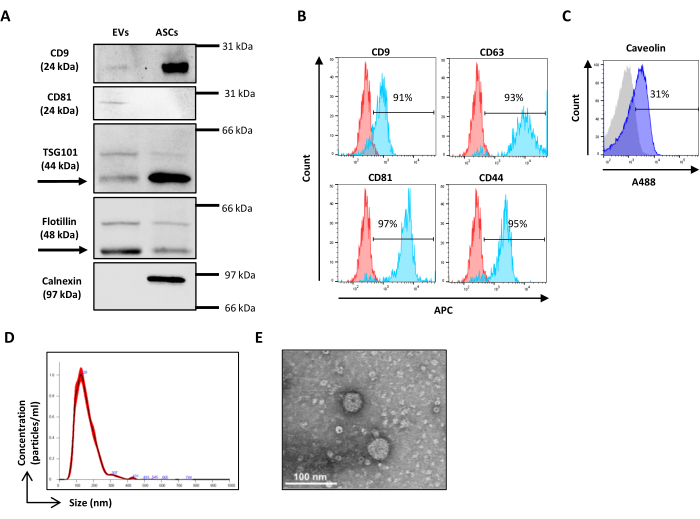
Figura 2: Caratterizzazione delle ASC-EVs. (A) Western blot rappresentativo di marcatori positivi (CD9, CD81, TSG101 e Flotillin) e negativi (Calnexin) per le EV. Vengono riportati i pesi molecolari corrispondenti e i lisati di ASC sono stati utilizzati come controllo. (B) Analisi in citometria a flusso di marcatori di vescicole extracellulari. È stata analizzata l'espressione dei seguenti marcatori: CD9, CD63, CD81 e CD44. Solo le ASC-EV CFSE-positive sono state analizzate per l'espressione del marcatore. Gli istogrammi rappresentano ASC-EV non colorati (istogrammi rossi) e colorati (istogrammi blu). (C) Citometria a flusso, analisi intracellulare del marcatore EVs Caveolina. Gli istogrammi rappresentano ASC-EV non colorati (istogramma grigio) e colorati (istogrammi blu). (d) Caratterizzazione di ASC-EV mediante NTA. Gli istogrammi rappresentano la concentrazione (particelle/mL)/dimensione (nm) del campione. (e) Visualizzazione degli ASC-EV da parte della TEM. Barre di scala = 100 nm. Clicca qui per visualizzare una versione più grande di questa figura.
3. Smistamento ASC-EV
- Configurazione del selezionatore di celle
NOTA: Un selezionatore cellulare è un citometro a flusso che consente l'isolamento di una popolazione pura da un campione di partenza eterogeneo. Il selezionatore di cellule separa le particelle bersaglio facendo oscillare il flusso con un piezoelettrico ad alta frequenza per generare gocce contenenti un evento. Le gocce che contenevano le particelle di interesse, come cellule o vescicole, vengono caricate e deviate attraverso piastre di deflessione metalliche. La frazione ordinata viene utilizzata per eseguire l'analisi a valle.- Aprire la linea di pressione e aspirare.
NOTA: Alcuni smistatori hanno un avvio automatico, mentre altri hanno un avvio manuale. Si preferisce una selezionatrice con avviamento manuale, in quanto consente l'ottimizzazione di alcune caratteristiche tecniche come la frequenza, la pressione e la scelta della punta dell'ugello. In particolare, si consiglia di lavorare con una frequenza di 66.000 Hz, una pressione di 35 psi e un ugello da 70 μm. - Accendere lo strumento, aprire la cabina di biosicurezza e avviare il software di selezione.
- Pressurizzare la fluidica e quindi accendere il sistema fluidico.
- Attiva Drop Drive, il cristallo piezoelettrico nell'ugello che vibra per avere goccioline.
- Eseguire la procedura di debubbling per eliminare la presenza di bolle nel sistema, quindi far scorrere una provetta da 5 ml di soluzione detergente per 5 minuti ad alta pressione differenziale e una provetta da 5 ml di acqua deionizzata per 5 minuti.
- Eseguire la procedura di avvio manuale.
- Nella scheda Controllo laser, premere il pulsante di accensione del laser per accendere il laser.
NOTA: Ripetere questa procedura per tutti i laser: Blu 488 nm, Giallo-Verde 561 nm, Viola 405 nm e Rosso 640 nm. - Esaminare l'allineamento verticale del flusso.
NOTA: In caso di necessità, spostare lo stadio di montaggio dell'ugello, in particolare il micrometro anteriore e posteriore, il micrometro sinistro e destro e il giunto cardanico per regolare l'allineamento verticale e verificare il flusso verticale con il micrometro su e giù; Per ottenere il miglior allineamento, il flusso deve essere verticale su ciascun laser. Se è la prima volta che si utilizza un ugello specifico, è necessario eseguire un ritardo laser . Sul pannello touch screen, nella scheda Laser e intercettazione flusso, selezionare la dimensione corretta dell'ugello, premere il pulsante Ritardo laser e seguire le istruzioni del ritardo laser per eseguire la procedura di ritardo laser. In generale, quando si modifica la pressione della guaina e, di conseguenza, la punta dell'ugello, la determinazione del ritardo laser viene eseguita prima di trovare l'allineamento. Al termine della procedura di ritardo laser , si suggerisce di eseguire la procedura di sottrazione dell'immagine di sfondo seguendo le istruzioni sullo schermo per ridurre al minimo il segnale di fondo. - Eseguire la determinazione del punto laser premendo la scheda Intercetta flusso laser , il pulsante freccia verde e seguendo le istruzioni sul monitor touch screen.
- Nella scheda Controllo laser, premere il pulsante di accensione del laser per accendere il laser.
- Inizializzare Intellisort. Impostare la frequenza di trasmissione della goccia e un valore di ampiezza predefinito, che fa sì che il flusso formi una gocciolina.
- Una volta eseguito questo passaggio, caricare una configurazione salvata. Per caricare una configurazione di impostazione salvata, selezionare Carica impostazione di ordinamento sulla barra degli strumenti del software di smistamento. Dopo aver controllato diverse frequenze e ampiezze, scegli quella migliore che garantisca la migliore stabilità di caduta. Lavora a una frequenza di 66.000 Hz e un'ampiezza di circa 40-45 V.
- Eseguire la procedura di allineamento laser fine .
- Caricare nel campionatore una provetta da 5 mL di perline di allineamento QC ed eseguirla; selezionare nella scheda Allineamento fine il parametro desiderato sugli assi X e Y per visualizzare le perle ben compattate e collimate. Nell'area di visualizzazione dei dati, selezionare prima di tutto 488 - 513/26-H per il parametro dell'asse Y e 488-FSC1-H per il parametro dell'asse X. Quindi, per mettere a punto tutti i laser, selezionare 405-488/59-H per il parametro dell'asse Y e 640-795/70-H per il parametro dell'asse X.
NOTA: I parametri selezionati dipendono dalla configurazione laser dello smistatore. Il suggerimento del manuale dello strumento è la scelta dei laser che hanno la maggiore separazione spaziale sulla striscia stenopeica. A tale scopo, utilizzare un laser viola (405 nm) e un laser rosso (640 nm). - Una volta che l'allineamento manuale è stato controllato dallo specialista dello smistatore, eseguire il controllo qualità automatico. Selezionare il diametro delle perle QC: diametro 3 μm.
NOTA: Al termine di questa procedura, il risultato potrebbe essere QC non superato o QC superato. Nel caso in cui il controllo qualità non vada a buon fine, è necessario ottimizzare manualmente l'allineamento. - Salvare l'acquisizione del controllo qualità sul software Protocollo di allineamento.
- Caricare nel campionatore una provetta da 5 mL di perline di allineamento QC ed eseguirla; selezionare nella scheda Allineamento fine il parametro desiderato sugli assi X e Y per visualizzare le perle ben compattate e collimate. Nell'area di visualizzazione dei dati, selezionare prima di tutto 488 - 513/26-H per il parametro dell'asse Y e 488-FSC1-H per il parametro dell'asse X. Quindi, per mettere a punto tutti i laser, selezionare 405-488/59-H per il parametro dell'asse Y e 640-795/70-H per il parametro dell'asse X.
- Finalizzare la procedura Intellisort
- Posizionare le piastre di rinvio nella posizione corretta nello smistatore e attivare la tensione (si consiglia una carica di 3.000 V sulle piastre di deflessione).
- Scegliere l'uscita di ordinamento 6 Tube Holder, abilitare i flussi selezionandoli sull'indicatore di flusso ed eseguire il flusso di prova.
NOTA: Se i flussi non sono chiaramente separati e definiti, regolare la fase di carica, il defanning o modificare altri parametri in modo da ottenere un flusso chiaramente definito e non oscillante. - Abilitare il pulsante Intellisort Automatic Drop Delay Determination . Questo passaggio consente di impostare il corretto ritardo di rilascio. Dopo questo passaggio, verificare nuovamente i flussi.
- Attivare la modalità di manutenzione di Intellisort. Verificare manualmente il ritardo di rilascio .
- Caricare il protocollo manuale Drop Delay sul software di smistamento. Acquisire perline di controllo fluorescenti.
- Inserire il supporto per diapositive corretto. Nel software di smistamento, selezionare Ordina > Ritardo rilascio guidato. Selezionare Logica di ordinamento.
- Verificare con un microscopio fluorescente la presenza del 97% di perle fluorescenti sulla quinta pozzanghera.
- Aprire la linea di pressione e aspirare.
- Configurazione dello strumento: calibrazione della dispersione
NOTA: La calibrazione della dispersione viene eseguita utilizzando perle Verity Shells (d'ora in poi denominate perle di silice organica cava). Queste perle di silice organica sono caratterizzate da una distribuzione dell'indice di rifrazione e da proprietà di diffusione della luce più vicine alle vescicole extracellulari rispetto alle perle di polistirene, consentendo così l'impostazione della tensione SSC e FSC per discriminare meglio tra eventi simili a EV e il rumore elettronico. Le perle di silice organica sono costituite da due flaconi con miscele di perline, VER01A (perle da 189 nm) e VER01B (perle da 374 nm). Ogni fiala contiene una miscela di perle di silice organica cave e perle fluorescenti verdi da 380 nm, denominate perle di riferimento. La concentrazione delle perle di silice organica cave è di 1 x 108 perle/mL.- Preparare un campione di perle VER01A e VER01B diluendo una goccia (50 μL) di ciascuna in 1 mL di PBS filtrato da 0,22 μm con una concentrazione finale di 5.000 perle/μL.
NOTA: Agitare le perline per 5 s prima dell'uso. - Creare un grafico a punti della scala logaritmica SSC rispetto alla scala logaritmica FITC.
- Acquisire le perline VER01B e regolare la tensione per discriminare bene le perline di riferimento nella parte in alto a destra del grafico a punti SSC/FITC (Figura 3A).
- Imposta una regione attorno a questa popolazione di perline.
- Creare un grafico a punti della scala logaritmica SSC rispetto alla scala logaritmica FSC. Identificare le perle di riferimento e la popolazione di perline VER01B. Impostare una regione attorno alla popolazione di perline VER01B (Figura 3B).
- Acquisire perline VER01A e creare una regione attorno a questa popolazione di perline (Figura 3C).
NOTA: Questa popolazione di perline si sovrappone in parte al rumore di fondo dello strumento. - Acquisisci PBS filtrato da 0,22 μm e regola la soglia per diminuire il rumore di fondo dello strumento senza perdere la visualizzazione delle microsfere più piccole.
NOTA: La calibrazione della dispersione può essere eseguita utilizzando perle FSC Megamix (d'ora in poi denominate perle di polistirene FSC), una miscela di perle fluorescenti con i seguenti diametri: 100 nm, 300 nm, 500 nm e 900 nm. L'uso delle perle di silice organiche cave deve essere preferito alle perle di polistirene FSC perché hanno proprietà di distribuzione dell'indice di rifrazione e di diffusione della luce simili alle vescicole extracellulari. La popolazione di perle di polistirene FSC da 300 nm si sovrappone al riferimento delle perle di silice organiche cave. Pertanto, un gate basato su perle di silice organica cave seleziona vescicole extracellulari di dimensioni simili sul citometro a flusso.
- Preparare un campione di perle VER01A e VER01B diluendo una goccia (50 μL) di ciascuna in 1 mL di PBS filtrato da 0,22 μm con una concentrazione finale di 5.000 perle/μL.
- Acquisizione del campione
- Creare un grafico a punti della scala logaritmica SSC rispetto alla scala logaritmica FITC, acquisire PBS filtrato a 0,22 μm e definire il rumore di fondo di riferimento (Figura 4A).
NOTA: Impostare la portata del citometro su Bassa e controllare la portata. Il numero di eventi non deve essere superiore a 2.000 eventi. Portata Bassa significa a bassa pressione differenziale. - Acquisire il campione di controllo (EV non colorate) e controllare la portata. Assicurati che il numero di eventi sia di circa 5.000 eventi/s.
NOTA: Se il numero di eventi supera quello suggerito, diluire il campione. - Acquisire PBS colorato e trattato come campione di CFSE e verificare che non siano visibili eventi positivi (Figura 4B).
- Acquisire il campione colorato con CFSE. Diluirlo in base alla portata. Disegna una regione che identifichi gli eventi positivi della CFSE e una che identifichi gli eventi negativi della CFSE. Utilizzare un campione non colorato come controllo (Figura 5A, B). Queste sono le regioni di smistamento.
- Creare un grafico a punti della scala logaritmica SSC rispetto alla scala logaritmica FITC, acquisire PBS filtrato a 0,22 μm e definire il rumore di fondo di riferimento (Figura 4A).
- Selezione dei campioni
- Sul software di smistamento, aprire un nuovo protocollo (sulla barra degli strumenti selezionare File > Protocollo > Nuovo).
- Sul software di smistamento, fare clic su Impostazioni di acquisizione dati; nella finestra Parametro di Acquisizione, selezionare i canali di interesse e disabilitare gli altri. Per questo specifico pannello, i segnali abilitati sono: 488-FSC1, 488-FSC2, 488-SSC e 488-513/26 (per il segnale CFSE).
- Posizionare sul campionatore una provetta da 5 ml di campione. Sul touchscreen, fare clic sul pulsante Carica e, sulla barra degli strumenti del software di smistamento, selezionare Acquisizione > Avvia (o premere il pulsante F2 ). Apparirà una finestra delle proprietà di esempio; Inserire il nome del campione e fare clic su OK.
- Crea il pannello, con il grafico di interesse e crea la strategia di gating.
- Sulla barra degli strumenti del software di smistamento, selezionare Istogramma > Crea istogramma.
- Nell'area di lavoro, creare tre grafici a punti, il primo con il parametro Height-Log 488-FSC1 sull'asse x e l'asse y 488-SSC Height-Log, il secondo con il parametro Height-Log 488-FSC2 sull'asse x e l'asse y 488-SSC Height-Log, il terzo con il parametro Height-Log 488-513/26 CFSE sull'asse x e l'asse y 488-SSC Height-Log.
- Nella scheda Ordina identificare le regioni da ordinare. Nel software di smistamento, fare clic su Impostazioni ordinamento. Nella finestra Logica di ordinamento e statistica , selezionare la regione da ordinare nel generatore di logica.
NOTA: Per prendere una decisione di ordinamento, ci sono diverse impostazioni da prendere in considerazione: Logica di ordinamento, Modalità di ordinamento e Drop Envelope. La logica di ordinamento si riferisce alla strategia di gating. Gli eventi che si trovano al di fuori del gate selezionato non vengono ordinati. La modalità di ordinamento è correlata all'output finale. Lavora in modalità Purify, in questo modo tutte le gocce ordinate contengono solo gli eventi positivi desiderati. La Drop Envelope definisce quante gocce verranno caricate e ordinate in relazione alla posizione nel drop dell'evento positivo: scegli 1-2 drop in modo da essere sicuro che tutti gli eventi positivi siano ordinati. - Quando la portata è stabile, interrompere l'acquisizione (sulla barra degli strumenti del software di smistamento, selezionare Acquisizione > Stop o premere nuovamente il pulsante F2 ). Avvia l'ordinamento (sulla barra degli strumenti del software di ordinamento, seleziona Ordina > Avvia o premi il pulsante F4 ).
NOTA: Prima di iniziare con l'ordinamento, controllare il flusso di test. Verificare che la frazione selezionata cada correttamente nella provetta di raccolta. - Salvare l'impostazione di ordinamento. Sulla barra degli strumenti del software di ordinamento, selezionare Ordina > Salva impostazioni di ordinamento.
- Controllo della purezza della popolazione selezionata
- Lavare lo strumento acquistando una provetta da 5 ml di soluzione detergente per 10 minuti ad alta pressione differenziale e una provetta da 5 ml di acqua deionizzata per 10 minuti.
- Acquisire PBS filtrato da 0,22 μm e verificare che non siano presenti eventi positivi alla CFSE.
- Diluire 5 μl del campione selezionato in 100 μl di PBS filtrato a 0,22 μm.
- Acquisire e registrare tutti i volumi di campione (Figura 5C, D).
NOTA: Viene riportata la rianalisi dei veicoli elettrici selezionati positivi e negativi CFSE.
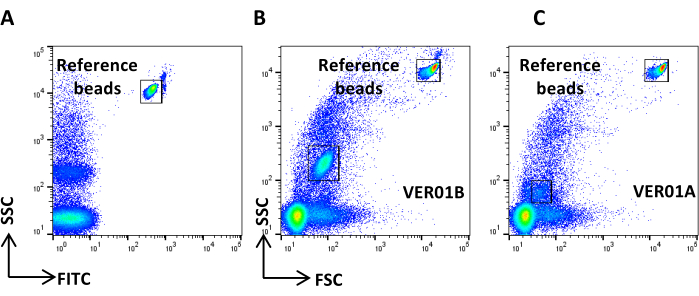
Figura 3: Impostazione dei parametri fisici con perle di silice organiche cave. (A) Grafico a punti SSC/FITC: per impostare il parametro SSC sono state utilizzate perle fluorescenti verdi di riferimento. Grafico a punti SSC/FSC di perline (B) VER01B e (C) VER01A. Clicca qui per visualizzare una versione più grande di questa figura.
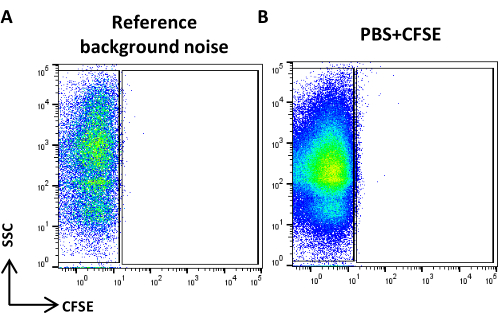
Figura 4: Rumore di fondo di riferimento. (A) Grafico a punti SSC/CFSE del campione PBS. (B) Grafico a punti SSC/CFSE del campione PBS + CFSE. Clicca qui per visualizzare una versione più grande di questa figura.
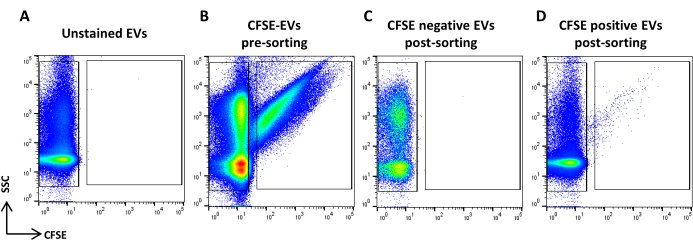
Figura 5: Ordinamento delle EV colorate con CFSE. (A) Grafico a punti SSC/CFSE di EV non colorate, (B) EV colorate con CFSE, (C) EV negative CFSE post-smistamento e (D) EV positive a CFSE post-smistamento. Clicca qui per visualizzare una versione più grande di questa figura.
4. Analisi post smistamento
NOTA: A causa della quantità limitata di materiale dopo lo smistamento, potrebbe non essere possibile eseguire tutte le analisi. Con l'importo ottenuto si eseguono le seguenti operazioni.
- Caratterizzazione delle EV mediante citometria a flusso: colorazione superficiale (vedi passaggio 2.2)
NOTA: Come descritto in precedenza per la pre-selezione dei campioni, ad eccezione della preparazione del campione. I campioni dopo la cernita possono essere utilizzati non diluiti.- Utilizzare campioni selezionati non diluiti e procedere come indicato al punto 2.2.3. (Figura 6A)
- Caratterizzazione della concentrazione e delle dimensioni delle EV mediante NTA (vedi passaggio 2.4)
NOTA: Come descritto in precedenza per la pre-selezione dei campioni, ad eccezione della preparazione del campione. I campioni dopo la cernita possono essere utilizzati non diluiti.- Utilizzare campioni selezionati non diluiti e procedere come indicato al punto 2.4.2. (Figura 6B)
- Caratterizzazione della morfologia delle EV mediante TEM (vedi passaggio 2.5)
NOTA: Come descritto in precedenza per la pre-selezione dei campioni, ad eccezione della preparazione del campione.- Aggiungere 2 mL di PBS a un concentratore centrifugo (membrana di cellulosa rigenerata, MWCO 100 kDa), tappare e centrifugare a 4.000 x g per 10 minuti in un rotore a secchiello oscillante. Rimuovere il PBS non filtrato dalla parte inferiore del dispositivo di filtraggio.
- Aspirare il filtrato dal tubo di raccolta. Il protocollo di ultrafiltrazione centrifuga delineato si basa sul trattamento di campioni fino a 15 mL (volume massimo).
- Aggiungere fino a 15 ml di campione al filtro AU-15 e tappare il dispositivo. Centrifugare a 4.000 x g per un massimo di 30 min. Concentrare fino al volume minimo consentito dal dispositivo, circa 100-150 μl.
- Recuperare il campione EV concentrato selezionato dal dispositivo di filtraggio e procedere come descritto in precedenza per la pre-selezione dei campioni TEM (passaggio 2.5.2) (Figura 6C).
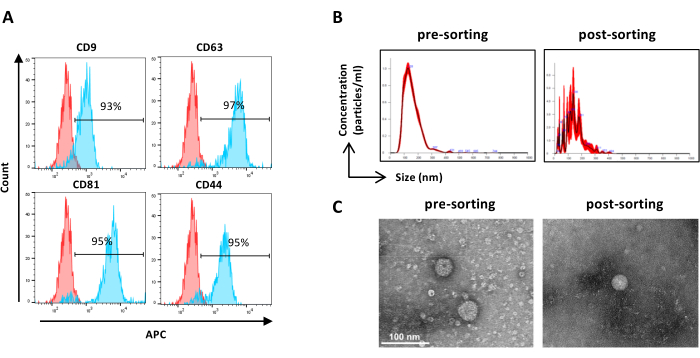
Figura 6: Caratterizzazione di ASC-EV ordinati. Analisi in citometria a flusso di marcatori EV. È stata analizzata l'espressione dei seguenti marcatori: CD9, CD63, CD81 e CD44. Solo le ASC-EV CFSE-positive sono state analizzate per l'espressione del marcatore. (A) Gli istogrammi rappresentano ASC-EV non colorati (istogrammi rossi) e colorati (istogrammi blu). (b) Caratterizzazione di ASC-EV mediante NTA. Gli istogrammi rappresentano la concentrazione (particelle/mL)/dimensione (nm) dei campioni pre-selezione (a sinistra) e post-selezione (a destra). (C) Visualizzazione degli ASC-EV mediante TEM del campione pre-sorting (a sinistra) e post-sorting (a destra). Barre di scala = 100 nm. Clicca qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Le perle di polistirene FSC sono state selezionate per convalidare la configurazione dello strumento e le condizioni di smistamento. Le perle di polistirene FSC sono un mix di perle fluorescenti che vanno da 100 nm, 300 nm, 500 nm e 900 nm e sono visibili sul canale FITC. La Figura 7A mostra la scala logaritmica SSC rispetto al dot plot della scala logaritmica FITC con le quattro popolazioni di perline prima dell'ordinamento. Le popolazioni fluorescenti di 1...
Access restricted. Please log in or start a trial to view this content.
Discussione
L'analisi e lo smistamento delle vescicole extracellulari è difficile a causa delle loro piccole dimensioni e del fatto che sono vicine al limite di rilevamento della maggior parte dei citometri a flusso. Il nostro obiettivo era quello di sviluppare un protocollo per isolare le vescicole extracellulari derivate da AMSC marcate con CFSE. Il CFSE è stato scelto come metodo di colorazione per l'elevata efficienza di marcatura delle vescicole extracellulari (≥90%), senza la formazione di...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Emanuele Canonico per il supporto tecnico. Parte di questo lavoro è stato svolto in ALEMBIC, un laboratorio di microscopia avanzata istituito dall'IRCCS Ospedale San Raffaele e dall'Università Vita-Salute San Raffaele. Il lavoro di Enrico Ragni e Laura de Girolamo è stato sostenuto dal Ministero della Salute italiano, "Ricerca Corrente".
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 5(6)-Carboxyfluorescein diacetate N-succinimidyl ester | Merck | 150347-59-4 | |
| Adipose Mesenchymal Stromal Cells | Wepredic, Parc d'affaires, 35760 Saint-Grégoire, France | Cells used in this study | |
| Alexa 488 anti-Caveolin | R&D Systems | IC5736G | Flow cytometry antibody |
| APC anti-human CD44 | BioLegend | 338805 | Flow cytometry antibody |
| APC anti-human CD63 | BioLegend | 353007 | Flow cytometry antibody |
| APC anti-human CD81 (TAPA-1) | BioLegend | 349509 | Flow cytometry antibody |
| APC anti-human CD9 | BioLegend | 312107 | Flow cytometry antibody |
| BC CytoFLEX S | Beckman Coulter | BC CytoFLEX S equipped with 3 lasers, Blue, Red and Violet | |
| Flow-Check Pro Fluorospheres | Beckman Coulter | A63493 | Fluorescent control beads for MoFLO Astrios EQ |
| FlowJo software (version 10.8.1) | BD | version 10.8.1 | Analysis software |
| IntraSure kit | BD Biosciences | 641776 | Fixation and permeabilization for intracellular staining |
| Megamix-Plus FSC | BioCytex | 7802 | FSC polystyrene beads |
| MoFLO Astrios EQ | Beckman Coulter | MoFLO Astrios EQ equipped with 4 lasers, Blue, Yellow - Green, Violet and Red | |
| Mouse anti-FLOT1 antibody | BD Transduction Laboratories | 610820 | Western Blot antibody |
| NanoSight NS300 | Malvern | NS300 | |
| Rabbit anti-Calnexin antibody | Origene | TA336279 | Western Blot antibody |
| Rabbit anti-CD9 and CD81 antibody (ExoAb antibody kit) | System Biosciences | EXOAB-KIT-1 | Western Blot antibodies |
| Rabbit anti-TSG101 antibody | Merck | HPA006161 | Western Blot antibody |
| Triton X-100 | Merck | 9036-19-5 | |
| Ultra Rainbow Fluorescent Particles | Spherotech | URFP-30-2 | |
| Ultracel 100 kDa MWCO | Merck | UFC910024 | |
| VER01 - Verity Shells | Exometry | Organo silica beads for scatter calibration |
Riferimenti
- Welsh, J. A., et al. Minimal information for studies of extracellular vesicles (misev2023): From basic to advanced approaches. J Extracell Vesicles. 13 (2), e12404(2024).
- Xu, R., Greening, D. W., Zhu, H. J., Takahashi, N., Simpson, R. J. Extracellular vesicle isolation and characterization: Toward clinical application. J Clin Invest. 126 (4), 1152-1162 (2016).
- Dixson, A. C., Dawson, T. R., Di Vizio, D., Weaver, A. M. Context-specific regulation of extracellular vesicle biogenesis and cargo selection. Nat Rev Mol Cell Biol. 24 (7), 454-476 (2023).
- Witwer, K. W., Wolfram, J. Extracellular vesicles versus synthetic nanoparticles for drug delivery. Nat Rev Mater. 6 (2), 103-106 (2021).
- Cheng, L., Hill, A. F. Therapeutically harnessing extracellular vesicles. Nat Rev Drug Discov. 21 (5), 379-399 (2022).
- Du, S., et al. Extracellular vesicles: A rising star for therapeutics and drug delivery. J Nanobiotechnology. 21 (1), 231(2023).
- Keshtkar, S., Azarpira, N., Ghahremani, M. H. Mesenchymal stem cell-derived extracellular vesicles: Novel frontiers in regenerative medicine. Stem Cell Res Ther. 9 (1), 63(2018).
- Orbay, H., Tobita, M., Mizuno, H. Mesenchymal stem cells isolated from adipose and other tissues: Basic biological properties and clinical applications. Stem Cells Int. 2012, 461718(2012).
- Caplan, A. I., Dennis, J. E. Mesenchymal stem cells as trophic mediators. J Cell Biochem. 98 (5), 1076-1084 (2006).
- Rani, S., Ryan, A. E., Griffin, M. D., Ritter, T. Mesenchymal stem cell-derived extracellular vesicles: Toward cell-free therapeutic applications. Mol Ther. 23 (5), 812-823 (2015).
- Galipeau, J., Sensébé, L. Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell. 22 (6), 824-833 (2018).
- Jia, Y., et al. Small extracellular vesicles isolation and separation: Current techniques, pending questions and clinical applications. Theranostics. 12 (15), 6548-6575 (2022).
- Ohnuma, K., Yomo, T., Asashima, M., Kaneko, K. Sorting of cells of the same size, shape, and cell cycle stage for a single cell level assay without staining. BMC Cell Biol. 7, 25(2006).
- Morales-Kastresana, A., et al. High-fidelity detection and sorting of nanoscale vesicles in viral disease and cancer. J Extracell Vesicles. 8 (1), 1597603(2019).
- Mortati, L., et al. In vitro study of extracellular vesicles migration in cartilage-derived osteoarthritis samples using real-time quantitative multimodal nonlinear optics imaging. Pharmaceutics. 12 (8), 734(2020).
- Andreu, Z., Yanez-Mo, M. Tetraspanins in extracellular vesicle formation and function. Front Immunol. 5, 442(2014).
- Mildmay-White, A., Khan, W. Cell surface markers on adipose-derived stem cells: A systematic review. Curr Stem Cell Res Ther. 12 (6), 484-492 (2017).
- Welsh, J. A., Tang, V. A., Van Der Pol, E., Gorgens, A. MIFlowCyt-EV: The next chapter in the reporting and reliability of single extracellular vesicle flow cytometry experiments. Cytometry A. 99 (4), 365-368 (2021).
- Maia, J., et al. Employing flow cytometry to extracellular vesicles sample microvolume analysis and quality control. Front Cell Dev Biol. 8, 593750(2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon