È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Una tecnica per la raccolta seriale del liquido cerebrospinale dalla Magna Cisterna in Mouse
In questo articolo
Riepilogo
Transgenici (Tg) modelli murini di AD forniscono un'eccellente opportunità per indagare come e perché i livelli di Aβ o tau nel liquido cerebrospinale cambiare il progredire della malattia nei pazienti umani. Qui, dimostrano una raffinata tecnica di puntura cisterna magna per il campionamento CSF seriale dal mouse.
Abstract
La malattia di Alzheimer (AD) è una malattia neurodegenerativa progressiva che è patologicamente caratterizzata dalla deposizione extracellulare del peptide β-amiloide (Aβ) e l'accumulo di intraneuronale iperfosforilata proteina tau. A causa del liquido cerebrospinale (CSF) è in contatto diretto con lo spazio extracellulare del cervello, fornisce un riflesso dei cambiamenti biochimici nel cervello in risposta a processi patologici. CSF di pazienti dC mostra una diminuzione del 42 aminoacidi forma di Aβ (Aβ42), e aumenta in totale iperfosforilata tau e tau, anche se i meccanismi responsabili di questi cambiamenti non sono ancora pienamente compreso. Transgenici (Tg) modelli murini di AD forniscono un'eccellente opportunità per indagare come e perché i livelli di Aβ o tau nel liquido cerebrospinale cambiare con la progressione della malattia. Qui, dimostrano una raffinata tecnica di puntura cisterna magna per il campionamento CSF dal mouse. Questa tecnica di campionamento estremamente delicata permette seriale campioni di liquido cerebrospinale di ottenere dal mouse stesso a intervalli di 2-3 mesi, che riduce sensibilmente l'effetto confondente della tra-mouse variabilità nei livelli di Aβ o tau, che consente di rilevare alterazioni sottili nel tempo. In combinazione con Aβ e tau ELISA, questa tecnica sarà utile per studi volti a indagare il rapporto tra i livelli di CSF Aβ42 e tau, e il loro metabolismo nel cervello in modelli murini dC. Studi nei topi Tg potrebbe fornire la convalida importante per il potenziale di Aβ CSF o livelli di tau per essere utilizzati come marcatori biologici per monitorare la progressione della malattia, e per monitorare l'effetto degli interventi terapeutici. Come i topi possono essere sacrificati e il cervello possono essere esaminati per cambiamenti biochimici o istologici, i meccanismi alla base dei cambiamenti CSF può essere meglio valutata. Questi dati sono suscettibili di essere informativo per l'interpretazione dei cambiamenti umani CSF dC.
Protocollo
Tirare il tubo capillare di vetro
- Il tubo capillare di vetro viene acquistato dallo strumento Sutter Inc (vetro borosilicato, B100-75-10).
- Tirare i tubi capillari su un Sutter P-87 Flaming micropipetta estrattore, con l'indice di calore fissato a 300 e l'indice di pressione fissato a 330.
- Tagliare la punta del tubo capillare di vetro con le forbici, in modo che la punta conica ha un diametro interno di circa 0,5 mm.
Cisterna magna tecnica di puntura di CSF
Campioni di CSF sono prese dal cisterna magna (Figura 1) utilizzando un metodo che è stato pubblicato in precedenza 1. 
Figura 1
1. I topi sono anesthesized da ketamina (100mg/kg) e xilazina (10mg/kg), somministrato per via intraperitoneale. Durante il periodo di induzione dell'anestesia, i topi sono conservati in un incubatore o 37 ° C.
2. La pelle del collo è rasata, e il mouse viene posto prono sullo strumento stereotassico con il contatto diretto di una piastra elettrica. Una sonda di temperatura rettale viene inserito nel retto modo che il calore prodotto dal pad di riscaldamento viene regolata in risposta ai cambiamenti della temperatura corporea. La testa è assicurato con le schede di testa. Il sito chirurgico è tamponata con iodio povidone al 10%, seguita da 7 0% di etanolo (ripetere 3 volte), e un'incisione sagittale della pelle è fatta inferiore all'occipite.
3. Sotto il microscopio dissezione, il tessuto sottocutaneo e dei muscoli (m. biventer del collo e m. retto capitis dorsale principale) sono separati per via smussa con una pinza. Un paio di microretractors è utilizzato per tenere i muscoli a pezzi.
4. Il mouse è stabilito in modo che la testa forma un angolo di quasi 135 ° con il corpo.
5. Sotto il microscopio dissezione, la dura madre della cisterna magna appare come un triangolo scintillante e chiara inverso attraverso il quale il midollo allungato e di un vaso sanguigno principale (arteria spinale dorsale), e lo spazio CSF sono visibili (Figura 2). 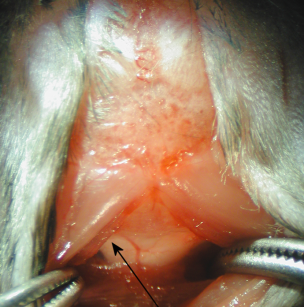
Figura 2
6. La dura madre è asciugate con tampone di cotone sterile. Penetrare il tubo capillare in magna Citerna attraverso la dura madre, laterale alla arteria spinale dorsale (Figura 2). A seguito di un notevole cambiamento nella resistenza per l'inserimento del tubo capillare, il QCS scorre nel tubo capillare.
7. Rimuovere con attenzione il tubo capillare, e collegarlo a una siringa da 3 ml con un tubo di polietilene che ha un diametro interno 1 mm. Iniettare il liquido cerebrospinale in un pre-segnato 0,5 ml di tubo Eppendorf, e congelare immediatamente la provetta in ghiaccio secco e poi trasferirlo in un congelatore C ° -80.
8. Dopo il campionamento CSF, i muscoli sono nuovamente allineati, e la pelle viene suturata (4-0, Ethicon, Johnson & Johnson). Circa 1 ml di NaCl 0,9% viene iniettata per via sottocutanea per evitare de-idratazione. Il mouse è conservato presso l'incubatore per mantenere la temperatura corporea fino a che non recupera, il peso del mouse viene monitorata 1 giorno, e 1 settimana dopo l'intervento chirurgico.
Risultati e discussione
Abbiamo descritto un protocollo altamente affidabile per il campionamento di serie del CSF da topi, senza contaminazioni plasma rilevabili.
1. L'intera procedura richiede solitamente 10 min per il mouse (incluso anestesia). Il volume di CSF ottenuti dipende dal ceppo di topi. Nella PS / APP topi doppio Tg abbiamo usato 2, il volume medio è di circa 5 microlitri (3-7 mL), mentre la (JNPL3) topi P301L 3 danno una resa di circa 10 microlitri-15 microlitri. Per il campionamento di serie, un massimo di 7-8 microlitri può essere tranquillamente assunto di volta in volta ad un intervallo di 2-3 mesi.
2. Durante l'intervento, è importante posizionare la testa e il corpo del mouse correttamente sul telaio stereotassico in modo che la dura madre della cisterna magna può essere esposto a sufficienza. Accuratamente evitare i vasi sanguigni quando penetra la dura madre con il tubo capillare per evitare la contaminazione da proteine plasmatiche, che possono essere monitorate nel campione di liquido cerebrospinale di immunoblotting per ApoB 4.
3. Riducendo al minimo il danno ai tessuti durante ogni intervento chirurgico è importante, come conglutination tessuto può aumentare la difficoltà di sanguinamento predisponendo per il campionamento successivo.
4. La temperatura corporea deve essere ben mantenuto durante l'intervento chirurgico a causa ipotermia causata da anestesia possono influenzare significativamente i livelli di tau fosforilata nel cervello molto rapidamente 5.
5. L'Ab ELISA protocollo e gli anticorpi che abbiamo utilizzato sono stati descritti in dettaglio nel Refolo et al. 6. Due ml di liquor dal PS / APP topi darà risultati soddisfacenti se diluito 1:50-1:60. Per l'ELISA tau, 4-5 CSF microlitri da P301L (JNPL3) topi sarà sufficiente per larilevazione del totale tau, o tau fosforo ylated a treonina 231 (I kit sono acquistati da Bio-Source).
6. Questa tecnica può essere applicata ad altri modelli murini di patologie neurologiche, per la quale un piccolo volume di CSF è soddisfacente per le analisi desiderata.
Discussione
Abbiamo descritto un protocollo altamente affidabile per il campionamento di serie del CSF da topi, senza contaminazioni plasma rilevabili.
1. L'intera procedura richiede solitamente 10 min per il mouse (incluso anestesia). Il volume di CSF ottenuti dipende dal ceppo di topi. Nella PS / APP topi doppio Tg abbiamo used2, il volume medio è di circa 5 microlitri (3-7 mL), mentre la (JNPL3) topi P301L 3 danno una resa di circa 10 microlitri-15 microlitri. Per il campionamento di serie, un massimo di 7-8 microlitri può essere tranq...
Riconoscimenti
Il nostro lavoro è supportato dal NIH concede NS048447 e AG017216to KD. Li Liu desidera ringraziare il Dott. Heikki Tanila (Università di Kuopio, Kuopio, Finlandia) per la sua supervisione e supporto durante lo sviluppo del protocollo originale.
Riferimenti
- Liu, L., et al. Longitudinal observation on CSF Abeta42 levels in young to middle-aged amyloid precursor protein/presenilin-1 doubly transgenic mice. Neurobiol Dis. 17, 516 (2004).
- Holcomb, L., et al. Accelerated Alzheimer-type phenotype in transgenic mice carrying both mutant amyloid precursor protein and presenilin 1 transgenes. Nat Med. 4, 97 (1998).
- Lewis, J., et al. Neurofibrillary tangles, amyotrophy and progressive motor disturbance in mice expressing mutant (P301L) tau protein. Nat Genet. 25, 402 (2000).
- DeMattos, R. B., et al. Plaque-associated disruption of CSF and plasma amyloid-beta (Abeta) equilibrium in a mouse model of Alzheimer's disease. J Neurochem. 81, 229 (2002).
- Planel, E., et al. Anesthesia leads to tau hyperphosphorylation through inhibition of phosphatase activity by hypothermia. J Neurosci. 27, 3090 (2007).
- Refolo, L. M., et al. A cholesterol-lowering drug reduces beta-amyloid pathology in a transgenic mouse model of Alzheimer's disease. Neurobiol Dis. 8, 890 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon