化合物の中には、溶解したときに水分子と反応して水酸化物イオンを生成するものがあります。いずれの場合も部分的にしか反応しないため、弱塩基に分類されます。また、これらの化合物は自然界に多く存在し、さまざまな技術において重要な物質となっています。例えば、弱塩基であるアンモニアの世界生産量は年間100トンを超え、農業用肥料、他の化合物の化学合成原料、家庭用洗剤の有効成分などとして広く利用されています。アンモニアを水に溶かすと、部分的に反応して水酸化物イオンが生成され、以下のようになります。
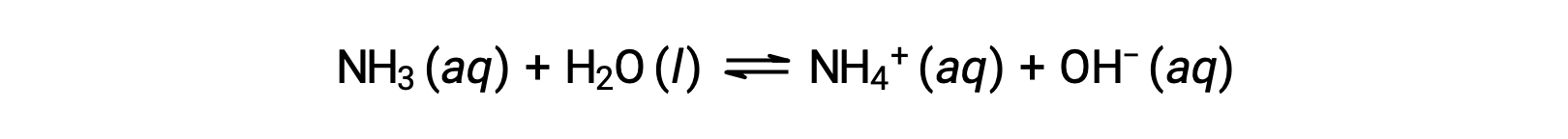
これは酸塩基反応であり、この場合は水分子からアンモニア分子へのH+イオンの移動を伴う。一般的な環境下では、溶存しているアンモニアのうちNH4+イオンとして存在するのは約1%です。
弱塩基性溶液中の水酸化物イオン濃度とpOH計算
弱塩基であるトリメチルアミンの0.25 M溶液の水酸化物イオン濃度、pOH、およびpHを求めます。:
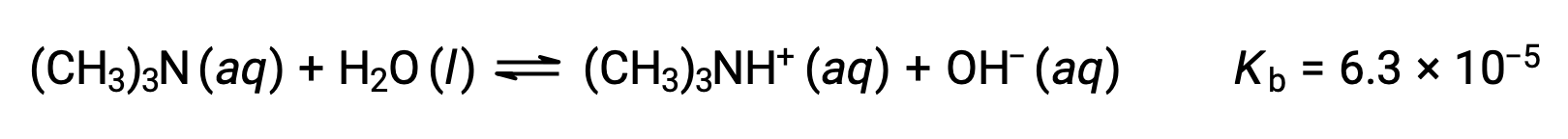
この系のICE表は以下の通りです。
| (CH3)3N (aq) | (CH3)3NH+ (aq) | OH− (aq) | |
| 初期濃度 (M) | 0.25 | 0 | ~0 |
| 濃度変化 (M) | −x | +x | +x |
| 平衡濃度 (M) | 0.25 − x | 0 + x | ~0 + x |
平衡濃度の項をKbの式に代入すると、
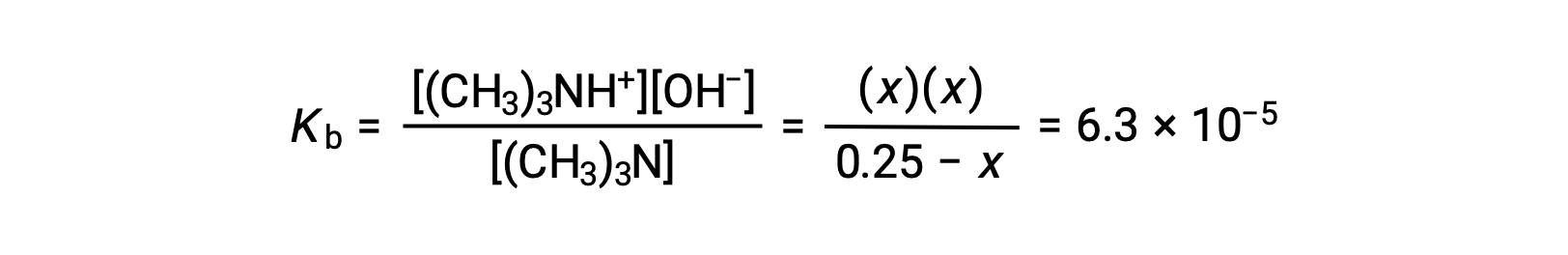
x << 0.25と仮定し、xを解くと次のようになります。
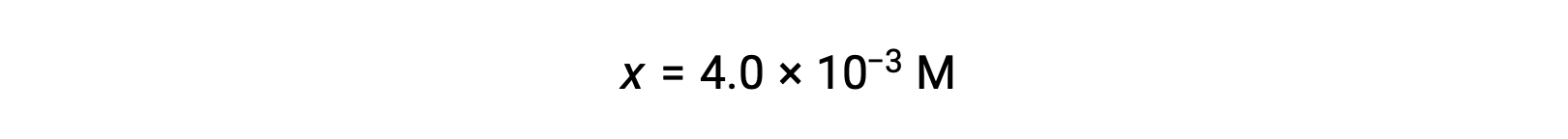
この値は、初期濃度(0.25)の5%以下なので、この仮定は正当です。
ICE表で定義されているように、xは水酸化物イオンの平衡濃度に等しくなります。
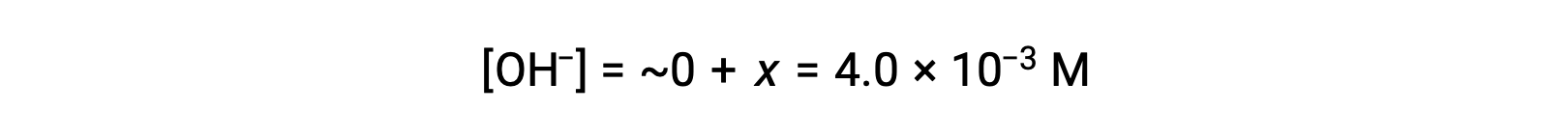
The pOH is calculated to be
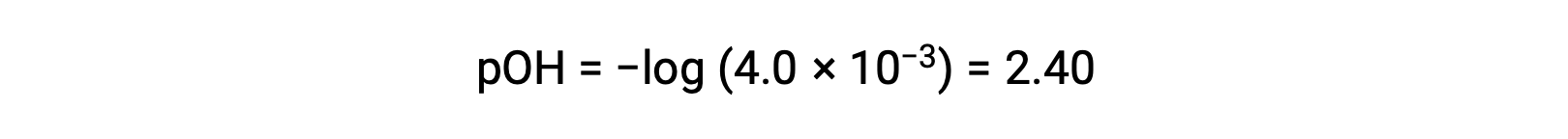
Using the relation;
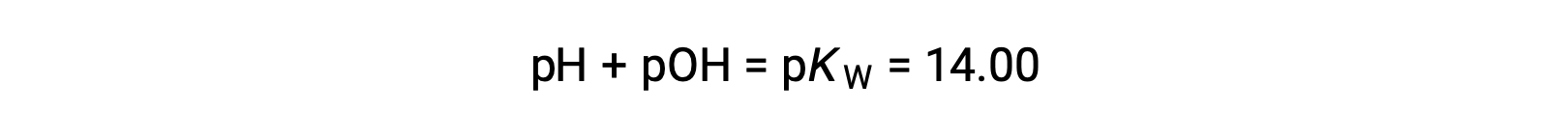
permits the computation of pH:
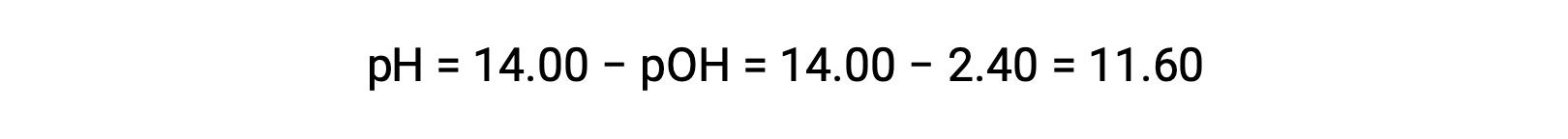
pHからのKbの決定
エチルアミン(C2H5NH2)の0.28 M溶液のpHが12.10の場合、そのKbはいくらでしょうか?
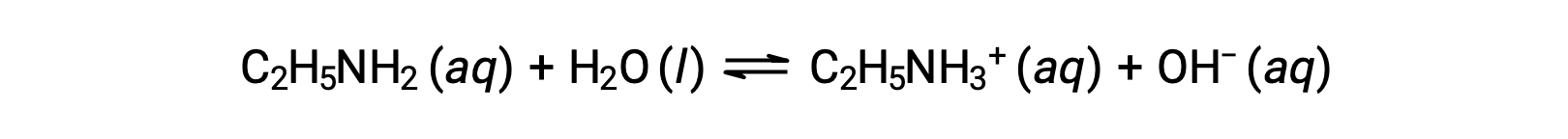
エチルアミンのKb を計算するには、まずpOHと水酸化物イオン濃度を求める必要があります。pHが12.10であることから、pOHは次のように計算できます。
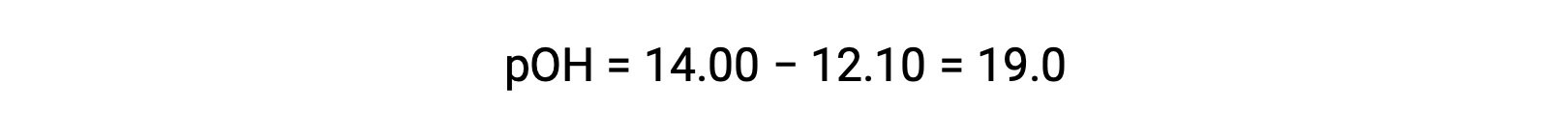
pOHが1.90なので、溶液の水酸化物イオン濃度は、次の式で計算できます。
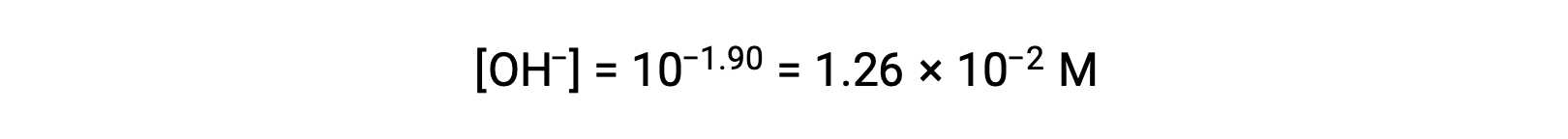
この系におけるICE表は次の通りです。
| C2H5NH2 (aq) | C2H5NH3+ (aq) | OH− (aq) | |
| 初期濃度(M) | 0.28 | 0 | ~0 |
| 変化量(M) | −0.0126 | +0.0126 | +0.0126 |
| 平衡濃度(M) | 0.28 − 0.0126 | 0.0126 | 0.0126 |
0.0126Mは0.28Mの4.5%なので、0.28 −0.0126は5%ルールを用いると0.28 Mとほぼ等しいと考えることができます。
上記の値をエチルアミンのKbの式に代入してみると、
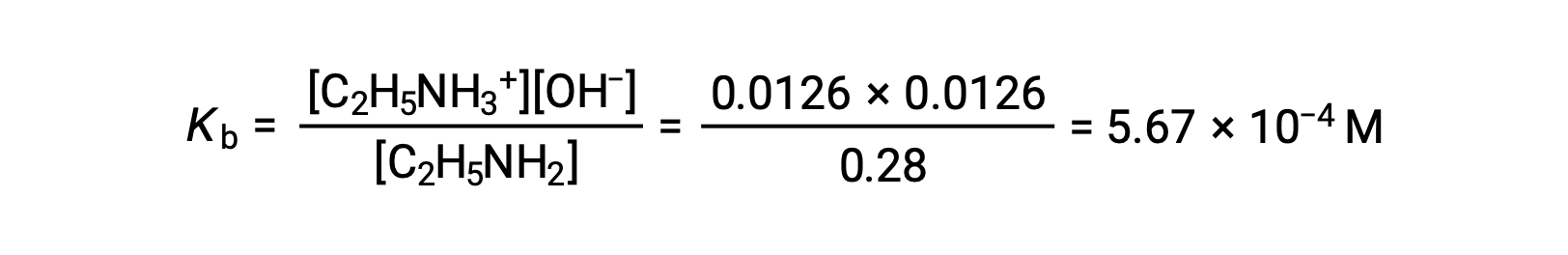
上記の文章は下記から引用しました。 Openstax, Chemistry 2e Section 4.2: Classifying Chemical Reactions and 14.3 Relative Strengths of Acids and Bases.
Copyright © 2023 MyJoVE Corporation. All rights reserved