15.11 : 塩水溶液のpHの決定
塩の水溶液のpHは、構成要素である陰イオンと陽イオンによって決まります。pH的に中性の陰イオンと、ヒドロニウムイオンを生成する陽イオンを含む塩は、pH7以下の溶液を生成します。例えば、硝酸アンモニウム(NH4NO3)溶液では、NO3−イオンは水と反応せず、NH4+イオンはヒドロニウムイオンを生成して酸性溶液となります。例えば、フッ化ナトリウム(NaF)溶液では、Na+はpH中性ですが、F-は水酸化物イオンを生成して塩基性溶液を生成します。強酸または強塩基の対イオンはpH中性であり、そのような対イオンによって形成される塩は、pHが7に等しい中性溶液を生成します。例えば、KBrでは、K+陽イオンは加水分解反応に対して不活性のため、pHに影響を与えません。臭化物イオンは、強酸の共役塩基であるため、塩基強度は無視できるほど小さく、溶液は中性となります。
塩の中には、酸性の陽イオンと塩基性の陰イオンの両方を含むものがあります。溶液の全体的な酸性度または塩基性度は、それらの陽イオンと陰イオンの相対的な強さによって決定され、KaとKbを用いて比較することができます。例えば、NH4Fでは、NH4+イオンが酸性で、F−イオンが塩基性(弱酸HFの共役塩基)となります。2つの解離定数を比較すると、NH4+のKaは5.6 × 10−10であり、F−のKbは1. 6×10−11なので、Ka >Kbなので、この溶液は酸性です。
酸性塩水溶液のpH計算
アニリンは染料の製造に使われるアミンの一種です。アニリンは、弱塩基のアニリンと塩酸を反応させた塩である塩化アニリニウム[C6H5NH3+]Clとして単離されます。塩化アニリニウムの0.233 M溶液のpHはいくらでしょうか?
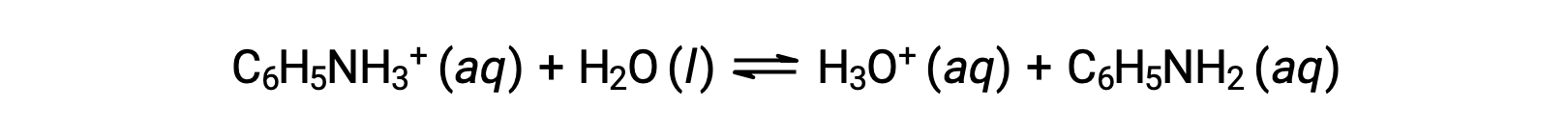
アニリニウムイオンのKaは、その共役塩基であるアニリンのKbから導出されます。
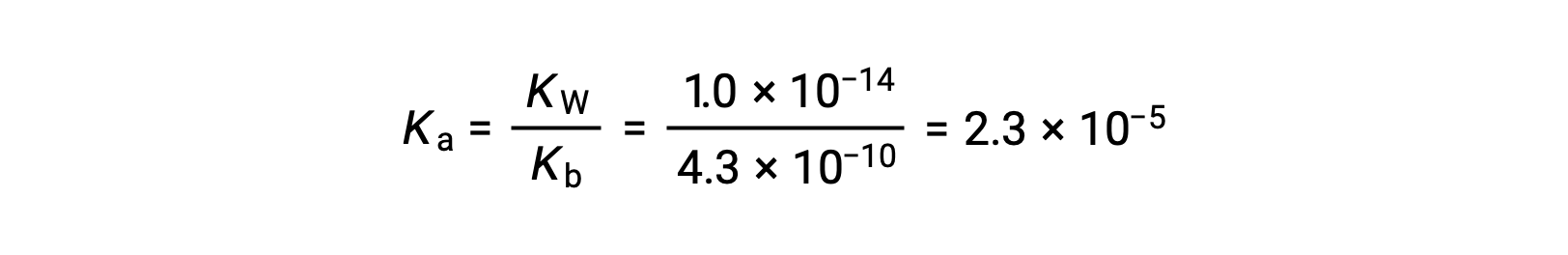
Using the provided information, an ICE table for this system is prepared:
| C6H5NH3+ (aq) | H3O+ (aq) | C6H5NH2 (aq) | |
| 初期濃度 (M) | 0.233 | ~0 | 0 |
| 濃度変化 (M) | −x | +x | +x |
| 平衡濃度 (M) | 0.233 − x | x | x |
これらの平衡濃度の項をKaの式に代入すると、
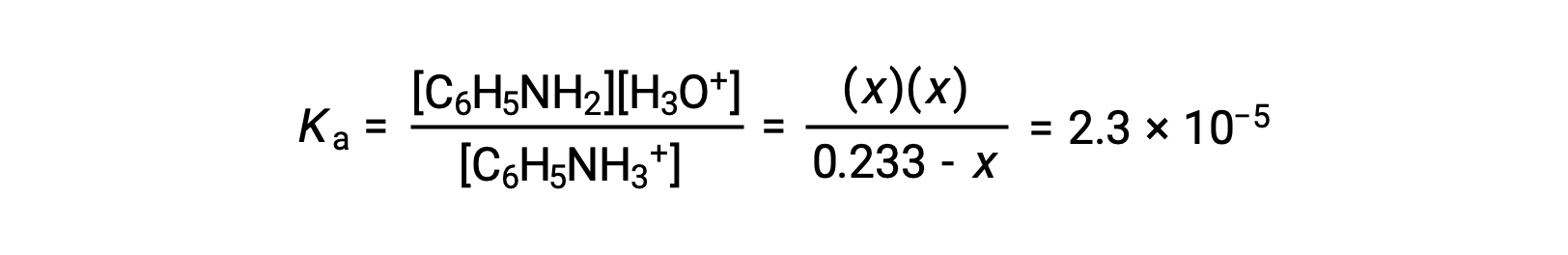
Assuming x << 0.233, the equation is simplified and solved for x:
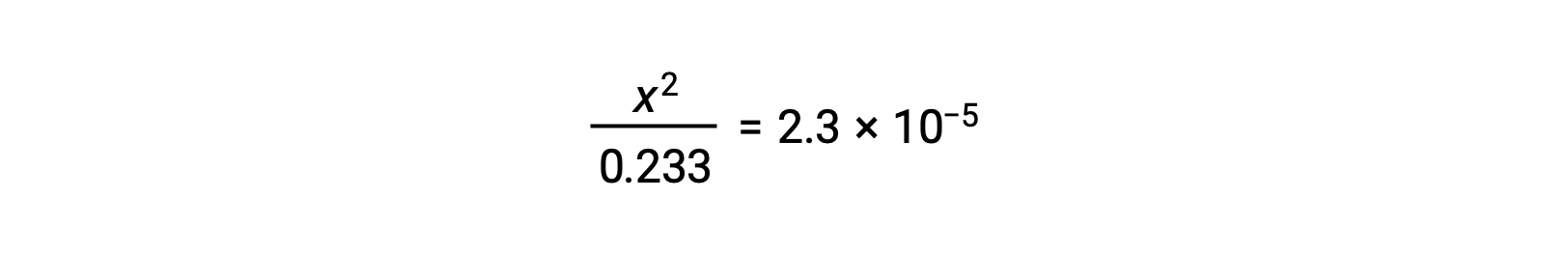

ICE表では、xをヒドロニウムイオンの物質量として定義しているので、pHは次のように計算されます。
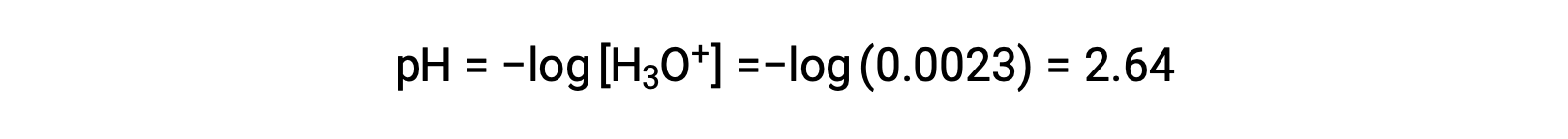
[Al(H2O)6]3+の電離
塩化アルミニウムの0.10 M溶液は、完全に溶解して水和アルミニウムイオン[Al(H2O)6]3+を生成するため、その溶液のpHを計算します。
反応の式とKaは、
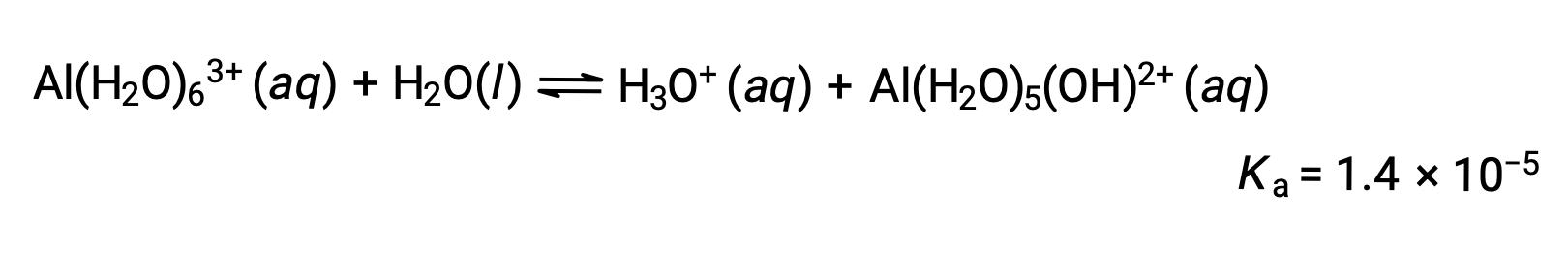
An ICE table with the provided information is
| Al(H2O)63+ (aq) | H3O+ (aq) | Al(H2O)5(OH)2+ (aq) | |
| 初期濃度 (M) | 0.10 | ~0 | 0 |
| 濃度変化 (M) | −x | +x | +x |
| 平衡濃度 (M) | 0.10 − x | x | x |
これらの平衡濃度の式をイオン化定数の式に代入すると、
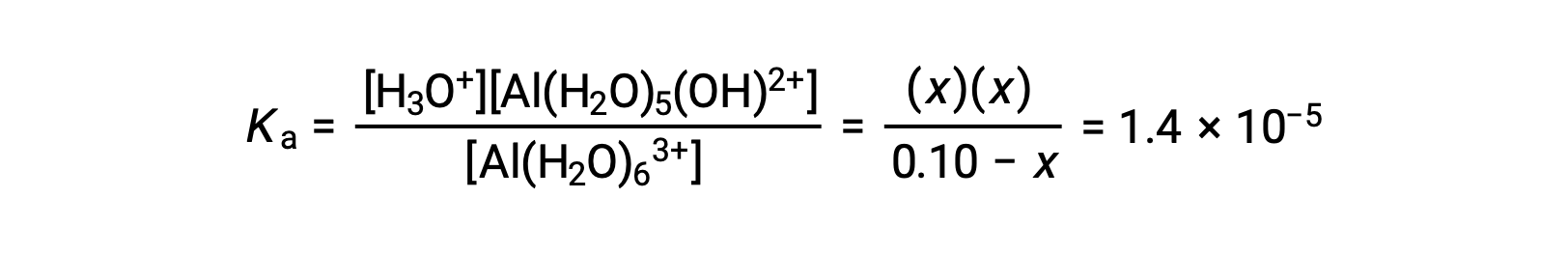
Assuming x << 0.10 となり、簡略化した式を書くと、
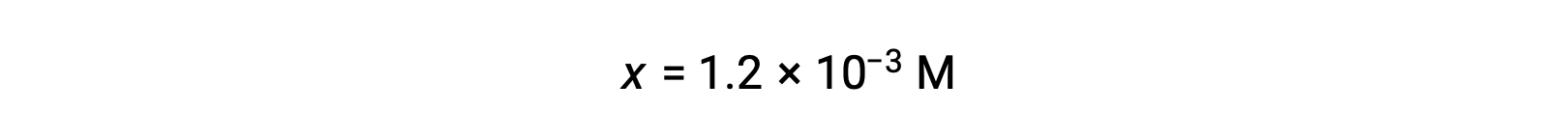
ICE表では、xがヒドロニウムイオン濃度に等しいと定義されているため、pHは2.92と計算され、溶液は酸性です。
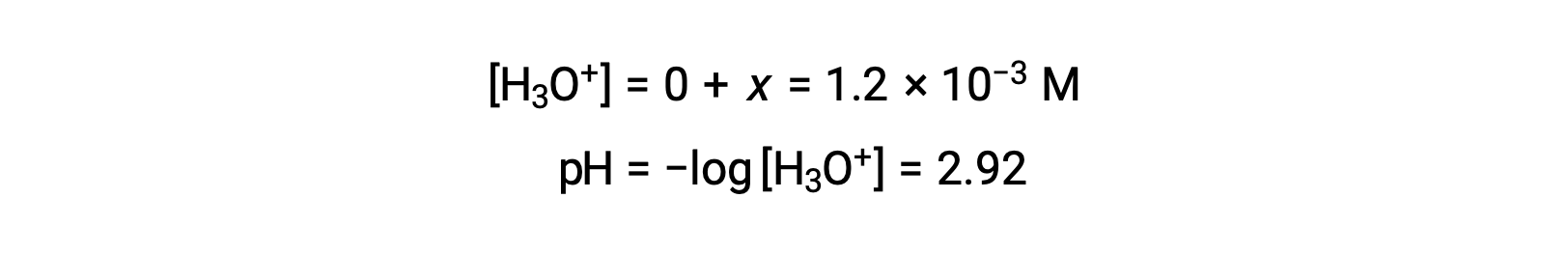
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 14.4: Hydrolysis of Salts.
章から 15:

Now Playing
15.11 : 塩水溶液のpHの決定
酸・塩基
43.3K 閲覧数

15.1 : ブレンステッド・ローリーの酸塩基理論
酸・塩基
90.9K 閲覧数

15.2 : 酸/塩基強度及び解離定数
酸・塩基
60.2K 閲覧数

15.3 : 水:ブレンステッド・ローリーの酸塩基理論
酸・塩基
50.0K 閲覧数

15.4 : pHスケール
酸・塩基
68.3K 閲覧数

15.5 : 共役酸塩基対の相対強度
酸・塩基
45.3K 閲覧数

15.6 : 強酸、強塩基性溶液
酸・塩基
31.4K 閲覧数

15.7 : 弱酸性溶液
酸・塩基
37.6K 閲覧数

15.8 : 弱塩基性溶液
酸・塩基
22.5K 閲覧数

15.9 : 酸の混合物
酸・塩基
19.5K 閲覧数

15.10 : 酸・塩基性イオン
酸・塩基
23.6K 閲覧数

15.12 : 多価酸
酸・塩基
29.0K 閲覧数

15.13 : 酸性強度と分子構造
酸・塩基
30.8K 閲覧数

15.14 : ルイス酸及びルイス塩基
酸・塩基
43.4K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved