標準条件外における反応
標準電極電位と、標準自由エネルギー変化 ΔG°や平衡定数Kなどの様々な熱力学的パラメータとの相互関係については、これまでにも検討してきた。例えば、Eºcell = +0.291 V, ΔG°= −56.2 kJとなる1 mol/Lの亜鉛(II)イオンとスズ(II)イオンの酸化還元反応は自発的に起こります。
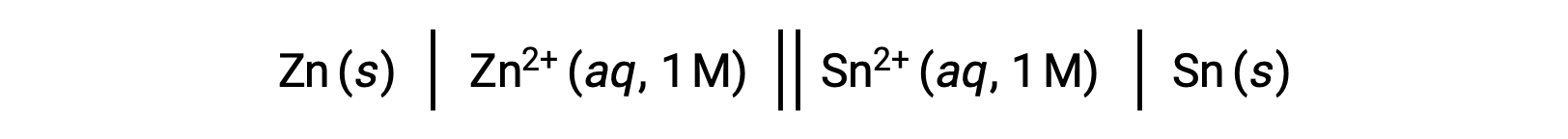
しかし、この電池を放電させると、反応物の濃度が変化し、電池の電極電位が徐々に低下します。しかし、電極電位と熱力学パラメータとの関係は、濃度、温度、圧力が標準化された状態(すなわち、濃度1 mol/L、298Kまたは25℃、圧力1気圧)でのみ成立するため、容易には相互変換できません。しかし、科学的に重要な酸化還元反応の多くは、ガルバニ電池内の異なる反応物濃度や、生体膜に生じる濃度勾配など、標準化されていない状態で起こります。そのため、このような系の電位を計算することは重要です。
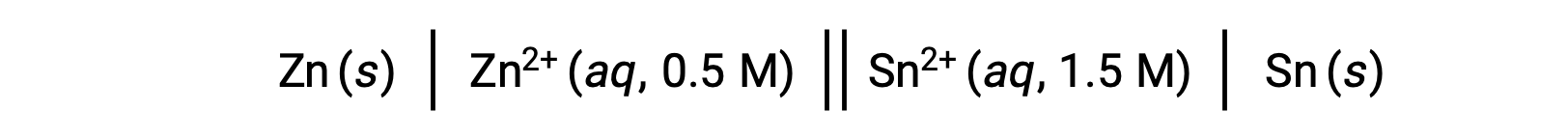
反応中の亜鉛イオンの濃度が標準状態に比べて低く、スズイオンの濃度が高い場合、酸化還元反応の自発性はル・シャトリエの原理によって定性的に予測できます。反応物に対する生成物の濃度が高ければ、反応は生成物に有利な方向に進む。その結果、Ecellの値がE°cellの値よりも高くなります。
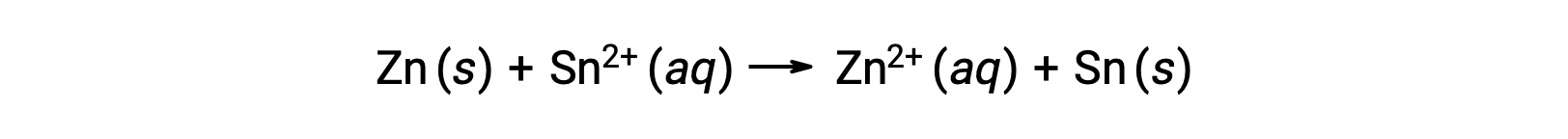
この反応は順方向に進むが、この電極電位の定量的な値は簡単にはわかりません。
非標準条件で起こる酸化還元反応に対するネルンスト式の導出
EcellとE°cellの値の関係は、標準状態と非標準状態での自由エネルギー変化の間で成り立つ関係から導き出すことができ、次のように与えられます。
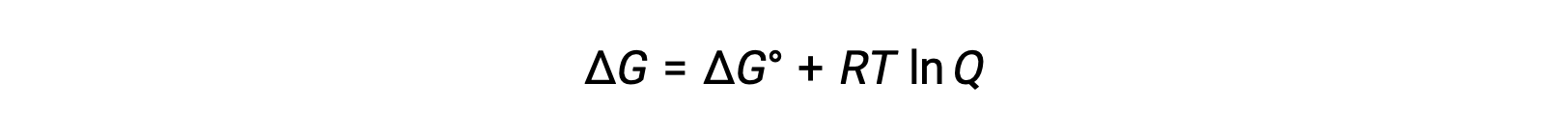
ΔGは自由エネルギー変化、ΔG°は自由エネルギーの標準変化、Rは気体定数(8.314 J/mol∙K)、Qは反応商で、反応混合物’の組成の違いによる自由エネルギーの変化を考慮したものです。反応物が固体の場合、Q値は省略されます。
自由エネルギーの変化と電極電位の関係式を代入すると、ネルンスト式と呼ばれる修正式が得られます。
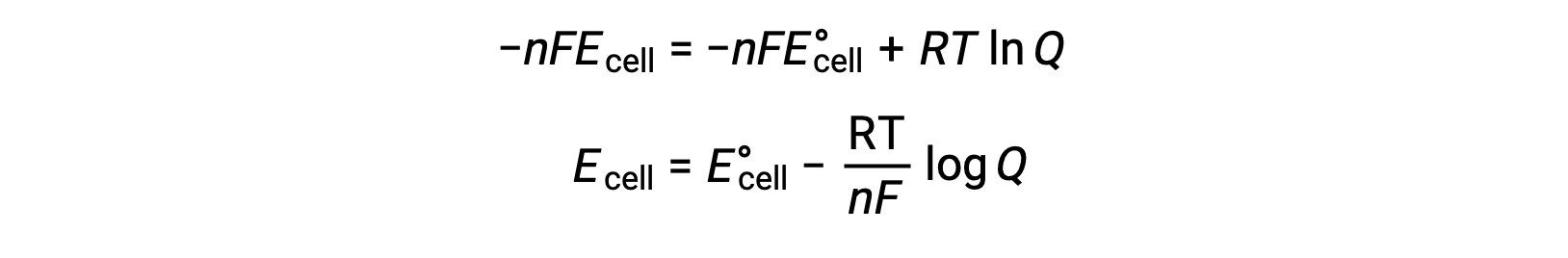
ネルンスト方程式は、非標準条件下における酸化還元系(ガルバニ電池など)の変化した電位を表します。この方程式は、酸化還元反応中に移動した電子の数n、絶対温度T、およびQとして与えられた反応混合物の組成に依存します。
実用的なネルンスト式の簡略化された形は、基本的な定数(RとF)の値と、自然対数から常用対数へと変換する係数が含まれているものです。
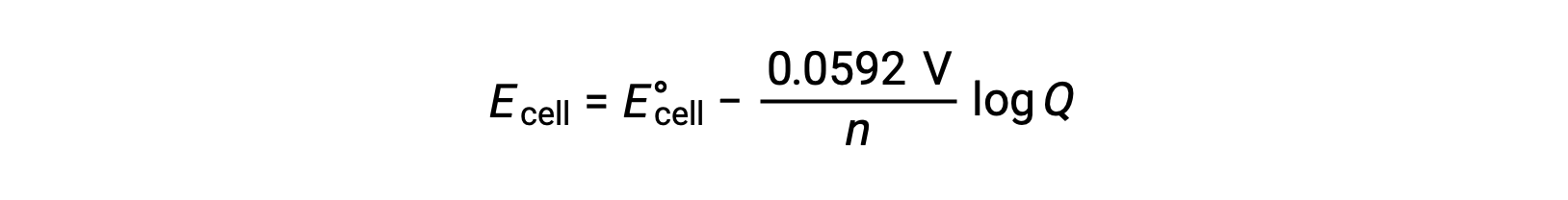
標準状態では、反応商Qの値は1であり、その対数は0です。これは、標準状態の条件では、反応物と生成物の濃度が等しいためです。この場合、EcellはE°cellと等しいです。Qの値が1より小さい場合は、反応物の濃度が高いために反応平衡が右にシフトし、その結果、電極電位の値が高くなります。Qの値が1より大きい場合は、生成物の濃度が高いために反応が左に移動し、電極の電位の値が低くなります。平衡状態では、Q値がKに等しく、電池としての電極電位はゼロになり、反応はどちらの方向にも進まません。これは、電池の連続放電で電池が切れる理由を説明しています。反応物の濃度が低下することで、反応が平衡状態に向かい、電池の電位が徐々にゼロになっていくからです。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 17.4: Potential, Free Energy, and Equilibrium.
Copyright © 2023 MyJoVE Corporation. All rights reserved
