비표준 반응 조건
표준 세포 전위와 표준 자유 에너지 변화 ΔG°및 평형 상수 K와 같은 다양한 열역학 파라미터 간의 상호 연결은 이전에 탐구되었습니다. 예를 들어, Eº셀 =+0.291 V 및 Δ G°=-56.2 kJ를가진 1M 농도에서 아연(II) 및 주석(II)을 포함하는 레독스 반응은 자발적이다.
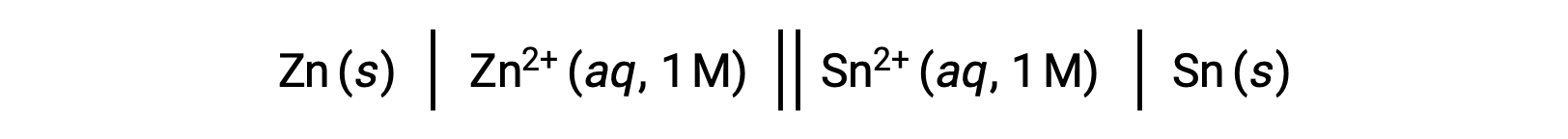
그러나 이 세포의 방전은 반응성 농도의 변화와 세포 전위가 꾸준히 감소하는 결과를 낳는다. 그러나 이러한 조건에서, 세포 전위와 열역학 파라미터 사이의 관계는 온도, 온도 및 압력(즉, 1M 농도, 298 K 또는 25°C 및 1대기의 압력)의 표준화된 조건에서만 참을 수 있기 때문에 쉽게 확립될 수 없다. 중요한 과학적 관심의 많은 redox 반응은 비표준 상태 조건, 예를 들면, 생물학적 막을 통해 생기는 갈바닉 세포 또는 집중 그라데이션에 있는 다른 반응성 사격량에서 생깁니다. 따라서 이러한 시스템의 잠재력을 계산하는 것이 중요합니다.
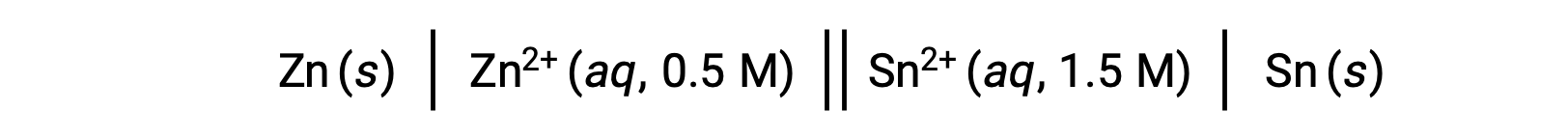
반응에서 아연 이온의 농도가 낮고 주석 이온의 농도가 표준 조건에 비해 더 큰 경우, 레독스 반응의 자발성은 르 샤텔리에의 원리를 사용하여 질적으로 예측될 수 있다. 반응하는 제품의 농도가 높을수록, 반응은 제품의 생성을 선호하는 방향으로 진행되는 경향이 더 높다. 이것은 E°세포 값의 그것 보다는 더 높은 세포 전위 값 또는 E세포 결과.
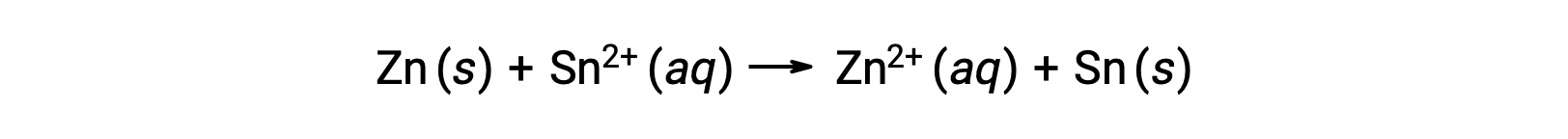
이 반응은 전진 방향으로 진행됩니다. 그러나, 이 세포 전위의 정량적 가치는 쉽게 결정할 수 없습니다.
비표준 조건하에서 발생하는 레독스 반응에 대한 Nernst 방정식의 파생
E셀과 E°세포 값 간의 관계는 다음과 같이 주어진 표준 및 비표준 조건에서 자유 에너지 변화 사이의 이전에 확립된 관계에서 파생될 수 있습니다.
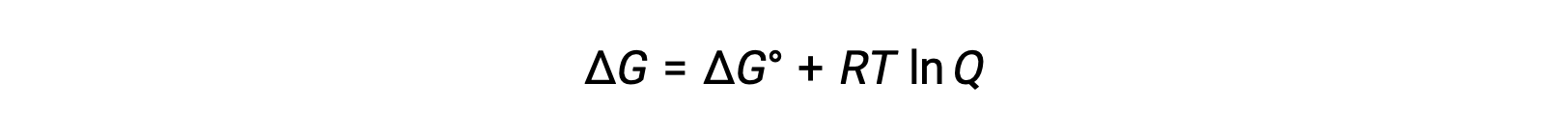
ΔG는 자유 에너지의 변화이며, ΔG°는자유 에너지의 표준 변화이며, R은 가스 상수(값 = 8.314 J/mol∙K)이며, Q는 반응 혼합물의 차이로 인해 자유 에너지의 변화를 차지하는 반응 지수이다. 반응제가 고체인 경우 Q 값이 생략됩니다.
세포 전위에 대한 자유 에너지 변화와 관련된 방정식을 대체할 때, 수정된 방정식을 얻을 수 있으며, Nernst 방정식으로 알려져 있다.
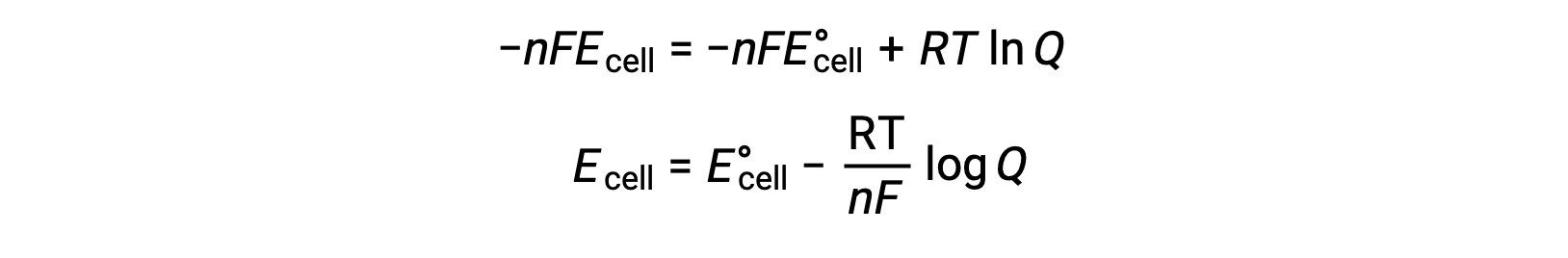
Nernst 방정식은 표준 상태 값에서 레독스 시스템(예: 갈바닉 셀)의 잠재력의 변동을 설명합니다. 그것은 레독스 반응 동안 전달된 전자의 수에 따라 달라 지며, n,켈빈, T로 측정된 온도 및 Q로서 주어진 반응 혼합물 조성물에 의존한다.
대부분의 작업에 대한 Nernst 방정식의 단순화된 형태는 기본상수(R 및 F)에대한 값과 자연 로그에서 기본 10 로개반스로 변환하는 요인이 포함된 방정식입니다.
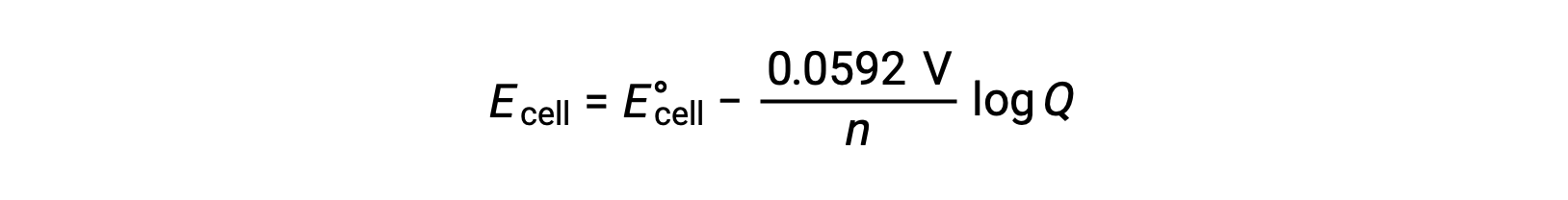
표준 상태 조건에서 반응 지수 Q의 값은 단일화이며, 로가릿은 0입니다. 이는 표준 상태 조건에서 반응제 및 제품의 동등한 농도 때문입니다. 여기서, E셀은 E°셀과동일하다. Q 값미만은 반응의 농도가 높고 반응 평형을 오른쪽으로 이동시켜 세포 전위가 더 높다는 것을 나타낸다. Q 값이 하나보다 큰 것은 더 높은 제품 농도를 나타내며, 왼쪽에 대한 반응을 유도하고, 셀 전위가 낮다. 평형에서, Q값은 K와같고, 세포 전위가 0이 되고, 즉, 반응은 어느 방향으로든 진행되는 경향을 나타내지 않는다. 이것은 왜 배터리가 연속 방전에 "다이"이유를 설명합니다: 반응성 농도의 감소는 평형쪽으로 반응을 유도하고 그것의 세포 잠재력은 꾸준히 0으로 감소합니다.
Tags
Copyright © 2025 MyJoVE Corporation. 판권 소유
