Method Article
遺伝子機能を解析するためにゼブラフィッシュ胚のマイクロインジェクション
要約
このビデオは、モルホリノまたはmRNAが、その後の開発中に特定の遺伝子産物のレベルを増減して1細胞段階でゼブラフィッシュ胚に注入する方法を示しています。
要約
ゼブラフィッシュを研究することの利点の一つは、胚のタンパク質レベルの操作の容易さと速度です。標的RNAに対するアンチセンス相補性を有する合成オリゴヌクレオチドであるモルフォは、、特定の遺伝子産物の発現を減らすために胚に追加することができます。逆に、処理されたmRNAは、遺伝子産物のレベルを高めるために胚に追加することができます。胚へのmRNAまたはモルホリノのいずれかを追加するための車両は、マイクロインジェクションです。マイクロインジェクションは、時間あたりの胚数百の注入を可能にする、効率的かつ迅速です。このビデオでは、マイクロインジェクションに関係するすべてのステップを示しています。簡単に言えば、卵は敷設後すぐに採取し、ペトリ皿で顕微鏡のスライドに対して、並んでいる。次に、注入材料がロード先の細い針は、インジェクターと空気源に接続されており、インジェクターコントロールが望ましい注入量を生成するために調整されます。最後に、針は、胚の卵黄に突入されており、モルホリノまたはmRNAが排出されます。
プロトコル
パート1:卵の生産とコレクション
- 注射前に夜、場所の仕切りでタンクを繁殖で魚をセットアップする。必要に応じて総産卵数を増やすために、魚は1つの男性に女性2の比率で設定することができます。
- 次の朝は、部屋の点灯後、電源をオンにいくつかのタンクから仕切りを引き出し、邪魔されずに嵌合時の約20分間できます。
- ストレーナーを使用して、繁殖ケージから卵を収集し、卵の水ですすいでください。卵を水でペトリ皿に卵を注ぐと、転送ピペットで未受精卵や破片を取り除く。魚は、注射のために卵の追加のラウンドを生産する大規模なタンクに再グループ化することができます。それらが単一の細胞の段階を通過させることなく生産される卵の最大数を可能にするために採卵のタイミングを調整します。
- 100ミリメートルペトリ皿の倒立蓋の顕微鏡スライドを置きます。単一の列を形成するスライドの側面に卵を整列するために、転送ピペットを使用してください。卵反対側に対してキムワイプを押すことで、スライドから過剰な卵水を取り外します。 (図1A)
パート2:引っ張ってニードル、ロード、および準備
- マイクロピペットプラーで、愚かなパテのランプを介して敷設して、2つの針および150mmシャーレ内ストアにキャピラリー1.0ミリメートルODのガラスを引き出します。針は、事前にプルアップすることができます。
- microloaderピペットを用いて注入材料の3μLと積み込む針。残りのほとんどまたはまったく気泡がなくなるまで、針の先端に向かってボーラスを振る。
- 空気源とマイクロインジェクターをオンにします。微量注入器に針を挿入し、ハウジング内に密封を保証する。マイクロマニピュレータの運動と調整の広い範囲を可能にするために適切な位置にあることを確認してください。ステージから高い顕微鏡の視野の平面、、、チップの薄地域を中心に針の先端をもたらす。ピアス絨毛膜と卵黄に十分な針は、細い葉が一貫性のあるビーズの大きさを提供する能力がまだある時点で針をピンチオフする鋭いピンセットを使用してください。マイクロメータでのミネラルオイルを一滴は、各注射の量を計算するために使用することができます。オイルに注入すると、0.1mmの直径を持つビーズは、注入材料の500 PL(図1b)が含まれ、500 PLまたは1nLの注入量は、一般的に使用されています。フットペダルを踏むと針をトリミングし、必要に応じて射出圧力を調整しながらビーズの大きさを監視します。理想的な注入量は、卵の体積の約10%を記入します。針先の品質は、注入の容易さと結果の質と一貫性の両方にとって非常に重要です。
パート3:インジェクション
- 胚は、4細胞期を過ぎて開発していないことを確認します。理想的には、胚は1細胞期になっているはず。
- あなたの反対側の片手で料理を持って、卵の列に向かって針を下ろします。
- ピアースは、絨毛膜の表面および卵黄嚢の破砕または引き裂くために見ている間の滑らかなストロークで卵黄を入力してください。卵黄(図1C)への注入材を注入します。気泡を注入するかのどちらかの胚に致死となることができるように卵黄をストレッチすることは避けてください。行を下に向かって、ピペットチップを使用して一貫性のあるビーズのサイズとを、維持するために必要な圧力を調整し、未受精卵を見たり、射出プロセス中に破棄される卵を除去する。
- 卵の列が完了した後、きれいなペトリ皿に注入卵を移動するために卵の水の穏やかな流れを使用してください。必要に応じて繰り返します。対照として、いくつかのuninjected胚を保管してください。初日の終わりには、死亡胚を除去し、注入された胚の数を記録。感染の機会を減らすために定期的に皿の中で卵の水を交換してください。
パート4:代表的な結果
注入されているものに応じて、胚は、彼らのuninjected兄弟よりも低いレートで生き残ることができる。幸いなことに、それはそれらの膨大な数字を入れることは容易であるので、これはほとんど問題になりません。それはわずかに発育の遅れを示すことがmorphantsのは正常です。
マイクロインジェクションの結果を説明するために、我々は、ガラスのタンパク質のハート(HEG)のレベルを操作するためにこのプロトコルを使用していました。 HEGは、正常な心臓の開発に必要な膜貫通タンパク質である。その不在では、胚は巨大な流入の器官とチャンバー1の心を開発する。我々は、500μMの濃度で、heg_e3i3_egfr1とheg_e4i4_egfr2、HEGに対して2以前に未記載モルフォを注入した。 2日後の受精では、uninjected兄弟のコントロールは、(図2AおよびB)期待される、正常に表示されます。 heg_e3i3_egfr1を注入された胚は、脳浮腫(図2C)を持っている。これらmorphantsのほとんどの心は、形態を変更したものの、彼らのチャンバーは(図2D)は通常サイズです。胚の注入heg_e4i4_egfr2展示変数心臓欠陥を持つ。他の人が大規模な流入の広大と適度に拡大した心房(図2E及びF)を持っている一方、一部では、正常に表示されます。 HEGの変異体、以前に1を報告したが、非常に拡大した流入路およびアトリウム(図2GおよびH)があります。
我々はまた、完全長cDNA HEGから転写された400 ng /μLのmRNAと野生型胚を注入した。 uninjectedコントロールが(図3AおよびB)正常に発達しながら、HEG mRNAを注入された胚は、本体の軸の短縮野生外観から厳しい単眼症に至るまで表現型のスペクトル、、頭と体の壊死、及び正中線欠陥(図3Cに示すおよびD)。
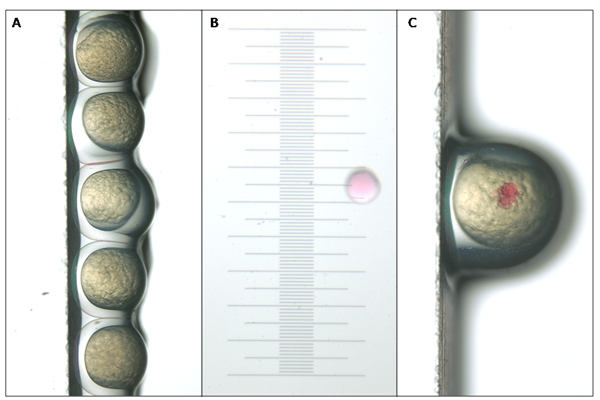
注入されるように図1。胚をシャーレ()で顕微鏡のスライドに対して、並んでいる。注入量は、マイクロメートルに置かれた鉱物油中に注入することによって決定されます。一般的に使用される500 PL、、の注入量は0.1 mm(B)の直径を有している。すぐに注入した後、モルホリノまたはmRNAは卵黄(C)で中断させるスポットとして表示されます。

図2:2日後の受精では、uninjected胚は、肉眼的欠陥()または心臓の表現型(B)を持っていません。モルホリノheg_e3i3_egfr1を注入された胚は、脳浮腫(C、矢印)が、通常サイズの心腔(D)を持っている。モルホリノheg_e4i4_egfr2を注入いくつかの胚は肥大流入地帯と心房(E、F)を持っている。 HEG変異が著しく拡大した流入地帯と心房(G、H)を持っている。 ()、(C)、(E)、及び(G)4X DICイメージです。、(D)、(B)(F)及び(H)20 × DICイメージです。 =アトリウム、それ=流入路。
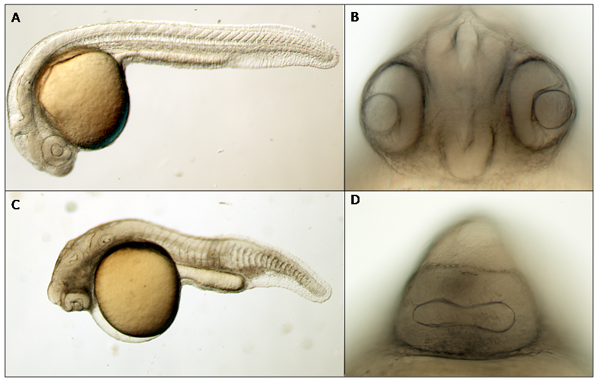
図3。24時間後の受精で、胚は、それらの(B)の間に神経管となく壊死や正中欠損()と2つの明確に定義された目で長く、まっすぐなボディを持っているuninjected。 HEG mRNAを注入されたいくつかの胚は、対照的に、短縮された体軸、壊死、misshaped体節(C)、及び単眼症(D)を示す。 (A)と(C)4X DICイメージです。(B)と(D)20 × DIC画像です。
ディスカッション
ゼブラフィッシュのモデルシステムの強みの一つは、特定の遺伝子産物が追加されたり、マイクロインジェクションによる胚から除去することができる容易さです。普遍的に特定のタンパク質を過剰発現するように、コードするmRNAは、それは、1細胞期における卵黄中に注入される。胚のその後の開発中に、RNAは生物全体に分散して変換されます。逆に、特定のタンパク質を除去するために、モルフォが使用されます。モルフォは、特定のRNAのアンチセンス相補性で設計された合成オリゴヌクレオチドである。のmRNAと同様に、モルフォは、1細胞期における卵黄中に注入されています。胚の内部に、彼らは翻訳を防止する、彼らのターゲットRNAをバインドします。
各モルホリノまたはmRNAのために作られる必要がある主な変更は、注入された物質の濃度である。あまりにモルホリノまたはmRNAのどちらかの高濃度は、非特異的毒性を引き起こす可能性があります。各モルホリノが、その最適濃度を決定するために経験的にテストしなければならない一方、200μMと500μMの間で一般的にモルホリノ濃度は、非固有の欠陥を引き起こすことなく効果的に遺伝子の活性をノックダウン。針の開口部の正確なサイズは重要ではありません。針のサイズは、噴射圧力と噴射時間の範囲内で適切なボリュームのボーラスを生成するために調整することができます。
モルフォは、蛋白質内ドメインの機能解剖を含む多くのアプリケーションを持っている。特定のエクソン - イントロン接合部を標的とするように設計するときに、モルフォが発生スプライシングを防止します。我々は、HEGのpre - mRNAの二つモルフォそのバインドエクソン-イントロン接合部の影響を調べた。モルホリノheg_e3i3_egfr1は、成熟した成績証明書にエクソン3を組み込んだからスプライシング機構を防止する、エクソン3とイントロン3の間の接合部を結合する。モルホリノheg_e4i4_egfr2は、同様にエクソン4を削除します。エクソン3と4の両方がEGF様リピートを含むドメインをエンコードする。いくつかの胚はheg_e4i4_egfr2適度に模写変異体を注入し、さらに実験は、心臓の開発にエクソン4をHEGの役割を理解する必要があります。驚いたことに、heg_e3i3_egfr1を注入胚では、脳浮腫、HEG変異体では見られない特徴を持っている。これにより、接合子の変異体では影響を受けないであろう母親の成績証明書をバインドするモルフォの能力に起因する可能性があります。
謝辞
我々は彼らの技術支援のためにマブリーラボとNarieのStorerのメンバーを認識し、米国心臓協会(NCRPサイエンティスト開発グラント0635363N)と資金調達のための国立心臓、肺、血液研究所(グラントSCCOR RFA HL02 - 027)。
資料
| Name | Company | Catalog Number | Comments | |
| Microinjector | Tool | Harvard Apparatus | PLI 100 | |
| Micromanipulator | Tool | Narishige International | MN 153 | |
| Needle Puller | Tool | Sutter Instrument Co. | P 97 | |
| Glass Capillaries | Tool | World Precision Instruments, Inc. | TW100 F6 | |
| Microloader Pipettes | Tool | Eppendorf | 5242956.003 | |
| Needle Holder | Tool | World Precision Instruments, Inc. | MPH310 |
参考文献
- Mably, J. D., Mohideen, M. P. K., Burns, C. G., Chen, J., Fishman, M. C. heart of glass regulates the concentric growth of the heart in zebrafish. Curr. Biol. 13, 2138-2147 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved