このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
の浸透圧の回避線虫(Caenorhabditis elegans):二つの遺伝子のシナプス機能、ヒトのオルソログ NRXN1と NLGN1、
要約
Neurexinsとneuroliginsはシナプス分化と伝達に重要な役割を実行する膜ニューロンの接着タンパク質です。のニューロリギン欠損変異体 C.エレガンス浸透圧強度を検出するのに欠陥がある、しかし彼らはまた、ニューレキシンをコードする遺伝子に変異が含まれている場合、彼らは野生型の表現型を回復する。
要約
Neurexinsとneuroliginsは、興奮性と抑制性シナプスに存在する細胞接着分子であり、それらは正しいニューロンのネットワーク機能1に必要です。これらのタンパク質は、シナプス前及びシナプス後膜2で見られる。マウスの研究では、neurexinsとneurologinsがシナプス伝達1の本質的な役割を持っていることを示している。最近の報告では、人間の神経系の開発中に変更された神経細胞の接続は、自閉症スペクトラム障害3の多数の例病因の基礎を構成することができることが示されている。
線虫(Caenorhabditis elegans)があるため実験室での実験のためのそのシンプルさ、シナプス成分の機能の研究を促進するために実験的なツールとして使用し、その神経系、シナプスの配線が完全に特徴付けされていることを与えることができます。 Cで。 エレガンスNRX - 1とNLG - 1遺伝子は、それぞれα-ニューレキシン- 1、ニューロリギン- 1タンパク質を、エンコード人間NRXN1とNLGN1遺伝子にオルソロガスです。ヒトと線虫では、neurexinsとneuroliginsの組織は、機能ドメインの点で似ています。
線虫の頭部はamphid、浸透力を含め様々な刺激に応答を媒介する線虫の感覚器官が含まれています。 amphidは繊毛状突起一シナプス前終末軸索4の12の感覚バイポーラの神経細胞で作られています。 ASHRとASHLという名前のこれらのニューロンの二つは、高い浸透力5で水溶性の忌避剤を検出し、浸透圧感覚機能に特に重要です。これら2つのニューロンの樹状突起は、口の先端に長くし、軸索は、彼らが行動反応6を決定する他のニューロンとのシナプス結合を作る神経リング、に拡張します。
高い浸透力の回避にニューレキシンとニューロリギンの影響を評価するために、我々は、4Mフルクトースリング7に基づいてメソッドを使って、NRX - 1とNLG - 1遺伝子に欠陥のある線虫変異株の異なる応答を示しています。行動の表現型が特異的RNAiのクローン8を用いて確認された。 C.で虫は 、RNAiを引き起こすために必要なdsRNAは、9を供給することにより投与することができます。食品を介してdsRNAの配信は、このように遺伝的要素とのネットワーク経路の同定を可能にする目的の遺伝子のRNAiの干渉を誘導する。
プロトコル
1:浸透回避アッセイ。
- 約16-24時間アッセイの前に、OP50 E.を含む新鮮なNGMプレートに各遺伝子型のL4幼虫期の動物を選ぶ大腸菌は、20℃で、それをandincubate翌日、若年成人での実験を開始します。
- それは、アッセイ"盲目的に"行うことをお勧めします。アッセイすべき各菌株でプレートを実験が終了したときにマスク解除されるrelabelledプレートを用いてアッセイを行うこと、第二実験者によってrelabelledされるべきである。
- 検定の日、1%コンゴーレッド溶液とフルクトースの4Mストック溶液を調製し、室温で完全に溶解する。色素が時間と共に沈殿する可能性があるため私たちは、各アッセイの前に解決策を確認することをお勧めします。
- NGMプレート上に環状のリング(直径1cm)が赤4Mのフルクトースの溶液15μlを、固体培地の中心に概説されています。フルクトース溶液は寒天に浸透させ、これは通常、2〜5分かかります。
- リング内の各菌株の個々の若年成人の動物を配置し、浸透障害への応答を決定するために次の10分をオーバー従ってください。行の6倍以上のリングを回避する動物は、通常のように分類され、以下の6回でリングを終了するものは、浸透圧感受性に欠陥とみなされます。
注 :コントロール株がそれぞれのアッセイで使用されている必要があります。彼らは断固としてリングの障壁を避けるようにN2若い成人の動物は、ポジティブコントロールとして使用されています。以前に、飢えDauer幼虫を通過または乾燥しすぎているプレートから来ているされている動物は使用しないでください。冒頭で、対照動物は、アッセイプレートと解決策が正しいことを確認するために、重複して評価されるべきである。
2:RNAiの給餌によるノックダウンのワームの発生。
- RNAiのプレート:NGM RNAiの餌皿は、リットル当たりが含まれています:17 gの寒天、2,5グラムペプトン、3.0グラムのNaCl、5 mgのml -1のコレステロールを1mlのH 2 Oおよびオートクレーブで1リットルフラスコを埋める。寒天は、約65に冷却した後° C、1 M KPO 4、pH6.0で、1 M CaCl 2を 、1M MgSO 4を 、0,5 mlカルベニシリン(50 mgをml -1)を、1を1 ml 1 mlの25 mlを追加するミリリットル1M IPTG。準備された固体NGMで開始している場合は、電子レンジで固形培地を溶融し、その後冷却してから、以前に示されているKPO 4、pH6.0で、のCaCl 2、MgSO 4を 、カルベニシリンおよびIPTGを追加するには、ベンチに液体NGMを置きます。
それぞれ60ミリメートルシャーレにNGMの10mlを追加します。冷却を可能にし、使用前に室温で一晩、それらを維持するプレートを反転させる。プレートは、約4〜5日間4℃でビニール袋に格納することができます。 - 細菌の準備と誘導:ルリア-ベルターニ(LB)寒天プレート(17 gの寒天、10gトリプトン、5gの上に、標的遺伝子に対応する断片を含むL4440ベクターで形質転換大腸菌 HT115(DE3)株のコロニーを、分離酵母エキス、1リットル当たり10グラムのNaCl)アンピシリン(50μg/ mlの)とテトラサイクリン(15μg/ ml)を含む。
細菌のコロニーをピックアップし、50μg/ mlのアンピシリンを含むLBに接種し、37℃で振盪しながら6〜8時間のために栽培℃、準備NGMプレート上にシードこの文化のドロップをし、一晩インキュベートされる前に徹底的にプレートを乾燥させる(細菌が成長すると誘導を開始できるように室温で12 24時間)。テトラサイクリンは光に敏感であり、それはプレート間でのRNAiアッセイの変動性に影響を与える可能性があるため、インキュベーションは暗闇の中だった。
それは正とRNAiの給餌実験のネガティブコントロールを使用する必要があります。陽性対照は、UNC - 22遺伝子の配列を含むL4440ベクターで形質転換された大腸菌 HT115セルです。 UNC - 22遺伝子のノックダウンは、"けいれん表現型"を生成します。ネガティブコントロールは、空のL4440ベクターで形質転換した大腸菌 HT115セルです。 - ワームの取り扱いとスコアリング:初日、20℃細菌とインキュベートすることなく、NGMプレート上にOP50を接種したNGMプレートから場所L4段階のワーム℃で12時間(空腹時)。
次の日、特定の標的遺伝子のRNAiを発現している細菌でseeddedプレートの上に若い絶食大人の雌雄同体を転送する。 F1子孫を生成するために20℃40〜48時間° Cにしておきます。
その後、同じ細菌を接種した別のプレートの上にいくつかのF1の成虫を置きます。 24〜48時間後、選択してF2子孫、若年成人(少数の卵に完全に形成された突出外陰部)と表現型のスコアから隔離する。
注:。神経細胞におけるRNAiの誘導が原因C elegansの神経系の耐火特性のRNAiにいくつかの制限があります。ニューロンにおけるこの非効率性の問題を克服するためには、RRF - 3株、ニューロン10のRNAiの影響に過敏な背景を使用することをお勧めします。我々の実験がないdifferencでESは遺伝子のためにブリストルN2とRRF - 3株の間に発見し、表現型が分析された。
3:使用される菌株。
C.本研究で使用した線虫株を表1に示す。変異株は、N2野生に対して外交配- タイプの少なくとも4倍、突然変異誘発のプロトコル中に生成されている可能性が不要なランダムな突然変異を削除する。
。。OP50 E coli株は、プラスミドNRX - 1を運ぶpL4440(JA:C29A12.5)と線虫遺伝子センター、ミネソタ大学、米国大腸菌 HT115(DE3)でsuppliiedしたとNLG - 1(JA:C40C9.5 )遺伝子断片は、ピーターAskjaer、セントロアンダルシアデBiologíaデル開発省(CABD)、CSIC大学パブロオラビデ、セビリア、スペインで提供されていました。
4:代表的な結果。
例示的な結果は図1と図2で表されます。各菌株三レプリカ実験の最低の10匹を行った。
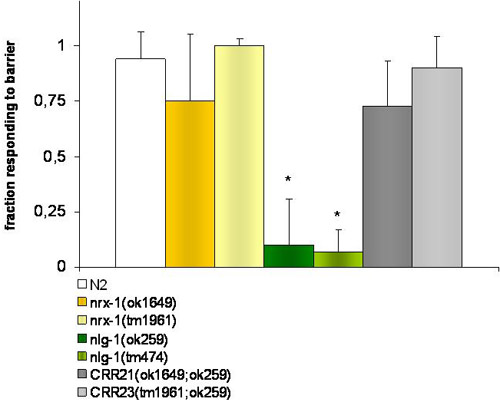
図1。浸透回避行動の実験。
対照株とNRX - 1 V欠損mutantwormsは、彼らが浸透バリア(4Mフルクトース)を発生したときに逆方向に反転することで対応(ok1649とtm1961)。NLG - 1(ok259とtm474)X変異体はこのバリアーを検出に失敗する。 NLG - 1とNRX - 1の欠損二重変異体は、菌株CRR21(ok1649、ok259)VXとCRR23(tm1961、ok259)VXは、野生型の表現型を回復した。 *は、t -学生の試験によるブリストルN2野生型に各菌株の応答では、T -生徒のテストで有意差(P≤0.001)を示しています
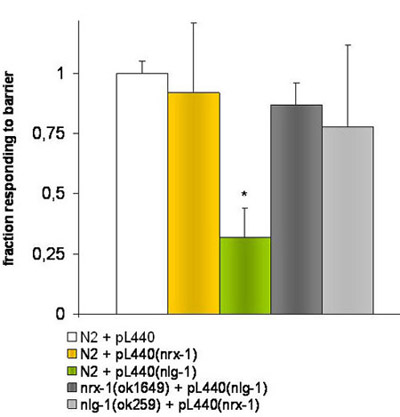
図2。 RNAiの給餌によるノックダウンのワームを用いた実験。
大腸菌 HT115(DE3)空のpL4440ベクターで形質転換または標的遺伝子NRX - 1またはNLG - 1に対応するフラグメントを含むが飼育異なるワームの菌株に使用されていました。 *は、空のpL4440ベクトルが供給N2株と比較して、NLG - 1遺伝子を標的断片でpL4440ベクターを保持する細菌が供給N2株の応答では、T -生徒のテストで有意差(P≤0.001)を示しています。
ディスカッション
Neurexinsとneuroliginsはシナプス伝達11とシナプス結合12の分化に重要な役割を行う。両分子は、自閉症13,14のための候補遺伝子として同定されている。
このビデオでは、私たちはCの浸透回避反応に影響を及ぼす遺伝子の影響を研究することができるシンプルな方法を示してエレガンス 。ニューロリギン欠損変異体では、浸透力を検出す...
謝辞
我々は彼の貴重な支援に感謝博士アントニオミランダ- Vizueteしたいと思います。我々はまた、貴重な技術支援のためにサルマBoulayouneとイザベルキャバに私たちの感謝の意を表したいと。この作品は、アンダルシア州政府(BIO - 272)からの助成金によって賄われた。この研究は、ヨーロッパでは遺伝子実験を規制する現行の法律との合意で行われている。
資料
表1。C.虫系統。
| Name | Company | Catalog Number | Comments |
| ひずみ | 遺伝子 | 対立遺伝子 | 元 |
| ブリストルN2 | - | - | aCGC |
| VC228 | NLG - 1 | ok259 | CGC |
| FX00474 | NLG - 1 | tm474 | bNBP - 日本 |
| VC1416 | NRX - 1 | ok1649 | CGC |
| FX1961 | NRX - 1 | tm1961 | NBP -ジャパン |
| NL2099 | RRF - 3 | pk1436 | CGC |
| CRR21 | NRX - 1、NLG - 1 | ok1649; ok259 | この作業 |
| CRR22 | NRX - 1、NLG - 1 | tm1961; ok259 | この作業 |
A. 線虫遺伝子センター、ミネソタ大学、米国。
B.実験動物"線虫C. elegans"のためのナショナルバイオリソースプロジェクト。東京女子医大、 日本。
参考文献
- Sudhof, T. C. . Nature. 455 (7215), 903-903 (2008).
- Fabrichny, I. P., Leone, P., Sulzenbacher, G. . Neuron. 56 (6), 979-979 (2007).
- Garber, K. . Science. 317 (5835), 190-190 (2007).
- Wang, K., Zhang, H., Ma, D. . Nature. 459 (7246), 528-528 (2009).
- Ward, S., Thomson, N., White, J. G. . The Journal of comparative neurology. 160 (3), 313-313 (1975).
- Bargmann, C. I., Thomas, J. H., Horvitz, H. R. Cold Spring Harbor symposia on quantitative biology. 55, 529-529 (1990).
- White, J. G., Southgate, E., Thomsom, J. N., Brenner, S. . Philos. Trans. R. Soc. Lond. B Biol. Sci. 314, 1-1 (1986).
- Culotti, J. G., Russell, R. L. . Genetics. 90 (2), 243-243 (1978).
- Fire, A., Xu, S., Montgomery, M. K. . Nature. 391 (6669), 806-806 (1998).
- Timmons, L., Fire, A. . Nature. 395 (6705), 854-854 (1998).
- Simmer, F., Tijsterman, M., Parrish, S., Koushika, S. P., Nonet, M. L., Fire, A., Ahringer, J., Plasterk, R. H. . Curr Biol. 12, 1317-1317 (2002).
- Missler, M., Zhang, W., Rohlmann, A. . Nature. 423 (6943), 939-939 (2003).
- Varoqueaux, F., Aramuni, G., Rawson, R. L. . Neuron. 51 (6), 741-741 (2006).
- Graf, E. R., Zhang, X., Jin, S. X., Scheiffele, P., Fan, J., Choih, J. . Cell. 119 (7), 1013-1013 (2004).
- Scheiffele, P., Fan, J., Choih, J. . Cell. 101 (6), 657-657 (2000).
- Jamain, S., Quach, H., Betancur, C. . Nature genetics. 34 (1), 27-27 (2003).
- Szatmari, P., Paterson, A. D., Zwaigenbaum , L. . Nature genetics. 39 (3), 319-319 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved