このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヘリオス遺伝子銃を用いたタマネギの細胞における蛋白質 - 蛋白質相互作用のための二分子蛍光相補(BiFC)アッセイ
要約
この記事では、タマネギ表皮細胞にプラスミドDNAを導入する遺伝子銃をヘリオス適切にBioRad社製を使用する方法を示して、どのように二分子蛍光相補性の原理(BiFC)に基づいて、タマネギの細胞におけるタンパク質間相互作用をテストする
要約
多様な生物の遺伝子機能の調査では、遺伝子産物が正常な細胞環境の相互作用についての知識に依存しています。二分子蛍光相補(BiFC)アッセイ
プロトコル
I.プラスミド調製
砲撃のために使用されるプラスミドDNAは高純度と500ng/μl以上の濃度ででなければなりません。 BiFCは2つのプラスミドコンストラクトを含むために、各プラスミド25μgのが必要です。言い換えれば、2つのプラスミドの1:1のモル比は、カートリッジの準備のために50μgのプラスミドDNAの総を生じさせるために混合されるべきである。 50μgのより多くのDNAを追加すると金粒子の凝集を引き起こす可能性があり、避けるべきであることに留意してください。市販のプラスミドDNA抽出キットは、プラスミドDNAを単離するために推奨されています。
プラスミドベクターは、pUC19のようなサイズが比較的小さいはずです。我々は、それぞれ3、pUC19を- SPYNE及びpUC19 - SPYCEにSEUとLUH cDNAをクローニングした。 アグロバクテリウムによる形質転換用バイナリーベクターには大きすぎると爆撃には不向きです。
II。カートリッジの準備
カートリッジの準備は、プラスミドDNAと続いて遺伝子銃のカートリッジホルダーにロードすることができる半インチ長い断片に切断されているプラスチック製のチューブにそれらをロードするとコーティングの金粒子を含む。カートリッジの準備は別々のJoveの記事4に詳しく説明されていますので、ここでは説明されていません。タマネギの細胞の爆撃のために、我々は、1μgのDNA/0.25 MGゴールド/カートリッジで50カートリッジに約をもたらす準備あたりの金粒子、12.5 mgのプラスミドDNA50μgのを混合することをお勧めします。各カートリッジには、ワンショット用です。金粒子は、0.6μm以下または直径が1.0μmの(;バイオラッドカタログ番号1652262またはCat#1652263)のいずれかになります。我々はまた、カートリッジの準備のためには0.5 mg / mlのPVP溶液を使用することをお勧めします。 BiFCの場合は、同じカートリッジの準備の各推定相互作用のパートナーの2つのプラスミドDNAを結合する。
カートリッジの準備の後、ペトリ皿の周りにラップされている正方形のパラフィルムに150から200 psiの間にヘリウム圧力で新たに作られたカートリッジを焼成してカートリッジをテストすることが重要です。金粒子は、カートリッジから効率的に推進することができればこれがテストされます。あなたは、パラフィルム上でかすかな金粒子が表示されるはずです。これにより、各ショットがカバーする領域のアイデアを提供します。あなたが別のヘリウム圧力(150-200 psiの範囲にある)で、パラフィルムの上に推進さの金粒子の量が異なることがあります。有意差がない場合は、爆撃のためのより低い圧力を選択してください。
III。タマネギの組織の準備
撮影の日に、大規模な黄色のタマネギから外側の皮膚が剥離してしまいます。クリーンで鋭いカミソリの刃を使用して、約2 × 8 cmの深さの矩形領域4から5層をカット。 、長方形のタマネギの組織を取り出し、外側の2つの層を捨てる、2X1.5 cm程度の小片にタマネギの残りの層をカット。ろ紙(ワットマン3MMペーパーに円にカット)を含むペトリ皿にタマネギの部分を配置するには、滅菌水で湿らせた。ペトリ皿をカバーし、彼らが行って準備ができている。
IV。砲撃
- 白い丸いカートリッジホルダーにカートリッジをロードする。別のプラスミドコンストラクトを含むカートリッジは、別のカートリッジホルダーにロードする必要があります。各カートリッジホルダーは12枚で12カートリッジを収容できます。
- ヘリオス遺伝子銃にバッテリーと新鮮なバレルのライナーを挿入します。バレルライナーと銃の両方が接続されたそれぞれのO -リングを持っていることを確認してください。
- 最初に、銃の上部が直面しているカートリッジホルダーのマーク#12で、遺伝子銃に空のカートリッジホルダーを挿入する。アドバンスカートリッジホルダーは、一度か二度、それが正しく挿入されていることを確認する。
- ヘリウムタンクに銃を取り付け、150から200 psiの間の圧力を調整する。
- 銃のチャンバーを一掃すると圧力が安定していることを確認するために、空のカートリッジホルダーに耳の保護と火災の銃を数回着用してください。
- 空のカートリッジホルダーを取り外し、ロードされたカートリッジホルダーを挿入します。あなたが解雇するカートリッジはカートリッジホルダーの底部(6時位置)に配置されるように、カートリッジホルダーを進める。ここでタマネギの部分を撮影するとバックグラウンド蛍光の陰性コントロールのフォームが用意されています。
- 上向きにタマネギの最も内側の層を持つ空のペトリ皿の中央にタマネギのピースを置きます。ペトリ皿上に遺伝子銃の銃身のライナーを置き、トリガーを引きながらサイドボタンを押したままにして拳銃を発射する。湿った3MM濾紙を含むペトリ皿に砲撃タマネギを転送する。
- 次のカートリッジに進み、別のタマネギの部分を発生させます。玉ねぎ4〜5枚が撮影されるまで、この手順を繰り返します。各タマネギの部分は一度撮影されています。
- 別のプラスミドまたは異なるプラスミドの組み合わせを含むカートリッジを搭載した別のカートリッジホルダーに変更。バレルライナーを変更してくださいsはよく汚れを防止する。四から五タマネギの部分を撮影。
- 爆撃の後、perti皿にすべての玉ねぎを返します。蓋つきペトリ皿をカバーしています。乾燥を防ぐためパラフィルムでそれらをラップします。 16〜48時間、暗所で室温でタマネギの部分をインキュベートする。
- ヘリウムタンクから遺伝子銃をデタッチする前にガスと放出圧力をオフにします。ネジを外しバレルライナー、およびカートリッジのホルダーと(または未使用)使用済みカートリッジを取り外します。
- せっけん水とビーカーにそれらを沈めることによってカートリッジホルダーとバレルライナーのクリーニング。風呂のソニケーターにビーカーを置き、20分間超音波処理。その後、すべての石鹸の残留物を除去するために水ですすいでください。時間を70%エタノールでそれらを浸し、その後、ペーパータオルの上に乾燥させる。
V.観測
- 室温で16〜20時間砲撃タマネギの部分をインキュベートした後、我々は本研究で使用されているようなツァイスAxioはObserver.z1として蛍光顕微鏡を用いてGFPまたはYFPの蛍光を観察することができます。
- タマネギの内側の表皮(直接砲撃中に銃を向く層)から単一細胞層皮をゆっくりと平らな端部と鉗子を使用してください。スライド上の水滴の上に皮を置きます。カバースリップを追加しますが、気泡を最小限に抑えるように注意してください。
- 顕微鏡の明視野の下、最初の細胞が生きていることを確認するために細胞質流動を確認してください。そのためには、色素の移動を探してからタマネギの組織をウォームアップする数分間明るい場光にスライドを公開して。細胞質流動は、常に参照することは容易ではない、ので、何も表示されない場合落胆されません。
- 蛍光検出の場合は、GFPまたはYFPのために適切な励起および検出フィルタを使用してください。このような非蛍光性プラスミドで撮影タマネギピースなどのネガティブコントロールを含めることは重要である。かすかな黄色の信号が傷ついた細胞、気泡、または破片から表示されることがあります。ポジティブコントロールを含めることも重要です。このような35Sのようなプラスミドを含む恒常的に発現蛍光レポーター::GFPは、優秀なポジティブコントロールです。タマネギ表皮細胞(図1A、D)から見えるGFPシグナルは、カートリッジ、タマネギの組織、および遺伝子銃の発砲が適切に準備され、実行されていることが示された。 :SEU - pSPYNEと35S:::LUH - pSPYCEのDNAはその後、我々は、35Sの混合物を含むカートリッジが殺到タマネギの部分でSEU - pSPYNEとLUH - pSPYCE間の相互作用を観察した。かすかなYFPの蛍光が核内に一緒に分割YFPの断片をもたらしたSEUとLUH間の直接的な物理的相互作用を示し、(図1のB、E)のみ核内に観察された。 :GFP:BiFCからYFPシグナルは35SからGFPの信号よりもはるかに弱いことに注意してください。
代表的な結果
我々の研究では35S、ここで報告::GFP陽性対照はプラスミド核と細胞質(図1A、D)の両方を含むセル全体を塗りつぶし、強い蛍光を発します。 GFPタンパク質は核局在化シグナルなしに核内に拡散するのに十分小さいです。対照的に、SEUとLUHは、以前に酵母two - hybridアッセイ2に相互作用するように、2つのシロイヌナズナの転写因子です。 SEU - pSPYNE(SEUはYFPのN末端 フラグメントに融合)とLUH - pSPYCE(SEUはYFPのN末端 フラグメントに融合)、核内に拡散するには大きすぎるの両方、核局在化シグナル2,5が含まれています。タマネギの細胞核(図1 B、E)で検出されたYFP蛍光シグナルは、SEU - pSPYNEとLUH - pSPYCEはタマネギの核で対話できることを示します。いいえ蛍光シグナルがYFPとLUH - pSPYCE(図1C、F)のN末端フラグメントを含有するベクタープラスミドpSPYNEのプラスミド混合が殺到玉ねぎに検出されない。
BiFC介したYFPの蛍光は35SからGFPを介した蛍光よりもかなり弱いです::GFPプラスミド。私たちの研究では、彼らはまた、(Bと図1Aと比較)異なる細胞内局在性を示した。両方のパートナーのプラスミドが正常に入力すると、同じタマネギの細胞で発現しているときにBiFCのみ動作としてさらに、蛍光細胞の数は、BiFC著しく低いのが特色です。
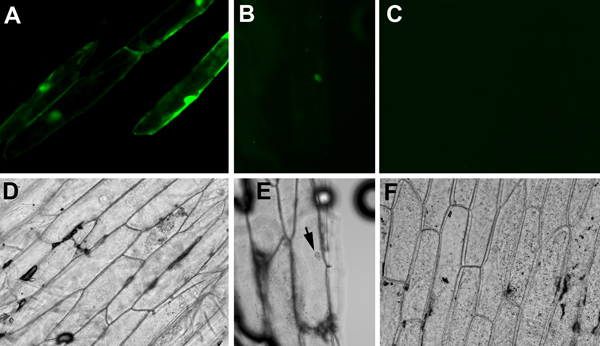
図1蛍光(A、B、C)と明視野(D、E、F)タマネギの細胞のイメージが異なるプラスミドコンストラクトが殺到。 (A)と(D)、タマネギの細胞は、35Sが殺到::GFP。 GFPは細胞質と核外を通して拡散する。 (B)と(E)、タマネギの細胞は、35Sの等モルミックスが殺到::SEU - pSPYNE(SEUはYFPのN末端フラグメントに融合)し、35S::LUH - pSPYCE(LUHは、C -末端断片に融合)プラスミドDNA。 SEU - pSPYNEとLUH - pSPYCE間の相互作用を蛍光核によって示されています。 (C)と(F)、ベクターpUC19 - SPYNEとLUH - pSPYCE plasmiのミックスが殺到タマネギの細胞を示す陰性対照DS。いいえ蛍光信号が検出されていません。
ディスカッション
- :GFPまたは35S:::GUS、初めてユーザーのために、我々は、35Sのような単一のプラスミド構成レポーターで、カートリッジの準備から観察するために、全体の手順を練習することをお勧めします。我々は、35Sを使用::プラスミドGFPは、博士から入手。スティーブ山と小寧張6(図1A、D)。 RioRad(猫165〜2244)で販売して遺伝子のショットコントロールのカートリッジは、植物には適していませ?...
開示事項
謝辞
我々は、博士に感謝する。 35S用のスティーブマウントと小寧張::GFP pGlowbug構造とHokensen博士フェローシップCH研究にZ. L'の研究室では、米国国立科学財団(IOB0616096とMCB0744752)によってサポートされています。 ZLは部分的にメリーランド州農業試験場の大学によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Yellow onion | Any Supplier | ||
| Helios Gene Gun | Bio-Rad | ||
| Fluorescent microscope with appropriate filters for GFP or YFP | Zeiss, Nikon, Olympus |
参考文献
- Hu, C. D., Chinenov, Y., Kerppola, T. K. Visualization of interactions among bZIP and Rel family proteins in living cells using bimolecular fluorescence complementation. Mol Cell. 9 (4), 789-789 (2002).
- Sitaraman, J., Bui, M., Liu, Z. LEUNIG_HOMOLOG and LEUNIG perform partially redundant functions during Arabidopsis embryo and floral development. Plant Physiol. 147 (2), 672-672 (2008).
- Walter, M. Visualization of protein interactions in living plant cells using bimolecular fluorescence complementation. Plant J. 40 (3), 428-428 (2004).
- Woods, G., Zito, K. Preparation of gene gun bullets and biolistic transfection of neurons in slice culture. J Vis Exp. , (2008).
- Azhakanandam, S., Nole-Wilson, S., Bao, F., Franks, R. G. SEUSS and AINTEGUMENTA mediate patterning and ovule initiation during gynoecium medial domain development. Plant Physiol. 146 (3), 1165-1165 (2008).
- Zhang, X. N., Mount, S. M. Two alternatively spliced isoforms of the Arabidopsis SR45 protein have distinct roles during normal plant development. Plant Physiol. 150 (3), 1450-1450 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved