このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
実験的転移とCTLの養子移入免疫療法のマウスモデル
要約
腫瘍細胞- T細胞相互作用の分析のための実験的肺転移とCTL免疫療法のマウスモデル in vivoで。
要約
実験的転移のマウスモデルは、生理学的に関連はまだシンプルと転移モデルです。循環の生存率、遠位臓器の血管外漏出と植民地化:腫瘍細胞は腫瘍細胞自然転移の最後のステップに似て、それによって、マウスの尾静脈に(IV)静脈内に注射し、肺に植民地化されています。遠位臓器で確立された転移性腫瘍:治療の目標はしばしば転移のエンドポイントであるので、治療的観点から、実験的転移モデルは最も単純で理想的なモデルです。このモデルでは、腫瘍細胞は、マウスの尾静脈に静脈注射し、肺に植民地化と拡張されます。腫瘍特異的CTLは、その後、転移、担癌マウスに静脈注射されています。肺転移の数と大きさが注入される腫瘍細胞の数と腫瘍の成長の時間によって制御することができます。したがって、転移の様々な段階では、広範な転移への最小限の転移から、モデル化することができます。肺転移は、このように簡単に目視観察および定量を可能に、インクでインフレによって分析されています。
プロトコル
1。実験的転移モデルマウス
- 腫瘍細胞の注射の前日に、シードone T75フラスコ上で1 × 10 7〜急成長中の腫瘍細胞を得るために、10%血清を含むRPMI培地10mLに細胞をCMS4 - MET。 37℃で一晩インキュベート℃、
- 注射の日に、培地を除去し、PBSで細胞を1回洗い流した後、37℃で0.05%トリプシン- EDTAで腫瘍細胞を収穫℃で5分間。 10%血清を含むRPMI培地10mlで反応を停止します。コニカルチューブに細胞を移す。
- 室温で3分間ソーバルレジェンドRT遠心機で1300 rpmで細胞をスピンダウン。上清を取り除く。洗浄に10mLの新鮮な1X HBSSで細胞を再懸濁し、再度スピンダウンと同じように再懸濁します。
- 血球計算板上で腫瘍細胞を数える。それぞれの注入に必要な細胞を100μLの全体積に再懸濁しているように、HBSSで細胞を希釈する。
- 尾静脈を拡張させるために温水に浸漬ビーカーに6〜8週齢のBALB / cマウスを温める。ベンチ上で尾静脈の現像抑制剤の上にマウスを置きます。外側尾静脈内に腫瘍細胞を100μLを注入するためにマイクロシリンジを使用してください。感染を避けるために、無菌操作を使用してください。出血が停止するまで注入した後、注射部位にわずかな圧力を適用する。
- ケージにマウスを返し、そして腫瘍が目的の段階に成長することができます。
2。細胞傷害性Tリンパ球(CTL)の養子移入免疫療法
- 移転の日に、精製されたT -リンパ球細胞傷害性、またはCTLは、テキストで説明したように調製を再懸濁するために上下にピペッティングし。つのプレートから15 mLコニカルチューブに細胞のすべてを譲渡する、ボリュームがチューブの2 / 3以上を超えてさせることではない。
- コニカルチューブに滅菌パスツールピペットを挿入し、総容量は14 mLのに近づくまで、セルの下に、リンパ球分離媒体、またはLSMを置く。
- 層を乱さないように注意してください。室温で20分間2000rpmで遠心する。スピンした後ローターを減速させるブレーキを使用しないでください。
- 新しい15 mLコニカルチューブにCTLを転送する。洗浄に約10mlの体積にHBSSを追加。
- 細胞を数える。室温で5分間1300 rpmでスピンダウン。 100μLに注入あたりの総容積を保ち、注射のために必要な細胞密度にHBSSに再懸濁します。
- 担癌マウスにCTLを注入する前のこのビデオで見たのと同じテールのインジェクションの手法を使用してください。
- ケージにマウスを返す、とCTLsは腫瘍と対話することができます。マウスは、通常14-21日CTL治療後の分析のために犠牲にされています。
3。肺転移の可視化
- 肺転移を可視化するために、発泡スチロールのボードに、その裏に犠牲にマウスを置きます。気管に遮るもののないアクセスを確保するために足を固定。 70%エタノールで腹側を吹き付けます。
- 半ば腹部から始まる、正中線に沿って、胸郭を介して、とまで唾液腺に向かってカットするはさみを使用してください。気管を公開。気管の周囲の組織を削除するには、ピンセットを使用してください。
- 気管の下に200μLピペットの先端を通します。片手で先端を保持する、静かに体から気管を持ち上げて。
- プラットフォームを180 °回転させる。気管から肺にインドのインクを注入するために50mLのシリンジを使用してください。あなたが強い抵抗を感じるまで、完全にインクで肺を膨らませる。
- 気管をカットするはさみを使用してください。肺の下にピンセットをスライドさせ、それらをマウスから持ち上げます。水の1Lビーカーに簡単に肺をすすいでください。
- 化学煙フードでは、フェケテの液5 mLを含有するガラスシンチレーションバイアルに肺を転送する。腫瘍組織は、数分後に黒の肺に白い結節として現れるだろう。腫瘍は、現在カウントし、無期限にフェケテのソリューションに格納することができます。
4。視覚による肺の代表的な転移
- ここでは、乳癌細胞株4T1を注入したマウスからの肺には腫瘍を示す白い斑点を示す。 IRF8ドミナントネガティブ変異体K79Eでトランスフェクトした4T1細胞を注入したマウスは、腫瘍細胞の拡張された転移能を示す。
- これらのイメージは、CTLの養子移入免疫療法の有効性の組織学的分析を示しています。生理食塩水を注射した担癌マウスでは、黄色の矢印()で示される、6日後に複数の腫瘍を認めた。腫瘍特異的T細胞を注射したマウスは、その一方で、腫瘍(B)の減少を示した。
- 同じ実験では、インドのインクの治療は、CTL養子免疫伝達の有効性を測定する簡単な方法を提供します。ここでは、担癌肺の白い腫瘍結節は、明らかに成功したCTLの養子移入を受けた肺からそれらを区別し、結節を数える度を可能に組織学と定量の可能性ではない。
5。代表的な結果
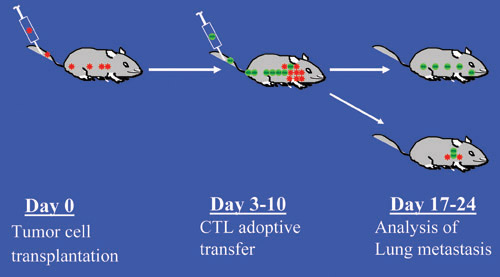
図1実験的な腫瘍転移およびCTL適応転送免疫療法のマウスモデルの実験スキーム。赤い点は、腫瘍細胞と緑のドットはCTLを示して示している。
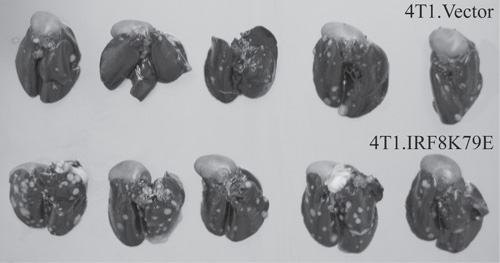
図2。IRF8機能の破壊は、腫瘍細胞の転移能を増強した。マウス乳癌細胞株4T1は安定してベクトル(4T1.Vector)またはIRF8ドミナントネガティブ変異体K79E(4T1.IRF8K79E)(15,16)を発現ベクターでトランスフェクトした。腫瘍細胞は、マウスの外側尾静脈に静脈注射された。腫瘍のある肺は腫瘍結節を視覚化するインドのインクで膨らませていた。腫瘍結節は、簡単に黒の肺組織の背景に白い斑点として見られている。
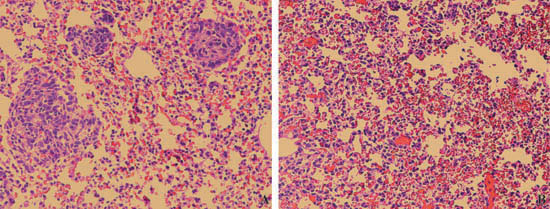
図3。CTLの養子移入免疫療法の有効性の組織学的分析。マウス肉腫細胞株CMS4 - Metはマウス側面尾静脈に静脈注射した。三日後、生理食塩水()または腫瘍特異的T細胞は、(B)担癌マウスに注入した。肺は6日、従来のH&E組織染色により、CTL治療後に分析した。腫瘍結節は、矢印で示されている。

図4。水墨インフレによる腫瘍結節の可視化。マウス肉腫細胞株CMS4 - Metはマウス側面尾静脈に静脈注射した。三日後、生理食塩水(コントロール)または腫瘍特異的T細胞は、(+ CTL)担癌マウスに注入した。肺は14日CTL治療後に分析した。腫瘍結節ている白い点は、、CTL治療の有効性を簡単に定量化が可能になります。
開示事項
マウスは、国立癌研究所(Friderick、MD)から購入し、ジョージア州の動物施設の医科大学に収容された。実験と医療/福祉は連邦政府の規制との契約とグルジアIACUC委員会の医科大学によって承認されたプロトコルでいた。
謝辞
国立衛生研究所(KLへCA133085)と米国癌学会からの補助金(KLにRSG - 09 - 209 - 01 - TBG)によってサポートされています。
資料
ソリューション:
インドのインク液(17):
- 250mlのフラスコに蒸留水150mlを注ぐ。
- 4滴を蒸留水に水酸化アンモニウムを追加。
- アンモニアと水の混合物に30ミリリットルインドのインク株式(すなわちサンフォードブラックマジック防水ドローイングインク4465アイテム44011)を追加します。
- 200mlの量を蒸留水で仕上げる。解決策は、注射の準備ができています。
フェケテのソリューション(17):
フェケテのソリューションは、正常組織の背景を黒から白の腫瘍結節を区別するために漂白剤墨汁-水増し担癌肺に使用されます。
- 1Lガラス瓶に350ミリリットルの95%EtOHを追加します。
- 150ミリリットルの蒸留水を追加します。
- 50ミリリットルホルムアルデヒドを追加
- 25ミリリットルの氷酸性酸を追加
参考文献
- Ryan, M. H., Bristol, J. A., McDuffie, E., Abrams, S. I. Regression of extensive pulmonary metastases in mice by adoptive transfer of antigen-specific CD8(+) CTL reactive against tumor cells expressing a naturally occurring rejection epitope. J Immunol. 167 (8), 4286-4292 (2001).
- Caldwell, S. A., Ryan, M. H., McDuffie, E., Abrams, S. I. The Fas/Fas ligand pathway is important for optimal tumor regression in a mouse model of CTL adoptive immunotherapy of experimental CMS4 lung metastases. J Immunol. 171 (5), 2402-2412 (2003).
- Liu, K., Caldwell, S. A., Greeneltch, K. M., Yang, D., Abrams, S. I. CTL Adoptive Immunotherapy Concurrently Mediates Tumor Regression and Tumor Escape. J Immunol. 176 (6), 3374-3382 (2006).
- Yang, D., Stewart, T. J., Smith, K. K., Georgi, D., Abrams, S. I., Liu, K. Downregulation of IFN-gammaR in association with loss of Fas function is linked to tumor progression. International journal of cancer. 122 (2), 350-362 (2008).
- Pages, F., Berger, A., Camus, M. Effector memory T cells, early metastasis, and survival in colorectal cancer. N Engl J Med. 353 (25), 2654-2666 (2005).
- Galon, J., Costes, A., Sanchez-Cabo, F. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science. 313 (5795), 1960-194 (2006).
- Strater, J., Hinz, U., Hasel, C. Impaired CD95 expression predisposes for recurrence in curatively resected colon carcinoma: clinical evidence for immunoselection and CD95L mediated control of minimal residual disease. Gut. 54 (5), 661-665 (2005).
- Camus, M., Tosolini, M., Mlecnik, B. Coordination of intratumoral immune reaction and human colorectal cancer recurrence. Cancer research. 69 (6), 2685-2693 (2009).
- Dudley, M. E., Wunderlich, J. R., Yang, J. C. Adoptive cell transfer therapy following non-myeloablative but lymphodepleting chemotherapy for the treatment of patients with refractory metastatic melanoma. J Clin Oncol. 23 (10), 2346-2357 (2005).
- Srivastava, M. K., Sinha, P., Clements, V. K., Rodriguez, P., Ostrand-Rosenberg, S. Myeloid-derived suppressor cells inhibit T-cell activation by depleting cystine and cysteine. Cancer research. 70 (1), 68-77 (2010).
- Nagaraj, S., Gabrilovich, D. I. Tumor escape mechanism governed by myeloid-derived suppressor cells. Cancer research. 68 (8), 2561-2563 (2008).
- Nguyen, D. X., Bos, P. D., Massague, J. Metastasis: from dissemination to organ-specific colonization. Nature reviews. 9 (4), 274-284 (2009).
- Heijstek, M. W., Kranenburg, O., Rinkes, B. o. r. e. l., H, I. Mouse models of colorectal cancer and liver metastases. Digestive surgery. 22 (1-2), 1-2 (2005).
- Yang, D., Ud Din, N., Browning, D. D., Abrams, S. I., Liu, K. Targeting lymphotoxin beta receptor with tumor-specific T lymphocytes for tumor regression. Clin Cancer Res. 13 (17), 5202-5210 (2007).
- Yang, D., Thangaraju, M., Browning, D. D. IFN Regulatory Factor 8 Mediates Apoptosis in Nonhemopoietic Tumor Cells via Regulation of Fas Expression. J Immunol. 179 (7), 4775-4782 (2007).
- Yang, D., Thangaraju, M., Greeneltch, K. Repression of IFN regulatory factor 8 by DNA methylation is a molecular determinant of apoptotic resistance and metastatic phenotype in metastatic tumor cells. Cancer research. 67 (7), 3301-3309 (2007).
- Wexler, H. Accurate identification of experimental pulmonary metastases. Journal of the National Cancer Institute. 36 (4), 641-645 (1966).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved