È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Metastasi sperimentale e CTL adottivi Immunoterapia modello di trasferimento del mouse
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Una metastasi al polmone sperimentale e CTL modello murino immunoterapia per l'analisi delle cellule tumorali interazione cellule-T In vivo.
Abstract
Sperimentale modello murino metastasi è un modello metastasi semplice ma fisiologicamente rilevanti. Le cellule tumorali vengono iniettate per via endovenosa (iv) nelle vene coda di topo e colonizzare nei polmoni, quindi, che assomiglia le ultime fasi della metastasi delle cellule tumorali spontanea: la sopravvivenza nel stravaso circolazione, e la colonizzazione negli organi distali. Da un punto di vista terapeutico, il modello sperimentale metastasi è il modello più semplice e ideale, poiché l'obiettivo delle terapie è spesso il punto finale di metastasi: stabilito tumore metastatico nell'organo distale. In questo modello, le cellule tumorali vengono iniettate nelle vene iv coda di topo e ha permesso di colonizzare e crescere nei polmoni. CTL tumore-specifici sono poi iniettate iv in metastasi portante del mouse. Il numero e le dimensioni delle metastasi polmonari possono essere controllati in base al numero delle cellule tumorali da iniettare e il momento della crescita tumorale. Pertanto, le varie fasi di metastasi, da metastasi minimo metastasi estese, possono essere modellati. Metastasi polmonari vengono analizzati con l'inflazione con l'inchiostro, permettendo così più facile l'osservazione visuale e la quantificazione.
Protocollo
1. Modello sperimentale Metastasi mouse
- Il giorno prima della iniezioni di cellule tumorali, semi di uno T75 fiasco con un massimo di 1 x 10 7 CMS4-Met cellule in 10 ml di terreno RPMI contenente il 10% del siero per ottenere cellule tumorali in rapida crescita. Incubare per una notte a 37 ° C.
- Il giorno di iniezione, rimuovere il terreno e lavare le cellule una volta con PBS e poi raccogliere le cellule tumorali con il 0,05% tripsina-EDTA a 37 ° C per 5 minuti. Arrestare la reazione con 10 ml di medium RPMI contenente 10% siero. Trasferire le cellule in una provetta conica.
- Spin giù le cellule a 1300 rpm in una centrifuga Sorvall Legenda RT per 3 minuti a temperatura ambiente. Rimuovere il surnatante. Risospendere le cellule in 10 ml fresca 1X HBSS da lavare, poi girare di nuovo e risospendere nello stesso modo.
- Contare le cellule tumorali in un emocitometro. Diluire le cellule in HBSS, in modo che le cellule necessarie per ogni iniezione vengono risospese in un volume totale di 100 ul.
- Caldo della settimana 6-8 vecchi topi BALB / c in un bicchiere immerso in acqua calda per dilatare la vena della coda. Posizionare il mouse su un dispositivo di immobilizzazione coda vena in panchina. Utilizzare una microsiringa di iniettare 100 l di cellule tumorali nella vena della coda laterale. Utilizzare una tecnica asettica per evitare l'infezione. Dopo l'iniezione, applicare una leggera pressione al sito di iniezione fino a sanguinamento si è fermato.
- Ritorna il mouse per la gabbia, e permettere al tumore di crescere allo stadio desiderato.
2. Linfociti T citotossici (CTL) Immunoterapia trasferimento adottivo
- Il giorno del trasferimento, pipetta su e giù per risospendere citotossici purificato linfociti T, o CTL, preparato come descritto nel testo. Trasferire tutte le celle da una piastra in una provetta da 15 ml conica, non lasciando che il volume di superare più di 2 / 3 del tubo.
- Inserire una pipetta Pasteur sterile nel tubo conico e laici Media linfociti separazione, o LSM, sotto le cellule fino a quando il volume totale si avvicina 14 mL.
- Fare attenzione a non disturbare gli strati. Centrifugare a 2000 rpm per 20 minuti a temperatura ambiente. Non utilizzare il freno per rallentare il rotore dopo la filatura.
- Trasferire il CTL di un nuovo tubo 15 ml. Aggiungi HBSS ad un volume di circa 10 ml per il lavaggio.
- Contare le cellule. Spin down a 1300 rpm per 5 minuti a temperatura ambiente. Risospendere in HBSS alla densità cellulare richiesto per preparazioni iniettabili, mantenendo il volume totale per iniezione a 100 ul.
- Utilizzare la stessa tecnica di iniezione coda come si è visto in precedenza in questo video per iniettare il CTL in topi portatori di tumore.
- Ritorna il mouse per la gabbia, e consentire al CTL di interagire con il tumore. I topi sono di solito sacrificati per l'analisi di 14-21 giorni dopo il trattamento CTL.
3. Visualizzazione delle metastasi polmonari
- Per visualizzare metastasi polmonari, posto un topo sacrificato sulla sua schiena su una tavola di polistirolo. Pin le gambe per garantire libero accesso alla trachea. Spruzzare il lato ventrale con il 70% di etanolo.
- A partire dalla metà addome, usare le forbici per tagliare lungo la linea mediana, attraverso la cassa toracica, e in alto verso le ghiandole salivari. Esporre la trachea. Usare pinze per rimuovere tessuti circostanti la trachea.
- Filetto da 200 microlitri punta della pipetta sotto la trachea. Tenendo la punta con una mano, sollevare delicatamente la trachea e lontano dal corpo.
- Ruotare la piattaforma 180 °. Utilizzare una siringa da 50 ml per iniettare inchiostro India nei polmoni attraverso la trachea. Completamente gonfiare i polmoni con l'inchiostro fino a sentire una forte resistenza.
- Usare le forbici per tagliare la trachea. Far scorrere un paio di pinze sotto i polmoni e sollevare fuori del mouse. Sciacquare i polmoni brevemente in un bicchiere da 1 litro d'acqua.
- In una cappa, trasferire i polmoni di una fiala di scintillazione in vetro contenente 5 ml di soluzione di Fekete. Il tessuto tumorale emergerà come noduli bianco sui polmoni nero dopo pochi minuti. I tumori possono essere contati e conservati in soluzione Fekete a tempo indeterminato.
4. Metastasi Rappresentante in Polmoni Visualized
- Qui, i polmoni di topi che sono stati iniettati con 4T1 carcinoma mammario linea mostrare macchie bianche che indicano i tumori. I topi che sono stati iniettati con cellule 4T1 trasfettate con un dominante negativo IRF8 K79E mutante mostrano il potenziale maggiore metastatico delle cellule tumorali.
- Queste immagini mostrano una analisi istologica di efficacia del trasferimento CTL immunoterapia adottiva. Portatori di tumore nei topi iniettati con soluzione salina ha mostrato tumori multipli dopo 6 giorni, indicato da frecce gialle (A). I topi iniettati con tumore-specifiche cellule T, invece, ha mostrato una riduzione dei tumori (B).
- Nello stesso esperimento, il trattamento con inchiostro di china offre un modo semplice per misurare l'efficacia di CTL trasferimento adottivo. Qui, i noduli tumorali bianco su portatori di tumore dei polmoni distinguerli nettamente dai polmoni che hanno superato con successo CTL trasferimento adottivo, e contando i noduli permette un gradodi quantificazione non è possibile con istologia.
5. Rappresentante Risultati
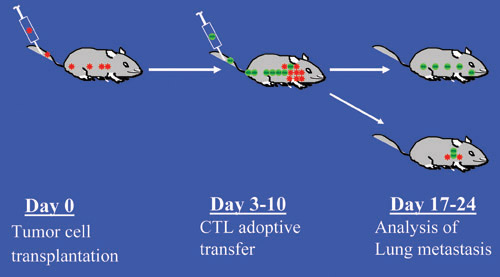
Figura 1. Schema sperimentale a fini sperimentali o metastasi tumorali e CTL modello di trasferimento di adattamento immunoterapia del mouse. I punti rossi indicano le cellule tumorali e puntini verdi indicano CTL.
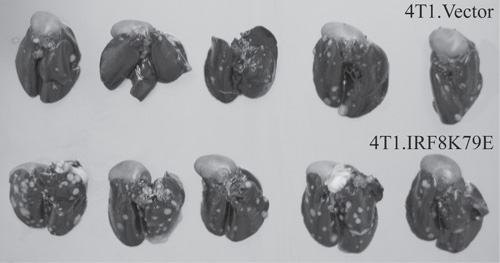
Figura 2. Turbativa di IRF8 funzione migliorato il potenziale metastatico delle cellule tumorali. Carcinoma mammario del topo 4T1 linea cellulare è stata stabilmente transfettate con vettore (4T1.Vector) o vettoriale che esprime uno IRF8 dominante negativo mutante K79E (4T1.IRF8K79E) (15, 16). Le cellule tumorali sono state iniettate nelle vene iv coda di topo laterale. Portatori di tumore polmonare sono stati gonfiati con inchiostro di china di visualizzare noduli tumorali. Noduli tumorali sono facilmente visibili come macchie bianche sullo sfondo nero del tessuto polmonare.
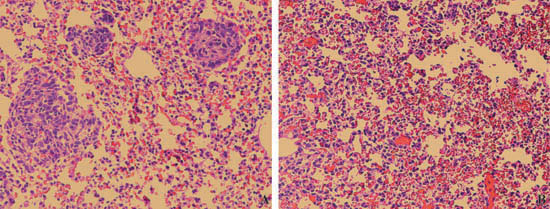
Figura 3. Analisi istologica di efficacia del trasferimento CTL immunoterapia adottiva. Sarcoma linea di topi cellule CMS4-Met è stato somministrato per via endovenosa nelle vene coda di topo laterale. Tre giorni dopo, soluzione salina (A) o tumore-specifica delle cellule T (B) sono state iniettate in topi portatori di tumore. I polmoni sono stati analizzati sei giorni dopo il trattamento convenzionale con CTL colorazione H & E istologici. Noduli tumorali sono indicati da frecce.

Figura 4. Visualizzazione di noduli tumorali dall'inflazione inchiostro di china. Sarcoma linea di topi cellule CMS4-Met è stato somministrato per via endovenosa nelle vene coda di topo laterale. Tre giorni dopo, soluzione salina (controllo) o tumore-specifica delle cellule T (+ CTL) sono state iniettate in topi portatori di tumore. I polmoni sono stati analizzati quattordici giorni dopo il trattamento CTL. Le macchie bianche, che sono noduli tumorali, consentono un facile quantificazione dell'efficacia del trattamento CTL.
Divulgazioni
Topi sono stati acquistati presso il National Cancer Institute (Friderick, MD) e ospitato nel Medical College of Georgia stabulario. Esperimenti e cura / benessere erano d'accordo con le normative federali e un protocollo approvato dal Medical College of Georgia IACUC commissione.
Riconoscimenti
Supportato anche da finanziamenti del National Institutes of Health (CA133085 a KL) e l'American Cancer Society (RSG-09-209-01-TBG a KL).
Materiali
Soluzioni:
India Soluzione d'inchiostro (17):
- Versare 150 ml di acqua distillata in un pallone da 250 ml.
- Aggiungere 4 gocce di idrossido di ammonio in acqua distillata.
- Aggiungere 30 ml di inchiostro magazzino India (cioè Sanford Black Magic impermeabile Ink Drawing 4465 Item 44011) per la miscela di ammoniaca e acqua.
- Top con acqua distillata per un volume di 200 ml. Soluzione è pronta per l'iniezione.
Soluzione di Fekete (17):
Fekete soluzione è usata per candeggina India ink-gonfiato portatori di tumore dei polmoni di distinguere noduli tumorali bianco sullo sfondo nero dei tessuti normali.
- Aggiungere 350ml EtOH 95% a bottiglia di vetro da 1 litro.
- Aggiungere 150 ml di acqua distillata
- Aggiungere 50 ml di formaldeide
- Aggiungere 25 ml di acido glaciale acida
Riferimenti
- Ryan, M. H., Bristol, J. A., McDuffie, E., Abrams, S. I. Regression of extensive pulmonary metastases in mice by adoptive transfer of antigen-specific CD8(+) CTL reactive against tumor cells expressing a naturally occurring rejection epitope. J Immunol. 167 (8), 4286-4292 (2001).
- Caldwell, S. A., Ryan, M. H., McDuffie, E., Abrams, S. I. The Fas/Fas ligand pathway is important for optimal tumor regression in a mouse model of CTL adoptive immunotherapy of experimental CMS4 lung metastases. J Immunol. 171 (5), 2402-2412 (2003).
- Liu, K., Caldwell, S. A., Greeneltch, K. M., Yang, D., Abrams, S. I. CTL Adoptive Immunotherapy Concurrently Mediates Tumor Regression and Tumor Escape. J Immunol. 176 (6), 3374-3382 (2006).
- Yang, D., Stewart, T. J., Smith, K. K., Georgi, D., Abrams, S. I., Liu, K. Downregulation of IFN-gammaR in association with loss of Fas function is linked to tumor progression. International journal of cancer. 122 (2), 350-362 (2008).
- Pages, F., Berger, A., Camus, M. Effector memory T cells, early metastasis, and survival in colorectal cancer. N Engl J Med. 353 (25), 2654-2666 (2005).
- Galon, J., Costes, A., Sanchez-Cabo, F. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science. 313 (5795), 1960-194 (2006).
- Strater, J., Hinz, U., Hasel, C. Impaired CD95 expression predisposes for recurrence in curatively resected colon carcinoma: clinical evidence for immunoselection and CD95L mediated control of minimal residual disease. Gut. 54 (5), 661-665 (2005).
- Camus, M., Tosolini, M., Mlecnik, B. Coordination of intratumoral immune reaction and human colorectal cancer recurrence. Cancer research. 69 (6), 2685-2693 (2009).
- Dudley, M. E., Wunderlich, J. R., Yang, J. C. Adoptive cell transfer therapy following non-myeloablative but lymphodepleting chemotherapy for the treatment of patients with refractory metastatic melanoma. J Clin Oncol. 23 (10), 2346-2357 (2005).
- Srivastava, M. K., Sinha, P., Clements, V. K., Rodriguez, P., Ostrand-Rosenberg, S. Myeloid-derived suppressor cells inhibit T-cell activation by depleting cystine and cysteine. Cancer research. 70 (1), 68-77 (2010).
- Nagaraj, S., Gabrilovich, D. I. Tumor escape mechanism governed by myeloid-derived suppressor cells. Cancer research. 68 (8), 2561-2563 (2008).
- Nguyen, D. X., Bos, P. D., Massague, J. Metastasis: from dissemination to organ-specific colonization. Nature reviews. 9 (4), 274-284 (2009).
- Heijstek, M. W., Kranenburg, O., Rinkes, B. o. r. e. l., H, I. Mouse models of colorectal cancer and liver metastases. Digestive surgery. 22 (1-2), 1-2 (2005).
- Yang, D., Ud Din, N., Browning, D. D., Abrams, S. I., Liu, K. Targeting lymphotoxin beta receptor with tumor-specific T lymphocytes for tumor regression. Clin Cancer Res. 13 (17), 5202-5210 (2007).
- Yang, D., Thangaraju, M., Browning, D. D. IFN Regulatory Factor 8 Mediates Apoptosis in Nonhemopoietic Tumor Cells via Regulation of Fas Expression. J Immunol. 179 (7), 4775-4782 (2007).
- Yang, D., Thangaraju, M., Greeneltch, K. Repression of IFN regulatory factor 8 by DNA methylation is a molecular determinant of apoptotic resistance and metastatic phenotype in metastatic tumor cells. Cancer research. 67 (7), 3301-3309 (2007).
- Wexler, H. Accurate identification of experimental pulmonary metastases. Journal of the National Cancer Institute. 36 (4), 641-645 (1966).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon