Method Article
の複合植物の世代ウマゴヤシtruncatula根粒形成のアッセイに使用
要約
私たちは、毛状根複合植物が困難な変換種で植物 - 根粒菌の相互作用と根粒形成を研究するために使用することができる方法を示していますウマゴヤシtruncatula。
要約
アグロバクテリウムのtumerfaciensと同様に、アグロバクテリウムリゾゲネスは、自律的なルート誘導(Ri)のプラスミド。A.に基づいて植物細胞に外来DNAを転送することができますリゾゲネスは、植物組織やフォームの変換後の複合植物の毛状根の形成を引き起こす可能性があります。芽はまだ非トランスジェニックいる間、エネルギーや成長支援を提供するために提供する、これらの複合の植物で、再生された根の一部は、野生型T - DNAと人工バイナリーベクターを有するトランスジェニック、です。これらの毛状根の複合植物が遺伝子組み換え種子を生成しませんが、植物の研究でこれらの複合植物は非常に便利なように重要な機能がいくつかあります。最初に、広い宿主範囲を持つ、A.リゾゲネスは 、様々な種の遺伝子工学を可能にする、特に多くの植物種、双子葉植物を変換することができます。第二に、A.リゾゲネスは、直接組織し、外植片に感染、形質転換前には組織培養では手に負えない植物種の形質転換に最適です、複合植物を得るためには必要ありません。また、トランスジェニックルートの組織は、数週間のうちに生成することができます。 ウマゴヤシtruncatulaの場合、我々は正常な花のディップシロイヌナズナ形質転換よりも速く、短く3週間でトランスジェニックルーツを取得することができます。全体的に、毛状根の複合プラントテクノロジーは、遺伝子の機能とルートに関連する、表現型を研究するために汎用性と有用なツールです。ここでは、毛状根複合植物が困難な変換種M.の植物-根粒菌の相互作用と根粒形成を研究するために使用することができる方法を示していますtruncatula。
プロトコル
以下のプロトコールは、モデルマメ科植物種M.の毛状根複合植物を生成するために使用されていますtruncatula。同様のプロトコルは、少なくとも8つの植物種1〜4の適応されている。我々はMを使用truncatula毛状根複合植物は根と根粒形成における遺伝子機能を研究する。毛状根複合植物を生成する2); 3)共生根粒菌の感染症、4)トランスジェニックのルートの識別を準備する植物材料の1):プロトコルは、以下の4つのセクションに分けられた。我々は、複合植物のトランスジェニックルート3をスクリーニングするためのレポーターとして緑色蛍光タンパク質(GFP)遺伝子を含むバイナリーベクターを使用していました。抗生物質ベースの選択と比較すると、GFPベースのスクリーニングは、迅速、簡単、かつ安価である。私たちの構造では、ER -発現に最適化されたGFP遺伝子は、トランスジェニックおよび非トランスジェニック根の間で容易に区別ができるように、トランスジェニック根に強力な構成的GFPシグナルを持っているスーパーユビキチンプロモーターによって駆動される。
1。植物材料の準備
- M. truncautlaの種子は、温室で栽培植物(相対湿度50%、16 / 8時間の明/暗、18分の22 ° C昼/夜温)から収穫されています。成熟した種子は4℃で保存することができます
- 約100種が定期的に振盪しながら10分間、10mlの濃硫酸(95から98パーセント、Sigma - Aldrich社、MO)でscarifiedされています。
- 種子は、穏やかに撹拌しながら滅菌水で5〜7倍をすすぐ。
- 種子を6時間室温で水に浸漬し、℃で36〜48時間の発芽を同期させるために4で保持されます。
- 約20〜30の種子をシャーレに入れ湿ったろ紙上に広げています。彼らは22℃に維持されています° Cを、μmol.m-2 8分の16時間明/暗サイクル、及び40で。s -1の光強度は、5-6日間。
- 発芽苗が土壌に移し、月に温室内に配置されています。
2。毛状根複合プラントの生成
- 関心のある遺伝子を運ぶのバイナリ構造はAに変換された標準プロトコルを使用してリゾゲネス 。我々はトランスジェニック組織のスクリーニングを容易にマーカーとしてGFP遺伝子を含むバイナリーベクターのセットを設計した。これらのベクターは、種々のプロモーターを含み、すべての過剰発現または標的遺伝子の3,5のサイレンシングのためのゲートウェイのクローニング部位を(Invitrogen社、カールスバッド、カリフォルニア州)がある。
- A.リゾゲネスは 28で適切な抗生物質選択と50ミリリットルのLB培地中で16〜24時間のためのCで培養される。
- 細菌は窒素を含まない植物の栄養液(表1と6)の= 0.3を採取し、OD 600の最終濃度に再懸濁されている。
- 毛状根の再生をサポートするために、滅菌支持マトリックス("ロックウール"、Hummertインターナショナル、アースシティ、MO)は約3 cm 3のプラグに切断される。我々一ペトリ皿に4プラグを置きます。
- 穴は、外植片の挿入を容易にするためのピペットチップを使用して、各プラグの上部につついている。A.リゾゲネス (5mL)を、各プラグインに追加されます。
- 2月3日腋芽で撮影セクションは斜めカットで切り出される。外植片は、プラグに挿入し、約3週間22℃で栽培されています。我々は、5mlの窒素フリーのソリューションに必要な水、それらを、その後、最初の10日間、水遣りせずにメディの外植片を保持。我々は、頂端分裂組織を削除すると不定根の形成を減少させるかもしれないことがわかった。
3。共生根粒菌(Sinorhizobium Meliloti)感染
- 3週間後、いくつかの不定根は、ロックウールから出てくる。毛状根複合プラントはロックウールの有無に関係なく、砂またはバーミキュライト(滅菌)に転送されます。彼らは22の温室で栽培されています° C、16 / 8時間の明/暗サイクル、および300μmol.m-2のもう1週間に-1光強度。
- 根粒菌感染症、S.の前にmeliloti 1201は、30 ° C(表2、および6,7)で7日間に50 mlの酵母エキス-マンニトール培地中で培養する。
- 再懸 根粒菌の細胞は窒素フリー栄養液を用いてOD 600の最終濃度= 0.08に希釈されています。 S.の10 mlの新鮮なサスペンションmelilotiは、結節形成を誘導するために各複合プラントに適用した。
4。トランスジェニックルートの識別
- 二週間根粒菌接種後、複合植物は水で洗浄することにより、最大-根ざしている。根は容易に水に砂やパーライトから分離することができる。
- 我々は、UV -顕微鏡(ニコンSMZ1500、励起460 - 500nmの、ダイクロイック505nm、510nm以上のバリア)の下に毛状根を置く。トランスジェニックのルーツは、GFP陽性であり、不定根はGFP陰性である。私たちは、その後、根accordinを収集するグラムGFPの信号、および、結節数をカウントルートの長さを測定し、側根の密度を計算する。 GFP陰性の根を対照として使用されています。
5。代表結果
私たちの実験では、新しい毛根はA.後2-3週間で外植片から再生するリゾゲネス innoculation。 UV -顕微鏡下で、GFP遺伝子を有するトランスジェニックルーツは強い緑色の蛍光(図1)を示す。再生ルーツとGFP陽性の根の部分の量は、外植片と複合plants.Onの平均の生育環境の条件に依存し、生成された根の25%が遺伝子組み換え毛状根3であった。形質転換効率、1)を高めるためにとしてビデオに表示されているプラスチックのカバーの運命は、、最初の数日間のための成長のトレイの湿度を維持するのに十分であり、そして植物は最初の数日間で少し水を必要とする。過度の水遣りは、毛状根の形成に有害である、2) アグロバクテリウム innoculantの濃度は形質転換のために重要です。細胞の過剰な量は、毛状根の形成や結節形成に有用ではない。結節形成のため、散水ソリューションは窒素フリーにする必要がある、そうでなければ、いくつかの結節が形成されます。
毛状根複合植物を原料として子葉またはentactの苗を使用して生成することができます。上記のプロトコルのマイナーな修正だけでは、他の組織8から毛状根を生成するためにncessaryです。重要なのは、それぞれの毛状根は、独立した形質転換事象です。したがって、一つの複合プラントにおいて観察された表現型は、複数のコンポジット工場で繰り返しによって確認するために必要ないくつかのtransforamtionイベントの合計です
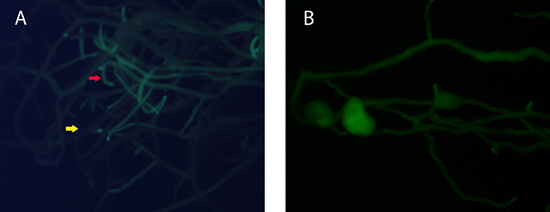
図1。 A.トランスジェニックルーツは、毛状根からソートすることができます。 B.の結節は、毛状根複合植物に形成された。我々は、4週齢のMを配置するUV -顕微鏡とGFP陽性の根の下にtruncatula毛状根の植物は簡単に識別することができます。 (赤矢印:GFPのルート、黄色矢印:非GFPのルート)
| 在庫切れ | g/200ml | mlストック/リットル |
| のMgSO 4 · 7H 2 O | 12.3 | 2 |
| のCaCl 2 · 2H 2 O | 14.7 | 4 |
| K 2 HPO 4 · 3H 2 O | 6.8 | 1 |
| K 2 SO 4 | 11 | 4 |
| 鉄塩素3 · 6H 2 O | 0.49 | 2.5 |
| 微量栄養素 | 下記参照してください。 | 1 |
| 微量栄養素 | リットル当たりのグラム |
| H 3 BO 3 | 0.142 |
| MnSO 4 H 2 O | 0.077 |
| ZnSO 4 · 7H 2 O | 0.1725 |
| のCuSO 4 .5 H 2 O | 0.037 |
| NaMoO 4。 H 2 O | 0.024 |
| のCoCl 2。 H 2 O | 0.0025 |
| NISO 4 | 0.001 |
表1。Nitogenフリー栄養液
| K 2 HPO4 | 0.5グラム |
| NaClの | 0.1グラム |
| し、MgSO 4 · 7H 2 O | 0.2グラム |
| 酵母エキス | 0.4グラム |
| マンニトール | 10グラム |
| pH値= 6.8 |
表2。酵母はマンニトール培地を抽出(1リットル当たり)
ディスカッション
毛状根の複合プラントを生成すると、多くの双子葉植物の種のトランスジェニック材料を大量に得るために迅速かつ容易な方法です。このメソッドは、トランスジェニック種子を生産することはできませんが、それは数週間でトランスジェニック材料を生成することができます。方法は困難組織培養の確立や、安定した形質転換体を生成している植物に特に適しています。長年にわたり、我々は、遺伝子機能、プロモーターの機能、マイクロRNA、根と側根の発達、防御と非生物的ストレス応答、根粒形成および他の共生のプロセス、ホルモン応答、メタボリックプロファイリング、遺伝子プロファイリング、プロテオーム解析の研究にこの技術を使用している、と他の生物学的プロセス。プロトコルは、堅牢で複製可能です。
開示事項
謝辞
著者は、私たちの研究室と博士に毛状根の技術を導入するための博士クリステイラー(オハイオ州立大学)に感謝したいと思います。 Senthil Subramanianは(サウスダコタ州立大学)、プロトコルを改善するためのファン張(魯東大学、中国山東省)。我々はまた、このビデオを作るのに役立つために博士ハオチェン(南京農業大学を)感謝。この作品は、OYにDOE(DE - SC0001295)、NSF(MCB - 0923779)とUSDA(2010-65116-20514)からの助成金によって部分的にサポートされています
参考文献
- Limpens, E., Ramos, J., Franken, C., Raz, V., Compaan, B., Franssen, H., Bisseling, T., Geurts, R. RNA interference in Agrobacterium rhizogenes-transformed roots of Arabidopsis and Medicago truncatula. J. Exp. Bot. 55, 983-992 (2004).
- Collier, R., Fuchs, B., Walter, N., Kevin, L. W., Taylor, C. G. Ex vitro composite plants: an inexpensive, rapid method for root biology. Plant J. 43, 449-457 (2005).
- Zhang, J., Subramanian, S., Stacey, G., Yu, O. Flavones and flavonols play distinct critical roles during nodulation of Medicago truncatula by Sinorhizobium meliloti. Plant J. 57, 171-183 (2009).
- Boisson-Dernier, A., Chabaud, M., Garcia, F., Becard, G., Rosenberg, C., Barker, D. G. Agrobacterium-rhizogenes-transformed roots of Medicago truncatula for the study of nitrogen-fixing and endomycorrhizal symbiotic associations. Mol. Plant-Microbe Interact. 14, 695-700 (2001).
- Zhang, J., Subramanian, S., Zhang, Y., Yu, O. Flavone synthases from Medicago truncatula are flavanone-2-hydroxylases and are important for nodulation. Plant Physiol. 144, 741-751 .
- Subramanian, S., Hu, X., Lu, G., Odelland, J., Yu, O. The promoters of two isoflavone synthase genes respond differentially to nodulation and defense signals in transgenic soybean roots. Plant Mol Biol. 54, 623-639 (2004).
- Vincent, J. . A manual for the practical study of root nodule bacteria International Biological Program Handbook. , 1-13 (1970).
- Subramanian, S., Graham, M. Y., Yu, O., Graham, T. L. RNA Interference of Soybean Isoflavone Synthase Genes Leads to Silencing in Tissues Distal to the Transformation Site and to Enhanced Susceptibility to Phytophthora sojae. Plant Physiol. 137, 1345-1353 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved