このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
培養中枢神経系ニューロンの樹状突起スパイン形態の解析
要約
数々の最近の研究では、脳の病理学に関連したシナプス蛋白の変異を同定した。初代培養皮質ニューロンは樹状突起スパイン形態と運動性にこれらの疾患関連タンパク質の影響を調べることで最大限の柔軟性を提供します。
要約
樹状突起スパインは脳内の興奮性の接続の大部分の部位であり、シナプスのシナプス後コンパートメントを形成する。これらの構造は、アクチンに富み、非常に動的であることが示されている。古典的なヘブ可塑性だけでなく、神経調節の信号に応答して、樹状突起は、神経回路と脳内の情報の処理と貯蔵の改良に重要であると考えられる形状と数を、変更することができます。樹状突起棘内で、タンパク質の複雑なネットワークでは、樹状突起スパイン形態と数の制御を可能にアクチンcyctoskeletonと細胞外シグナルにリンクします。神経病理学的研究は、統合失調症から、自閉症スペクトラム障害に至るまで、病気の状態の数は、、異常な樹状突起スパインの形態や数字を表示することが実証されている。また、最近の遺伝学的研究は、これらのタンパク質は、部分的に、これらの疾患の病態の根底にある異常な背骨の可塑性に寄与することが提案につながる、シナプスタンパク質をコードする多数の遺伝子の変異を同定した。樹状突起スパインの形態/数を制御することでこれらのタンパク質の潜在的な役割を研究するために、培養皮質ニューロンの使用は、いくつかの利点があります。まず、このシステムは、固定された細胞の樹状突起の高分解能イメージングだけでなく、生細胞のタイムラプスイメージングが可能になります。第二に、in vitroの系で、これは変異体タンパク質、shRNAコンストラクトによるノックダウン、または薬理学的治療の発現による蛋白質の機能を簡単に操作することができます。これらの技術は、研究者が疾患関連タンパク質の役割を分析すると、これらのタンパク質の変異が生体内で機能することができるかを予測し始めることができます。
プロトコル
ここで説明するプロトコルは、任意の初代培養系での樹状突起スパイン形態とダイナミクスを調べるために使用することができます。
1。一次皮質ニューロンの培養の準備
- グリア付きの無血清培地1-2のSprague - DawleyラットE18胚培養物から高密度の皮質ニューロンの培養を準備します。
- ACUC手順に従って、ある妊娠ラット(E18)を安楽死させる、すぐに氷の上に100ミリメートルペトリ皿の中で子宮(その中に胎児を持つ)と場所を削除する。
- 一鉗子で(臍帯無傷)首で胎児を保持後ろから前に剥離頭皮に別の鉗子を使用し、背面から前面への正中線に沿って傾け鋭いピンセットで開いている頭蓋骨をスリット、オープン子宮と羊膜を切り取ります。
- およびMg 2 +フリーHBSS -湾曲鉗子(スクープの動きで)と場所10mlの氷冷カルシウムを含む100mMペトリ皿の中で+で脳全体を削除します。
- one鉗子、別のピンセットを用い、別々の半球と脳幹を保持し、髄膜から皮質組織を剥がし海馬と線条体、別々の皮質と慎重に取り外します。
- プールは、皮質組織を解剖し、簡単にミンチし、4 mlを含む15 mlのチューブに移す予め温めておいたトリプシン/ EDTA(0.25%トリプシン、0.53 mMのEDTA; HyClone SH30042.01からHYQトリプシン)を37℃の水浴中でインキュベート〜 15分、1.5ミリリットル神経培地を追加し、使い捨てのプラスチック製のピペットを用いて可能な限りトリプシン/ EDTAを除去する。
- 5ミリリットルピペット(〜10ストローク、気泡の作成を避ける)で緩やかにピペッティングにより機械的に消化された組織を解離させ、15 mlのチューブに2 mlの上清を転送して、30秒のために解決できるように、2mlの培地を加える。
- (〜15分の合計約取るべきである)二回ステップ6を繰り返します。
- 2分間200グラムで細胞懸濁液をスピン。
- 上清を(5ミリリットルピペットと - 真空吸引しない)を取り外し、50 mlチューブに40μmのセルストレーナーを介して5 mlの培地とフィルターで再懸細胞ペレット、底に指を反転させることにペレットを緩めます。
- 10μlの細胞懸濁液と10μlのトリパンブルーを混ぜて、血球計数器で生存細胞を(トリパンブルー排除)カウント。
- 典型的な収量:5 × 10 6細胞/脳は、メッキのための所望の密度(例えば1.5 × 10 6細胞/ ml)に希釈する。
- ポリ- D -リジンでコートした18 mmの円形または22x22 mm角のカバースリップを含む(合計体積を引いたメッキのボリューム)、(:メッキのメディア(stretomycin Neurobasalメディアは2%B27、0.5 mMグルタミンおよび1%ペニシリンを補充)で培養プレートを埋めるは0.2 mg / mlの、シグマ)は、0.1 Mホウ酸緩衝液(3.1グラム/ Lホウ酸、4.8グラム/ Lホウ砂、pHは8.5、フィルター滅菌)に溶解し、12ウェルプレート= 0.8ミリリットル/ウェルの全体積を。
- 次のステップで提供される密度でプレートのニューロンは、ロッキング/タッピング穏やかで均一に細胞を分散させる。
- 、6ウェルプレート(HI -密度3 × 10 5 /ウェル= 857/mm 2)(半ば密度1.5 × 10 5 /ウェル= 430/mm 2):12ウェルプレート(3.5センチメートル2 /ウェル)のための(9.6センチメートル2 /ウェル):(HI -濃度9 × 10 5 /ウェル= 624/mm 2)(半ば密度4.5 × 10 5 /ウェル= 312/mm 2)。
- めっき後の一時間、(:stretomycin NeurobasalメディアはB27 2%、0.5mMのグルタミンおよび1%ペニシリンを添加した)、新鮮な培地ですべての培地を交換してください。いつでも細胞は乾燥させないよう注意して、細胞の破片は破片の除去を促進するために最初のウェル、スワールプレートの真ん中に定住する傾向があるので。
- 変更½その後培地回毎週(各ウェルから〜300〜350μlを削除し、そして400μlの各ウェルに新鮮な栄養培地を温めるの追加)。
オプション:DIV 4日200μMのD、培地を供給するL -アミノ酸- phosphonovalerateアミノ酸(D、L - APV、アセントサイエンティフィック)追加、2%B27、0.5 mMグルタミンおよび1%ペニシリンを添加したNeurobasal培地での培養神経細胞:stretomycinを+200μMのAPV。 - としてこの時間ポイントの樹状突起棘で、 試験管内 (DIV) で 24から28日間、皮質ニューロンの初代培養を育てるには(すなわち、それらがシナプス前のパートナーとの接続を形成する、と明確な頭部のような構造を持っている)成熟した形態を表示し、 3月4日げっ歯類における思春期に対応しています。 18mmの円形のカバースリップ上に成長させた神経細胞は、固定免疫染色、共焦点顕微鏡を用いて画像と樹状突起棘の詳細morphometeric分析のために使用される前に、薬理学的にtranfectedと治療することができます。 22x22 mm角のカバースリップ上で培養した細胞は、樹状突起スパインの動態を調査するタイムラプスイメージングの実験に使用することができます。
2。初代培養皮質ニューロンのトランスフェクション
- 皮質ニューロンは、2〜3日リポフェクタミン2000(Invitrogen社製)5を使用して実験する前にトランスフェクトされています。
- DMEM(ダルベッコ改変イーグル培地のpHのバランスを取ることによって"H - DMEMを"準備していない;はグルタミンを、10mMの滅菌HEPESとインビトロジェン11965〜092)(4 - (2 -ヒドロキシエチル)-1 - piperazineethanesulfonic酸; MediaTech Cellgro 25から060 - CI、1M、pHは7)。 37℃くらいまで温め
- 600/1000μL(18/22x22 mmのカバーガラス)予め温めておいた(37℃)加湿37℃インキュベーターで新しい抗生物質を含まない培地(Neurobasal培地、B27、0.5 mMのグルタミン)、インキュベート細胞、補足するためにカバースリップを転送する5%30分間CO 2を 。
- H - DMEM 50μlに、それぞれのカバーのために、DNAの定める金額を(構造に応じて1〜2μgのつまたは複数のDNAプラスミド、細胞の形態とタグ付けされた変異シナプスタンパク質を概説するなどpEGFPを)、追加5のために放置する分。
- それぞれのカバーのために、50μlのH - DMEM〜4 / 6μlの(18/22x22 mmのカバースリップ)リポフェクタミン2000を追加し、5分間放置する。
- 徹底的に、5%CO 2を添加した加湿37℃インキュベーターで少なくとも20分間維持し、手順1.3&1.4からチューブを混ぜる。コンプレックスは、メーカーによると、最大6時間までは安定である。
- ステップ1.5滴下から細胞にリポフェクトアミン2000/DNAの混合物を追加。 4時間、5%CO2、補充した加湿37℃インキュベーターで細胞をインキュベート。
- ステップ1.1(600分の300μl)を、予め温めておいたとサプリメントから栄養培地を用いて(37℃)800分の400μlの新鮮な栄養培地(18/22x22 mmのカバースリップ)。以下のステップ1.6、古いと新鮮な栄養培地を含む培地に移すのカバースリップ。
- プラスミドの発現は2〜3日間継続することができます。
3。初代培養皮質ニューロンの治療は、18 mmのカバースリップ上に成長
以前にトランスフェクトさ18 mmのカバースリップ上に成長させた神経細胞は、、また簡単に薬理学的治療に供することができる。
- ACSFを(;:125のNaCl、2.5 KClを、26.2のNaHCO 3、1のNaH 2 PO 4、11グルコース、5 HEPES、2.5 CaCl 2および200μMの1.25 MgCl 2の D、L - APV mMで人工脳脊髄液)を調製する。 37℃くらいまで温め30〜60分間900μlの暖かいACSFでプレインキュベートカバースリップ。阻害剤で前処理は、この期間中に行うことができます。
- 原液から10倍の作業濃度に薬理学的作用物質/車両を準備し、ACSFのソリューションの希釈を行う。注意深く細胞(1Xエージェント/車両の最終濃度〜1000μlの最終容量、)にエージェント/車両を追加し、治療が目的の時間5の上に運ぶことができます。
- 以下の治療(s)は、immunocytohistochemistryのセルとプロセスを修正。
4。固定とimmunocytohistochemistry(ICC)
- PBSで2倍洗浄に続いて室温で10分間、4%ホルムアルデヒド/室温で20分間、4%スクロースPBS(800μL)のいずれかで神経細胞を固定、または4%ホルムアルデヒドで/ 4%ショ糖PBS(800μL)、 、10分が4であらかじめ冷却した(-20℃)、メタノール(800μL)℃で修正が続くメタノール固定は、タンパク質を変性して沈殿させることによって動作します。この手順では、シナプス後密度(PSD)で、同様に脂質が豊富な地域でのタンパク質のアンマスクにつながります。
- 10分ごとに、PBS(800μL)、2倍、でカバーグラスを洗ってください。
- 透過処理し、室温で1時間、2%正常ヤギ血清と0.1%のTriton - X - 100を(800μl)を含むPBS中で同時に細胞をブロックする。
- 適切な濃度でPBSを含む2%正常ヤギ血清に、GFP、エピトープタグ(彼、MYC、V5など)または内因性タンパク質に対して生じた一次抗体を追加。 、15cmの皿を取るの正方形にそれを分割し、番号を付けて、そしてパラフィルムで覆う。下向きにして細胞を用いた抗体/ブロックのミックスへのパラフィルム(平方あたり1滴)、および場所のカバースリップに抗体とブロック混合物の約80μlを添加する。 4℃で一晩インキュベート。
- 15分ごとに3倍のPBSでカバーグラスを、洗う。
- 適切な濃度で2%正常ヤギ血清を含むPBSでアレクサ標識二次抗体(Invitrogen)を希釈する。光から保護1時間、室温で、手順3.4と同様に二次抗体をインキュベートする。
- 洗浄は、PBSでさらに3倍の15分をカバースリップ。
- 標準的な顕微鏡にカバースリップをマウントするゴールド褪色防止試薬(Invitrogen)を褪色を使用してスライド。
5。脊椎の形態の定量分析
我々は、シングルとツァイスLSM5パスカル共焦点顕微鏡を用いて二重染色ニューロン(細胞がGFPを発現し、関心の内因性タンパク質を構築するか)の共焦点画像を得る。すべてのイメージング実験は、その後の分析で結像されると使用される健康な錐体細胞を選択するために。健康な神経細胞は、ブレブ形成や治療または固定のために苦痛の兆候を表示しないと完全な、途切れない樹のあずまやを含むその細胞である。
- NA(numで63x油浸対物レンズを用いて神経細胞の画像(ツァイス)を取得する1.4 erical絞りは)、3-8画像のZシリーズとして、0.37μmの間隔で、セクションごとに2.5秒のスキャン速度で1024x1024のピクセルの解像度で、4回平均した。直接比較される文化は、同じ収集パラメータで撮像する必要があります。 10月20日神経細胞/条件、3-5別々の実験からそれぞれ、および神経細胞当たり100μmの2樹状突起を分析する必要があります。実験は、ブラインドと妹の文化で行われる必要があります。検出器のゲインを調整し、背骨の蛍光シグナルとバックグラウンドとの間の遷移が正確な定量を可能にする、シャープになるような樹状突起の周りにハローを、作成することがなくても薄暗い蛍光薄い棘を含むようにオフセット。取得パラメータ、同じ実験内のすべてのスキャンに対して同じしてください。
- GFPの画像は、488 nmで励起アルゴンレーザーのラインを、使用して505から530 nmのバンドパスフィルターで収集取得することができます。過剰発現するタンパク質または内因性タンパク質の画像アレクサ568二次抗体(インビトロジェン社)で免疫染色を543 nmでエキサイティングなHeNeレーザーを使用して収集、および560 nmのロングパスフィルターを使用して収集することができます。試料の退色を避けるために最小限にレーザーパワーをキープ。
- MetaMorphソフトウェア(モレキュラーデバイス社)を用いて、二次元、バックグラウンドサブトラクション、Zシリーズの画像の最大投影再構成は、形態学的分析および定量化のために使用されています。しきい値しきい値は棘の輪郭(図2E、F)に正確に対応した方法ですべての棘を含むようにして樹状突起の形態を調べるために、崩壊Zシリーズの画像を、必要な距離をキャリブレーション、と。唯一の二次と三次樹状突起上の棘(ニューロンごとに100μmの合計長さ)のばらつきを減らすために、測定されるべきである、とセグメントの測定は、分岐点との間で行われる必要があります。それは閉じた境界(図2G)になるように手動で各脊椎の概要を説明します。
- 背骨の長さ、背骨の幅広さ、断面積、および樹状突起棘線密度:MetaMorphで自動的に以下の背骨のパラメータを測定します。定量化のためにExcelに樹状突起スパイン形態学的パラメータをエクスポートします。 2群間の差の統計的有意性を決定するために学生の不対t検定を使用して、一方向ANOVAは、テューキー- B事後多重比較のために続いて、3つ以上のグループを比較するために使用することができます。統計分析は、Excel、グラフパッドまたはSPSSで実行することができます。コルモゴロフ-スミルノフ検定(KS検定)2,5-6を使用して、累積プロットを分析する。
6。定量的免疫蛍光法(IF)
特定のシナプスタンパク質に対する免疫蛍光用いた抗体の定量は、クラスタリングと内因性シナプス蛋白質のシナプス局在の変化を調べるために使用できる、アレクサ568二次抗体(Invitrogen)を用いて可視化。
- 上記のような共焦点顕微鏡を使って画像を取得する。画像二重染色ニューロンにアルゴンやヘリウムネオンレーザーを(上記参照)を使用してください。苦痛の兆候を表示しないだけのイメージ健康錐体細胞。
- 蛍光強度測定では、MetaMorphを使用して、"バックグラウンドを差し引いた"画像を(図2J)を生成するための樹状シャフト(図2I、黄色の四角)に対応するバックグラウンドを引く。同様にしきい値は画像の強度と、隣接する樹状突起(図2K)上記少なくとも2倍のクラスタを含むように。 MetaMorphを使用して、"境界"ユーティリティ(図2D)と、自動的に線密度(number/100μmの樹状突起の長さ)を測定し、それぞれのシナプスクラスタの積分強度を(強度IF合計)を使用して樹状突起(ニューロンあたり100μm)に沿って輪郭領域7-9
- シナプスタンパク質の相対的な背骨の含有量を測定するには、まずMetaMorphを使用して、スパイン形態(図2E、F)を決定するためにGFPの画像を二値化することによって、タンパク質のクラスタリングを決定する。のみ、他のチャンネル(図2G、H)でキャプチャされた目的のタンパク質の画像に棘を含む関心領域を転送する。蛋白質のクラスターの数をカウントし、脊椎のタンパク質含有量を評価するために棘内側免疫蛍光積分強度を測定する。
- 定量化のためにExcelにシナプス蛋白のIFパラメータをエクスポートします。 2群間の差の統計的有意性を決定するために学生の不対t検定を使用して、一方向ANOVAは、テューキー- B 事後多重比較のために続いて、3つ以上のグループを比較するために使用することができます。統計分析は、Excel、グラフパッドまたはSPSSで実行することができます。
7。タイムラプスイメージング
このような脊椎の運動性や個々のスパインのスパイン形態の変化などの樹状突起棘のダイナミクスを、調べるために、疾患関連シナプスタンパク質の存在下または非存在下で、24から28 DIVのための22x22 mm角のカバースリップ上で培養した一次皮質ニューロンを成長させる。 Neurアドオンは、細胞の形態を定義するためにGFP / mCherryで二重トランスフェクション、および上記のような蛍光体のシナプスタンパク質をタグ付けすることができます。すべてのイメージング実験の場合は、両方の構造を表現する健康な錐体細胞を選択し、これらの細胞は、薬理学的処理を施して画像化し、以降の分析で使用することができます。
- 加湿37℃インキュベーターで30〜60分のために1.5ミリリットルACSFで22x22 mmのカバースリップ上に成長させたプレインキュベートニューロンは、5%CO 2を補給。細胞はまた、同様にこの段階では薬で前処理することができます。以下pre-incubation/treatment、同封のイメージングステージ室(ワーナー、RC - 30HV)への転送細胞。 37の温度を維持するコントローラユニットと° C(ワーナー、TC - 344B)2,5-6,10。
- 脊柱の運動性、イメージングチャンバーに細胞を転送する前に、最大30〜60分間薬や車両との事前御馳走細胞を調べることができます。これは、薬物/車両のための十分な時間がニューロン内二次メッセンジャー経路を開始することができます。 10分間隔で2Xアベレージングを使用して63Xの目的(Ziess、NA 1.4)で画像を取得する。 GFP / mCherryまたは蛍光標識タンパク質を発現する全体的なピラミッド型の形態を持つ健康な神経細胞を選択してください。光損傷を最小限に抑えるために、0.5から1パーセントにレーザーパワーを減少させる。薬剤処理細胞対ビヒクル処理の比較は、脊柱の運動性の変化を紹介します。また、脊椎の運動性は、薬物/車両の灌流(下記参照)によって、治療前と後に評価することができます。各時点で、Z -スタックを収集する。
- 時間をかけて樹状突起スパイン形態の変化を追跡するには、形態のベースラインの変化を確立するために1時間のイメージカバースリップ。この時点では、さらに1時間ペリスタポンプ(ギルソン、Minipuls 3)、および画像のニューロンを用いた撮像室内への薬物/車両を灌流。 2Xは10分ごとに平均して、63X油浸対物(Ziess、NA 1.4)を用いて共焦点Z -スタックを取得する。光損傷を最小限に抑えるために0.5から1パーセントにレーザーパワーを減少させる。
- 各イメージングセッションの終了時に、光損傷の把握レベルに全体のニューロンの20倍の画像を得る。苦痛の徴候を呈するあらゆるニューロンは、定量化から除外する必要があります。各時間点のZ -スタックはMetamorphの2D投影にまとめる必要があります。トランスフェクションの画質とレベルに応じて、中央値はローパスフィルタやバックグラウンド減算は、分析のための明確なイメージを作り出すのにMetamorphに適用することができます。
- 脊椎モーフィングと運動性を評価するには、100分のイメージングセッションの開始、中間、終了時に撮影した画像は、色分けとMetaMorphで重ねにする必要があります。セルあたりの樹状突起の少なくとも100μmが分析する必要がある。合計脊柱の運動性の画分は、運動性のイベント、すなわち拡張、収縮、モーフィング頭や背骨の番号6,11に正規化された突出運動性の合計数として定義されます。それはプールのすべてのタイプのイベントを、そして全体的な運動の一般的な推定ですが、この方法では、その大きさを考慮することなく、イベントの頻度を測定します。突出イベントは、脊椎の頭や樹状シャフトから新しい、一時的な突起の出現と定義されています。リトラクションイベントが脊椎の頭や樹状シャフト上にある既存のまたは一時的な突起の消失として定義されています。突起と拡張イベントの合計が定量化される樹状突起の領域での棘の合計数で除算されています。
- 以下の薬物治療に反応して、個々のスパイン形態の変化を評価するために、時間のポイント-1時間(灌流の前に1時間)で断面樹状突起の領域、または樹状突起棘線密度を測定し、直ちに治療を先行し、各時点で治療。 1時間前から治療の時点に、各時点を正規化する。樹状突起スパイン形態または線密度の変化は、光損傷する原因ではなかったことを決定するために、車で灌流神経細胞を分析する。手段の違いは、学生の不対t検定または1標本t検定によって決定することができる。
8。成功への代替的なアプローチとキー
- 我々は、満期までDIV 4(DIV24 - 28)から、L - APV、NMDA受容体阻害剤、Dの存在下で培養皮質ニューロンを記載している。それはDの存在下で培養皮質ニューロン間に、L - APVは、長期的な皮質ニューロン培養の健康を維持することの利点を持っていることに留意されたい、D、L - APVの存在は、シナプス発達に影響を与える可能性がある。そのような選択肢はD、L - APV 2,5の不在下での培養神経細胞になりますように。ときにDがない場合で培養神経細胞は、L - APV余分な注意が過剰なCa2 +を過剰にアクティブなNMDA受容体の活性化を介して細胞毒性に起因する細胞死の増加の可能性があるとして、文化の全体的な健康状態に注意を払う必要があります。
- このプロトコールに記載されて神経細胞の培養物dendritiの樹状突起スパインの形態と運動性を規制するための関連するメカニズムを調べるために使用することができます。cは、成熟形態(すなわち、それらがシナプス前のパートナーとの接続を形成する、と明確な頭部のような構造を持っている)2,4,5を表示刺。また、時間の時点以前における文化の使用、例えば、DIV11 - 16は、樹状突起棘の形成、または初期の開発中に樹状突起棘の調節に関連する問題に対処するより適している可能性があります。
- 共焦点顕微鏡を使用する代わりに、治療を培養皮質ニューロンの画像を取得するために広い視野落射蛍光を使用することです。適切なデコンボリューションアルゴリズムと組み合わせて、棘の詳細な形態学的解析は、固定またはライブの細胞で行うことができます。さらに、そのようなImageJが(のような代替ソフトウェア、使用することが可能ですhttp://research.mssm.edu/cnic/tools-ns.html )またはNeuronstudio( http://research.mssm.edu/cnic/tools-nsを。htmlの樹状突起スパイン形態の分析のために、フリーソフトウェアです)。
- 樹状突起棘の運動性を調べる/タイムラプスイメージングを使用してモーフィングするとき、それは短いタイムラプス間隔の使用、例えば、5〜10分は、樹状突起棘turnover2、5のより詳細な分析を提供することができることに留意すべきである。短い時間間隔を使用すると、また長い時間間隔を用いて検出されないことをモーフィング脊椎のより迅速な形態を識別することができる。
- 培養皮質ニューロンの使用が考慮される必要がある欠点といくつかの懸念を持っています。まず、培養皮質ニューロンを用いての懸念は、樹状突起棘の密度などのパラメータに影響を与えることができる文化間のばらつきがあるかもしれないということです。このように、それは以下の点を慎重にばらつきの最低額を保証するために遵守されることが不可欠です。まず、培養パラメータと試薬は良好な培養の実践に加えて、可能な限り一貫性を維持する必要がありますが、これは非常に文化間のばらつきのレベルが低下します。第二に、それはすべての実験は同一の時間の時点で、そして妹の文化で実行することが不可欠です。さらに、実験が行われる時間点は慎重に(上記の点2を参照)実験者は適切な質問をするように選択する必要があります。最後に、それは適切なコントロールが治療の条件が常にこれらの内部統制への相対検討されるように、全ての実験で使用されていることが重要です。これは、文化間のばらつきのいずれかの懸念が削除されます。
- 培養皮質ニューロンの使用は、批判的に樹状突起スパイン形態と運動性の調節に不可欠なメカニズムを調べるために研究を可能にする上で強力なツールです。しかし、これらの培養が in vivo の状況で要点を繰り返すしないことに注意することが重要であり、そのような皮質層の組織とシナプス形成にそのようなグリア細胞など他の細胞型、の効果、などの部品は、上述のシステムで対処することができます。それにもかかわらず、そのようなシステムは、樹状突起スパインの形態と運動性の制御の根底にある潜在的に重要なメカニズムを識別するために使用することができます。
9。代表的な結果
上記のアッセイは薬理学的治療および/またはin vitroでのタンパク質の機能の遺伝子操作に応答して樹状突起スパインの形態、数と運動性の変化を調査するために設計されています。私たちの研究室では、我々はこのように、それらの構造2,9を変えること、樹状突起スパインのアクチン細胞骨格を調節するシナプスのタンパク質の役割を特徴づけるためにこれらの技術を利用してきた。さらに、我々は、神経修飾物質として神経活性化合物は、樹状突起スパイン形態、数値や形状の変化、単独4,6,10、または活動依存的刺激5の存在下での運転ができる方法を決定するために、このアッセイを使用している。
1Dまたは2Dのパラメータの我々の測定の精度を推定するために、我々は研究を通してニューロンと同じ条件でマウントされている既知の寸法の蛍光ラテックス微小球(デュークサイエンティフィック)(0.2、0.52、1.0μm)の直径と面積を測定した。脊椎の測定(63X、NA = 1.4の油浸対物レンズ、LSM 5パスカル)の場合と同一の撮像条件を用いて我々は脊椎の測定と同様に、微小球を撮像し、Metamorphでその直径と地域を決定。私たちは、その後、微小球の既知の寸法と実際の測定値を比較した。
図1(図1)のグラフは、我々は正確に0.52および1.0μmの微小球の領域を測定できることを示しています(それぞれの領域= 0.21μmの2、0.78μmの2)(測定標準偏差〜15%、メーカーは標準偏差を決定〜 9%)。ても0.2μmのマイクロスフェアのために我々の測定はかなり(ただし、大きなSDと)実際の寸法に接近していた。これは、計算された横方向のレゾールと一致しているこの特定の目的を使用して私たちの共焦点顕微鏡のution、0.3μmの(式を使用してΔxcf=(0.61/v2)√/ NA)12。これは、共焦点、2光子顕微鏡のために貧しい人々であることが知られている軸方向の分解能、よりも有意に良好です。さらに、我々は実験的に約0.5μmと200nmの直径(デュークサイエンティフィック)の緑色蛍光マイクロスフェアを測定することにより、横方向(X / Y軸)点像分布関数(PSF)を決定する。この推定は、ピンホールを開いた状態で行い、そのためには、ピンホールが閉じているときに、PSFが実際より小さくなると仮定することができます。それにもかかわらず、これは再び我々は正確に0.196μmの2(直径= 0.5μm)よりも大きな領域を測定することができることを示しています。実際の横方向のPSFは"0.16μmの2の領域につながるだろう0.4μmの、よりもはるかに少ないではない "として13(スボボダら )に与えられているのを示す。これらの比較や理論的な考察は、我々が測定した棘の寸法は、この解像度の限界(> 0.25μmの2)を超えていたので、我々は正確に、棘の大きさの類似したオブジェクトの領域を測定できることを示している。そのような条件については、我々は確実に脊椎領域を測定し、正確に別の処理条件で脊椎の形態を比較することができることを示す、13" 古典的な形態学的手法は定量的です "。
正確に樹状突起スパイン形態を測定するために、我々は2日間EGFPコンストラクトにDIV 23皮質ニューロンをトランスフェクトしている。トランスフェクション後、細胞を治療に供することができる、と固定されており、GFPのシグナルは、樹状突起(またはニューロン)に均一に分散できるように拡張されたICC、のために処理されます。図2は、GFPをトランスフェ皮質ニューロンの代表画像を示す、63X目的(NA 1.4)(図2A)と共焦点顕微鏡を用いて画像化。これは樹状突起棘の詳細な高解像度の画像(図2B)が可能になります。樹状突起棘の詳細な形態学的分析は、Metamorphのプログラムを使用して私たちのラボで行われている。このプログラムは、樹状突起スパイン形態を測定するだけでなく、内在性タンパク質の局在を調べるためだけでなく、私達が可能になります。我々はこの分析を実行する方法の概要を図2(図2C - G)で提供されています。
活動依存的刺激の十分に特徴付けられた効果は、樹状突起棘の大きさ2の増加です。図3は、活動依存的刺激の前と後の30分間撮像EGFPを発現するDIV 24皮質ニューロンの樹状突起棘の代表的なタイムラプスイメージングを示しています。このタイムラプス実験では、活動依存的刺激が(図3A、B)樹状突起棘のサイズを増やすことを確認します。基礎背骨の運動性を調べるために、画像は時間の点で0、50、100分を取得し、脊椎の拡張、収縮、モーフィング突出運動性とヘッドは別々に測定し、総運動として統合した。図3C - Dは、さらに基礎の条件下で、皮質ニューロンの樹状突起棘は運動性のいくつかのレベルを表示することを確認します。
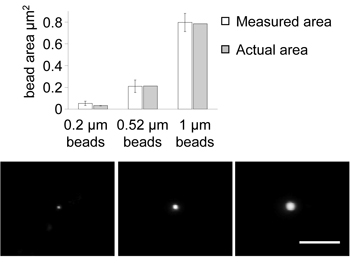
図。 1。蛍光マイクロスフェア。エラーバーの測定値と実際の面積の比較は、測定領域の標準偏差を表しています。 0.2μm以下の微小球のイメージを、0.52ミクロン、1ミクロン。スケールバー= 5ミクロン。
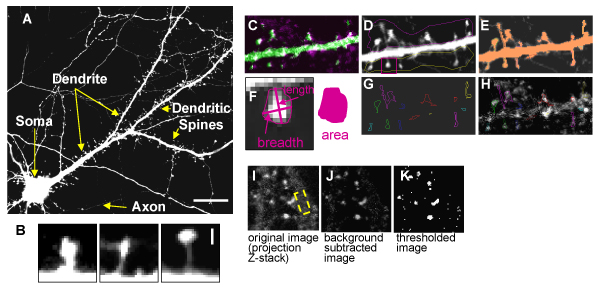
図。 2。スパイン形態とIF定量化。 DIV 25培養皮質ニューロンをEGFP発現のA.イメージ 。皮質ニューロンに見られる典型的な樹状突起スパイン形態のB.高倍率に。C. EGFPと内因性タンパク質(GluR1)オーバーレイが。D.は、EGFP -トランスフェクトされた錐体のZシリーズを縮小細胞の樹状突起は、シャフトと棘の間の分裂は、手動でトレースされますE.個別、superthreshold領域がその後Metamorphで概説し、定量化される決定F.ハンドトレースした脊柱の長さ、幅及び断面積を決定するために使用されるニューロンG.領域 。。。 Metamorphによる棘に対応する。H.スパインのアウトラインが、背骨固有の信号を定量化するために赤チャンネルの画像(内因性蛋白質)に転送されること。IK。Zシリーズの投影画像が使用されている、、IF受容体やシナプスタンパク質のクラスターを定量化する。 I.樹状シャフトの背景IFは(黄色の四角)"バックグラウンドを差し引いた"画像を生成するために減算されます。J.はこの画像はその後、閾値処理とプログラムは自動的にクラスタの領域、線密度、および合計灰色の値を測定さ(強度IF)K. H.のスケールバーは、= 15μmから閾値画像、B = 1μmの。
G"ALT ="図3"/>
図。 3。活動依存スパイン形態の変化、および樹状突起棘の基底運動性。活動依存刺激を加える前と後の代表的な樹状突起棘のA.は、タイムラプスイメージング。活動依存的な刺激はMg2 +とAPVなくACSFにMg2 +をとAPVを含むASCFから実験的なメディアを切り替え、ただし-30分時点(30に正規化された樹状突起棘の面積の10μmのグリシンB.定量化(サイズ)を、含有させることにより誘導された樹状突起棘の運動性の0、50、100分の時点の前灌流の分)。C.代表画像。下の画像が別々に各時点いる間にトップの画像は、0(赤)、50(緑)と100(青)分時点のオーバーレイを示しています。アスタリスクは、背骨の延長を示し、白矢印は、背骨の収縮を示し、緑色の矢印の頭が突出運動性を示し、オープンな黄色の矢印の頭は、脊椎の頭がモーフィング表しD.の樹状突起棘の運動パラメータの定量化と全体の運動性EGFP以下の画像を表現する皮質ニューロンのE. 20Xの画像。。細胞の健康状態を判断するためにセッション。
ディスカッション
技術が樹状突起スパインの形態の詳細な定量分析のために上記の、固定またはライブ一次皮質ニューロンにおける線密度と運動性がneuropathologiesに貢献するかもしれないポストシナプスメカニズムの効果を理解することに重点を置いています。同様のアプローチは、海馬錐体、プルキンエ、または中型有棘ニューロンを含むいずれかの有棘ニューロンのスパイン形態や運動性を、定量化するた...
開示事項
謝辞
我々は慎重に編集するためのケリージョーンズに感謝。この作品は、NIHの助成金R01MH 071316、アルツハイマー病協会、統合失調症とうつ病に関する研究のための国民の同盟(NARSAD)、および自閉症研究のための国民の同盟(ナー)(PP)によって支えられて、アメリカ心臓協会特別研究員(DPS)、アメリカン心臓協会博士号を取得する前のフェローシップ(KMW)。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| 18mmの円形のカバーガラス第1.5 | ワーナーインスツルメンツ | 64〜0714(CS - 18R15) | |
| 22ミリメートルの正方形カバーガラス第1.5 | ワーナーインスツルメンツ | 64〜0721(CS - 22S15) | |
| ポリ- D -リジン | シグマ | P - 0899 | MW 70〜150kDaの |
| Neurobasalメディア | インビトロジェン | 21103049 | |
| B27 | インビトロジェン | 17504044 | |
| グルタミン | インビトロジェン | 21051024 | |
| ペニシリン - ストレプトマイシン | インビトロジェン | 15140148 | |
| D、L - APV(AP - 5) | アセントサイエンティフィック | ASC - 004 | |
| リポフェクタミン2000 | インビトロジェン | 11668019 | |
| DMEM | インビトロジェン | 11965092 | |
| HEPES | MediaTech Cellgro | 25から060 - C 1 | 1M、pH7の |
| ホルムアルデヒド溶液 | EMDケミカルズ | FX0415 - 5 | 36%、組織学グレード |
| 正常ヤギ血清 | VWR | 100188-514 | ジャクソンイムノ研究所 |
| トリトンX - 100 | フィッシャーサイエンティフィック | AC21568 - 2500 | アクロスオーガニック |
| のAlexa Fluor ® 488ヤギ抗マウスIgG(H + L)は高度に架橋吸着 | インビトロジェン | - 11029 | |
| のAlexa Fluor ® 488ヤギ抗ウサギIgG(H + L)*高度に架橋吸着* | インビトロジェン | - 11034 | |
| ゴールド褪色防止試薬を延長 | インビトロジェン | P36934 | 特別包装 |
| 同封のイメージングステージ室 | ワーナー | RC - 30HV | |
| 温度コントローラユニット | ワーナー | TC - 344B | |
| MetaMorph | ユニバーサルイメージング |
参考文献
- Banker, G., Goslin, K. Developments in neuronal cell culture. Nature. 336, 185-186 (1988).
- Xie, Z. Kalirin-7 controls activity-dependent structural and functional plasticity of dendritic spines. Neuron. 56, 640-656 (2007).
- Spear, L. Modeling adolescent development and alcohol use in animals. Alcohol Res Health. 24, 115-123 (2000).
- Srivastava, D. P., Woolfrey, K. M., Liu, F., Brandon, N. J., Penzes, P. Estrogen receptor ss activity modulates synaptic signaling and structure. J Neurosci. 30, 13454-13460 (2010).
- Srivastava, D. P. Rapid enhancement of two-step wiring plasticity by estrogen and NMDA receptor activity. Proc Natl Acad Sci USA. 105, 14650-14655 (2008).
- Woolfrey, K. M. Epac2 induces synapse remodeling and depression and its disease-associated forms alter spines. Nat Neurosci. 12, 1275-1284 (2009).
- Allison, D. W., Gelfand, V. I., Spector, I., Craig, A. M. Role of actin in anchoring postsynaptic receptors in cultured hippocampal neurons: differential attachment of NMDA versus AMPA receptors. J Neurosci. 18, 2423-2436 (1998).
- Harms, K. J., Tovar, K. R., Craig, A. M. Synapse-specific regulation of AMPA receptor subunit composition by activity. J Neurosci. 25, 6379-6388 (2005).
- Xie, Z., Huganir, R. L., Penzes, P. Activity-dependent dendritic spine structural plasticity is regulated by small GTPase Rap1 and its target AF-6. Neuron. 48, 605-618 (2005).
- Jones, K. A. Rapid modulation of spine morphology by the 5-HT2A serotonin receptor through kalirin-7 signaling. Proc Natl Acad Sci USA. 106, 19575-19580 (1957).
- Dunaevsky, A., Tashiro, A., Majewska, A., Mason, C., Yuste, R. Developmental regulation of spine motility in the mammalian central nervous system. Proc Natl Acad Sci USA. 96, 13438-13443 (1999).
- Lichtman, J. W., Conchello, J. A. Fluorescence microscopy. Nat Methods. 2, 910-919 (2005).
- Svoboda, K. Do spines and dendrites distribute dye evenly. Trends Neurosci. 27, 445-446 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved