Method Article
生体力学的解析と組織工学のための細胞由来の組織のリングを製作する監督セルラーセルフアセンブリ
要約
この記事では、細胞の自己組織化による細胞由来の組織のリングを作成するには、汎用的な方法を概説します。平滑筋細胞は、リング状のアガロース井戸の集合体と7日以内に強固な3次元(3D)の組織を形成するために契約に播種。ミリスケールの組織のリングは機械的なテストに資するものであり、組織の組み立てのためのビルディングブロックとして機能する。
要約
毎年、患者数十万人は米国の冠動脈バイパス手術を受ける。これらの患者の1約3分の1が病気の進行または前の収穫のために適切な自己ドナーの容器を持っていない。血管組織工学の目的は、これらのバイパスグラフトに適した代替ソースを開発することです。さらに、設計血管組織は、心血管疾患を研究するために血管モデルを生きているような貴重な証明するかもしれない。エンジニアリングの血管へのいくつかの有望なアプローチは、細胞ベースの手法の開発と分析に焦点を当てた多くの最近の研究で、調査されている2-5ここでは、我々がで使用できる3次元組織のリングに急速に自己集合細胞に方法を提示血管組織をモデル化するためのin vitro。
これを行うには、平滑筋細胞の懸濁液を丸底環状アガロースのウェルに播種されています。アガロースの非接着性は、目を許可するまとまりのある組織の環を形成してウェルの中央でポストの周りに、骨材との契約を決済する電子細胞。6,7は、これらのリングは前に、機械的な生理学的、生化学的、または組織学的分析のために収穫するために数日間培養することができる。我々は、これらの細胞由来の組織のリングは同じような期間(<30 kPa)の培養、他の組織工学的血管構造のために報告された値を超えて100〜500 kPa引張強さ8で得られることが示されている。9,10我々の結果は、その堅牢な細胞を実証由来の血管組織のリングの生成は、短い期間内に達成し、そして細胞および血管組織の構造と機能への細胞由来のマトリックス(CDM)の貢献の直接的および定量的に評価するための機会を提供することができます。
プロトコル
1。細胞播種の金型製作
2mmのセンターポストの直径は15、丸底、環状の井戸を作るためにポリカーボネートの1 / 2"厚切りを粉砕することによって開始する。粉砕されたチャネルは6深さmmと幅の3.75ミリメートルです。クリーンとするポリカーボネートの鋳型を乾燥製粉工程からプラスチック製の破片を取り除く。
ミックスポリジメチルシロキサン(PDMS)硬化剤に塩基を10:1の比(w / w)の時、脱気は、すべての気泡を除去するため、およびポリカーボネートの金型に流し込む。ドガは、再び残りの気泡を除去し、4時間、60℃のオーブンで硬化する。
一度硬化、慎重にゆっくりとポリカーボネートから離れて剥がすことによりPDMSのテンプレートを削除し、石鹸と水で洗浄し、オートクレーブ。また、ダルベッコ改変イーグル培地(DMEM)中に溶解した二パーセントアガロース(W / V)の溶液をオートクレーブ。
水平な面にPDMSのテンプレートを置き、溶融AGAで埋めるセンターポストの金型のそれぞれに最初にピペッティングアガロース増加し、その周りの空間にピペッティング。アガロースが(約15分)固化することを許可し、PDMSからアガロースを解放するために金型を反転させる。各ウェルの周囲から余分なアガロースを切断し、12ウェルプレートにアガロース井戸を配置。
2。細胞培養とリングの播種
金型の上面を覆っなく、アガロースの金型の外側に細胞培養培地(10%FBS、1%ペニシリン - ストレプトマイシン含有DMEM)を追加します。インキュベーターでプレートを配置し、セルを準備しながら約15分間平衡化することができます。
90%の合流点に、ラットの大動脈平滑筋細胞(rSMCs)をトリプシン処理し、5 × 10 6細胞/ mlの濃度で懸濁します。各ウェルに細胞を適用する円運動を使用して環状のアガロース各ウエルに細胞懸濁液100μL添加、。
内容が">必ずインキュベーターの棚が水平になっていることを確認し、インキュベーターでプレートを配置して、24時間邪魔されずに座ってすることができます。Exchangeの培地は2日ごとに、その後も世界中からメディアを吸引し、そして再充填を各ウェルになるまでアガロースがよく、完全に水没しています。3。組織のリングの収穫と厚さ測定
文化の結論では、中央の支柱の上にそれをスライドさせてアガロースの型からリングを取り外します。
、(PBS)リン酸緩衝生理食塩水で小さなペトリ皿にリングを置き、センターのサンプル、およびデジタルイメージングシステムを用いて画像を取得。
エッジ検出のための画像解析プログラムを使用し、その円周に沿って4ヶ所(上、下、左と右)にリングの厚さを測定する。各リングの平均厚さの値(t)を計算し、断面積を計算するためにこの値を使用(2π(T / 2)2)。
4。リングの機械的試験
水平位置での引張試験機(インストロンEPS 1000)を設定します。 1N ± 1mNロードセルとカスタム細いワイヤグリップを(ステンレス鋼線を曲げることにより作成された)に取り付けます。
二つの薄い線のグリップでリングのサンプルをマウントします。 5表面張力風袋荷重がサンプルに適用されるまでグリップを延長する。断面積を(厚さの測定値から算出)を入力して、ゲージの長さを記録。
プレサイクルの8倍10mm /分の速度で風袋荷重と50 kPaの応力と鳴る。第八プレサイクル後に、10mm /分で失敗に引き出します。失敗は次への一回の測定から40%力の低下として注目されている。各リングのサンプルの場合は、究極の引張応力(UTS)と故障のひずみを測定し、取得したデータから最大接線係数(MTM)を計算する。
5。組織のリングとしてsembly組織のチューブを作製する
カスタムチューブホルダーは、長方形の切り欠き(2センチ× 3センチ)で丸5センチメートルポリカーボネートディスクから機械加工されています。 twoホルダーをねじ込むことができるように、これらのディスクを介してネジ穴を開けます。カスタムチューブホルダーをオートクレーブしてから、空のシャーレにバイオセーフティキャビネット及び場所に移す。
斜めのエッジを作成するための角度で1.9ミリメートルの直径のシリコンチューブの端をカットして、シリコンチューブをオートクレーブに外科はさみを使用してください。チューブはオートクレーブされている間、メディアとのペトリ皿を埋める。
アガロース井戸からリングを外し、メディアとのペトリ皿の中に置いてください。場所は、使用前にそれらを湿らせると同じシャーレにシリコンチューブをオートクレーブ。
リングの中心にシリコンチューブの斜めの端に置くと静かにシリコンチューブの上にリングをスライドさせて鉗子を使用してください。里の希望数を繰り返すNGS。軽くチューブに沿って両方向に連続してそれらを押すことでお互いに接触するリングをスライドさせます。このメソッドは、文化の中で唯一の1日後に収穫したリングに使用することができます。
リングがマウントされると、ポリカーボネートホルダー内にシリコンチューブを合わせ、一緒にホルダーの二つの部分をねじ込みます。 100ミリメートルシャーレにホルダーを配置し、55 mLのメディアを追加します。交換メディア文化の期間中、3日ごと。
組織のチューブを削除するには、ポリカーボネートのホルダーからシリコンチューブを解放し、シリコンチューブをオフし、PBSで満たしたシャーレに組織管をスライドさせて鉗子を使用する。
6。代表的な結果:
プロトコルが正しく実行されると、細胞は24時間以内に対応する金型ポストの直径に等しい内径と組織のリングを形成するために集約。 cultur場合、リングの縁は、外観と(通常スムーズです。レベルの表面上にED)、全周厚さで均一である。組織のリングは、取り扱いが容易であり、その後の機械的および組織学的分析のための彼らの井戸(Gwyther ら参照。、2011 8)から削除することができます。組織のリングの形態、マトリックス組成、および機械的性質は、播種された細胞の数と種類によって異なります。
さまざまな種類の細胞、播種条件、および文化の長さから作られた組織のリングからの代表的な結果を表1に示す。 5 × 5 rSMCsから作成した2つの内径のリングは、私たちの以前に発行さ2 mmのリング(6.6x10 5 rSMCsから作られる)から作成されたリングよりも高いUTSを示した。ラットの細胞、ヒト平滑筋細胞(HSMC)と同様に8が容易に組織を形成するために集約文化の中で唯一の14日間(データは示さず)の後にコラーゲンを大量に含まれているリングは、。ヒト間葉系幹細胞(hMSCの)も集約して形成された凝集リングが、ラcked機械的強度と一軸引張試験の初期プリサイクリング段階で破った。
| N | セル数 | 厚さ(mm) | 文化の長さ(日数) | UTS(kPa)の | MTM(kPa)の | 障害株(MM / MM) | |
| rSMCリング | 6 | 66万 | 0.94 ± 0.12 | 14 | 97 ± 30 | 497 ± 91 | 0.50 ± 0.08 |
| rSMCリング | 4 | 50万 | 0.53 ± 0.02 | 7 | 113 ± 8 | 189 ± 15 | 0.88 ± 0.05 |
| HSMCリング | 3 | 75万 | 0.51 ± 0.05 | 14 | 160 ± 30 | 270 ± 20 | 0.92 ± 0.08 |
| hMSCのリング | 3 | 75万 | 0.40 ± 0.07 | 14 | N / | N / | N / |
表1。培養パラメーターと異なる種類の細胞、播種濃度、及び文化の持続時間から生成さ2ミリメートルのリングの機械的性質を示す表。
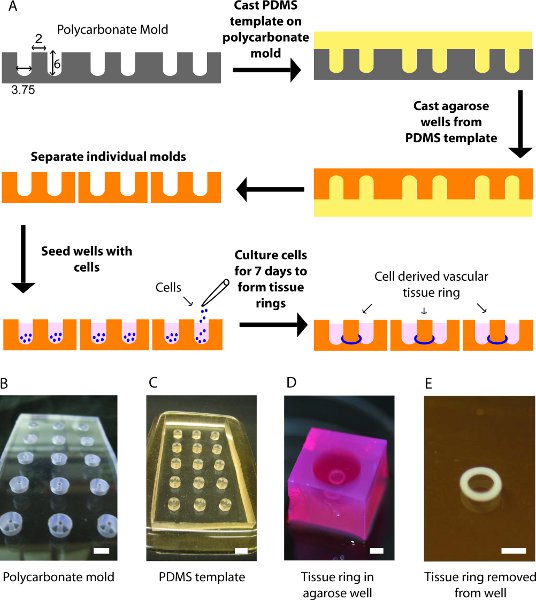
図1()組織のリングの生成プロセスの模式図。粉砕された環状のウェル(B)カスタムポリカーボネート型。中央郵便直径は2mmです。それはポリカーボネートの金型から剥離された後に(C)PDMSのテンプレート。 (D)集計組織のリングは、2 mmのポストでアガロースの金型で培養。 PBSで(E)二mmの直径の組織のリング。スケールバーは= 6ミリ(B、C)と2ミリメートル(D、E)。
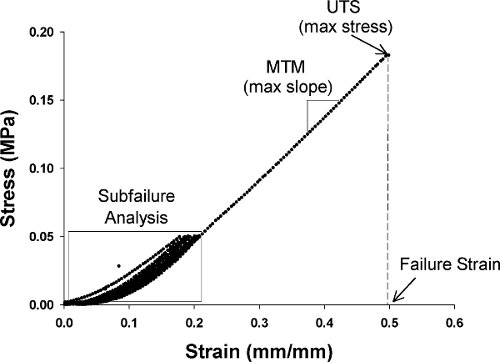
図2応力-ひずみ曲線produの代表プロット一軸引張試験からCED。
ディスカッション
最近では、セルベースまたは足場ベースの組織工学的アプローチのいくつかの制限を解決するために"足場のない"組織工学の手法に関心の高まりがあった。特定の細胞由来の組織、細胞およびそれらが生産する行列から作成されていることを、彼らは本質的には外因性物質が含まれていない、非常に高い細胞密度を含んでおり、人間の細胞やタンパク質から完全に行うことができます。ヒトの細胞から作られた人工血管は、外因性の足場の不在で実質的な機械的強度(例えば、ヒト伏在静脈1600 mmHgに比べて圧力が3400 mmHgにバースト)12を得ることができる。セルベースの血管組織が 改善された細胞密度と機械的強度を示すが、ほとんどの現在の製造方法は、(そのような"シートベースのエンジニアリング"3,4,12または5,13を "bioprinting"のような)大規模な文化の期間が必要(> 3ヶ月)または三次元組織の構築のための特殊な装置。細胞由来の組織のリングメタodは短期間内におよび特殊な装置を使用せずに強固な3次元組織構造を形成するために迅速な細胞の自己組織化を可能にするここで説明する。
このプロトコルの詳細私が2mm内径のラット平滑筋細胞由来の組織のリングを作成するために開発された手順。本例では、組織のリングは7日間(その後、リングの融合と管形成のための追加の7日間培養)培養した。しかし、2mmのラットは(と人間)平滑筋細胞のリングウェルから除去し、細胞播種後の一日には早く処理(例えば、シリコンチューブへの転送)のための十分な粘着性がありますすることができます。さらに、様々な内径(2、4、および6 mm)を持つ堅牢な組織のリングは、単にオリジナルのポリカーボネート型のポスト径を変更することにより、この方法で作成することができます。8私達はまた、最近5 2をイネーブルにするにはポリカーボネートの金型の設計を変更単一のマルチウェルアガロース室でキャストするミリシーディング井戸、どの以下PDMSとアガロースを使用し、6穴プレート(データは示さず)の1つのウェルに収まります。よく、ポスト径の変化、播種の幅、丸みを帯びた底部の曲率半径、井戸のシード数、またはシード井戸の深さは、すべてのCNCのCADファイルに仕様を変更するだけで変更できますポリカーボネートの金型の加工。最後に、単一のポリカーボネートの金型は、PDMSのテンプレートを無制限に製造するために使用することができ、それぞれのPDMSのテンプレートは、洗浄オートクレーブと何十回も再利用することができます。
初代ラットの平滑筋細胞(セルアプリケーション、R354 - 05)、初代ヒト冠状動脈平滑筋細胞(ロンザ、CC - 2583)、初代ヒト:組織のリングのサイズを変更することに加えて、我々はを含む、多くの異なる細胞型からリングを行っている皮膚線維芽細胞11(博士ジョージピンの寛大な贈り物、生体医工学のWPI部)、ラットの肺線維芽細胞(RFL - 6、ATCC CCL - 192)、および間葉系幹細胞(ロンザ、PT-2501)。これらの細胞型の凝集と組織のリングを形成するためにセンターポストの周りの契約のそれぞれ、細胞の組織、ECMの構成、および構成要素の機械的性質は、各セルのタイプによって異なりますが。各セルのタイプのためのシードパラメータは経験的に細胞の大きさと能力を集約するために基づいて決定する必要があります。従って、細胞由来の組織のリングを作成するこのシステムは非常に汎用性のときに、プロトコルは、異なる細胞タイプで最適な組織形成のための微調整が必要な場合があります。
説明したように組織のリング形状は、一軸引張試験によって容易に積載し、組織の材料特性の評価を容易にします。血管収縮と生理的機能を測定するために血管のリングセグメントを使用するための実質的な先例もあります。予備研究では、細胞由来の組織のリングは薬理学的応答を測定するためのワイヤーミオグラフデバイス上でマウントできることを示していると収縮力発生(データは示さず)。完全に、迅速に、組織学的、機械的、生理学的、および生化学的分析のために自己組織化セルのリングを製作する能力は、健康と疾病における血管組織の構造と機能をモデル化するための有用である可能性が強力な新しいツールを示唆している。
開示事項
利害の衝突は宣言されません。
謝辞
作者は感謝してCNC加工との彼の援助のためにニールホワイトハウス(WPI、ヒギンズのマシンショップ)を認める。さらに、我々は、Camtasiaの支援については、MATLABプログラミングだけでなく、ケイト飲料とジョセフCotnoir(WPI学術技術センター)との援助の彼女アドリアーナヘラを(WPI学術情報基盤センター)に感謝いたします。ソフィーバークとJacleenベッカー(WPI学術技術センター)は、補足的なビデオ映像を提供。この作品は、国立衛生研究所(R15 HL097332)、マサチューセッツ州立大学医学部 - WPIのパイロット研究イニシアチブ、米国心臓協会(JZHに学部研究フェローシップ)、及びウースター工科大学(JZHや制度への夏季留学研究フェローシップによって資金を供給された)MWRに立ち上げ資金。
資料
| Name | Company | Catalog Number | Comments |
| 試薬/装置の名前 | 会社 | カタログ# | |
|---|---|---|---|
| ポリジメチルシロキサン(PDMS) | ダウコーニング | Sylgard 184 | |
| アガロース | ロンザ | 5万 | |
| DMEM | Mediatech | 15から017 - CV | |
| ウシ胎児血清(FBS) | PAA | A05 - 201 | |
| ペニシリン/ストレプトマイシン | Mediatech | 30から002 - CI | |
| デジタルイメージングシステム | DVT株式会社 | モデル630 | |
| 一軸試験機 | インストロン | E1000 ElectroPuls | |
| エッジ検出ソフトウェア | DVT株式会社 | フレームワーク2.4.6 |
参考文献
- Roger, V. L. Heart Disease and Stroke Statistics--2011 Update: A Report From the American Heart Association. Circulation. 123, e18-e209 (2011).
- Kelm, J. M. A novel concept for scaffold-free vessel tissue engineering: self-assembly of microtissue building blocks. J. Biotechnol. 148, 46-55 (2010).
- Gauvin, R. A novel single-step self-assembly approach for the fabrication of tissue-engineered vascular constructs. Tissue. Eng. Part. A. 16, 1737-1747 (2010).
- L'Heureux, N., McAllister, T. N., de la Fuente, L. M. Tissue-engineered blood vessel for adult arterial revascularization. N. Engl. J. Med. 357, 1451-1453 (2007).
- Norotte, C., Marga, F. S., Niklason, L. E., Forgacs, G. Scaffold-free vascular tissue engineering using bioprinting. Biomaterials. 30, 5910-5917 (2009).
- Dean, D. M., Napolitano, A. P., Youssef, J., Morgan, J. R. Rods, tori, and honeycombs: the directed self-assembly of microtissues with prescribed microscale geometries. FASEB. J. 21, 4005-4012 (2007).
- Livoti, C. M., Morgan, J. R. Self-assembly and tissue fusion of toroid-shaped minimal building units. Tissue. Eng. Part. A. 16, 2051-2061 (2010).
- Gwyther, T. Engineered vascular tissue fabricated from aggregated smooth muscle cells. Cell. Tissues. Organs. 194, 13-24 (2011).
- Seliktar, D., Black, R. A., Vito, R. P., Nerem, R. M. Dynamic mechanical conditioning of collagen-gel blood vessel constructs induces remodeling in vitro. Ann. Biomed. Eng. 28, 351-362 (2000).
- Rowe, S. L., Stegemann, J. P. Interpenetrating collagen-fibrin composite matrices with varying protein contents and ratios. Biomacromolecules. 7, 2942-2948 (2006).
- Pins, G. D., Collins-Pavao, M. E., De Water, L. V. an, Yarmush, M. L., Morgan, J. R. Plasmin triggers rapid contraction and degradation of fibroblast-populated collagen lattices. J. Invest. Dermatol. 114, 647-653 (2000).
- Konig, G. Mechanical properties of completely autologous human tissue engineered blood vessels compared to human saphenous vein and mammary artery. Biomaterials. 30, 1542-1550 (2009).
- Mironov, V. Organ printing: tissue spheroids as building blocks. Biomaterials. 30, 2164-2174 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved