Method Article
定向细胞自我组装制造,为生物力学分析与组织工程细胞衍生的组织环
摘要
本文概述了一个通用的方法来创建由细胞来源的组织细胞自我组装环。平滑肌细胞接种到环形琼脂糖井总与合同内形成强大的三维(3D)组织的7天。毫米波规模的组织环,有利于力学性能测试,并作为组织大会的组成部分。
摘要
每年,数以十万计的患者进行冠状动脉搭桥手术在美国大约这些患者的三分之一不适合自体捐赠者的船只因病情恶化或以前收获。血管组织工程的目标是开发出适合这些旁路移植的替代来源。此外,血管组织工程可能证明是有价值的生活血管模型来研究心血管疾病。已探索工程血管的几个有前途的方法,与许多最近的研究重点发展和基于细胞的方法的分析。2-5此中,我们提出了一个方法来迅速自我组装成三维组织,可用于环细胞体外模型的血管组织。
要做到这一点,平滑肌细胞的悬浮液接种到圆底环形琼脂糖井。琼脂糖非粘接性能允许日Ë细胞定居,周围以及中心的职位总量和合同,形成一个有凝聚力的组织环。6,7这些戒指可以收获的机械,生理,生化,或病理分析前几天的培养。我们已经表明,这些细胞衍生的组织环产量在100-500千帕的极限抗拉强度超过其他组织工程血管培养结构类似的持续时间(<30千帕)报告的值 。9,10我们的研究结果表明,强大的细胞衍生的血管组织环发电可以实现的一个短的时间内内,并提供机会直接和定量评估细胞和细胞衍生矩阵(CDM)血管的组织结构和功能的贡献。
研究方案
1。细胞种植模具制造
铣1 / 2"的聚碳酸酯中心后直径为2毫米厚片创建15日,圆底,环形井开始了。碾磨渠道6毫米深和3.75毫米宽,清洁和干燥的聚碳酸酯模删除任何铣削过程的塑料碎片。
在10:1(W / W)的基地,固化剂,脱气,以消除所有气泡,倒到聚碳酸酯模混合聚二甲基硅氧烷(PDMS)。德加再次删除任何剩余的气泡,并在60 ° C固化烤箱4个小时。
治愈后,小心地取出慢慢剥离聚碳酸酯的PDMS模板,用肥皂和水清洗,并高压灭菌。同时蒸压%琼脂糖(W / V)溶解在贝科的改良Eagle培养基(DMEM)的解决方案。
放置在一个水平面上的PDMS模板和填写熔融AGA第一吹打琼脂糖上升到每个中心后的模具,然后进入它周围的空间吹打。允许琼脂糖凝固(约15分钟),然后反转模具的PDMS琼脂糖释放。剪下多余的琼脂糖,各地各井和12孔板放入琼脂糖井。
2。细胞培养和环播种
周围添加细胞培养基(10%FBS和1%青霉素,链霉素的DMEM)琼脂糖模具外,不包括模具的顶部。板放置在孵化器,并允许他们平衡约15分钟,当您准备的细胞。
在90%汇合,trypsinize大鼠主动脉平滑肌细胞(rSMCs)和重悬在5X10 6细胞/毫升的浓度。吸取100μL的细胞悬液到每个环形琼脂糖井,用一个细胞每孔的圆周运动。
内容">请确保孵化器的货架上水平,然后放置在孵化器板,让他们坐了24小时不受干扰。交换的媒介,此后每隔两天吸从周围以及媒体,并重新填充每口井,直到琼脂糖以及完全淹没。3。组织环收获和厚度测量
在文化的结论,请从琼脂糖模具中心后上方滑动环。
环放置在一个小的Petri菜用磷酸盐缓冲液(PBS),中心样品,并使用数字成像系统获取图像。
使用边缘检测的图像分析程序,并测量其周长周围的4个位置(上,下,左,右)在环的厚度。计算平均厚度为每个环值(T),并使用这个值来计算的横截面积(2π(T / 2)2)。
4。机械测试的戒指
拉力试验机(英斯特朗公司每股收益1000),在水平位置。附加1N ± 1mN称重传感器和自定义细线夹具(不锈钢丝弯曲创建)。
两个细线夹具安装在环形样品。延长交手,直到一个5分钟的皮重负载应用到样品。输入截面积(厚度测量计算),并记录测量长度。
前皮负载50千帕的压力,并在10毫米/分钟的速度的8倍之间循环圈。第八周期前,后拉要失败的,在10毫米/分钟。失败是指出作为一个有效的减少了40%,从一个测量到下一个。对于每个环样品,测量的极限拉伸应力(UTS)和失效应变和最大切线模量(MTM)从采集到的数据计算。
5。组织环AS组装编造组织管
自定义的持有人管加工轮5厘米聚碳酸酯矩形切口(2厘米× 3厘米)的磁盘。通过这些磁盘上钻螺纹孔,让两个持有人,被拧在了一起。高压灭菌器自定义管人,然后转移到生物安全柜和一个空的培养皿。
用手术剪创建斜面边缘的角度削减1.9毫米直径的硅胶管的两端,然后高压灭菌的硅胶管。正在蒸压管,填补了与媒体的培养皿。
从琼脂糖井的戒指取出,并放置在与媒体的培养皿。地方蒸压在同一培养皿硅胶管使用前湿。
使用镊子放到中心的一环斜面结束的硅胶管,轻轻地滑入硅胶管环。所需的里数与重复农工商超市。在两个方向轻轻推他们先后沿管滑入相互接触的戒指。这种方法可用于收获后,只有一个在文化一天的戒指。
一旦环上,对齐内的聚碳酸酯持有硅胶管和螺杆两部分持有人。将在100毫米的培养皿持有人,并添加55毫升媒体。交换媒介文化的持续时间为每3天。
要删除的组织管,释放聚碳酸酯持有人的硅胶管,并使用镊子滑落到培养皿中填充用PBS的硅胶管和组织管。
6。代表性的成果:
正确执行协议时,细胞聚集形成一个内径等于相应的模具后,直径在24小时内组织环。环边缘通常是平滑的外观和(如果cultur在一个水平面上ED),是统一的,在围绕整个圆周的厚度。组织环易于处理,可从随后的机械和组织学分析井(见Gwyther等,2011 年 8)删除。环组织形态,基质成分,性能和机械性能,因种子细胞的数量和类型而定。
组织环代表从不同类型的细胞,播种条件,文化长度的结果如表1所示。两个MM的ID创建环5X10 5 rSMCs 展出 8类似的鼠细胞,人类平滑肌细胞(HSMC)环比从我们先前公布的2毫米戒指(6.6x10 5 rSMCs)创建一个较高的抗拉强度。容易聚合,形成组织环,其中包含大量的胶原蛋白后仅14天文化(数据未显示)。人类间质干细胞(HMSC)汇总,并形成凝聚力的戒指,但LAcked机械强度和发生在单轴拉伸试验的初始precycling阶段。
| ñ | 细胞数量 | 厚度(mm) | 文化的长度(天) | 悉尼科技大学(千帕) | MTM(千帕) | 失效应变(毫米/毫米) | |
| RSMC环 | 6 | 660000 | 0.94 ± 0.12 | 14 | 97 ± 30 | 497 ± 91 | 0.50 ± 0.08 |
| RSMC环 | 4 | 500000 | 0.53 ± 0.02 | 7 | 113 ± 8 | 189 ± 15 | 0.88 ± 0.05 |
| HSMC环 | 3 | 750000 | 0.51 ± 0.05 | 14 | 160 ± 30 | 270 ± 20 | 0.92 ± 0.08 |
| HMSC环 | 3 | 750000 | 0.40 ± 0.07 | 14 | N / A | N / A | N / A |
表1。表显示的文化参数和从不同的细胞类型,播种浓度,和文化的持续时间产生的2毫米环的机械性能。
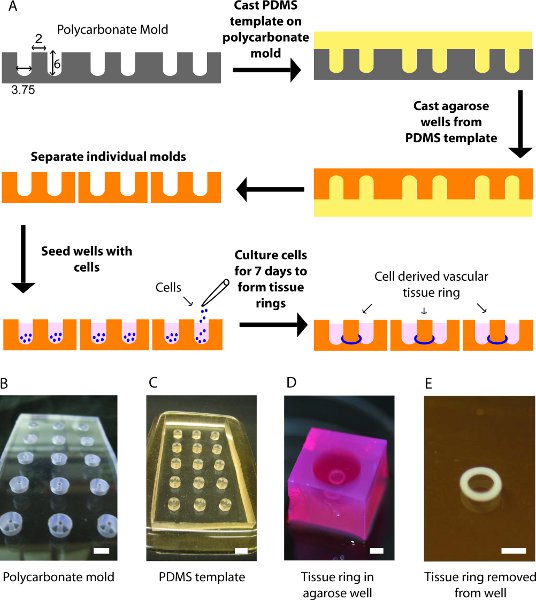
图1:(一)组织环生成过程的示意图。 (二)自定义聚碳酸酯模碾磨环形井。中央邮政局直径为2毫米。 (三)PDMS模板后,这是从聚碳酸酯模去皮。 (四)培养琼脂糖模具聚合组织环与一个2毫米后。 (e)两毫米直径的PBS组织环。比例尺= 6毫米(B,C)和2毫米(D,E)。
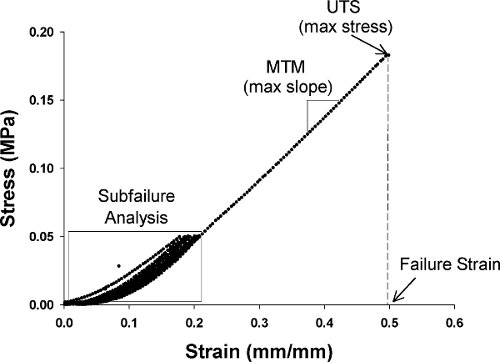
图2代表积应力-应变曲线机生产线。CED从单轴拉伸试验。
讨论
最近,出现了增加细胞为基础的"脚手架"组织工程方法来解决一些支架为基础的组织工程方法的局限性的利益。由于细胞衍生的组织创建从细胞和它们产生的矩阵,他们本质上包含的细胞密度高得多,不包含外源性材料,可完全从人体细胞和蛋白质。从人类细胞中的血管移植可以达到大量的机械强度,在缺乏外源性支架(例如,爆破压力3400毫米汞柱相比,1600毫米汞柱为人类隐静脉)12。虽然细胞为基础的血管组织表现出提高细胞密度和机械强度,目前大多数的制造方法(如"表为基础工程"3,4,12"bioprinting"5,13)需要广泛的文化时期(> 3个月)或3D组织建设的专门设备。细胞衍生的组织环方法这里所描述的OD能够快速的细胞自组装,形成一个很短的时间时期内并没有使用专门的设备强大的3D组织结构。
该协议的细节的过程中,我们开发创建2 mm的内径大鼠平滑肌细胞衍生的组织环。在本例中,组织培养7天(再培养一个额外的7天环融合和管形成)环。然而,2毫米的老鼠细胞种植后的一天早日(人)平滑肌细胞环可以从水井中删除和凝聚力处理(例如,转移到硅胶管)不够。此外,强大的组织环不同内径(2,4和6毫米),可以用这种方法创建通过简单地改变了原来的聚碳酸酯模后直径 8我们最近还修改了聚碳酸酯的模具设计,使5个2毫米播种要在一个单一的多井琼脂糖室的投井,使用较少的硅橡胶和琼脂糖,适合于6孔板(数据未显示)。后直径的变化,以及播种的宽度,曲率半径的圆形底部,播种井,或播种井的深度都可以进行修改,只需通过改变数控CAD文件的规格聚碳酸酯模具的加工。最后,一个单一的聚碳酸酯模可用于制造的PDMS模板的数量不受限制,每个PDMS的模板,可清洗,灭菌和重复使用几十次。
除了改变组织环的大小,我们从许多不同类型的细胞环,包括:原代大鼠平滑肌细胞(细胞应用,R354 - 05),主人体冠状动脉平滑肌细胞(龙沙,CC - 2583),首要人权皮肤成纤维细胞11(乔治销博士的慷慨捐赠,WPI的生物医学工程学系),大鼠肺成纤维细胞(RFL - 6,ATCC CCL - 192),和间质干细胞(龙沙,PT-2501)。这些类型的细胞聚集和围绕中心岗位合同形式组织环;虽然不同的细胞类型的细胞组织的ECM成分,和力学性能的构造不同。播种不同的细胞类型参数必须是经验确定,根据细胞的大小和他们的能力,以总。因此,在这个创建细胞衍生的组织环系统是非常灵活的,该协议可能需要轻微调整优化组织形成与不同类型的细胞。
组织环几何促进单轴拉伸试验容易装载和评估组织的材料特性,描述。使用血管环段测量血管收缩和生理功能也有大量的先例。初步研究表明,可在丝肌动描记设备安装测量的药理反应的细胞衍生的组织环和收缩力发电(数据未显示)。总而言之,能够迅速编造的组织学,机械,生理,生化分析自组装细胞环,表明一个强大的新工具,可用于血管的组织结构和在健康和疾病的功能建模。
披露声明
没有利益冲突的声明。
致谢
作者非常感谢协助他与数控加工尼尔豪斯(WPI的,希金斯机铺)。此外,我们想感谢她与MATLAB编程,以及凯特饮料和约瑟夫Cotnoir(WPI的学术技术中心)的帮助下,阿德里安娜赫拉(WPI的计算和通信中心)为协助与CAMTASIA。梁刘柔芬伯克和Jacleen贝克尔(WPI的学术技术中心)提供的补充录像。这项工作是由美国国立卫生研究院(R15 HL097332),麻省大学医学院WPI的试验研究倡议,美国心脏协会(本科生科研奖学金JZH)和伍斯特理工学院(JZH和机构的暑期大学生研究奖学金启动资金,水利部)。
材料
| Name | Company | Catalog Number | Comments |
| 试剂/设备名称 | 公司 | 目录# | |
|---|---|---|---|
| 聚二甲基硅氧烷(PDMS) | 道康宁 | Sylgard 184 | |
| 琼脂糖 | 龙沙 | 50000 | |
| DMEM培养液 | Mediatech | 15 - 017 - CV | |
| 胎牛血清(FBS) | 临时机场管理局 | A05 - 201 | |
| 青霉素/链霉素 | Mediatech | 30 - 002 - CI | |
| 数字成像系统 | DVT的公司 | 型号630 | |
| 单轴试验机 | 英斯特朗 | ElectroPuls E1000 | |
| 边缘检测软件 | DVT的公司 | 框架2.4.6 |
参考文献
- Roger, V. L. Heart Disease and Stroke Statistics--2011 Update: A Report From the American Heart Association. Circulation. 123, e18-e209 (2011).
- Kelm, J. M. A novel concept for scaffold-free vessel tissue engineering: self-assembly of microtissue building blocks. J. Biotechnol. 148, 46-55 (2010).
- Gauvin, R. A novel single-step self-assembly approach for the fabrication of tissue-engineered vascular constructs. Tissue. Eng. Part. A. 16, 1737-1747 (2010).
- L'Heureux, N., McAllister, T. N., de la Fuente, L. M. Tissue-engineered blood vessel for adult arterial revascularization. N. Engl. J. Med. 357, 1451-1453 (2007).
- Norotte, C., Marga, F. S., Niklason, L. E., Forgacs, G. Scaffold-free vascular tissue engineering using bioprinting. Biomaterials. 30, 5910-5917 (2009).
- Dean, D. M., Napolitano, A. P., Youssef, J., Morgan, J. R. Rods, tori, and honeycombs: the directed self-assembly of microtissues with prescribed microscale geometries. FASEB. J. 21, 4005-4012 (2007).
- Livoti, C. M., Morgan, J. R. Self-assembly and tissue fusion of toroid-shaped minimal building units. Tissue. Eng. Part. A. 16, 2051-2061 (2010).
- Gwyther, T. Engineered vascular tissue fabricated from aggregated smooth muscle cells. Cell. Tissues. Organs. 194, 13-24 (2011).
- Seliktar, D., Black, R. A., Vito, R. P., Nerem, R. M. Dynamic mechanical conditioning of collagen-gel blood vessel constructs induces remodeling in vitro. Ann. Biomed. Eng. 28, 351-362 (2000).
- Rowe, S. L., Stegemann, J. P. Interpenetrating collagen-fibrin composite matrices with varying protein contents and ratios. Biomacromolecules. 7, 2942-2948 (2006).
- Pins, G. D., Collins-Pavao, M. E., De Water, L. V. a. n., Yarmush, M. L., Morgan, J. R. Plasmin triggers rapid contraction and degradation of fibroblast-populated collagen lattices. J. Invest. Dermatol. 114, 647-653 (2000).
- Konig, G. Mechanical properties of completely autologous human tissue engineered blood vessels compared to human saphenous vein and mammary artery. Biomaterials. 30, 1542-1550 (2009).
- Mironov, V. Organ printing: tissue spheroids as building blocks. Biomaterials. 30, 2164-2174 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。