このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
の成長結核バイオフィルム
要約
特定の条件下で培養すると結核菌は、薬剤耐性バイオフィルムを形成します。ここでは、培養M.ための方法を説明結核のバイオフィルムと薬剤耐性の永続化の頻度を決定する。これらのプロトコルは、M.の薬剤耐性のメカニズムにさらなる研究のために有用であろう結核 。
要約
結核菌は、ヒト結核の病原体は、抗生物質を含む環境ストレスに対して生き残るためには並外れた能力を持っています。ただしMのストレス耐性結核は、結核の1 6ヶ月の長期化学療法への可能性が高い貢献の一つであり、病原体のこの特徴的な表現型の根底にある分子メカニズムは不明である。多くの微生物種がバイオフィルム2から4と 呼ばれる高度に組織化され、接続された表面、およびマトリックスカプセル化された構造に自己組織化によるストレスの多い環境で生き残るために進化してきました。コミュニティの成長は、微生物の好適な生存戦略であることが表示され、表面の付着、細胞間コミュニケーション、細胞外高分子物質の合成(EPS)5,6を制御する遺伝的要素によって実現されます。環境ストレスに対する耐性はおそらくEPSによって、おそらくphysioloによって促進されるバイオフィルム7の複雑なアーキテクチャ内で異種の微小環境に個々の菌のgical適応。
最近の一連の論文では、確立されているM.結核と結核スメグマチスは、抗結核薬イソニアジドとリファンピシン8-10 50回以上最小発育阻止濃度を許容できるバイオフィルムと呼ばれる組織的な多構造で成長する強い傾向を持っています。M.結核は、しかし、興味深いことにヘッドスペースの特定の午前9時01分比で、成熟したバイオフィルムを形成するために特定の条件を満たす必要があります。メディアのほか、大気9空気の限られた交換。特殊な環境条件の要件は、おそらくそのM.実際にリンクすることができます結核は絶対ヒト病原体であり、したがって、組織の環境に適応している。この文書では、培養M.ための方法を実証する結核ボトルや細菌などの遺伝子研究のための便利な12ウェルプレートフォーマットでのバイオフィルム。我々は、M.の弱毒株のためのプロトコルを説明した病原体9のin vivo増殖に重要である2つの遺伝子座、panCDとRD1、欠失を持つ結核、MC 2 7000、。この株は、安全に、高価なBSL-3施設の要件を回避し、結核の病原体の基礎生物学を理解するためのBSL-2の封じ込めに使用することができます。メソッドは、他の培養可能なマイコバクテリア種のバイオフィルムを成長させるために、メディアの適切な変更で、拡張することができます。
全体的に、培養抗酸菌バイオフィルムの均一なプロトコルは、マイコバクテリアの基本的な弾力性のある特性の研究に興味を持って捜査に役立ちます。さらに、成長マイコバクテリアバイオフィルムの明確かつ簡潔な方法は、臨床や製薬INVを助けるestigators潜在的な薬剤の有効性をテストします。
プロトコル
1。 Mの成長バイオフィルム250mlのスクリューキャップボトルの結核
- メディアの準備:水900mlの中のグリセロールの60mlを、クエン酸第二鉄アンモニウムの0.05グラムのMgSO 4 KH 2 PO 4、0.5グラム、L-アスパラギン4グラム、クエン酸2gの、の0.5グラムに溶解する。 NaOHでpHを7.0に調整します。実験を始める直前に涼しいし、オートクレーブでは、最終濃度0.1%w / vのに滅菌硫酸亜鉛4を追加MC 2 7000パントテン酸要求株であるため、この株は、最終濃度10μg/mlのでパントテン酸を必要とします。
注:これは、結核のために使用Sautonのメディアの標準的な組成物である。ただし、必要に応じてその他の特殊なメディアは、他のマイコバクテリア種に使用することができます。
- 接種の準備:M.グロウ 0.7の一週間で0.05%のTween-80、またはOD 600 1.0〜7H9OADCで結核 。 cuはltureは直接1:100希釈で接種物として使用することができます。
- 250mlのスクリューキャップ付きポリスチレン瓶(コーニング)にSautonのメディアの25MLを分注する。非常に緊密に培地、キャップボトルに接種の250μlのを追加し、3週間加湿37℃インキュベーターに邪魔されずにそれを置く。全く汚染がないことを確認するために毎日1回瓶を観察します。
- 第三週の終わりに、Mの更なる成長を可能にするためにボトルのキャップを緩め界面での結核 。キャップがこの段階で緩んでいないされている場合、コンテナ内の不十分な酸素濃度は、細菌の更なる成長を遅らせることになります。
2。 M.の成長12ウェルプレート中の結核バイオフィルム
- セクションA1とA2で説明したようにMC 2 7000のメディアと接種を準備します。
- 接種の600μlでメディアの60mlを混合します。 4.5メートルディスペンスプレートの各ウェルに混合物のL。蓋付きプレートをカバーしています。パラフィルムでプレートを数回巻き付けます。 5週間37℃で加湿インキュベーター内で邪魔されずに、プレートをインキュベートします。
3。 M.における薬剤耐性の永続化の頻度を決定する結核のバイオフィルム
- M.を育てるセクションBで説明したように、12ウェルフォーマットでの結核のバイオフィルムはこれが約5週間の合計になります。
- バイオフィルムが成熟された後(インキュベーションの5週間後)にピペットでマイクロチップを用いたバイオフィルムの下にメディアに所望の濃度で抗生物質の選択を注入します。
注:ペリクルの下にメディアのボリュームは約3.0mLまで減少します。したがって、研究者はそれに応じて薬の量を計算する必要があります。
- スワール抗生物質を徹底的に培地中に拡散して静かになるようにプレート。統計的に有意な結果を得るためには、抗生物質を注入する4ウェルの耳。並行して、抗生物質が他の4つのウェルに溶解した溶媒と同じボリュームを注入し、手付かずのプレートの最後の4つの井戸を残す。蓋とカバープレートとプレートの周りにパラフィルムの新鮮な層を配置します。希望の期間のインキュベーターに戻します。
- インキュベーションの終わりに、プレートを開き、各ウェルに0.1%(体積/体積)の最終濃度になるようにトゥイーン-80を追加します。渦巻洗剤の均一分散のために静かにプレート全体。 15分間室温で静置します。その内容全体が均一に15mlのコニカルチューブに移すことができるので、ピペットで数回、各ウェルの内容を混ぜ合わせます。
- 室温で10分間4000RPMでチューブの内容をスピンダウンする。新鮮な洗浄緩衝液(10%グリセロール、0.05%のTween-80を含むPBS)5mLのでペレットを再懸濁します。洗濯を3回繰り返します。洗浄緩衝液の5mLのでペレットを再懸濁します。 Oのためにロッカーに保管してください4でvernight℃、
注意:低温は、もともとM.スメグマチスのために開発(分散時に、その成長を最小限にするため)と同様に結核のために使用されていますが、成長の遅い種が最も可能性の高い結果に影響を与えることなく、室温で揺れることができます。 BSL-3施設で作業している場合、室温でロッキングする必要がある可能性があります。
- 、適切なサイズに、その幅広いエンドをカットするシリンジにフィットし、パラフィルムでそれをラップすることによって、マイクロチップ(2-200μlの)を装備し、滅菌注射器を準備します。先端フィット注射器からチューブの内容全体を渡して、新鮮な15mlのチューブに集める。あなたはかなり均一な懸濁液を観察するまで、このステップを5から6回繰り返します。
- 各ウェル中の生存コロニーの数を決定するために7H11OADCプレート上に懸濁液およびプレート希釈液の希釈系列を準備します。 37℃インキュベーターで3週間培養する。周波数を決定する溶剤処理されたプレート上で得られたものと扱われ、抗生物質で得られたコロニー数の比を計算することにより、バイオフィルムの人口の永続化機構ち消されます。
4。代表的な結果
M.の瓶で培養し、成長結核は、最初の週の終わりまでにボトルの底で見ることができます。エア·メディア·インターフェイスでの成長は第三週(図1A)の末尾に常に表示されているものの、2週目の終わりまでに、エア·メディア·インターフェイス上の細菌の斑状の成長は、見ることができます。この時点では容器の壁への細菌の付着も観察されています。この時点以降の文化の成長は主にエア·メディア·インターフェイス上で発生します。表面成長の下に液体が明確である。通常、構造体は、5週目(図1B)の終わりまでに成熟する。インキュベーションが長引く場合には、構造体は、容器の底に沈むが開始されます。興味深いことに、第三週の終わりまでキャップの締め付けは、プロセスの重要なステップであり、未知の理由のためにルーズに覆われた瓶は大幅にインターフェイス9上での成長の開始を遅らせる。
12ウェルフォーマットでは、空気媒体の界面で強固なバイオフィルムは、5週間(図2A)の最後にウェルのそれぞれで見られます。プレートは完全にラップされていない場合は、差動、バイオフィルムの成長が観察される。最悪の場合には、重要なメディアの蒸発は、細菌の増殖(図2B)を停止させることができます。したがって、プレートのラッピングは、両方の蒸発を防ぐためだけでなく、バイオフィルム形成(前の段落を参照)環境を提供する必要があります。
この手法で決定バイオフィルム中の生菌数は非常に再現性がある。 M.の応答結核バイオフィルムは抗生物質の性質によって異なります。そのようなリファンピシンとして殺菌性抗生物質については、生存率の低下は、バイファに従う SICの傾向9。人口の割合が小さいに関係なく、抗生物質や曝露時間の濃度の抗生物質に完全に反抗的なままにする永続的な段階に続いた最初の3〜4日の間に生存率の急激な減少。図3は、リファンピシンの50μg/mlの7日間暴露(MICの50倍)の後に成熟したバイオフィルム中の生菌数を示します。

M.の図1A。早期出現インキュベーションの3週間後の細菌のエア·メディア·インターフェイス上で結核菌 。

図1Bは、Mのバイオフィルムを成熟インキュベーションの5週間後の空気·メディア·インターフェイス上で結核 。
820/3820fig2A.jpg "/>
M.の図2A 5週齢のバイオフィルム結核は、12ウェルフォーマットで増殖させた。
図2B。パラフィルムなしで12ウェルプレートに結核菌バイオフィルムの成長に失敗した。
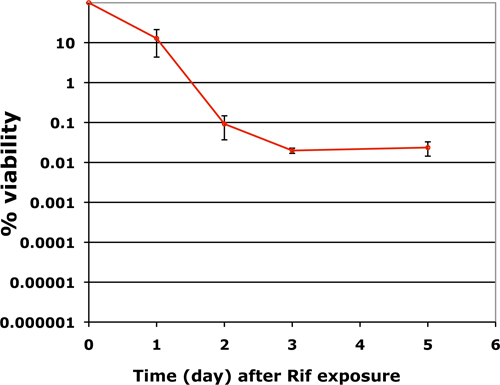
M.における薬剤耐性の永続化の頻度を示す図3代表的なプロット結核は、12ウェルフォーマットで成長し、7日間のリファンピシン50μg/mlのにさらされたバイオフィルム。
ディスカッション
結核菌の感染によって引き起こされる結核(TB)は、世界の公衆衛生にとって大きな脅威となっている。世界の人口の3分の1近くが無症候病原体に感染すると推定され、約900万の新しいケースは、結核や感染症の約170万、ダイの症状は毎年11で毎年診療所に表示されます。病気の大きな負担には、主にワクチンと六から九ヶ月にわたって投与多剤併用療法を含む非常に複雑な化?...
開示事項
我々は、開示することは何もありません。
謝辞
作品は、国立衛生研究所と米国肺協会からの財政支援を行った。
資料
| Name | Company | Catalog Number | Comments |
| Incubator | VWR international | Model # 1923/25 | |
| Polystyrene culture bottles | Fisher Scientific | 03-374-300 | |
| 12-well tissue culture plate | VWR international | 62406-165 | |
| 50-mL conical tubes | VWR international | 89039-660 | |
| Rocker | Thermo Fisher Scientific, Inc. | 57019-662 | |
| Chromatographic refrigerator | VWR international | 55702-520 | |
| petri dish | VWR international | 25384-342 | |
| KH2PO4 (monobasic) | EMD Millipore | PX1565-1 | |
| MgSO4 | Fisher Scientific | M65-500 | |
| L-asparagine | Sigma-Aldrich | A4284-100G | |
| citric acid | Sigma-Aldrich | C1857-100G | |
| ferric ammonium citrate | Sigma-Aldrich | F5879-100G | |
| glycerol | EMD Millipore | GX0185-5 | |
| NaOH | Sigma-Aldrich | S8045-500G | |
| ZnSO4 | Sigma-Aldrich | Z4750-500G | |
| D-pantothenic acid | Sigma-Aldrich | P2250-25G | |
| Difco Middlebrook 7H9 Broth | BD Biosciences | 271310 | |
| Middlebrook OADC Enrichment | BBL | 212351 | |
| Tween-80 | Fisher Scientific | T164-500 | |
| 250mL storage bottle | Corning | 430281 | |
| 12 well plates | Falcon BD | 353043 | |
| rifampicin | Sigma-Aldrich | R3501-1G | |
| methanol | JT Baker | 9070-05 | |
| 10mlLsyringe | BD Biosciences | 301604 | |
| 1-200μL pipet tips | VWR international | 89079-458 | |
| parafilm M | VWR international | PM-996 | |
| 15mL centrifuge tube | Greiner Bio-One | 188-285 | |
| Difco Mycobacteria 7H11 Agar | BD Biosciences | 283810 | |
| NaCl | Fisher Scientific | BP358-1 | |
| KCl | Sigma-Aldrich | P9333-500G | |
| Na2HPO4 (dibasic) | Sigma-Aldrich | S0876-500G |
参考文献
- Saltini, C. Chemotherapy and diagnosis of tuberculosis. Respir. Med. 100, 2085-2097 (2006).
- Hall-Stoodley, L., Stoodley, P. Biofilm formation and dispersal and the transmission of human pathogens. Trends Microbiol. 13, 7-10 (2005).
- Costerton, J. W., Stewart, P. S., Greenberg, E. P. Bacterial biofilms: a common cause of persistent infections. Science. 284, 1318-1322 (1999).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Curr Opin Microbiol. 9, 588-594 (2006).
- Henke, J. M., Bassler, B. L. Bacterial social engagements. Trends Cell Biol. 14, 648-656 (2004).
- Kolter, R., Losick, R. One for all and all for one. Science. 280, 226-227 (1998).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- Ojha, A. GroEL1: a dedicated chaperone involved in mycolic acid biosynthesis during biofilm formation in mycobacteria. Cell. 123, 861-873 (2005).
- Ojha, A. K. Growth of Mycobacterium tuberculosis biofilms containing free mycolic acids and harbouring drug-tolerant bacteria. Mol. Microbiol. 69, 164-174 (2008).
- Ojha, A. K., Trivelli, X., Guerardel, Y., Kremer, L., Hatfull, G. F. Enzymatic hydrolysis of trehalose dimycolate releases free mycolic acids during mycobacterial growth in biofilms. J. Biol. Chem. 285, 17380-17389 (2010).
- Dye, C., Lonnroth, K., Jaramillo, E., Williams, B. G., Raviglione, M. Trends in tuberculosis incidence and their determinants in 134 countries. Bull World Health Organ. 87, 683-691 (2009).
- Jindani, A., Dore, C. J., Mitchison, D. A. Bactericidal and sterilizing activities of antituberculosis drugs during the first 14 days. Am. J. Respir. Crit. Care Med. 167, 1348-1354 (2003).
- Carter, G., Wu, M., Drummond, D. C., Bermudez, L. E. Characterization of biofilm formation by clinical isolates of Mycobacterium avium. J. Med. Microbiol. 52, 747-752 (2003).
- Hall-Stoodley, L., Lappin-Scott, H. Biofilm formation by the rapidly growing mycobacterial species Mycobacterium fortuitum. FEMS Microbiol. Lett. 168, 77-84 (1998).
- Alibaud, L. Temperature-dependent regulation of mycolic acid cyclopropanation in saprophytic mycobacteria: role of the Mycobacterium smegmatis 1351 gene (MSMEG_1351) in CIS-cyclopropanation of alpha-mycolates. J. Biol. Chem. 285, 21698-21707 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved