このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
単純ヘルペスウイルスの待ち時間と再活性化の研究の主ニューロン培養システム
要約
プロトコルは、単純ヘルペスウイルス1型(HSV-1)の待ち時間と再活性化ヘルペスを研究するための効率的かつ再現可能なモデルシステムを説明しています。アッセイは、均質な交感神経ニューロンの培養を採用し、RNA干渉と組換えタンパク質の発現を含むさまざまなツールを使用してウイルスニューロンの相互作用の分子解剖を可能にします。
要約
単純ヘルペスウイルス1型(HSV-1)は、末梢神経における生涯潜伏感染を確立する単純。この潜在的な貯水池は、伝送を確保し、臨床疾患に寄与する再発再活性化イベントのソースです。現在の抗ウイルス薬は、潜在的な貯留層に影響を与えないし、ワクチンはありません。溶菌複製物の分子の詳細は十分に特徴付けされているが、ニューロンの遅延を制御するメカニズムは、とらえどころのないままになります。待ち時間の私達の現在の理解は、ウイルス遺伝子の要件と免疫応答の役割を定義するために欠かせないされている小さな動物モデルを使用して、in vivo試験から導出されます。しかし、それは生きた動物の免疫または非神経支持細胞によって媒介される感染症の、より一般的な結果から、ウイルスニューロンの関係で特定の効果を区別することは不可能である。さらに、動物実験では、ホストを操作するため、高価な時間がかかり、使用可能なオプションの点で制限されているプロセス。これらの制限を克服するために、ニューロンのみのシステムは、必死に待ち時間と再活性化の in vivo特性の再現が均質性とアクセシビリティの観点から組織培養の利点を提供することが必要になります。
ここでは、適合するHSV-1潜伏と再活性化を研究するためにラットの上頚神経節(SCG)( 図1)から培養された主要な交感神経ニューロンを活用したin vitroモデル内に存在するほとんどすべての希望する条件の場合。非神経細胞を除去した後、ほぼ均質体TrkA +ニューロン培養物は、溶菌複製を抑制するためにアシクロビルの存在(ACV)はHSV-1に感染しています。 ACVの除去に続いて、忠実に待ち時間の受け入れの特徴を示す非生産的なHSV-1感染が効率的に確立されています。特に、溶解性のmRNA、タンパク質、感染性ウイルスはさらに選択の非存在下で、検出限界以下になりますが、潜伏関連転写(LAT)急行イオンは、神経細胞核内に保持されます。ウイルスゲノムは、ニューロンあたり25の平均コピー数で維持されており、生産PI3-キナーゼ/ Aktシグナル伝達や神経成長因子1の単純な撤退を妨害することによって複製するように誘導することができる。ウイルスの溶菌タンパク質US11に融合した組換えHSV-1エンコーディングEGFPは、容易に定量化され再活性化に起因する複製の機能、リアルタイムのマーカーを提供する。化学的処理に加えて、このようなレンチウイルスベクターを介したRNA干渉または遺伝子送達などの遺伝の方法論は、正常動物では、非常に困難、不可能ではないです。機構の研究を可能にするシステムに適用することができます。要約すると、SCGベースのHSV-1の遅延/再活性化システムは、ニューロンのHSV1待ち時間と再活性化、そのソリューションは、新しい治療法の開発に新鮮な洞察を提供することがあり、ウイルス分野でも長年のパズルを制御する分子機構を解明するための強力な、必要なツールを提供していますターゲットT彼は、ヘルペスウイルスリザーバーを潜在。
プロトコル
1。ラット胚からSCG神経細胞の単離および培養
このプロトコルを理解するための有用なコンテキストを提供し、するために以前の文献の包括的な議論のためのそのin vitro培養、プレートコーティング基板、無血清培地の成分でSCGのための基礎を含むSCGニューロン培養の確立された方法、読者は参照2から4と 呼ばれています。
- SCG神経細胞のソースとしてラットの使用は、 動物実験ケア&使用委員会 (IACUC)によって承認され、アクティブなプロトコルの下でNIHのガイドラインに従って実施されました。
- 解剖を開始する前に、コラーゲン、ラミニンコート96ウェル組織培養皿を準備します。マルチチャンネルピペッティングデバイスを使用して、0.66 mg / mlのラット尾コラーゲンを含む溶液ですべての96ウェルを満たします。すぐに回復し、最大8解剖のために使用することができるコラーゲンを、削除します。トンを除去した後、彼コラーゲンは、層流フードの下に井戸が乾燥させることは非常に重要です。それが乾燥するのにかかる時間の量は、皿のウェルの数によって異なります。例えば、それは一般的に約5〜10分かかります。乾燥させ、96ウェルディッシュに井戸が、30まで取ることができます - 大きなフォーマット24ウェルディッシュが使用されている場合は40分。適切に貧しいSCGの添付ファイルのウェルの結果を乾燥させるために失敗しました。次に、2μg/ mlのラミニン溶液を用いて手順を繰り返します。あなたは、プレートあなたのニューロン(ステップ1.14)の準備が整うまで、37℃加湿CO 2インキュベーター内でCで少なくとも2時間のラミニン溶液をインキュベートします。
- 商業的に得られた妊娠雌ラットは、CO 2を用いて安楽死されています。 70%エタノールで死体を噴霧した後、U字型の切開は、腹部の周りに作られています。皮膚に戻って剥離した後、第二のU字型切開は、腹部の筋肉壁を介して行われます。子宮は腹部の筋層を持ち上げる時に表示されます。 15の子宮と場所を削除します。cmディッシュ。慎重の中に子犬の損傷を防ぐために、鈍いはさみを使って子宮を開きます。それぞれの子犬は、その胚嚢、切断された臍帯から解放され、PUPは、70%エタノールとキムワイプで拭いている必要があります。
- 解剖フードで働いて、胴体から頭を剪断により胎児E21仔ラットを生け贄に捧げる。ちょうど肩の上に、首の付け根にハサミを目指しています。神経を公開するには、3つの場所に23 G針を使用してヘッド(最大首側)突き止める;ⅱ)前の肌は鼻を介してプルアップとピン、i)は脊髄をおよびiii)食道/気管は離れて確保されることが必要首の付け根から。
- 頸動脈分岐部(胚あたり2 SCGs)のいずれかの側に位置する2つのSCG *を探します。 SCGはちょうどブランチの下にあります。離れて分岐を引っ張って動脈からSCGを分離します。氷上で15 mlのコニカルチューブにL15-メディア(0.4%D(+) - グルコース添加)の12ミリリットルに神経を置きます。
* SCGは、分岐を取り巻く不透明な、黄色がかった脂肪組織に比べて半透明で無色である。神経を収集する前に、残存脂肪組織と血管の限りを削除しようとする。
- すべてのSCGsは胚から採取されるまで、1.4および1.5を繰り返します。
- 穏やかに、600rpmで1分間神経を遠心して余分な培地を吸引除去する。
- L15-メディアを含むトリプシン(0.25%、EDTAを含まない)とコラゲナーゼ(1 mg / ml)を1ml中に神経を再懸濁します。 37℃で30分間インキュベート°C、10分毎に撹拌します。
- 600rpmで1分間トリプシン遠心を不活性化するためにC-メディア(1×MEM、0.4%D(+) - グルコース、2 mM L-グルタミン、10%FBS)10 mlを追加します。
- できるだけ*としてトリプシン/コラゲナーゼのメディアを削除し、C-メディア10mlのと神経を洗う。 600rpmで1分間遠心します。一度、この手順を繰り返します。
*残留コラゲナーゼはinterfeます。培養プレートに細胞接着に必要なコラーゲン基質を使用して再。
- 洗浄メディアを取り出して、C-培地1 mlの再懸濁核と細胞*の大きい塊を解離させるために、5 mlシリンジに取り付けられた21 G針を使用して粉薬。目に見える塊が解離されるまで23 G針で摩砕終了します。
*これは細胞を損傷するので、オーバー粉薬ないように注意してください。トリプシンとコラゲナーゼ処理が成功した場合、15の最大上下21 G針でサイクル;と23 G針を持つ3つのサイクルが十分でなければなりません。
- 70μmのナイロンフィルター[BD Biosciences社のセルストレーナー]から解離したニューロンをフィルタリングし、残りの塊を捨て、50 mlのコニカルチューブに。
- フィルタリング細胞懸濁液と生細胞数を決定するためにトリパンブルーと混合し、10μlのアリコートを撤回することができる。積極的にアンビルセルの数を数えるUDE血球を用いた色素。
- 37℃インキュベーター(STEP 1.2を参照)で待機している96ウェルディッシュからラミニン溶液を除去します。ラミニンが削除された後の皿を乾燥させないでください、それはメッキ細胞に対して直ちに使用することができます。コラーゲンとラミニンプレコート96ウェル組織培養皿に- * 5,000〜6,000 総生細胞(ウェルあたり100μlの50)分注します。 C-メディアで50 ng / mlの神経成長因子(NGF)が含まれています。
*これは、抗生物質が増殖培地から省略されているため、優れた滅菌組織培養技術を採用することが重要です。さらに、異なるサプライヤから供給コラーゲンの間で有意な変動がある場合もあります。我々は、ミリポアからラット尾コラーゲンを使用してバッチ間で一貫性のある結果がありました。
- グルコース、2 mM L-グルタミン、50 ng / mlのNGFを含むB-27サプリメント、 - DIV(in vitroでの日 )1で、50μlのNBM(0.4%D(+)プレートの細胞をするために使用するC-メディアを交換する5μMアフィジコリンおよび20μM5 - フルオロウラシル[5 - フルオロ-2'-デオキシウリジン]。 5日間の文化*をインキュベートします。この時点では、トリプシン処理し、いくつかのウェルに残りのセルをカウントすると、抗有糸分裂剤治療を生き残ったニューロンの数を決定することができます。通常は、約1,000のニューロンは、96ウェルプレートにウェル当たり残っています。
真菌や細菌汚染の*問題は文化の最初の24時間以内に通常明らかである。前に置き換えメッキメディアへの微生物の成長のために慎重に各ウェルを調べます。井戸の限られた数が影響されている場合にのみ、彼らは実験を続行するために、希釈漂白剤溶液で処理し、PBSですすぎ、乾燥させることができる。我々は井戸のも限られた数は、微生物汚染を持っていた実験を繰り返すことをお勧めします。広範囲の微生物汚染は、96ウェルディッシュに観察されている場合は、実験が終了しなければなりません。
2。 SCGカルトの感染レイテンシのHSV-1 US11-EGFPと設立したURES
基本的なウイルスのウイルス力価を決定する伝播、および感染多重度(MOI)を含むウイルス学的技法の有用な背景については、読者は参考文献5と呼ばれています。ヘルペスウイルスの生物学の議論のために、読者は参考文献6と呼ばれています。最後に、読者は前の例では、他のプロトコル、およびSCGニューロンのα-ヘルペスウイルス溶解感染に関する追加の背景および待ち時間と再活性化を研究する我々のプロトコルの適応との比較7-10参照と呼ばれています。
- DIV 6で、各ウェル*内の既存のメディアにアシクロビル(ACV)、最終濃度100μMを追加します。各ウェル50μlを含まれている場合、たとえば、300μMACVの株式の25μlを加える。通常は、ACVは、感染前の晩に追加されますが、また、感染する前に6から8時間を追加することができます。
*これは 、exです。すべての回でのニューロンの不必要な物理的な操作を最小限に抑えるためにceedingly重要です。単に削除して、メディアを交換したり、ウイルス株で感染は非常に優しく、ゆっくりと行う必要があります。そうでない場合、結果の機械的ストレスに悪影響ニューロンの生存に影響を与えることができます。
- DIV 7時、1〜2の間で感染多重度(MOI)(最適なMOIを決定する際に以下の重要なコメントを参照してください)で、HSV-1 US11-EGFP(REF 11に記載)とSCGの文化を感染させる*。ウェル内の既存のメディアに直接希釈したウイルスを追加します。モック感染制御とACVを欠く培地で溶解感染陽性コントロールが含まれています。感染は37℃で2〜3時間のために続行することができ℃の
* MOIは、Vero細胞12とステップ1.14ウェルあたり播種メッキ、生細胞数のプラークアッセイを実行することによって決定し、ウイルス力価を使用して計算されます。この計算では、唯一の運用という意味で便利です。総細胞数とシードは、グリア、および線維芽細胞を汚染すると共に、ニューロンが含まれています。これらの汚染に分裂する細胞は、抗有糸分裂剤で処理することによって殺されているように、生き残ったニューロンのMOI効果は実際に大きい。 5000の初期開始量から - 6,000生きた細胞、約1,000人の神経細胞は抗有糸分裂剤(としてトリプシン処理し、直接細胞計数により評価)で処理した後に残っています。神経培養を感染させるときに使用する最適なMOIは1ウイルスストックの調製次から次へと多少異なる場合があります。ウイルスのすべての新規作成では、我々は異なるMOIの1から2までの限られた範囲をテストすることをお勧めします。ここでの目標は、ニューロンの生存性および誘導性再活性化イベント(セクション3で定義されている)の最大数の結果に応じて、少なくとも影響を持つものを識別することです。 US11-EGFPウイルスは急速に条件を最適化する場合に特に便利ですが、1つはまた、プラークアッセイや量子などの他の読み出しを使用することができますtative PCR。これが不可欠と日常的に行っていないではありませんが、細胞の生存率を減少させる不純物を除去するためにショ糖クッションで精製ウイルスを使用するために役立ちます。
- 慎重に 50 ng / mlのNGFおよび100μMACV *を含む新鮮なNBM感染メディアを交換してください。
*これは、感染媒体を変更する場合に非常に穏やかであることが非常に重要です。井戸の壁ではなく、井戸の底にピペットの先端を目指し、メディアは静かに細胞に下にスライドすることができます。ピペットからのメディアでさえ急速な放出は、基板からの軸索を切り離し、細胞は細胞のシートとして一般的にオフスラウを引き起こすために十分な力を生成することができます。ニューロンのデタッチ(20-30%)の数は限られている場合にのみ、結果は、細胞が健康な表示されていることを提供する最小限に抑えられています。デタッチされたニューロンは、時間をかけて再接続する可能性がありますが、軸索は、もはやうまく延長されませんD新しい軸索が再成長します。最適ではありませんが井戸の限られた数が影響を受けている場合にのみ、実験が進むことができます。神経細胞(70-80%)の広範な剥離があれば、私達は実験の影響を受けるだけでなく、(S)を含むことはお勧めできません。井戸の大半は70〜80%戸建のニューロンが含まれている場合、我々は実験を終了することをお勧めします。 ニューロンがまだアタッチかもしれませんが、彼 らは一般的に大きな塊を形成します。これは、個々の再活性化ニューロンの適切な評価を複雑にします。我々は、デタッチされたニューロンと井戸が再活性化率がウェルにニューロンの差の付着の影響を受けなかったことを確認することが観察されたすべての実験を繰り返すことをお勧めします。
さらに、それは常に優しくとしての可能性としての文化を扱うことが重要です。不必要な、突然の動き(インキュベーター室のドアの繰り返し開閉を含む)からの機械的ストレスや力強いメディアアプリケーションCウルド妥協可能性が与えられた実験では自発的な再活性化の容認できないほど高い率で、その結果、HSV-1の遅延をサポートするための文化力。
- ウイルスは潜伏を確立し、その間6日間培養を維持します。この期間中に、溶菌複製の指標として、神経細胞の健康やUS11-EGFPの発現を監視するために蛍光顕微鏡を使用しています。 US11-EGFPは成功した一次感染と生産性溶菌複製を示す、ACV治療を欠いているコントロールウェルでのみ検出されるべきである。ニューロンは、さらに生産性の高いウイルス増殖の有無で細胞変性効果を示す可能性があります。感染した文化は密接に監視し、モック感染ニューロンに比較する必要があります。
3。再活性化と評価
- DIV 14で、慎重にACVを欠いている新鮮な培地とACV含有培地を交換してください。適切であれば、この時点では薬理学的(あるいは生物学的な)変数が含まれています。 sである2.3で述べた注意事項に従っるものをいい、ラベルにより表示。
- 5から6日間にわたって、再活性化を受けた神経細胞を検出するために蛍光顕微鏡を使用して、ライブの文化を監視します。また分析の他のタイプ(タンパク質、核酸、プラークアッセイなど)のサンプルを収集します。
- EGFP陽性ニューロンを含むウェルの数をカウントすることによって再活性化頻度を計算し、サンプルウェルの総数の割合としてこれを表現します。個々のEGFPの発現がうまくウイルスの拡散に起因する主な再活性化のイベントとその後の感染を区別しないことに注意してください。感染の広がりがよく、単一の文化に含まれているので、よく内の1つまたは複数のEGFP陽性ニューロンは、運用上、これらの条件下で1再活性化イベントとして定義されています。
1で説明したように*複数の再活性化イベントは、文化の中で発生する可能性があります。反応に起因するウイルスの拡散からの主な再活性化イベントを区別するために tivationは、カプシド形成阻害剤WAY-150138を追加することができます。キャプシドを遮断することによって、感染性ウイルスを生産し、再活性化から生じる広がるされていないことはできません。したがって、WAY-150138の存在下で検出されたEGFPシグナルは焦がす培養ウェル1,13-15内の独立した再活性化イベントの数を反映しています。 WAY-150138のみがHSV-1パットン株と市販されていないに対して有効であることに注意してください。 WAY-150138に代わるものとして、次のいずれかを使用することを検討します。i)隣接するセルに拡散する能力に障害の変異ウイルスを利用することができます。ⅱ)EGFPは連続存在下でIEプロモーターから発現されたレポーターウイルスACVのⅲ)IE遺伝子産物に対する免疫蛍光抗体を用い、続いて後期遺伝子の発現(および感染性ウイルスの産生を)防ぐために、PAAまたはACVによる治療。
4。 Assayを用いて再活性化を評価するための代替方法
個々の、単一の実験から ontent "> の結果は、SCGの単一の製剤から得られるべきである。それぞれの複製は、単一のSCGのバッチを用いて行ったとして複製実験は限り独立したSCGの準備を行うことができます。- HSV-1溶菌の転写産物の評価。再活性化の様々な実験的な誘導物質の存在下または非存在下でACVを除去した後、目的の時点でRNAを収集します。 96ウェル培養プレートを使用する場合、我々は(RNA試料当たり約10 5細胞)を各サンプルのために一緒に少なくとも20の井戸をプールすることをお勧めします。また、SCGsは、より大きなウェル(ウェル/ 4から5×10 4細胞を使用して、24ウェルプレートの場合など)に播種することができます。それが20未満の井戸からRNAを検出することは可能ですが、小さなボリュームでは、不当なサンプル間の変動の結果を含んだ。
- HSV-1溶解性タンパク質の検出。再活性化の誘導後、所望の時間で溶解物を収集します。 10ワットのそれぞれに溶解バッファー7.5μlを加え96ウェルプレートでellsとSDS-PAGEおよび免疫ブロッティングにより分析します。また、ウイルスタンパク質は、間接免疫蛍光顕微鏡で検出することができます。初期めっき(1.10を参照)などのコラーゲンとラミニンのアプリケーションへの事前のポリ-D-リジン(0.2 mg / mlと、Sigma)でプレコートされた無菌のカバーガラスとしてイメージングのためのマウント基板上に行わなければなりません。
- 感染性粒子の検出。再活性化時に培養上清を収集します。上清の希釈系列を用いたVero細胞の単層上でプラークアッセイを実行します。さらに、プラークアッセイ力価を決定するために細胞関連粒子を含むように凍結融解培養のライセートを用いて行うことができます。
5。代表的な結果
図2Aは、1μMのトリコスタチンAは、(TSA)、アクティベー16から18の既知の誘導は、野生型Hと潜伏感染の文化をSCGに適用される例を示していますSV1 EGFP-US11レポーター株。 TSAでは、再活性化は、井戸の約60%で再活性化の台地を2日以内に最大値の50%に達し、5日で。ベースライン( '自発的')再活性化は、この実験では約10%であり、通常はin vitroの系でこれを使って10から20パーセントの範囲である。最大再活性化のレベルが再活性化誘導を利用しているかによって異なります。多くの再活性化の誘導は、それらが生産的なウイルス複製を妨害しないように実験の期間中に適用されたが、これは経験的に決定する必要がありますすることができます。ニューロンの生存に影響を与えるか、ウイルス生産的な生活サイクルの完了を妨げるすべての試薬を含む、他の誘導剤は、一時的なパルス·アプリケーションが再活性化を引き起こすために必要な場合があります。
図2Aに示されている実験の各ウェルにEGFP-US11の蓄積は待ち 時間から再活性化の指標であるが、それはどうかは区別されません個々のニューロンのUS11-EGFP信号は独立した再活性化イベント、または文化を通じて再活性化ウイルスの拡散に由来しています。各ウェル中の独立した再活性化イベントを受けているニューロンの数を評価するために、文化はWAY-150138、具体的にはウイルスDNAゲノム13から15までのキャプシドを防止することにより、ウイルスの拡散を阻止する化合物で前処理した。感染した交感神経ニューロンの培養は、WAY-150138とTSAで誘導した再活性化処理した。 EGFP陽性ニューロンの重要な数字は独立した再活性化イベントの数が( 図2B)は、個々の文化あたりに発生することを実証し、DMSO処理対照培養と比較して、TSA処理したウェルでのみ検出された。
我々のアッセイでは、US11-EGFPレポーターは、内因性プロモーターUS11 11から表現されます。 US11は、 "真の遅い"またはγ2ウイルスの溶菌遺伝子であるため、ウイルスのDNA複製は、堅牢なexpressiが必要ですで。 EGFP-US11の蓄積がPI3-キナーゼ阻害剤LY294002で再アクティブ化するように誘導培養ではウイルスDNAポリメラーゼ阻害剤ホスホノ酢酸(PAA)によって損なわれるので、これは、 図3に示されています。
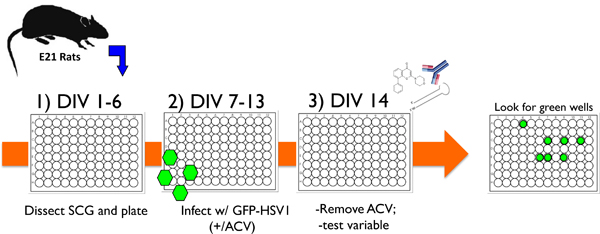
図1。 HSV-1潜伏と再活性化を研究するためにin vitroの系で培養したニューロンを用いた典型的な実験プロトコルを示す概略図。1)E21ラットから上頚神経節(SCG)を解剖した後、解離した神経細胞を96ウェルディッシュに播種され、抗有糸分裂で処理エージェントは、非神経細胞を除去します。 2) 試験管内 (DIV) で 6日後に培養物は、存在アシクロビル(ACV)、抗ウイルス薬でウイルスにエンコードされUS11後期遺伝子(EGFP-HSV-1)に融合したEGFPを含む組換えHSV-1に感染しているブロック溶菌複製。 3)14日(DIV 14)、アシクロビルが削除され、EGFP発現によって検出されません。 1ヶ月以上、またはテスト変数の文化を安定的にこのような方法で維持することができますが待ち時間の再活性化を誘発する能力を評価するために追加することができます。変数のいずれかの遺伝子特異的なshRNAまたは異所的に発現蛋白質を発現する小分子の化学的阻害剤、水溶性のニューロトロフィンまたは細胞表面タンパク質に対する抗体、またはレンチウイルスの形にすることができます。再活性化は、リアルタイムでのEGFP陽性ウェルの得点によって監視されています。
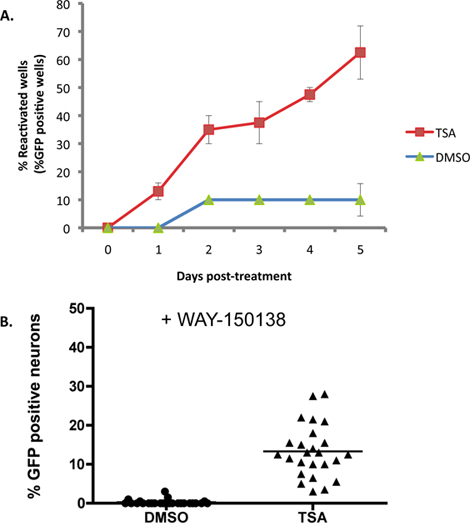
図2。 TSAは、SCGの文化ではHSV-1が再度アクティブになります。図1で説明したようにSCG文化が潜伏感染していた。 DIV 14で、ACVは、(TSA)1μMのトリコスタチンAを含むメディアを取り外して交換しました。 (A)の培養物を可視化し、5日間の期間の薬物治療の後に毎日、蛍光顕微鏡を用いて評価した。 reactivatを受けた井戸の割合実験の過程でイオンはDMSOコントロールで処理した培養物と比較して示されています。再活性化の割合は、96ウェル培養プレートの20ウェルの外EGFP陽性ウェルの数によって算出した。エラーバーは平均値の標準誤差を示しています。 (B)潜伏感染培養はTSAとウイルスDNAカプシドの阻害剤、WAY-150138(20μg/ ml)で処理した。 EGFP +ニューロンの数は、DMSOとWAY-150138で処理されたコントロールへの薬物による治療後48時間を比較した。各データポイントは、ウェル培養1,000ニューロンのEGFP +ニューロンのうちの比率を表しています。バーには、ウェル内のEGFP +ニューロンの平均比率を示しています。
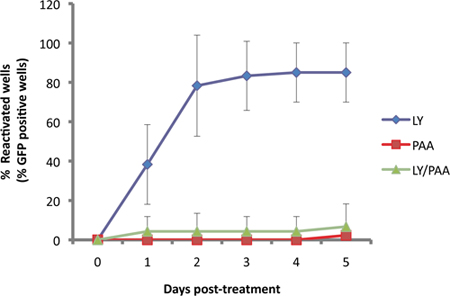
図3。 EGFPのdetecionは、ウイルスDNA複製に依存しています。SCG文化が潜在LY29004、再活性化1の既知の誘導剤の10μMで処理して感染させた。 LY(青)WAによって誘導される再活性化sはウイルスDNA合成阻害剤、phophonoacetic酸、PAA(300μg/ml、赤)と2つの化合物(緑)で処理したものに比較した。
ディスカッション
この主要なニューロンの培養と感染システムは、HSV-1潜伏と再活性化の分子機構を探索するためのシンプルで効果的な方法を提供します。システムは、忠実に反復するヒトの感染の両方で、ライブ動物モデルで定義された待ち時間の受け入れの特徴を。ウイルスはSCGの文化に潜在されている場合、感染性粒子とウイルスの溶菌遺伝子産物を検出することはできません。潜伏感染し...
開示事項
利害の衝突が宣言されません。
謝辞
我々は、この原稿を向上させるために助けた彼らの思慮深い提案のためのレビューに感謝します。この作品は、NIHからMVC(NS21072、HD23315)、ACW(GM61139、S10RR017970)とIM(AI073898、GM056927)への補助金によって支えられている。 MKは、NIHの訓練助成金(5T32 AI007180)によって部分的にサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬 | 会社 | カタログ# | コメント |
| 70μmナイロンフィルター(セルストレーナー) | BDバイオサイエンス | 352350 | |
| 1xのハンクス平衡塩溶液(HBSS - / - ) | インビトロジェン | 14175 | W / O CaCl 2とMgCl 2を |
| 1xの最小必須培地(MEM) | インビトロジェン | 11095-080 | |
| 5 - フルオロ-2'-デオキシウリジン | シグマ | F0503 | 1xのMEMに20 mMのストックを準備し、-20℃で保存 |
| 96ウェルフラットウェル底TCプレート | コーニング | 3599 | |
| アシクロビル | のカルビオケム | 114798 | DMSO 31 mMのストックを準備し、-20℃で保存 |
| アフィジコリン | カルビオケム | 178273 | DMSO中の10mMストックを準備し、-20℃で保存 |
| B-27サプリメント | インビトロジェン | 17504から44 | |
| コラゲナーゼ | シグマ | C2674 | -20℃ストア; - / - HBSSで10 mg / mlのストックを準備 |
| D-(+) - グルコース | シグマ | G6152 | H 2 Oで40%の株式を準備し、フィルタは4℃で殺菌&ショップ°C |
| L-グルタミン | インビトロジェン | 25030-081 | |
| ラミニン | シグマ | L2020 | クイックフリーズ20μlを、H 2 Oに1 mg / mlのストックを準備-80 aliquats&店舗°C;希〜2μg/ mlの仕事の濃滅菌H 2 Oで |
| Leibovit'z L-15メディア | インビトロジェン | 11415 | |
| 神経成長因子 | ハーランラボラトリーズ | BT.5017 | - / - HBSSで50μg/ mlのストックを準備し、-80℃で保存 |
| Neurobasal培地 | インビトロジェン | 12348 | |
| ホスホノ酢酸(PAA) | シグマ | P6909 | -20℃で店舗、H 2 Oの75 mg / mlのストックを準備 |
| ポリ-D-リジン臭化水素酸塩 | シグマ | P0899 | -20℃で店舗、H 2 Oで20 mg / mlのストックを準備 |
| ラットテールコラーゲン | ミリポア | 08から115 | 濃度は、供給のロットによって変化します。4℃保存と希〜0.66 mg / mlの仕事の濃滅菌H 2 Oで |
| トリコスタチンA | シグマ | T8552 | DMSO中1mMのストックを準備し、-20℃で保存 |
| トリプシン2.5パーセント | インビトロジェン | 15090から04 |
参考文献
- Camarena, V., Kobayashi, M., Kim, J. Y., Roehm, P., Perez, R., Gardner, J., Wilson, A. C., Mohr, I., Chao, M. V. Nature and duration of growth factor signaling through receptor tyrosine kinases regulates HSV-1 latency in neurons. Cell Host & Microbe. 8, 320-330 (2010).
- Johnson, M. I., Fedoroff, S., Richardson, A. Primary cultures of sympathetic ganglia. Protocols for Neural Cell Culture. , 71-94 (2001).
- Letourneau, P. C., Fedoroff, S., Richardson, A. Preparation of substrata for in vitro culture of neurons. Protocols for Neural Cell Culture. , 245-254 (2001).
- Price, J. P., Brewer, G. J., Fedoroff, S., Richardson, A. Serum-free media for neural cell cultures. Protocols for Neural Cell Culture. , 255-264 (2001).
- Flint, S. J., Enquist, L. W., Racaniello, V. R., Skalka, A. M. . Principles of virology. , (2008).
- Roizman, B., Pellett, P. E., Knipe, D. M., Howley, P. M. The family Herpesviridae: A brief introduction. Fields Virology. 2, 2381-2397 (2001).
- Price, R. W., Rubenstein, R., Khan, A. Herpes simplex virus infection of isolated autonomic neurons in culture: viral replication and spread in a neuronal network. Arch. Virol. 71, 127-140 (1982).
- Tomishima, M. J., Enquist, L. W. A conserved alpha-herpesvirus protein necessary for axonal localization of viral membrane proteins. J. Cell Biol. 154, 741-752 (2001).
- Ch'ng, T. H., Flood, E. A., Enquist, L. W. Culturing primary and transformed neuronal cells for studying pseudorabies virus infection. Methods Mol. Biol. 292, 299-316 (2005).
- Wang, F., Tang, W., McGraw, H. M., Bennett, J., Enquist, L. W., Friedman, H. M. Herpes simplex virus type 1 glycoprotein E is required for axonal localization of capsid, tegument, and membrane glycoproteins. J. Virol. 79, 13362-13372 (2005).
- Benboudjema, L., Mulvey, M., Gao, Y., Pimplikar, S. W., Mohr, I. Association of the herpes simplex virus type 1 us11 gene product with the cellular kinesin light-chain-related protein PAT1 results in the redistribution of both polypeptides. J. Virol. 77, 9192-9203 (2003).
- Blaho, J., Morton, E. R., Yedowitz, J. C. Herpes simplex virus: propagation, quantification and storage. Curr. Protoc. Microbiol. Chapter 14, Unit 14E.1 (2005).
- Van Zeijl, M., Fairhurst, J., Jones, T. R., Vernon, S. K., Morin, J., LaRocque, J., Feld, B. L., O'Hara, B. L., Bloom, J. D., Johann, S. V. Novel class of thiourea compounds that inhibit herpes simplex virus type 1 DNA cleavage and encapsidation: resistance maps to the UL6 gene. J. Virol. 74, 9054-9061 (2000).
- Newcomb, W. W., Brown, J. C. Inhibition of herpes simplex virus replication by WAY-150138: assembly of capsids depleted of the portal and terminase proteins involved in DNA encapsidation. J. Virol. 76, 10084-10088 (2002).
- Pesola, J. M., Zhu, J., Knipe, D. M., Coen, D. M. Herpes simplex virus 1 immediate-early and early gene expression during reactivation from latency under conditions that prevent infectious virus production. J. Virol. 79, 4516-14525 (2005).
- Arthur, J. L., Scarpini, C. G., Connor, V., Lachmann, R. H., Tolkovsky, A. M., Efstathiou, S. Herpes simplex virus type 1 promoter activity during latency establishment, maintenance and reactivation in primary dorsal root neurons in vitro. J. Virol. 75, 3885-3895 (2001).
- Danaher, R. J., Jacob, R. J., Steiner, M. R., Allen, W. R., Hill, J. M., Miller, C. S. Histone deacetylase inhibitors induce reactivation of herpes simplex virus type 1 in a latency-associated transcript- independent manner in neuronal cells. J. Neurovirol. 11, 306-317 (2005).
- Terry-Allison, T., Smith, C. A., DeLuca, N. A. Relaxed repression of herpes simplex virus type 1 genomes in murine trigenminal neurons. J. Virol. 71, 12394-12405 (2007).
- Harris, R. A., Preston, C. M. Establishment of latency in vitro by the herpes virus type 1 mutant in1918. J. Gen. Virol. 72, 907-913 (1991).
- Wagner, E. K., Bloom, D. C. Experimental investigation of herpes simplex virus latency. Clin. Microbiol. Rev. 10, 419-443 (1997).
- Strelow, L. I., Laycock, K. A., Jun, P. Y., Rader, K. A., Brady, R. H., Miller, J. K., Pepose, J. S., Leib, D. A. A structural and functional comparison of the latency-associated transcript promoters of herpes simplex virus type 1 strains KOS and McKrae. J. Gen Virol. 75, 2475-2480 (1994).
- Stroop, W. G., Banks, M. C. Herpes simplex virus type 1 strain KOS-63 does not cause acute or recurrent ocular disease and does not reactivate ganglionic latency in vivo. Acta Neuropathol. 87, 14-22 (1994).
- Sawtell, N. M., Poon, D. K., Tansky, C. S., Thompson, R. L. The latent herpes simplex virus type 1 genome copy number in individual neurons is virus strain specific and correlates with reactivation. J. Virol. 72, 5343-5350 (1998).
- Thompson, R. L., Cook, M. L., Devi-Rao, G., Wagner, E. K., Stevens, J. G. Functional and molecular analysis of the avirulent wild-type herpes simplex virus type 1 strain KOS. J. Virol. 58, 203-211 (1986).
- Wilcox, C. L., Smith, R. L., Freed, C. R., Johnson, E. M. Nerve growth factor-dependence of herpes simplex virus latency in peripheral sympathetic and sensory neurons in vitro. J. Neurosci. 10, 1268-1275 (1990).
- Roehm, P. C., Camarena, V., Gardner, J. B., Wilson, A. C., Mohr, I., Chao, M. V. Cultured vestibular ganglion neurons demonstrate latent herpes simplex type I reactivation. Laryngoscope. 121, 2268-2275 (2011).
- Kuhn, M. A., Nayak, S., Camarena, V., Gardner, J., Wilson, A., Mohr, I., Chao, M. V., Roehm, P. C. A cell culture model of facial palsy resulting from reactivation of latent herpes simplex virus type 1. Otology & Neurotology. , (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved