Method Article
バイオマーカー探索のためのメソポーラスシリカ薄膜の低分子量蛋白質の濃縮
要約
我々は、ヒト血清からの低分子量タンパク質およびペプチドの選択的回収のためのメソポーラスシリカ薄膜に基づいて技術を開発しました。私たちのメソポーラスチップの物理化学的性質を細かくペプチド濃縮の実質的な制御を提供し、その結果、診断のため血清プロテオームのプロファイリングをするように調整されました。
要約
循環バイオマーカーの同定は、非侵襲的な早期診断と予後のアプローチだけでなく、治療効果のモニタリングのための大きな可能性を保持しています。1〜3または組織や細胞から放出小さなタンパク質で構成される循環する低分子量のプロテオーム(LMWP)大規模なタンパク質のタンパク質分解に由来するペプチド断片が、患者の病態に関連付けられており、おそらく病気の状態を反映しています。これらの潜在的な臨床応用にもかかわらず、4,5されており、質量分析(MS)の使用はLMWPをからプロファイルする生物学的液体は非常にために、血清中のタンパク質およびペプチド濃度の広いダイナミックレンジに挑戦であることが判明した。6サンプル前処理なしで、より高濃度タンパク質のいくつかは、血清/血漿中の低濃度種の検出を不明瞭。そのような二次元ポリアクリルアミドゲル-ELとして、現在のプロテオミクスベースのアプローチ、ectrophoresis(2D-PAGE)とショットガンプロテオミクスの方法は、スループットの低い労働集約型であり、臨床応用のための限られた適合性を提供します。7月9日したがって、より効果的な戦略は、血液からLMWPを分離し、臨床試料のハイスループットスクリーニングを可能にするために必要とされる。
ここでは、特にターゲットとLMWPを豊かにするメソポーラスシリカのチップに基づいて、高速、効率的かつ信頼性の高いマルチ分画システムを提案する。10,11メソポーラスシリカ(MPS)、ナノスケールで調整可能な機能を備えた薄膜はトリブロック共重合体テンプレートの経路を用いて作製した。前駆体溶液の異なるポリマーテンプレートおよびポリマー濃度を用いて、様々な細孔径分布、細孔構造、接続性と表面特性が決定され、低質量のタンパク質の選択的回収に適用した。それらの物理化学的性質に応じて異なるサブクラスに富むペプチドの選択的な解析には専用ます回復と低濃度種の検出の効率化を見据え、。質量分析と統計分析との組み合わせで、我々は、メソポーラスシリカ薄膜のナノ相特性と低質量プロテオーム収穫の特異性と有効性の相関関係を示した。結果はここに複雑な生物学的流体からLMWP収穫のための従来の方法に強力な代替手段を提供するために、ナノテクノロジーベースの技術の可能性を明らかに提示した。材料特性を調整する機能、低コスト生産のための能力のために、サンプルの収集、および分析のために大幅に減少したサンプルの要件のシンプルさと速さは、この小説ナノテクノロジーは、実質的にプロテオミクス、バイオマーカーの研究と臨床プロテオミクスの分野に影響を与えます評価。
プロトコル
1。チップの作製
- 加水分解されたケイ酸塩前駆体溶液を用いて起動することによってチップのコーティング溶液を作成します。エタノール17 mLでオルトケイ酸テトラエチル(TEOS)の14 mLを混合し、強力な攪拌しながら脱イオン水と6M塩酸0.5 mLを6.5 mLの(1200 rpm)のホットプレートを攪拌使用します。攪拌を一定に保ち、2時間、80℃でこの溶液を加熱する。
- 強く攪拌しながら室温でエタノール10mlに所望のトリブロックcoploymer(プルロニックF127、L121およびP123)を追加することにより、ポリマー溶液を準備します。室温で強力な2時間撹拌し、続いてトリブロック共重合体溶液にケイ酸塩溶液(ステップ1.1から)7.5 mlを加えることによって混合物を完了します。これは最終的なコーティング溶液を表しています。
- 20秒間1500rpmの速度でスピンコーティングすることにより、4インチシリコンウエハにコーティング溶液の1 mLを適用します。 80その後、熱℃で12時間。
- 有機suを削除するには、フィルムを加熱する425温度1℃当たりの分を上げることによってrfactant°C、その後5時間焼く。
- 酸素プラズマアッシング( - 3プラズマシステムプラズマアッシャー)とメソポーラスシリカ(MPS)チップ表面を前処理。 (O 2流量:80 SCCM、消費電力:300 W、時間:10分)。
- N 2グローブボックス内で室温で72時間DI水(19:1)溶液:任意の表面化学修飾:メタノールで3%のシランでsilanateチップ。メタノール、DI水で順次すすぎます。 110℃でファン駆動のオーブンで15分間チップを治す。
2。サンプル前処理
- 最終濃度が0.01%TFA、5%ACNであること、各血清サンプルにTFAとACNを追加します。混在させる渦。
- 30分間室温でテーブル渦シェーカー上で、これらのサンプルを振る。
3。血清分画
- 160℃のオーブンで一晩プリベークチップ℃にまた、STOR電子デシケーター内のチップ空気中の周囲の水で表面の水和を防ぐために使用する準備ができるまで。
- チップの表面上に存在する可能性のある粒子をほこりに圧縮空気を使用しています。
- プレハブをカットし、井戸の希望する番号を含めることCultureWellチャンバーカバーガラスを購入しました。 100%エタノールとその後MPSチップ表面上の場所できれいなカバーガラス。チップとの完全なシールを確保するためにピンセットでカバーガラスを押し下げます。
- 各ウェルに3ミリメートルに血清サンプルのピペット10μL。室温で加湿チャンバー内で30分間インキュベートします。
- 井戸から血清をピペットで廃棄します。大規模なタンパク質を洗い流すために脱イオン水のピペット10μLを各ウェルに。 4回繰り返します。
- よく、各サンプルにピペット5μLの溶出バッファー(0.1%TFA + 50%ACN)。溶出緩衝液を混合することもで周りにピペットチップを移動させながら30回ピペッティングします。 (のみの溶出バッファーを防ぐために、一度に1から2のサンプルを溶出バッファーを適用するあっという間に蒸発から)。
- MALDI-TOF分析を実行する準備ができるまで混合した後、マイクロ遠心チューブ内のすべての溶出緩衝液と場所をピペット。
- 生物試料の複雑性をエミュレートするために、我々のオンチップ·分別システムと低分子量の種を収穫に濃縮効果を評価するために、我々は広いと二〇から六種を数え、タンパク質やペプチドの標準混合物を選択し、組み立て分子量(900から66 500 Da)のとPI(4.0から10.2)と濃度(0.5から8ピコモル/μL)の範囲( 表1の蛋白質のリストを参照してください)。
4。ペプチドのMALDI-TOF分析
- MALDIターゲットプレートにサンプルを0.5μLをスポットし、乾燥することができます。
- スポット0.5μLマトリックス(α-シアノ-4 - ヒドロキシ桂皮酸(CHCA)、5 g / L)を0.1%TFAを含む50%アセトニトリルのトランス-3,5 - ジメトキシ-4 - ヒドロキシ桂皮酸(SA)の飽和溶液と共結晶化することができます。
- 各キャリブレーションスポットにキャリブレーション溶液0.5μLをスポットし、乾燥することができます。
- MALDI-TOF質量分析計にターゲットプレートを挿入します。マシンは、サンプルあたりの4200と3000ショットのレーザ強度の正反射モードに設定する必要があります。選択した質量範囲は2000 Daのターゲット質量で800から5000ダなければなりません。
- リニアモードで同じMALDI-TOF分析を実行しますが、900万ダまたは3000〜70,000 Daと5000 Daのターゲット質量を質量範囲を変更します。
5。データ解析
- 生スペクトルはConvertPeakListソフトウェアを使用して処理された、データは前処理用のソフトウェアをSpecAlignにエクスポートされました。すべてのスペクトルはPAFFT相関法と強度をそれぞれに対応するスペクトルの総イオン電流(TIC)に正規化されたを使用して整列させた。すべてのスペクトルを平滑化し、それぞれ4と0.5の係数で解除noisedた。ピークは0.5、質量21の窓と高さの基準で検出された比1.5は、負の値は分析の前に削除されました。
- 階層的クラスタリングは、クラスタ3.0を使用して行い、MapleTreeソフトウェアを使用して可視化した。 MALDI MSデータ(m / zのピーク強度)は、対数変換、正規化され、中央値を中心とした。ピアソンの相関はサンプル間の距離を計算するために使用された、完全なリンケージクラスタリングを行った。
- 独立スチューデントt-検定前に教師なし階層的クラスタリング解析に検出された各ピークのMS群(n = 2のグループ)との間の比較のために使用されていました。 0.02以下のP値は異なるメソポーラスプロテオームチップ(大孔対小孔)間の差収穫ペプチドおよびタンパク質を選択することが重要と考えられた。
6。代表的な結果
図1に示すように、本 研究で我々はnanotexturesの様々なメソポーラスシリカ薄膜のシリーズを作製し、総合的に探求ヒト血清からの選択的取り込みと豊かな低分子のペプチドおよびタンパク質のIRを使用する。 図2aおよび b 900〜10,000 Daの範囲で、3,000の範囲内のタンパク質のペプチドを未処理の血清試料のMSスペクトルを示す〜70,000それぞれダ。これらのスペクトルはよくイオン化され、非常に豊富、高い分子量の存在はアルブミンなど(HMW)蛋白質による低分子領域での信号の抑制を示しています。 図2c、dは MPS L121による分画後、血清試料のMSスペクトルを描く(孔径、6 nm)の。大きな分子の大部分は、LMW成分の大幅な充実をもたらして、枯渇しています。コントロールとして、同じ血清試料は、LMWP回復のためのMPS薄膜の特異性を評価するために、無孔純粋なシリカ表面に塗布した。 図2eおよび fに見られるように、PEPの有意な収穫はありませんでした非多孔性シリカから潮の干満や蛋白質。したがって、それはメソポーラスアーキテクチャではなく、LMWPの濃縮で支配的な要因を構成するシリカの表面親和性であると結論することができます。
孔径を精密に制御バリエーションが疎水性ブロックの長さが異なるとの共重合体の使用によって達成することができます。設計されたタンパク質やペプチド混合物を使用することにより、LMWペプチドおよびタンパク質の回復効果で細孔径の影響は、4つのプルロニック界面活性剤(F127、P123、L121、およびL121加えて膨潤剤)から調製されたMPS薄膜を用いて調べた別のボリューム比のそれぞれ3.7 nmで、5.2 nmで、7.4 nm、および9.0 nmの細孔径を形成する親水性および疎水性成分の。細孔サイズのこの範囲は、サイズと形状の除外( 図3)を介してペプチドと同一の血清サンプルからのタンパク質の異なるレパートリーの回復につながった。高分子量dでタンパク質のスペクトルチップの各タイプのカットオフ分子をemonstrate。 HMWタンパク質の大きさに依存するの枯渇に加え、標準溶液のオンチップ·分別は、差動と細孔径に関連付けられたLMW種の選択的濃縮を表示します。 図3bに示す双方向の階層的クラスタリングは、別のMSCを用いて得られたLMW標準濃縮パターンを示しています。すべてのペプチドは、チップのカットオフ分子以下である場合であっても、細孔サイズと閉じ込められた種の分子量の間に正の相関があります。小さなペプチドは小さい細孔を有するチップで、より効率的に回収されている間に大きな孔を有するMSC、最大9 nmは、優先的に、より大きなペプチドを収穫。メソポーラス配置の構造変換は、テンプレートポリマーの濃度を調整することにより行った。テンプレートのポリマーの濃度を増加させると、相間の界面の曲率の減少をもたらしたの結果、球状から円筒状の構造体に相互に進行を開始水、共重合体、およびケイ酸塩、。プルロニックF127は、その高い分子量、構造の周期性のこの高度を持っています。ソリューションを開始するにはF127の濃度を増加させることにより、異なるMPS薄膜周期的ナノ構造を3次元ナノ構造から2次元ナノ構造を得ることができます。より望ましいナノ細孔の相互接続性とアクセス可能なナノ細孔の形態を有する3次元立方晶とハニカム六角形のナノ構造は、彼らが同様の細孔サイズ分布および血清中の同じ分子量カットオフを共有するにもかかわらず、選択的に2次元六方晶構造よりLMWペプチドを豊かで優れた性能を発揮分別( 図4)。また、我々はチップ表面を前処理しアッシング酸素プラズマを導入することにより、MPSチップ上に有機シランの合理化共役。質的に選択上の静電効果を研究するために、IVEは、オンチップ濃縮は、我々はタンパク質やペプチド混合物を使用しています。 L121で調製したMPSチップ上に分画し、化学官能基を結合させたプロテオミクスの標準溶液のMS分析は、 図5に示されています。正に帯電したと負に帯電したペプチドや低分子タンパク質がそれぞれアニオン性およびカチオン性チップ上に捕捉されています。正の正味電荷を有するペプチドを回収し、複数のMPSチップの定量的な比較は、 図5aに表示されます。負電荷とすべての変更(軽微な負電荷を持つもともと)なしでチップを搭載したチップは、APTES(-NH 2)で修飾されたチップよりも、これらのペプチドの有意に高い濃縮を示す。 図5bに示すように逆に、正に帯電したMPSチップは、負の正味電荷と、それらのペプチドを回復するための卓越した能力を持っています。 α-エンドルフィンは有意な変化dが表示されませんが約6そのPIへのUE。

図1 MPSチップの分別とLMW濃縮の原理。大きな種が毛穴の外に残っている間、サンプル表面にスポッティングした後、LMWのタンパク質やペプチドは、孔内にトラップされ、洗浄工程中に削除されます。濃縮画分を溶出し、MALDIで分析されています。
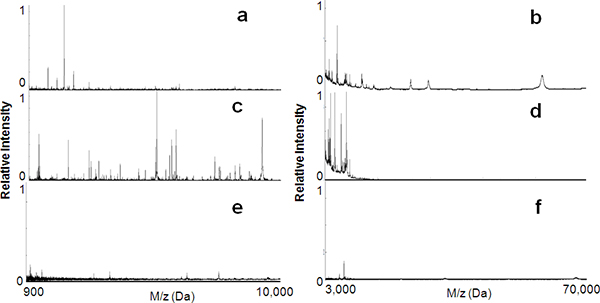
図2メソポーラスシリカ薄膜チップを用いたペプチド濃縮。前に、低質量範囲(900〜10 000 Da)と高質量範囲(3000から70 000 Da)を(a、b)の両方の後MALDI MSプロファイル(C、D)メソポーラスシリカ薄膜の血清処理( L121、6 nm)の。空白の非多孔性シリカの表面を(E、F)を使用する場合は分子の回復が大幅に削減されます。

図3 MPSチップの分子カットオフとサイズに依存する濃縮。細孔の大きさに相関する各MPSチップのカットオフ特性の分子を示すMALDIスペクトルの(a)の拡大図。異なるチップ間のペプチド混合機能の(b)の双方向の階層的クラスタリング。赤や黄色の色の強度は相対的なペプチド濃度を示しています。小さなペプチドは、(900から3500ダから)優先的に小さい細孔を有するチップから回収されながら、大きな細孔は、分子量の大きいペプチド(3600から8500 Daまで)の収穫を強化しました。
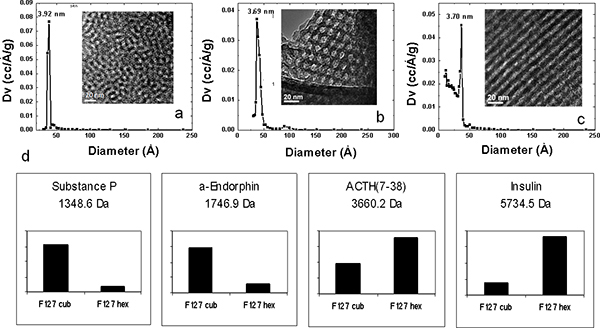
図4 MPS薄膜と異なるナノ構造の選択的回収の物理的特性評価。 XRDパターン(A、B、C)、TEM(はめ込み、B、C)、前駆体溶液の異なる濃度でプルロニックF127:4.0×10 -3 M()、6.0×10 -3 M(b)、および8.0×10 -2 M(C)。 (d)の3D立方体および3Dの六角形のF127プロテオームチップ(カブと六角、それぞれ)の選択的なペプチドの回復を示す検出強度のバーグラフ。異なる構造の変更は、選択的濃縮を提示します。
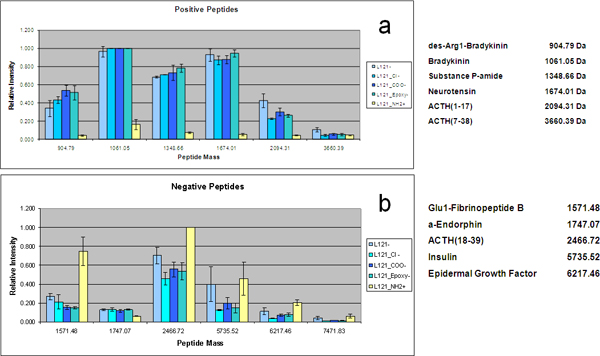
図5:異なる表面機能を持つチップのチャージ固有のリカバリ。官能チップ上に選択的にキャプチャされたペプチドの検出のMS強度のバーグラフ。それらの等電点に応じて、ペプチドは、肯定的または否定的にpH 7.0でご利用いただけます。 (a)は正のペプチド((1)DES-Arg1と、ブラジキニン、(2)ブラジキニン、(3)物質P-アミド、(4)ニューロテンシン、(5)ACTH(1-17)、(6)ACTH(7 - 38))具体的に負に帯電したシュールで濃縮される顔。 (b)負のペプチド((7)Glu1-フィブリノペプチドA、B、(8)α-エンドルフィン、(9)ACTH(18から39)、(10)インスリン、(11)EGF、(12)インスリン様GFII)がある具体的に正に帯電した表面上に濃縮。
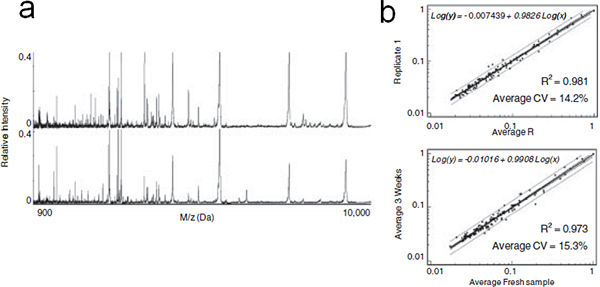
図6で分画し、血清の安定化を内蔵しています。 (a)のLMWのペプチドおよびタンパク質の代表的なMALDIプロファイルは、直ちに血清分画(上)後、または室温でのオンチップストレージの3週間(下)の後に溶出した。 (b)は上から下へ:室温で3wk MPSチップの貯蔵の後、新たに分画し、血清や血清を分画し1をレプリケートするために比較して、各複製で検出されたMSピークの平均強度の線形回帰分析。式、CVと決定係数(R 2)示されています。
ディスカッション
証拠は、循環プロテオームの低分子領域は、病気の早期発見のための診断マーカーの豊富な源であること実装されています。この技術では、様々な孔径、細孔構造と選択的にペプチドと低分子量蛋白質を豊かにするための変更でメソポーラスシリカチップのシリーズを発表した。タンパク質の安定性を評価するために、MPSチップは、ヒト血清とインキュベートし、洗浄後乾燥し、室温で3wkために保存されていました。得られたタンパク質/ペプチドのパターンは、新たに分画した血清( 図6a)のものと同等であったような統計的分析の結果によって確認され、図6bに示された。平均CVで測定したピーク信号の変動を粗血清の12.7パーセントで分画したサンプル用の14.2パーセントと推定された。限界バリエーションがMALDI装置の内部変動に起因すると示唆されなかったそのON-チップの前処理とストレージは、MSタンパク質プロファイルのいずれかに重大な変化を誘発しなかった。同様の実験は、非多孔質シリコン上で実行されています。シリコン表面上のストレージ後に回収された乾燥血清は、MALDI分析の前にMPSのチップ上に分画した。貧しいMSプロファイルは、メソポーラス表面の安定化の利点を実証し得た。以前に仮定メカニズムと同様に、我々は、ナノ細孔内に閉じ込められたLMW種はプロテアーゼのサイズ排除を通じて、またはナノ細孔の限られたスペースでのタンパク質分解活性の立体阻害による分解から保存されていたと仮定した。 MPSチップベースの手法は、複雑な生物学的流体研究のペプチドおよびLMWタンパク質プロファイリングの強力なツールである可能性があります。 MPSチップは、探索のスクリーニングとバイオのために有利な機能を提供し、多数のサンプルの同時処理を達成するためにスケールアップ生産のため製造し、可能にする安価であるマーカー発見。
開示事項
我々は、開示することは何もありません。
謝辞
この作品は、NanoHealthプレセンター賞(W81XWH-11-2から0168まで)と、がんナノメディシンのためにテキサス州センター(1U54CA151668-01)のアライアンスによって資金を供給された。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| テトラエトキシシラン | Sigma-Aldrich社 | 131903 | 98パーセント |
| スピンコーター | ブルーワー科学 | CEE 200X | |
| プラズマアッシャー | ノードソン月 | AP-600 | |
| 分光エリプソメーター | JAウーラム社 | M-2000DI | |
| MALDI-TOF | アプライドバイオシステムズ | ボイジャー-DE-STR | |
| α-シアノ-4 - ヒドロキシ桂皮酸 | シグマアルドリッチ(株) | C8982 | MALDI-TOF用のマトリックス |
| トランス-3,5 - ジメトキシ-4 - ヒドロキシ桂皮酸 | シグマアルドリッチ(株) | 85429 | MALDI-TOF用のマトリックス |
| ホットプレートをかき混ぜる | サーモフィッシャーサイエンティフィック | 11から475-30Q | |
| CultureWellチャンバーカバーガラス | Sigma-Aldrich社 | GBL103350 | 3 mmの直径。 ×1 mmの深さ、3-10μL、滅菌 |
| プルロニックF 127 | BASF | PEO 106-PPO 70-PEO 106 | |
| プルロニックL121 | BASF | PEO 5-PPO 70-PEO 5 | |
| プルロニックP123 | BASF | PEO 20-PPO 70-PEO 20 |
表1物理化学的性質と設計された濃度(分子量およびiso選択されたペプチドとタンパク質の規格の電点)。
参考文献
- Wulfkuhle, J. D., Liotta, L. A., Petricoin, E. F. Proteomic applications for the early detection of cancer. Nat. Rev. Cancer. 3, 267-275 (2003).
- Etzioni, R. The case for early detection. Nat. Rev. Cancer. 3, 243-252 (2003).
- Hanash, S. M., Pitteri, S. J., Faca, V. M. Mining the plasma proteome for cancer biomarkers. Nature. 452, 571-579 (2008).
- Liotta, L. A., Ferrari, M., Petricoin, E. Clinical proteomics: written in blood. Nature. 425, 905-905 (2003).
- Petricoin, E. F., Belluco, C., Araujo, R. P., Liotta, L. A. The blood peptidome: a higher dimension of information content for cancer biomarker discovery. Nat. Rev. Cancer. 6, 961-967 (2006).
- Anderson, N. L., Anderson, N. G. The human plasma proteome: history, character, and diagnostic prospects. Mol. Cell Proteomics. 1, 845-867 (2002).
- Gorg, A., Weiss, W., Dunn, M. J. Current two-dimensional electrophoresis technology for proteomics. Proteomics. 4, 3665-3685 (2004).
- Liu, H., Sadygov, R. G., Yates, J. R., 3rd, . A model for random sampling and estimation of relative protein abundance in shotgun proteomics. Anal. Chem. 76, 4193-4201 (2004).
- Rabilloud, T. Two-dimensional gel electrophoresis in proteomics: old, old fashioned, but it still climbs up the mountains. Proteomics. 2, 3-10 (2002).
- Hu, Y. Tailoring of the nanotexture of mesoporous silica films and their functionalized derivatives for selectively harvesting low molecular weight protein. ACS Nano. 4, 439-451 (2010).
- Bouamrani, A. Mesoporous silica chips for selective enrichment and stabilization of low molecular weight proteome. Proteomics. 10, 496-505 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved