Method Article
Низкая молекулярная масса белка Обогащение на мезопористых тонких пленок кремния для биомаркеров Discovery
В этой статье
Резюме
Мы разработали технологию, основанную на мезопористого кремния тонкую пленку для селективного восстановления низкомолекулярных белков и пептидов из сыворотки крови человека. Физико-химические свойства нашего мезопористых чипы были точно настроены оказывать существенную контроля пептид обогащение и, следовательно, профиль сыворотки протеома для диагностических целей.
Аннотация
The identification of circulating biomarkers holds great potential for non invasive approaches in early diagnosis and prognosis, as well as for the monitoring of therapeutic efficiency.1-3 The circulating low molecular weight proteome (LMWP) composed of small proteins shed from tissues and cells or peptide fragments derived from the proteolytic degradation of larger proteins, has been associated with the pathological condition in patients and likely reflects the state of disease.4,5 Despite these potential clinical applications, the use of Mass Spectrometry (MS) to profile the LMWP from biological fluids has proven to be very challenging due to the large dynamic range of protein and peptide concentrations in serum.6 Without sample pre-treatment, some of the more highly abundant proteins obscure the detection of low-abundance species in serum/plasma. Current proteomic-based approaches, such as two-dimensional polyacrylamide gel-electrophoresis (2D-PAGE) and shotgun proteomics methods are labor-intensive, low throughput and offer limited suitability for clinical applications.7-9 Therefore, a more effective strategy is needed to isolate LMWP from blood and allow the high throughput screening of clinical samples.
Here, we present a fast, efficient and reliable multi-fractionation system based on mesoporous silica chips to specifically target and enrich LMWP.10,11 Mesoporous silica (MPS) thin films with tunable features at the nanoscale were fabricated using the triblock copolymer template pathway. Using different polymer templates and polymer concentrations in the precursor solution, various pore size distributions, pore structures, connectivity and surface properties were determined and applied for selective recovery of low mass proteins. The selective parsing of the enriched peptides into different subclasses according to their physicochemical properties will enhance the efficiency of recovery and detection of low abundance species. In combination with mass spectrometry and statistic analysis, we demonstrated the correlation between the nanophase characteristics of the mesoporous silica thin films and the specificity and efficacy of low mass proteome harvesting. The results presented herein reveal the potential of the nanotechnology-based technology to provide a powerful alternative to conventional methods for LMWP harvesting from complex biological fluids. Because of the ability to tune the material properties, the capability for low-cost production, the simplicity and rapidity of sample collection, and the greatly reduced sample requirements for analysis, this novel nanotechnology will substantially impact the field of proteomic biomarker research and clinical proteomic assessment.
протокол
1. Чипов
- Создать покрытие решение для чипа, начиная с гидролизованного раствора силиката предшественника. Смешайте 14 мл тетраэтилортосиликат (ТУС) с 17 мл этанола, 6.5 мл дистиллированной воды и 0,5 мл 6М HCl при сильном перемешивании (1200 оборотов в минуту) с использованием перемешать плита. Нагрейте это решение при 80 ° С в течение 2 часов, сохраняя помешивая постоянно.
- Подготовка растворов полимеров, добавив желаемый три блока coploymer (F127 плуроник, L121 и P123) до 10 мл этанола при комнатной температуре с сильным перемешиванием. Заполнить смесью, добавляя 7,5 мл раствора силиката (с шагом 1.1) в три-блок-сополимер решение, затем 2 часа интенсивном перемешивании при комнатной температуре. Это представляет собой окончательное решение покрытия.
- Нанести 1 мл раствора для покрытия до 4 дюймовых кремниевых пластин спин-покрытие в размере 1500 оборотов в минуту в течение 20 секунд. Затем тепло при 80 ° С в течение 12 часов.
- Нагрейте фильмов для удаления органических суrfactant за счет повышения температуры 1 ° С в минуту до 425 ° C, а затем выпекать в течение 5 часов.
- Предварительной обработки мезопористого кремния (MPS) поверхности чипа с кислородной плазмы озоления (плазменные Ашер - март плазменные системы). (O 2 Расход: 80 SCCM, мощность: 300 Вт, время: 10 минут).
- Дополнительный химической модификации поверхности: silanate чипов в 3% органосилан в метанол: DI воды (19:1) решение в течение 72 часов при комнатной температуре в N 2 перчаточный ящик. Промыть последовательно Метанол и DI воды. Лечение чипов при 110 ° С в течение 15 минут в фан-приводом печи.
2. Пробоподготовки
- Добавить TFA и АКС каждого образца сыворотки, что окончательные концентрации 0,01% TFA и 5% АКС. Vortex перемешать.
- Встряхнуть этих образцов на стол вихрь шейкере при комнатной температуре в течение 30 минут.
3. Сыворотка фракционирования
- Предварительно выпекать чипов за ночь в духовке при температуре 160 ° C. Кроме того, хранениемэлектронных чипов в сушильном шкафу до готовности использовать для предотвращения гидратации поверхности воды окружающего воздуха.
- Использование сжатого воздуха, чтобы стереть любые частицы, которые могут быть на поверхности чипа.
- Вырезать сборных, приобретенные CultureWell камерных покровного стекла включать необходимое количество скважин. Чистая покровного стекла со 100% этанола, а затем место на поверхности чипа MPS. Нажмите покровного стекла вниз, щипцы для обеспечения полного уплотнения с чипом.
- Внесите 10 мкл сыворотки в каждом 3 мм хорошо. Выдержите в течение 30 минут во влажной камере при комнатной температуре.
- Пипетировать до сыворотки из колодцев и выбросить. Внесите 10 мкл деионизованной воды в каждую лунку, чтобы смыть больше белков. Повторить 4 раза.
- Внесите 5 мкл буфера элюирования (0,1% TFA + 50% ACN) для каждого образца хорошо. Пипетировать вверх и вниз 30 раз при перемещении пипетки вокруг в хорошо перемешать элюции буфера. (Только применять элюирующего буфера до 1-2 образцов в то время, для предотвращения вымывания буфериспарение очень быстро).
- После смешивания, пипетка все буфера элюирования и место в микроцентрифуге трубы до готовности выполнять MALDI-TOF анализа.
- Для того, чтобы подражать сложность биологических образцов и оценить эффект обогащения в уборке низкой молекулярной массы с нашей встроенной системы фракционирования, мы выбрали и собрал стандартной смеси белков и пептидов считая двадцать шесть различных видов с широким диапазон молекулярных масс (900-66 500 Да) и ИП (4.0-10.2) и концентрации (0,5-8 пмоль / мкл) (см. список белка в таблице 1).
4. MALDI-TOF анализа пептидов
- Пятно 0,5 мкл образца к пластине целевой MALDI и дать высохнуть.
- Пятно 0,5 мкл матрицы (α-циано-4-гидроксикоричных кислоты (CHCA), 5 г / л) или насыщенного раствора транс-3 ,5-диметокси-4-гидроксикоричных кислота (SA) в 50% ацетонитрила, содержащего 0,1% TFA и позволяют совместной кристаллизации.
- Пятно 0,5 мкл калибровочного раствора для калибровки каждого пятна и дать высохнуть.
- Вставьте цель пластинки в MALDI-TOF масс-спектрометра. Машина должна быть установлена в режиме положительного отражатель лазерного излучения 4200 и 3000 выстрелов в образце. Выбранном диапазоне масса должна быть от 800 до 5000 да с массой мишени 2000 Da.
- Выполните то же MALDI-TOF анализа в линейном режиме, но изменить диапазон масс до 900 до 10000 Да или 3000 до 70000 Да и цель массой 5000 Да.
5. Анализ данных
- Сырье спектры были обработаны с ConvertPeakList программное обеспечение и данные экспортировались в SpecAlign программное обеспечение для обработки. Все спектры были выровнены использованием PAFFT метод корреляции и интенсивности нормированы на общий ток ионов (TIC) в каждый из которых соответствует спектру. Все спектры были сглажены и де-носилась с в 4 раза и 0,5 соответственно. Пики были обнаружены с базовым 0,5, масса окна 21 и высотойкоэффициент 1.5, отрицательные значения были удалены перед анализом.
- Иерархическая кластеризация проводили с использованием кластера 3.0 и визуализированы с помощью программного обеспечения MapleTree. MALDI MS данных (м / з пик интенсивности) была войти трансформируется, нормированный, а средний по центру. Корреляции Пирсона был использован для расчета расстояния между образцами и полной кластеризации связь была выполнена.
- Независимых студенческих Т-тест был использован для сравнения между группами (п = 2 группы) для каждого обнаруженного MS пика до неконтролируемого иерархический анализ кластеризации. P-значение 0,02 или ниже считается значительным, чтобы выбрать дифференциально собрано пептидов и белков между различными мезопористых протеомных чипов (Большой пор против малых пор).
6. Представитель Результаты
Как показано на рисунке 1, в данном исследовании мы изготовили серию мезопористых тонких пленок кремния с различными nanotextures и всесторонне исследовалИК использования в избирательный захвата и обогащения низкомолекулярные пептиды и белки из сыворотки крови человека. На рисунке 2а и б показаны спектры MS из необработанных образцов сыворотки для пептидов в диапазоне от 900 до 10000 Да и для белков в диапазоне 3000 ~ 70000 Да соответственно . Эти спектры иллюстрирует подавление сигнала в регионе ЛМЗ в связи с наличием хорошо ионизованной, очень много, с высоким молекулярным весом (HMW) белков, таких как альбумин. Рис. 2, г изображены спектры МС сыворотку после фракционирования в MPS L121 (размер пор, 6 нм). Большинство крупных молекул были исчерпаны, что привело к значительному обогащению ЛМЗ компонентов. В качестве контроля той же сыворотки образец наносится на чистую поверхность непористый кремнезем для оценки специфики MPS тонких пленок для LMWP восстановления. Как видно на рисунке, и 2е е, не было никаких существенных сбор бодрости духаПриливы и белков из непористых кремнезема. Таким образом, можно сделать вывод, что это был мезопористых архитектуры, а не близость поверхности кремнезема, который представляет собой фактор преобладает в обогащении LMWP.
Именно контролируется изменение размера пор может быть достигнута с помощью сополимеров с различной длиной гидрофобного блока. При использовании предназначены белков и пептидов смеси, влияние размера пор на пептид низкомолекулярные белки и эффективность восстановления были исследованы с помощью MPS тонких пленок из четырех подготовленных Pluronic поверхностно-активных веществ (F127, P123, L121, L121 и плюс отек агента) с различным соотношением объема гидрофильных и гидрофобных компонентов с образованием размерами пор 3,7 нм, 5.2 нм, 7.4 нм и 9,0 нм соответственно. Этот диапазон размеров пор привело к восстановлению другой репертуар пептидов и белков из одного образца сыворотки по размерам и форме отчуждения (рис. 3). Белковые спектры с высоким молекулярным весом гemonstrate молекулярной отключение каждого типа микросхемы. В дополнение к зависимости от размера истощение белков HMW, на чипе фракционирования решение стандартам отображает дифференциальное и селективной обогащения ЛМЗ видов, связанных с размерами пор. Двусторонний иерархической кластеризации представлены на рисунке 3b показывает обогащение ЛМЗ стандартам шаблон, полученных с различных MSC. Даже если все пептиды ниже молекулярный отключение всех фишек, существует положительная корреляция между размерами пор и молекулярный вес захваченного видов. MSC с большими порами, до 9 нм, преимущественно собрать больше пептидов, в то время как меньшие пептиды восстанавливаются более эффективно, чипы с меньшими порами. Структурных преобразований в мезопористых договоренность была проведена настройка концентрации шаблон полимера. Увеличение концентрации шаблон полимеров привело к уменьшению поверхностного кривизны между фазамиводы, сополимера и силикатные, следовательно, начало взаимосвязанных переход от сферической к цилиндрической структуры. Pluronic F127, с высокой молекулярной массой, обладает такой высокой степени структурной периодичностью. При увеличении концентрации F127 в исходном растворе, различные MPS тонкая пленка периодических наноструктур могут быть получены из 3D в 2D наноструктура наноструктуры. 3D кубической и гексагональной сотовой наноструктур, обладающих более желательным взаимосвязанности нанопор и более доступными нанопор морфологии, демонстрируют превосходную производительность в выборочного обогащения низкомолекулярные пептиды, чем 2D гексагональную структуру, даже если они имеют сходные пор распределения размера и той же молекулярной отсечения на сыворотке фракционирования (рис. 4). Мы также упростили сопряжения органо-силана на MPS чипов путем введения кислородной плазмы озоления для предварительной обработки поверхности чипа. Для того, чтобы качественно изучать электростатического эффекта на выборив на чипе обогащения, мы будем использовать белки и пептиды смеси. MS анализа протеомных решение стандартам фракционированного на МПС чипов подготовлен с L121 и сопряженных с химическим функциональным группам представлен на рисунке 5. Положительно заряженные и отрицательно заряженные пептиды и низкомолекулярные белки, захваченные на анионных и катионных фишек соответственно. Количественное сравнение нескольких чипов MPS в восстановлении пептидов с положительной чистой заряда отображается на рисунке 5а. Чипы с отрицательным зарядом и чипсы без каких-либо изменений (с небольшой отрицательный заряд первоначально), имеют значительно более высокие обогащения для тех, пептиды, чем чипы модифицированных APTES (-NH 2). С другой стороны, положительно заряженные MPS чипы обладают исключительными возможностями для восстановления этих пептидов с отрицательным суммарным зарядом, как показано на рисунке 5б. В то время как α-эндорфин не показывают значительных изменений ге его PI около 6.

Рисунок 1. Принцип MPS чипов фракционирования и низкомолекулярные обогащения. После того, как образец пятен на поверхности, низкомолекулярные белки и пептиды оказались в ловушке в поры в то время как более крупные виды остаются вне поры и удаляются во время промывки. Обогащенной фракции затем элюировали и проанализированы MALDI.
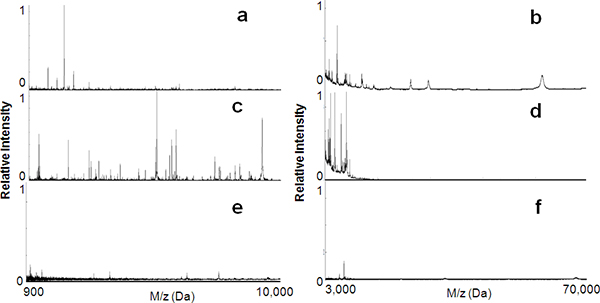
Рисунок 2. Пептида обогащения с использованием мезопористого кремния тонким фишек фильма. MALDI MS профилей как в низком диапазоне масс (от 900 до 10 000 Da) и высокий диапазон массы (от 3000 до 70 000 Da) до (а, б) и после (в, г) в сыворотке крови обработки на мезопористых тонких пленок кремния ( L121, 6 нм). Молекулярного восстановления значительно снижается при использовании пустой непористой поверхности кремния (E, F).

Рисунок 3. Молекулярная отсечки и размер зависит от обогащения MPS чипов. (А) Увеличенный вид спектров MALDI демонстрирует характерные молекулярные отключение каждого MPS чипов соотносить с размером пор. (Б) Двусторонняя иерархической кластеризации пептидных особенности сочетание между различными фишками. Интенсивность красного или желтого цвета указывает на относительную концентрацию пептида. Большие поры расширены уборки больших пептидов (от 3600 до 8500 Da), в то время как небольшие пептиды (от 900 до 3500 Da) были преимущественно оправился от чипов с меньшим поры.
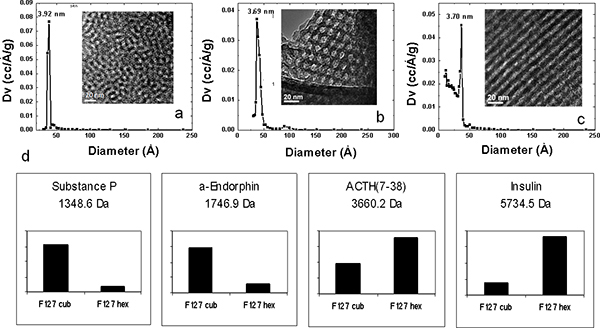
Рисунок 4. Физические характеристики MPS тонких пленок и селективного восстановления различных наноструктур. РСА модели (а, б, в), TEM (вставка, б, в), Pluronic F127 в различных концентрациях в предшественником решение: 4.0 ×10 -3 М (а), 6.0 × 10 -3 М (б) и 8.0 × 10 -2 М (с). (Г) Гистограмма интенсивности обнаружения иллюстрирующие селективного восстановления пептидов на кубический 3D и 3D гексагональной F127 протеомных фишек (Cub и Hex, соответственно). Различные структурные изменения представляют избирательный обогащения.
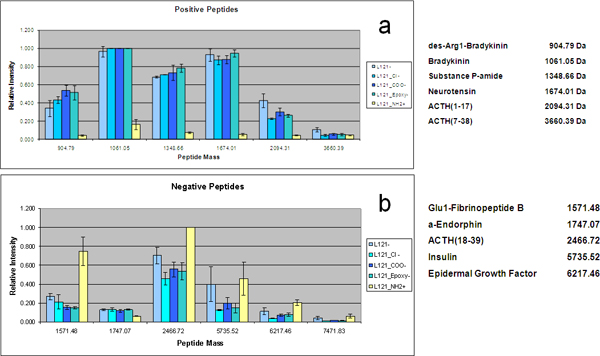
Рисунок 5. Заряда конкретного восстановления для чипов с различными функциями поверхности. Гистограмма интенсивности MS обнаружения выборочной захвачен пептидов на функционализированных чипов. По их изо-электрической точки, пептиды положительно или отрицательно заряженных при рН 7,0. () Положительные пептидов ((1), де-Arg1-брадикинин, (2) брадикинина, (3) вещества P-амид, (4) нейротензин, (5), АКТГ (1-17), (6) АКТГ (7 - 38)), специально обогащенные на отрицательно заряженной поверхностилица. (Б) Отрицательные пептидов ((7) Glu1-фибринопептида B, (8) α-эндорфин, (9) АКТГ (18-39), (10), инсулин (11) EGF (12) инсулиноподобного GFII) являются специально обогащенные на положительно заряженной поверхности.
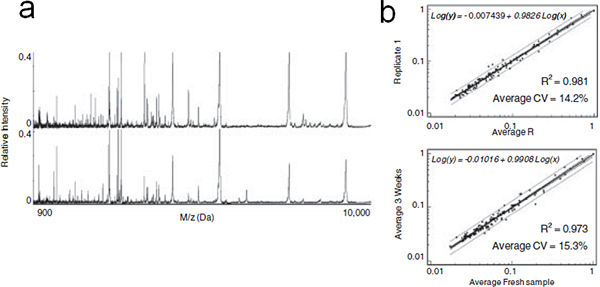
Рисунок 6. On-чип стабилизации фракционированного сыворотки. (А) представитель MALDI профили низкомолекулярные пептиды и белки элюируются сразу после фракционирования сыворотки (вверху) и после 3-х недель на чипе хранения при комнатной температуре (внизу). (Б) сверху вниз: Линейный регрессионный анализ средней интенсивности обнаруженных пиков MS в каждой репликации по сравнению с 1 повторить только что фракционированного сыворотки и сыворотки после фракционированного 3wk MPS чипов хранения при комнатной температуре. Уравнение, CV и коэффициент детерминации (R 2) указаны.
Обсуждение
Доказательства растет, что низкомолекулярные области кровообращения протеома является богатым источником диагностических биомаркеров для ранней диагностики заболевания. В этой технологии, мы представили ряд мезопористых чипов кремния с различными размерами пор, пора структуры и изменения выборочно обогащают пептидов и низкомолекулярных белков. Для оценки стабильности белка, MPS чипы инкубировали с человеческой сывороткой, сушат после стирки, и хранить 3wk при комнатной температуре. Белок / пептидных модели были получены сопоставимые с теми, недавно фракционированного сыворотки (рис. 6а), что подтверждается результатами статистического анализа показали на рисунке 6б. Изменчивость пик сигналов измеряется средняя CV оценивается в 12,7% на сырую сыворотке крови и в 14,2% фракционированного образца. Предельные изменения могут быть связаны с внутренней изменчивости прибора MALDI и предположил, что он-чип предварительной обработки и хранения не побуждать какое-либо значительное изменение профилей MS белка. Тот же эксперимент был проведен на не пористого кремния. Сухой сыворотки восстановился после хранения на поверхности кремния фракционировали на MPS чипов перед проведением анализа MALDI. Профиль бедных MS полученные продемонстрировали преимущества стабилизации мезопористых поверхности. По аналогии с ранее предположил механизмов, мы предполагаем, что низкомолекулярные видов в ловушке внутри нанопор были сохранены от разрушения через размеры исключения протеаз, или стерического ингибирования их протеолитической активности в ограниченном пространстве нанопор. Чип MPS на основе метода может стать мощным инструментом в пептида и низкомолекулярные белки профилирования сложных биологических исследований жидкости. MPS чипы недороги в изготовлении и позволяют расширить производство для достижения одновременную обработку большого количества образцов, обеспечивая возможности для выгодных поисковых скрининга и биоМаркер открытие.
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Эта работа финансировалась Альянс NanoHealth Предварительно центр Award (W81XWH-11-2-0168) и Техасского Центра рака Наномедицина (1U54CA151668-01).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| Тетраэтоксисилан | Sigma-Aldrich | 131903 | 98% |
| Спин для нанесения покрытий | Brewer Science | Cee 200X | |
| Плазменные Ашер | Nordson марта | AP-600 | |
| Спектроскопические эллипсометр | JA Woollam Ко | M-2000DI | |
| MALDI-TOF | Applied Biosystems | Voyager-DE-STR | |
| α-циано-4-гидроксикоричных кислоты | Sigma-Aldrich Ко | C8982 | Матрица MALDI-TOF |
| транс-3 ,5-диметокси-4-гидроксикоричная кислота | Sigma-Aldrich Ко | 85429 | Матрица MALDI-TOF |
| Движение плита | Thermo Scientific | 11-475-30Q | |
| CultureWell камерных покровного стекла | Sigma-Aldrich | GBL103350 | 3 мм диаметром. × 1 мм в глубину, 3-10 мкл, стерильные |
| Pluronic F 127 | BASF | ПЭО 106-ППО 70-ПЭО 106 | |
| Pluronic L121 | BASF | ПЭО 5-ППО 70-ПЭО 5 | |
| Pluronic P123 | BASF | ПЭО 20-ППО-ПЭО 70 20 |
Таблица 1. Физико-химические свойства и предназначен концентрации (молекулярный вес и Iso-Электрическая точка) выбран пептидных и белковых стандартов.
Ссылки
- Wulfkuhle, J. D., Liotta, L. A., Petricoin, E. F. Proteomic applications for the early detection of cancer. Nat. Rev. Cancer. 3, 267-275 (2003).
- Etzioni, R. The case for early detection. Nat. Rev. Cancer. 3, 243-252 (2003).
- Hanash, S. M., Pitteri, S. J., Faca, V. M. Mining the plasma proteome for cancer biomarkers. Nature. 452, 571-579 (2008).
- Liotta, L. A., Ferrari, M., Petricoin, E. Clinical proteomics: written in blood. Nature. 425, 905-905 (2003).
- Petricoin, E. F., Belluco, C., Araujo, R. P., Liotta, L. A. The blood peptidome: a higher dimension of information content for cancer biomarker discovery. Nat. Rev. Cancer. 6, 961-967 (2006).
- Anderson, N. L., Anderson, N. G. The human plasma proteome: history, character, and diagnostic prospects. Mol. Cell Proteomics. 1, 845-867 (2002).
- Gorg, A., Weiss, W., Dunn, M. J. Current two-dimensional electrophoresis technology for proteomics. Proteomics. 4, 3665-3685 (2004).
- Liu, H., Sadygov, R. G., Yates, J. R., 3rd, . A model for random sampling and estimation of relative protein abundance in shotgun proteomics. Anal. Chem. 76, 4193-4201 (2004).
- Rabilloud, T. Two-dimensional gel electrophoresis in proteomics: old, old fashioned, but it still climbs up the mountains. Proteomics. 2, 3-10 (2002).
- Hu, Y. Tailoring of the nanotexture of mesoporous silica films and their functionalized derivatives for selectively harvesting low molecular weight protein. ACS Nano. 4, 439-451 (2010).
- Bouamrani, A. Mesoporous silica chips for selective enrichment and stabilization of low molecular weight proteome. Proteomics. 10, 496-505 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены