Method Article
ラット腸間膜具象化:血管新生に関与する細胞のダイナミクスを調べるためのモデル
要約
この資料では、ラット腸間膜血管新生を刺激するための単純なモデルを説明しています。モデルは、単一細胞レベル全体を微小血管網のEN面の可視化を可能に組織内の比較的短い時間の経過とともに毛細管発芽、血管領域と血管密度の劇的な増加を生成します。
要約
Microvacularネットワークの成長とリモデリングは、創傷治癒、炎症、糖尿病性網膜症、腫瘍の成長や他の疾患状態1、2の重要な側面です。ネットワークの成長は、一般的に、既存の血管から新しい血管の成長として定義され、血管新生に起因しています。血管新生のプロセスはまた、直接血管周囲の細胞コーティングと血管の拡大のキャピラリー買収として定義され、動脈形成にリンクされています。言うまでもなく、血管新生は複雑であり、細胞および分子レベル3で複数のプレイヤーが含まれます。微小血管ネットワークが成長する方法を理解する血管新生の経時変化を介してネットワークの階層に沿って空間的および時間的なダイナミクスを識別する必要があります。この情報は、血管の成長を操作することを目的とした治療法の開発のための非常に重要です。
この資料に記載されている具象化モデルは、刺激のために、シンプルで再現可能なモデルを表していますラット腸間膜の血管新生をlating。それはラット腸間膜4-7の創傷治癒モデルから適応し、血管新生促進剤8、9の腹腔内注射を介して腸間膜の血管新生を刺激するための代替であるされました。それは最小限の外科的介入を必要とし、単一のダウン全体の微小血管網の二次元可視化を可能にする組織では比較的短い時間の経過とともに毛細管もやし、血管領域と血管密度の劇的な、再現性の増加を生成するため具象化モデルは魅力的です。セルレベル。刺激された成長は、外国血管新生の分子の干渉を受けずに生理的な環境で自然に血管新生応答を反映しています。免疫組織化学的標識法を用いて、このモデルは血管新生に関与する新規細胞事象を識別するのに非常に有用であることが実証されています。調べでは、容易に時間SPと改造の時間経過時の血管新生メトリックを関連付けることができますそのような細胞の表現型の変化や細胞間相互作用4、5、7、10、11などecificダイナミクス、。
プロトコル
1。外科手術セットアップノート
- 手術前に手術物資や機器を滅菌する。各ラットのための無菌外科手術のために使用される電源は、機器の配置のための滅菌表面のようにレイアウトされるために1ドレープを含む、中央にあるのx 1.5の約0.5プレカット穴付きドレープ1は、ラットの上に配置すると、ガーゼ。ドレープの事前カット穴がラットで行われた切開で整列します。手術に必要な機器は、縫合糸材料をカットするために使用するハサミの1標準ペア、鉗子、縫合糸の処理と把持用穿刺ホルダー、ブレードとメスが含まれています。我々は、特定の手術材料とツールのテーブルに私たちの研究室で使用される一般的なツールを記載しています。しかし、最終的なツールの選択は、実験者の好みに依存しています。
- 手術空間を準備します。確保するために加熱パッドの下に100 mLの0.9パーセント、滅菌生理食塩水バッグを置き、その連絡先wに来る生理食塩水i番目の腸間膜組織は約37にあらかじめ温め℃で生理食塩水の代わりに、リンゲル液または他の生理学的緩衝液を使用することができます。具象化手順の実行中に簡単にアクセスするための滅菌ドレープを滅菌手術器具および消耗品をレイアウトします。また、滅菌綿チップアプリケーターと縫合の適切な3種類(4-0、5-0、および7-0)が必要となります。必ずパッケージには、材料は滅菌処理を使用してアクセスすることができるように事前に開かれていることができます。最後に、少なくとも5分間、100%エタノールに浸漬することにより事前に変更されたプラスチック製のステージを駆除。ステージでは、中央( 図1)でカット楕円形の穴に100ミリメートルのペトリ皿である。ドレメルツールは、最初に行うと、必要に応じて、穴を広げるために使用することができます。穴が行われた後、カットプラスチックのエッジは、異なる粒子のサンドペーパーを使用して滑らかな作られています。ステージはその後洗浄し、最終的に、不活性粘土(地元の工芸品店から購入)のいずれか、またはsilicされてい接着剤で発生し、滑らかな表面を提供するために、穴の端に追加されます。組織と接触させる前に、ステージでは、十分に滅菌生理食塩水ですすいする必要があります。
- 血管新生のこのモデルでは、我々は、通常、成人の雄Wistarラット(350±25 g)を使用しています。他のラット系統と年齢を使用することができます。当研究室では、ラットはケタミン(80 mg / kg体重)、キシラジン(8 mg / kg体重)、およびアトロピン(0.08 mg / kg体重)を筋肉内注射を介して麻酔する。約5分後、麻酔の効果が確認されており、ラットの腹部皮膚を剃毛されています。
2。ラット腸間膜具象化モデル
- 体温を維持するために加熱パッドの上に背中に麻酔したラットを置きます。無菌テクニックは外科手術中に使用されます。滅菌手袋を着用し、楽器や消耗品は、ラットの組織以外の非滅菌表面に接触することはできません。
- ワイプUSIを交互に腹部をきれいにngの70%イソプロピル、ヨウ素に浸した滅菌ガーゼ。
- 手術用メスの刃を使用して、皮膚に沿って小さい(約0.75インチ)縦切開し、胸骨下の白線は約1インチを行います。
- 開口部は切開と揃うように腹部の節以上プレカットドレープを配置します。
- 優しく切開周囲の圧力を適用します。これは通常、それは簡単に識別するための十分な小腸の露出になります。
- 綿チップアプリケーターを使用して、静かに小腸の部分を引き出し、回腸を見つけます。腸間膜が引き出されているとして、それは穏やかにプラスチック製のステージ( 図2)にレイアウトする必要があります。
- 6月8日血管腸間膜のウィンドウを識別します。腸間膜のウィンドウが小腸( 図2)栄養動脈/静脈のペアの間の薄い半透明の膜として定義されています。
- 具象化の開始時間を記録します。 mesenteを残すRYセクションでは、20分間体外。具象化期間の間、断続的に組織を浸漬のままで乾燥させないようにするためのペトリ皿の中で生理食塩水を補充するために無菌の注射器(5 mL)を使用しています。
- 20分の露光時間の間に、無菌の7から0縫合糸で2中心部に位置する腸間膜窓をマークします。マークは、腸の近くに脂肪領域でなされるべきである。
- 腹腔内に腸間膜の体外領域を返します。
- 中断のパターンで5から0モノフィラメント縫合糸で腹部の筋肉を閉じます。
- 中断のパターンで4から0モノフィラメント縫合糸で皮膚を閉じます。
- 70%isopropoylとヨウ素に浸した滅菌ガーゼを使用してワイプを交互に縫合エリアを拭いてください。
- ラットの両眼に眼の潤滑油ゲルを広げた。眼を潤滑の目的は、外科手術と回復の間に角膜の乾燥を防ぐためです。眼潤滑剤の適用が適用されるべきである外科的介入の開始前に。必要であれば、回復のために、そのケージにラットを返す前に目の潤滑剤を再適用します。
3。組織の収穫と固定
- 利益のポスト刺激の日に、ラットを麻酔し、安楽死させる。当研究室では、ラットはケタミン(80 mg / kg体重)、キシラジン(8 mg / kg体重)、およびアトロピン(0.8 mg / kg体重)を筋肉内注射を介して麻酔しbeuthanasiaの心臓内注射を介して安楽死させています。 Beuthanasiaは、迅速かつ無痛の安楽死のために使用することができますペントバルビタールナトリウム/フェニトインソリューションです。 0.2ミリリットル - ラットあたりの私たちの研究室では、一般的に0.1を挿入します。
- 腹腔内を再度開くと優しく小腸を取り外し、2つのマークの付いたウィンドウを探します。
- 鉗子、マイクロはさみを使用して体外に腸間膜の各ウィンドウを切り取ります。脂肪ごとのウィンドウの境界線を含むことは顕微鏡スライド上に拡散後の組織のために有利である。すぐに、PBSで各ウィンドウを浸す。切断の際、窓の充填潜在的な血を最小限に抑えるために、Windowsの脂肪枠内動脈/静脈のペアを切断しないようにしてください。また、腸の内容の結果がウィンドウに接触することが腸を通り抜ける最小限に抑えることができます。
- 正に荷電した顕微鏡スライド上の組織を広げるために鉗子を使用しています。二つの組織は、スライドごとにマウントすることができます。
- 組織が部分的に乾燥させ、手術用メスの刃を使用して、余分な脂肪を除去することができます。
- 組織は、現在では修正する準備ができました。典型的な固定方法を使用することができます。私たちの研究室では、一般に30分間、メタノール(-20℃)でスライドを修正します。成功した標識は、また未定の組織で行われてきた。固定方法は、好ましい抗体に依存する場合があります。
4。組織の免疫標識
- 組織は、現在一般的に免疫組織化学用抗体ごとの指示に従って、ラベルを付けることができます。の役割を識別するのに我々の関心を与え血管新生時に血管周皮細胞、内皮細胞および血管周囲細胞のために我々の研究室、一般的にラベル10、12、13。微小血管ネットワークの階層に沿って血管内皮細胞を識別するための便利なラベルは抗PECAM抗体またはBSI-レクチンである。この組織で使用されている血管周囲の細胞マーカーNG2、デスミン、SM-αアクチン、PDFGRβ、クラスIIIβ-チューブリンが含まれています。以下、3.3節では、我々は比色や蛍光PECAMの免疫標識プロトコル用のプロトコルを記載しています。
- 最初の一次抗体のインキュベーションの前に、スライドは、過剰の緩衝液を除去するために真空乾燥しています。また、組織が最初に離れて組織からの抗体溶液の制御フローを防止するためにワックスペンで概説されています。最後に、すべてのラベル付けの手順は、洗浄工程に続いています。手順を洗浄するために、スライドを染色瓶の内側に配置されています。緩衝液は、洗浄期間中に3回交換されます。
- 内皮細胞抗体のラベリングの手順: PECAM比色Lableing
- 一次抗体のインキュベーション:各組織の上に約100〜200 mLの一次抗体溶液(抗体緩衝液で希釈1:200マウスモノクローナルビオチン化CD31抗体(PBS + 2%BSA 0.1%サポニン))ドリップ、全体の組織があることを確認してください抗体溶液で覆われている。室温で1時間インキュベートした。
- 30分間、PBS +0.1%サポニンで組織を洗浄します。
- 二次抗体のインキュベーション:ドリップ二次抗体溶液(ベクターラボラトリーズからベクタステインエリートABC溶液、ストレプトアビジンペルオキシダーゼ二次抗体溶液)組織の上に。室温で1時間インキュベートします。
- 30分間、PBS +0.1%サポニンで組織を洗浄します。
- 15分間のベクトルノヴァレッド組織をインキュベートします。その後水で組織を上昇。
- マウントスライド:95%エタノールでディップスライド10倍。に浸し、2分間、100%エタノールでスライドします。別の100%エタノールに浸しスライドので、徒歩2分のためにlution。その後2分ごとの連続した100パーセントキシレン溶液にスライドを浸す。 VectaMountの薄層とカバーガラスで組織を乾燥させてカバーすることができます。
PECAM蛍光標識
- 一次抗体のインキュベーション:各組織の上に約100〜200 mLの一次抗体溶液(抗体緩衝液で希釈1:200マウスモノクローナルビオチン化CD31抗体(PBS + 2%BSA 0.1%サポニン))ドリップ、全体の組織があることを確認してください抗体溶液で覆われている。室温で1時間インキュベートした。
- 30分間、PBS +0.1%サポニンで組織を洗浄します。
- 二次抗体のインキュベーション:組織の上にドリップ二次抗体溶液((1:100抗体緩衝液で希釈したストレプトアビジン - CY3(0.1%PBS + 2%BSA中のサポニン))室温で1時間インキュベートします。
- 30分間、PBS +0.1%サポニンで組織を洗浄します。
- マウントスライド:組織の上にグリセロールを50:50 PBSドリップ。カバーカバースリップである。その後、カバースリップとスライドの間のギャップを封止するためにマニキュアを使用します。
5。代表的な結果
免疫組織化学的にPECAMのために標識ラット腸間膜組織の代表画像を図3に表示されます。 PECAMラベリングは、微小血管ネットワークを改造の階層に沿ったすべての容器の種類を識別し、特定の時間点後の刺激で血管新生メトリクスを定量化するために使用することができます。 PECAM標識はまた、動脈に対して静脈の決定が可能になります。摂食動脈は、通常、ペア静脈( 図4)に比べて小さい直径細長い内皮細胞の形態を示す。毛細血管および毛細血管もやしは、その血管径およびネットワーク内の相対位置に基づいて識別することができます。リフォームネットワークの典型的な特性が増加した発芽毛細血管、血管密度、血管領域と細静脈tortuosを含むITY。様々な血管新生メトリクスの定量化は、ネットワークの成長( 図5)の経時変化を識別します。既存の船舶、3日と5日と10日目で刺激レベルに戻りの間にピークから発芽キャピラリー。発芽には、この一時的な増加は、血管密度と血管面積の増加が続いている。このモデルの大きな血管のリモデリングのための証拠として、細動脈と細静脈のセグメントの数も時間の経過とともに増加します。
当研究室では、このモデルは、このモデリングプロセス10、11中の特定時点での携帯電話表現型の変化を識別するために使用されています。たとえば、クラスIIIβ-チューブリンは、新生血管に沿った周皮細胞( 図6)を識別します 。刺激を受けていない組織では、クラスIIIβ-チューブリンの発現は、神経特異的である。対照的に、発芽キャピラリーのピーク時には、クラスIIIβ-チューブリンは血管周囲の細胞によって発現されています。このタイプの結果の血管新生過程に関与する新規細胞型を識別するには、このシンプルかつ堅牢な血管新生モデルの使用を強調しています。

図1プラスチックステージ事前·事後修正の画像。変更前の段階では100mmのペトリ皿である。変更は、中央に楕円形の穴のカットと引き上げ、滑らかな表面を作成するための穴の縁に粘土やシリコン接着剤のその後の加算が含まれています。この表面は体外に腸間膜窓の灌流を容易に内側の境界を提供します。スケールバーは1cmである。
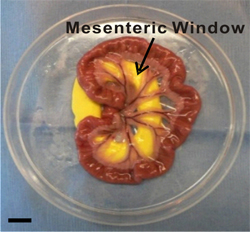
図2。体外に腸間膜領域の画像。腸間膜窓が小腸を供給する動脈/静脈のペアの間の薄い半透明の膜のように定義されています。具象化中期間は、腸間膜領域は、レイアウトと変更されたペトリ皿の内側に生理食塩水に浸漬されています。不活性黄色の粘土は、事前にカットホールを介してプルアップすることが腸間膜のために滑らかな表面を提供します。スケールバーは1cmである。
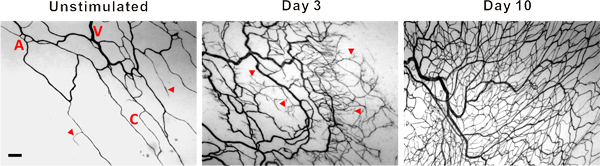
図3刺激の組織や組織の3時と腸間膜の10日後に具象化から腸間膜微小血管のネットワークの代表的な画像。 PECAM標識は、動脈(A)、静脈(V)と毛細血管(C)を含む、血管ネットワークの階層構造を同定した。ポスト刺激は、微小血管ネットワークが毛細血管発芽(矢頭)と血管密度の増加が表示されます。スケールバーは100μmである。
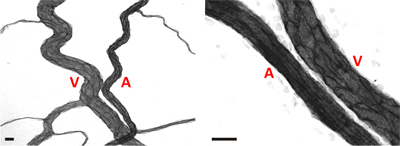
図4成体ラット腸間膜微小血管ネットワーク内の細動脈/静脈のペアの代表的な画像だ。両方のイメージでは、細動脈は()より小さい相対直径と細長い内皮細胞の形態に基づいて細静脈(V)と区別することができます。スケールバーは20μmである。
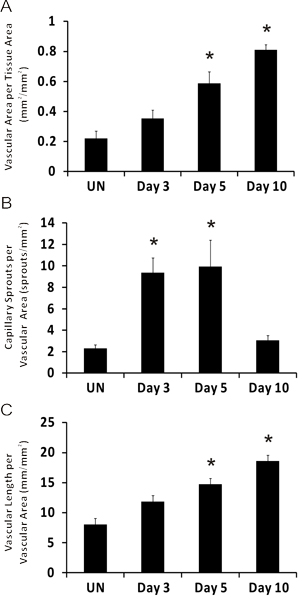
図5微小血管の成長後の腸間膜の具象化の時間経過とともに血管新生メトリクスの代表的な定量化。組織面積当たりのA)血管領域。血管面積当たりの毛細血管もやしのB)の数。血管面積当たりのC)の合計血管の長さ。 *刺激群に比べ有意差を表しています。統計的比較は、ダンのテストに続いてワンウェイANOVAを用いて行った。た(p <0.05)。国連は、刺激を表します。
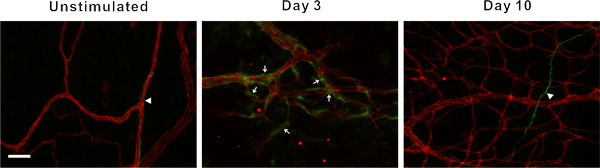
図6。3と10で刺激の組織や組織由来の腸間膜微小血管のネットワークの代表的な蛍光画像日は腸間膜の具象化を投稿してください。免疫PECAMラベル(赤)は内皮細胞を識別し、クラスIIIβ-チューブリン標識(緑)が神経(矢頭)および血管周囲細胞(矢印)を識別します。血管周囲の細胞が一時的に発芽キャピラリー中にクラスIIIβ-チューブリンをアップレギュレートする。刺激微小血管ネットワークでは、クラスIIIβ-チューブリンは、神経特異的であり、血管周囲の細胞を識別しません。 3日後に刺激、クラスIIIβ-チューブリンは、積極的に血管に沿って血管周囲細胞にラベルを付けます。 10日目では、クラスIIIβ-チューブリンの発現パターンは、非刺激シナリオに戻り始めます。スケールバーは50μmである。
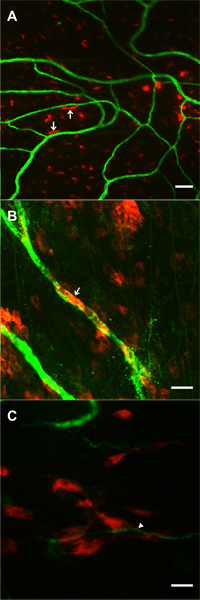
図7腸間膜の具象化によって刺激された微小血管ネットワークの成長の間にトラッキング事前に標識された局所的に適用された細胞の可能性をサポートしている画像。細胞はmesenterにわたって灌流された20分具象化期間中にICの窓。 1日後の手術、DII標識細胞(赤)がPECAM正の微小血管(緑)を持つ貴婦人焦点面で観察された。 A、B)DiIの例としては、丸められ、細長い形態を示す骨髄細胞を標識した。いくつかのケースで(矢印)細胞が血管に沿って伸長しました。 C)DiIのクラスタの例(矢印)もやしキャピラリの先端近くに間葉系幹細胞を標識した。スケールバーは50μm()、および20μmの(B、C)です。
ディスカッション
具象化モデルは、2006年に報告され、血管新生4-7の前の機械的損傷ラット腸間膜モデルから適応し、ラット腸間膜9を活用して十分に確立され腹腔内注射モデルに類似した結果を生成しています。 20分の具象化時間は、実験的に堅牢な血管新生応答を生成するために決定した。この期間を変化させることができますが、それはメカニズムの研究や細胞系譜研究のための外因性の細胞の直接アプリケーションのための血管新生阻害剤4のローカルアプリケーションに許可しています。腸間膜組織が 事前に標識された骨髄細胞と間葉系幹細胞( 図7)を使用して、我々の研究室での予備的研究によってサポートされている改造への細胞取り込みの可能性、およびヒト脂肪由来間質細胞注入のIP 14の運命を調査の成功により、 。私たちの研究室では、周皮細胞フェンを識別するためにこのモデルを使用している血管新生反応10時間の経過とともに、このような高血圧12などの病的状態、中に血管新生の可能性を評価するためにotypic変更されます。血管新生反応と、このモデルに関連付けられた細胞表現型の変化は、慢性低酸素暴露10、11などの他のラット腸間膜血管新生モデルで観察することができます。
具象化モデルの制限は、血管新生の正確なトリガメカニズムは不明であるということです。腸間膜の具象化は、マスト細胞の脱顆粒およびヒスタミンの増加レベル6にリンクされており、さらなる調査がより多くの洞察を得るために必要です。血管新生刺激は、微小血管ネットワークの階層構造全体の堅牢な改造応答を生成し、間違いなく多因子です。未知のメカニズムがこのモデルの主要な批評まま、その再現性とシンプルさは、細胞ダイナミクスinvolを識別するために、それが魅力的本質的に複雑な毛細血管発芽過程でVED。モデルの再現性は、我々の研究室10、12から以前に発行された研究では複数のラット系統間の微小血管網の成長(Wistar系雄と雌Sprague-Dawley)の時間経過とともに匹敵する血管新生の評価指標によってサポートされています。以来、成体ラット腸間膜組織の大部分は血管であり、モデルはまた、動物ごとに検討するために、複数の組織を可能にします。マウスの腸間膜窓が少ないネイティブ血管新生を持っていると、我々の経験では、一般的にネットワークを分岐観測欠いている残念ながら、このモデルは明らかに遺伝的マウスモデルには適用されません。将来のアプリケーションは、特定の時点で内の重要な顕微鏡を用いて血管新生時に血管の機能の調査とリンパ管と神経新生に関与して関連する細胞の動態の調査が含まれています。腸間膜のウィンドウごとにネイティブ血管新生の程度は、ROUと思われるものの年齢とともにghly比例し、我々は4-5週齢の幼いWistar系雄性ラットで微小血管ネットワークの分岐を観察した。これらの観察は、具象化モデルはまた、年齢間の血管新生の違いを比較するために適用されることが示唆された。
開示事項
我々は、開示することは何もありません。
謝辞
とチューレーン高血圧とNIHの助成金によって賄わエクセレンスの腎センターP20RR017659-08(PI:この作品は、ルイジアナ州LEQSF(2009-12)-RD-A-19(WL Murfee PI)の状態の理事会によってサポートされていました:L.ガブリエルナバー)。
資料
| Name | Company | Catalog Number | Comments |
| 名 | 会社 | カタログ番号 | 追加コメント |
| ドレープ | カーディナルヘルス | 4012 | 12 "X12"バイオシールド通常滅菌はラップ |
| Noyes氏マイクロシザー | Roboz手術器具 | RS-5677 | ノイスMicroは、春のはさみの解剖; ストレート、シャープブラントポイント、13ミリメートルカッティング·エッジ、0.25ミリメートル先端幅4 1/2 "全長 |
| グレーフェForcep | Roboz手術器具 | RS-5135 | 鋸歯状;わずかなカーブ、0.8ミリメートル先端幅、4 "長さMicroは、鉗子を解剖 |
| グレーフェForcep | Roboz手術器具 | RS-5130 | ミクロ解剖鉗子、鋸歯状、ストレート0.8ミリメートル先端幅、4 "長さ |
| 4から0縫合糸 | エチコン | 699G | (1.5メートル)ETHILONナイロン縫合糸ブラックモノフィラメント |
| 5から0縫合糸 | エチコン | 8556 | (1.0メートル)プロレンPolyprolene縫合ブルーモノフィラメント |
| 7から0縫合糸 | エチコン | 1647G | (0.5メートル)ETHILONナイロン縫合糸ブラックモノフィラメント |
| Castroviejoマイクロニードルホルダー | ファイン科学ツール | 12060から02 | 先端幅:0.6ミリメートル クランプ長さ:5ミリメートル 長さ:9センチメートル ストレートチップ |
| Castroviejoニードルホルダー | ファイン科学ツール | 12565から14 | 先端形状:ストレート 先端幅:1.5ミリメートル クランプ長さ:10ミリメートル はさみ:いいえ ロック:はい 長さ:14センチメートル 鋸歯状:はい |
| スカルペルハンドル | ロボzの手術器具 | RS-9843 | スカルペルハンドル、#3、ソリッド、4 "長さ |
| 無菌手術ブレード | シンシナティ外科 | 0110 | ステンレススチール、サイズ10 |
| ペトリ皿 | フィッシャー·サイエンティフィック | 08-757-13 | Slippableベベルリッジ、 |
具体的な手術材料とツールのテーブル。
| 名 | 会社 | カタログ番号 | 追加コメント |
| Beuthanasia | シェリング·プラウアニマルヘルス(株)ユニオン(MWI獣医電源から注文) | MWI#:011168 | 有効成分:100mlあたり、390 mgのペントバルビタールナトリウム、50mgのフェニトインナトリウム |
| ケタミン | フォートドッジアニマルヘルス(MWI獣医電源から注文) | MWI#:000680 | Katesetは100 mg / mlの |
| キシラジン | LLOYD。 (株) (MWI獣医電源から注文) | MWI#:009307 | は100 mg / mlをAnased |
| 生理食塩水 | ホスピーラ社 | 94から217-JT | |
| PBS | SIGMA | 011M8207 | |
| サポニン | シグマ | BCBB4080 | |
| PECAM(CD31) | BD Pharmingen社 | 553371 | |
| ストレプトアビジン-CY3 | ジャクソンイムノ | 016-160-084 | |
| BSA | ジャクソンイムノ | 096555 | |
| ベクタステインエリートABC | ベクターラボラトリーズ | PK-6100 | |
| ベクトルノヴァレッド | ベクターラボラトリーズ | SK-4800 | |
| VectaMount | ベクターラボラトリーズ | H-500 |
特定の試薬 のテーブル
参考文献
- Carmeliet, P., Jain, R. K. Angiogenesis in cancer and other diseases. Nature. 407, 249-257 (2000).
- le Noble, F. A., Stassen, F. R., Hacking, W. J., Struijker Boudier, H. A. Angiogenesis and hypertension. J. Hypertens. 16, 1563-1572 (1998).
- Peirce, S. M., Skalak, T. C. Microvascular remodeling: a complex continuum spanning angiogenesis to arteriogenesis. Microcirculation. 10, 99-111 (2003).
- Anderson, C. R., Ponce, A. M., Price, R. J. Immunohistochemical identification of an extracellular matrix scaffold that microguides capillary sprouting in vivo. J. Histochem. Cytochem. 52, 1063-1072 (2004).
- Ponce, A. M., Price, R. J. Angiogenic stimulus determines the positioning of pericytes within capillary sprouts in vivo. Microvasc. Res. 65, 45-48 (2003).
- Franzen, L., Ghassemifar, R., Malcherek, P. Experimental mast cell activation improves connective tissue repair in the perforated rat mesentery. Agents Actions. 33, 371-377 (1991).
- Anderson, C. R., Hastings, N. E., Blackman, B. R., Price, R. J. Capillary sprout endothelial cells exhibit a CD36 low phenotype: regulation by shear stress and vascular endothelial growth factor-induced mechanism for attenuating anti-proliferative thrombospondin-1 signaling. Am. J. Pathol. 173, 1220-1228 (2008).
- Norrby, K. In vivo models of angiogenesis. J. Cell. Mol. Med. 10, 588-612 (2006).
- Norrby, K. C. Rat Mesentery Angiogenesis Assay. J. Vis. Exp. (52), e3078 (2011).
- Murfee, W. L., Rehorn, M. R., Peirce, S. M., Skalak, T. C. Perivascular cells along venules upregulate NG2 expression during microvascular remodeling. Microcirculation. 13, 261-273 (2006).
- Stapor, C. P., Murfee, L. W. Identification of class III β-tubulin as a marker of angiogenic perivascular cells. Microvascular Research. , (2011).
- Yang, M., Aragon, M., Murfee, W. L. Angiogenesis in Mesenteric Microvascular Networks from Spontaneously Hypertensive Versus Normotensive Rats. Microcirculation. , (2011).
- Robichaux, J. L. Lymphatic/Blood endothelial cell connections at the capillary level in adult rat mesentery. Anat. Rec. (Hoboken). 293, 1629-1638 (2010).
- Amos, P. J. IFATS collection: The role of human adipose-derived stromal cells in inflammatory microvascular remodeling and evidence of a perivascular phenotype. Stem Cells. 26, 2682-2690 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved