Method Article
Extériorisation Mésentère Rat: Un modèle pour étudier la dynamique cellulaires impliqués dans l'angiogenèse
Dans cet article
Résumé
Cet article décrit un modèle simple pour stimuler l'angiogenèse dans le mésentère de rat. Le modèle produit des augmentations spectaculaires de la germination capillaire, la zone vasculaire et la densité vasculaire au cours d'une évolution dans le temps relativement court dans un tissu qui permet la visualisation en face de l'ensemble des réseaux microvasculaires vers le niveau de la cellule unique.
Résumé
La croissance du réseau Microvacular et le remodelage sont des aspects cruciaux de la cicatrisation des plaies, l'inflammation, la rétinopathie diabétique, la croissance tumorale et les conditions d'autres maladies 1, 2. Croissance du réseau est communément attribué à l'angiogenèse, définie comme la croissance de nouveaux vaisseaux à partir de vaisseaux pré-existants. Le procédé angiogénique est également directement relié à artériogenèse, défini comme l'acquisition d'un capillaire de revêtement cellule périvasculaire et l'élargissement navire. Inutile de dire que, l'angiogenèse est complexe et implique de multiples acteurs au niveau cellulaire et moléculaire 3. Comprendre comment un réseau microvasculaire augmente, il faut identifier les dynamiques spatiales et temporelles ainsi que la hiérarchie d'un réseau au cours du temps de l'angiogenèse. Cette information est essentielle pour le développement de thérapies visant à manipuler la croissance des vaisseaux.
Le modèle extériorisation décrit dans cet article représente un modèle simple et reproductible pour stimulerLating l'angiogenèse dans le mésentère de rat. Il a été adapté à partir de cicatrisation des modèles chez le rat mésentère 4-7, et est une alternative à stimuler l'angiogenèse dans le mésentère via des injections ip de pro-angiogéniques 8, 9. Le modèle extériorisation est attrayante parce qu'elle nécessite un minimum d'intervention chirurgicale et produit des augmentations dramatiques, reproductibles dans les germes de la zone capillaire, vasculaire et de la densité vasculaire au cours d'une évolution dans le temps relativement court dans un tissu qui permet de visualiser en deux dimensions des réseaux microvasculaires entières vers le bas pour unique niveau de la cellule. La croissance stimulée reflète naturelles réponses angiogéniques dans un environnement physiologique, sans ingérence des étrangers molécules angiogéniques. En utilisant des méthodes immunohistochimiques étiquetage, ce modèle a été révélée extrêmement utile pour identifier de nouveaux événements cellulaires impliqués dans l'angiogenèse. Les enquêteurs peuvent facilement corréler les mesures angiogéniques au cours du temps de remodelage avec le temps spdynamique, tels que S PROPRES cellulaires changements phénotypiques ou interactions cellulaires 4, 5, 7, 10, 11.
Protocole
1. Set-Up procédure chirurgicale notes
- Avant la chirurgie stériliser les fournitures et instruments chirurgicaux. Fournitures utilisées pour la procédure chirurgicale stérile pour chaque rat comprennent une drapé à être aménagé en tant que surface stérile pour le placement d'instruments, un champ d'un trou pré-découpé environ 0,5 à 1,5 x dans au centre pour être placé sur le rat , et de la gaze. Le trou de pré-coupe sur le champ s'alignera avec l'incision faite sur le rat. Instruments nécessaires pour la chirurgie comprennent 1 paire de ciseaux pour la norme être utilisé pour couper du matériel de suture, deux pinces et un porte-aiguille fine pour la manipulation et de préhension de la suture, et un scalpel avec une lame. Nous avons répertorié les outils communs utilisés par notre laboratoire dans le tableau des matériaux spécifiques chirurgicales et outils. Cependant, la sélection finale de l'outil dépend des préférences de l'expérimentateur.
- Préparer l'espace chirurgie. Placez un 100 mL à 0,9% sac saline stérile en vertu d'un coussin chauffant pour s'assurer que la solution saline qui entre en contact avecvec le tissu mésentère est préchauffée à environ 37 ° C. Comme une alternative à la solution saline, vous pouvez utiliser la solution de Ringer ou d'une autre tampon physiologique. Disposer des instruments chirurgicaux stérilisés et des fournitures sur un champ stérile pour un accès facile au cours de la procédure de l'extériorisation. En outre, vous aurez besoin stériles applicateurs pointe de coton et les 3 types de sutures appropriées (4-0, 5-0, et 7-0). Fait des paquets-vous que les pré-ouvert de sorte que les matériaux peuvent être consultés à la manipulation stérile. Enfin, désinfecter le stade de la pré-mise à jour en plastique en le plongeant dans de l'éthanol à 100% pendant au moins 5 minutes. La scène est un 100 mm boîte de Pétri avec un trou elliptique coupé dans le centre (Figure 1). Un outil de Dremel peut être utilisé pour d'abord faire et, si nécessaire, élargir le trou. Après que le trou est réalisé, les bords de la matière plastique coupe sont réalisés en utilisant du papier lisse sable de grains différentes. La scène est ensuite lavé et, enfin, que ce soit la pâte à modeler inerte (achetées dans un magasin de l'artisanat local) ou Silicsur la colle est ajouté à bord du trou afin de fournir une soulevée, la surface lisse. Avant le contact avec le tissu, le stade devra être bien rincée avec une solution saline stérile.
- Pour ce modèle de l'angiogenèse, nous utilisons généralement des rats mâles adultes Wistar (350 ± 25 g). Souches de rats et d'autres âges peuvent être utilisés. Dans notre laboratoire, les rats sont anesthésiés par injection intramusculaire à la kétamine (80 mg / kg de poids corporel), la xylazine (8 mg / kg de poids corporel), et de l'atropine (0,08 mg / kg de poids corporel). Après environ 5 minutes, l'effet de l'anesthésie est confirmée et la peau abdominale du rat est rasée.
2. Modèle Extériorisation Rat Mésentère
- Placez le rat anesthésié sur le dos sur un coussin chauffant pour maintenir la température du corps. Des techniques aseptiques sont utilisés pendant la procédure chirurgicale. Porter des gants stériles et ne permettent pas d'instruments et de fournitures pour communiquer avec les surfaces non stériles autres que les tissus de rat.
- Nettoyez la zone abdominale avec une alternance de lingettes using de la gaze stérile trempée dans isopropylique à 70% et l'iode.
- Utilisation de la lame de bistouri, faire une petite (environ 0,75 pouce) incision longitudinale le long de la peau, puis la ligne blanche d'environ 1 pouce au-dessous du sternum.
- Placer le champ de pré-coupe sur la section abdominale de telle sorte que l'ouverture s'aligne avec l'incision.
- Appliquez doucement la pression autour de l'incision. Ce général se traduira par l'exposition de l'intestin grêle assez pour qu'il puisse être facilement identifié.
- Utilisation des applicateurs de bout en coton, tirez doucement sur une section de l'intestin grêle et de localiser l'iléon. Comme le mésentère est sorti, il devrait être légèrement aménagé dans le stade plastique (Figure 2).
- Identifier les 6-8 fenêtres mésentériques vascularisées. Une fenêtre mésentérique est définie comme la membrane mince translucide entre les paires des artères / veines d'alimentation de l'intestin grêle (figure 2).
- Noter l'heure de départ de l'extériorisation. Laissez le mesentery section extériorisé pendant 20 minutes. Au cours de la période de l'extériorisation, utiliser une seringue stérile (5 ml) de façon intermittente reconstituer le sérum physiologique dans la boîte de Pétri afin de s'assurer que le tissu reste immergé et ne se dessèche pas.
- Pendant le temps d'exposition de 20 minutes, marquer les 2 fenêtres mésentériques situés au centre avec 7-0 stérile suture. Les marques doivent être réalisés dans le domaine graisse près de l'intestin.
- Retour de la région extériorisé du mésentère à la cavité abdominale.
- Fermez le muscle abdominal avec 5-0 monofilament dans le modèle interrompu.
- Fermer la peau avec une suture monofilament 4-0 dans motif interrompu.
- Essuyez la zone suturée avec une alternance de lingettes en utilisant la gaze stérile trempée dans isopropoyl 70% et l'iode.
- Fais gel lubrifiant œil sur les deux yeux du rat. Le but de lubrifier l'œil est d'empêcher le dessèchement de la cornée pendant la procédure chirurgicale et la récupération. L'application de lubrifiant oculaire doit être appliquéavant le début de l'intervention chirurgicale. Si nécessaire, appliquer à nouveau lubrifiant oculaire avant de retourner chez le rat dans sa cage pour la récupération.
3. La récolte de tissus et de fixation
- Le jour de la stimulation après l'intérêt, anesthésier et euthanasier le rat. Dans notre laboratoire, les rats sont anesthésiés par injection intramusculaire à la kétamine (80 mg / kg de poids corporel), la xylazine (8 mg / kg de poids corporel), et de l'atropine (0,8 mg / kg de poids corporel), puis euthanasiés par injection intracardiaque de beuthanasia. Beuthanasia pentobarbital de sodium est un / phénytoïne solution qui peut être utilisé pour l'euthanasie rapide et indolore. Par rat notre laboratoire injecte généralement de 0,1 à 0,2 ml.
- Re-ouvrir la cavité abdominale et retirez délicatement l'intestin grêle et de localiser les deux fenêtres marquées.
- Découpez chacune des fenêtres mésentériques extériorisées à l'aide de pinces et de micro-ciseaux. Y compris une bordure de fenêtre par la graisse est avantageux pour les tissus plus tard, la diffusion sur des lames de microscope. Immédiatement, Plonger chaque fenêtre dans du PBS. Lors de la coupe, essayez d'éviter de couper à travers l'artère / veine paires au sein de la frontière graisse des fenêtres afin de minimiser le potentiel du sang de remplissage des fenêtres. En outre, de minimiser les couper à travers l'intestin que les résultats dans le contenu intestinal contactant les fenêtres.
- Utilisez une pince à répandre les tissus sur les lames de microscope chargées positivement. Deux tissus peuvent être montés par diapositive.
- Autoriser les tissus de sécher partiellement et en utilisant une lame de scalpel retirer l'excès de graisse.
- Les tissus sont maintenant prêt à être fixé. Méthodes de fixation typiques peuvent être utilisés. Dans notre laboratoire, nous avons souvent fixer les diapositives dans le méthanol (-20 ° C) pendant 30 min. Étiquetage réussie a également été réalisée avec des tissus non fixées. Méthodes de fixation peut dépendre de votre anticorps préféré.
4. Immunomarquage tissulaire
- Les tissus peuvent généralement maintenant être étiquetés conformément aux instructions par anticorps pour l'immunohistochimie. Compte tenu de notre intérêt à identifier les rôlesde péricytes vasculaires au cours de l'angiogenèse, notre laboratoire qualifie couramment pour les cellules endothéliales et périvasculaires 10, 12, 13. Étiquettes utiles pour identifier des cellules endothéliales selon la hiérarchie des réseaux microvasculaires sont un anticorps anti-PECAM ou BSI-lectine. Des marqueurs de cellules périvasculaires utilisés dans ce tissu comprend NG2, la desmine, l'actine α-SM, PDFGRβ, et la classe III β-tubuline. Ci-dessous, dans la section 3.3, nous avons listé les protocoles pour colorimétriques et fluorescents protocoles immunomarquage PECAM.
- Avant l'incubation anticorps primaire initiale, diapositives sont séchés sous vide pour éliminer l'excès de solution tampon. En outre, les tissus sont d'abord exposé à un stylo cire pour empêcher l'écoulement incontrôlé de solutions d'anticorps loin du tissu. Enfin, toutes les mesures en matière d'étiquetage sont suivies par des étapes de lavage. Pour les étapes de lavage, les lames sont placées à l'intérieur des pots de coloration. La solution tampon est échangé 3 fois pendant la durée de lavage.
- Endothéliales des procédures de cellules d'anticorps en matière d'étiquetage:
PECAM colorimétrique Lableing
- D'incubation d'anticorps primaire: goutte à goutte environ 100-200 ml de solution d'anticorps primaire (anticorps monoclonal de souris biotinylé 1:200 CD31 anticorps dilué dans le tampon d'anticorps (0,1% de saponine dans le PBS + 2% de BSA)) sur le dessus pour chaque tissu, assurez-vous tout le tissu est couverts avec une solution d'anticorps. Incubation pendant 1 heure à température ambiante.
- Laver les tissus avec de la saponine PBS +0,1% pendant 30 minutes.
- D'incubation d'anticorps secondaire: goutte à goutte une solution d'anticorps secondaire (Vectastain Elite ABC solution de Vector Laboratories, une streptavidine peroxydase anticorps solution secondaire) sur le dessus de tissus. Incuber à température ambiante pendant 1 heure.
- Laver les tissus avec de la saponine PBS +0,1% pendant 30 minutes.
- Incuber les tissus avec Vector Nouvelle-Rouge pendant 15 minutes. Puis augmenter les tissus avec de l'eau.
- Diapositives à Mount Tremper les lames dans l'éthanol à 95% 10 fois. Plonger les lames dans de l'éthanol à 100% pendant 2 min. Immerger les lames dans une autre éthanol à 100% silution pendant 2 minutes. Puis Immerger les lames dans consécutifs solutions de xylène à 100% pendant 2 minutes chacun. Laisser sécher et couvrir les tissus avec une couche mince de VectaMount et une lamelle.
PECAM fluorescent étiquetage
- D'incubation d'anticorps primaire: goutte à goutte environ 100-200 ml de solution d'anticorps primaire (anticorps monoclonal de souris biotinylé 1:200 CD31 anticorps dilué dans le tampon d'anticorps (0,1% de saponine dans le PBS + 2% de BSA)) sur le dessus pour chaque tissu, assurez-vous tout le tissu est couverts avec une solution d'anticorps. Incubation pendant 1 heure à température ambiante.
- Laver les tissus avec de la saponine PBS +0,1% pendant 30 minutes.
- D'incubation d'anticorps secondaire:. Solution d'anticorps secondaire goutte à goutte ((1:100 streptavidine-Cy3 dilué dans le tampon d'anticorps (0,1% de saponine dans le PBS + 2% de BSA)) au-dessus des tissus Incuber à température ambiante pendant 1 heure.
- Laver les tissus avec de la saponine PBS +0,1% pendant 30 minutes.
- Diapositives de montage: goutte à goutte 50:50 PBS avec du glycérol sur le dessus de tissus. Couvriravec lamelle. Ensuite, utilisez le vernis à ongles pour sceller l'écart entre lamelle et des diapositives.
5. Les résultats représentatifs
Des images représentatives de tissus mésentère de rat par immunohistochimie étiquetés pour PECAM sont affichés dans la figure 3. PECAM étiquetage identifie tous les types de navires le long de la hiérarchie de remodelage réseaux microvasculaires et peut être utilisé pour quantifier métriques angiogéniques au moment de poste stimulation spécifique de points. PECAM étiquetage permet également pour la détermination des artérioles par rapport à des veinules. Artérioles alimentation présentent typiquement des diamètres plus petits et allongé la morphologie des cellules endothéliales par rapport aux veinules appariés (figure 4). Les capillaires et les choux de capillaires peuvent être identifiés en fonction de leur diamètre du vaisseau et la position relative au sein d'un réseau. Les caractéristiques typiques des réseaux de remodelage comprennent une augmentation de la densité capillaire germination navire,, zone vascularisée et tortuos veinuleslité. Quantification des différents paramètres angiogéniques identifie l'évolution temporelle de la croissance du réseau (figure 5). Capillaire germination de vaisseaux pré-existants, des pics entre le jour 3 et jour 5 et revient à son niveau non stimulées par jour 10. Cette augmentation transitoire de la germination est suivie par des augmentations de la densité vasculaire et de la zone vascularisée. Comme preuve pour la rénovation de grands navires dans ce modèle, le nombre de segments des artérioles et veinules augmente également au cours du temps.
Dans notre laboratoire, ce modèle a été utilisé pour identifier des changements phénotypiques cellulaires au point de temps spécifique au cours de ce processus de remodelage 10, 11. Par exemple, la classe III β-tubuline identifie péricytes le long des vaisseaux angiogéniques (Figure 6). Dans les tissus non stimulés, classe III β-tubuline expression est spécifique du nerf. En revanche, pendant le pic de germination capillaire, classe III β-tubuline est exprimé par les cellules périvasculaires. Ce typede résultat met en évidence l'utilisation de ce modèle simple et robuste angiogénique d'identifier de nouveaux types de cellules impliquées dans le processus angiogénique.

Figure 1. Images de la scène en plastique pré-et post-modification. La phase de pré-mise à jour est un 100 mm boîte de Petri. Modifications comprennent une coupe elliptique trou dans le centre et l'addition subséquente de pâte à modeler ou d'une colle de silicium jusqu'au bord de l'orifice pour la création d'un soulevée, la surface lisse. Cette surface offre une frontière intérieure qui facilite superfusion des fenêtres mésentériques extériorisées. La barre d'échelle est de 1 cm.
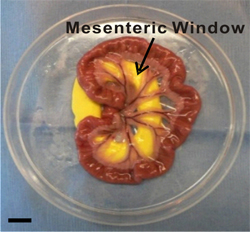
Figure 2. Image de la région mésentérique extériorisé. Fenêtres mésentériques sont définis comme des membranes minces translucides entre les paires des artères / veines d'alimentation de l'intestin grêle. Au cours de l'extériorisationdurée, la région mésentérique est aménagé et immergé dans une solution saline dans un plat de Petri modifiée. Inerte pâte à modeler jaune fournit une surface lisse pour le mésentère d'être tiré à travers le trou pré-découpé. La barre d'échelle est de 1 cm.
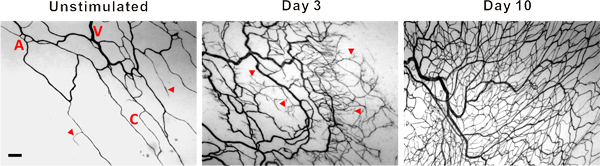
Figure 3. Des images représentatives de mésentériques réseaux microvasculaires à partir de tissus non stimulés et des tissus à 3 et 10 jours après l'extériorisation du mésentère. PECAM étiquetage identifié la hiérarchie des réseaux microvasculaires, y compris, artérioles (A), des veinules (V) et capillaires (C). La stimulation des postes, réseaux microvasculaires affiché une augmentation de la germination capillaire (têtes de flèches) et la densité des vaisseaux. La barre d'échelle est de 100 um.
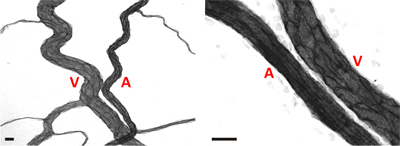
Images représentatives Figure 4. De l'artériole / paires veinules au sein du réseau microvasculaire chez le rat adulte mésentériques. Dans les deux images, artérioles (A) peut être différenciée de veinules (V) sur la base de plus petit diamètre par rapport allongé et la morphologie des cellules endothéliales. Barres d'échelle sont 20 um.
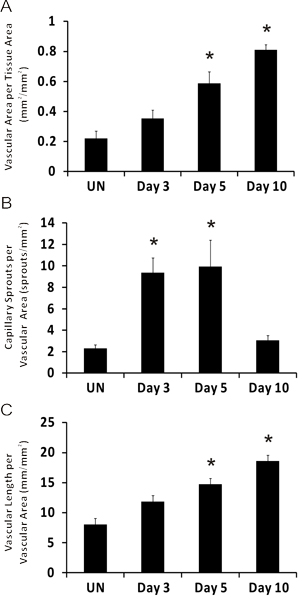
Figure 5. La quantification représentant des métriques angiogéniques au cours du temps de l'extériorisation de croissance mésentère microvasculaire après. A) zone vasculaire par zone de tissu. B) Nombre de choux de capillaires par région vasculaire. C) La longueur totale vasculaire par zone vasculaire. * Représente de différence significative par rapport au groupe non stimulé. Les comparaisons statistiques ont été faites en utilisant une analyse de variance à une voie suivie par le test de Dunn. (P <0,05). Des Nations Unies représente non stimulées.
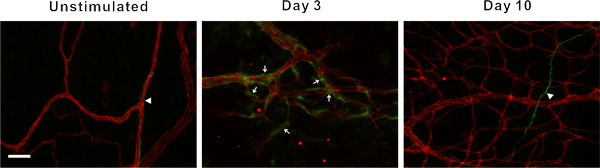
Figure 6. Représentant des images fluorescentes de mésentériques réseaux microvasculaires à partir de tissus non stimulés et des tissus à 3 et 10jours après l'extériorisation du mésentère. Immunofluorescence PECAM étiquetage (rouge) identifie les cellules endothéliales, et la classe III β-tubuline étiquetage (vert) identifie les nerfs (têtes de flèches) et des cellules périvasculaires (flèches). Cellules périvasculaires transitoirement réguler à la hausse de classe III β-tubuline lors de la germination capillaire. En non stimulées réseaux microvasculaires, classe III β-tubuline est nerveuse spécifique et ne pas identifier les cellules périvasculaires. 3 jours après la stimulation, la classe III β-tubuline qualifie positivement cellules périvasculaires long microvaisseaux. Au jour 10, classe III modèle d'expression β-tubuline commence à revenir au scénario non stimulées. La barre d'échelle est de 50 um.
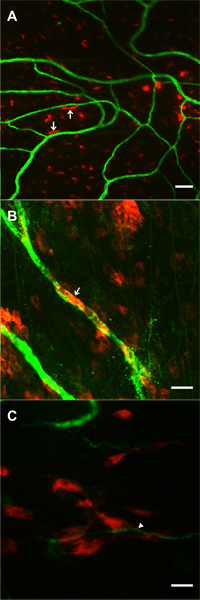
Figure 7. Images de soutien de la faisabilité du suivi des pré-cellules marquées appliqués localement au cours de la croissance du réseau microvasculaire stimulée par l'extériorisation mésentère. Les cellules ont été perfusés sur mesenteric fenêtres pendant la période de l'extériorisation de 20 minutes. 1 jour post-opératoire, les cellules marquées DII (rouge) ont été observées dans le plan focal avec dame PECAM positif microvaisseaux (vert). A, B) Exemples de DII étiquetés cellules de moelle osseuse exhibant arrondi et allongé morphologies. Dans certains cas (flèches) des cellules ont été allongée le long de microvaisseaux. C) Exemple d'un groupe de DiI a marqué les cellules souches mésenchymateuses à proximité de la pointe d'un capillaire de germes (flèche). Barres d'échelle sont 50 um (A), et 20 um (B, C).
Discussion
Le modèle extériorisation a été signalé en 2006 et est adapté des modèles précédents de blessures mécaniques du mésentère de rat de l'angiogenèse 4-7 et produit des résultats similaires à des modèles bien établis injection IP qui tirent parti du rat mésentère 9. Le temps de l'extériorisation 20 minutes a été déterminée expérimentalement pour produire une réponse robuste angiogénique. Bien que cette période pourrait être modifiée, elle permet à une application locale d'inhibiteurs de l'angiogenèse 4 pour des études mécanistiques et l'application directe des cellules exogènes pour les études de lignées cellulaires. De faisabilité de la constitution de cellules dans le remodelage des tissus mésentériques est appuyée par des études préliminaires dans notre laboratoire à l'aide pré-étiquetés cellules de moelle osseuse et les cellules souches mésenchymateuses (Figure 7), et par le succès d'enquêter sur le sort de l'homme tissu adipeux ip injection cellules stromales 14 . Dans notre laboratoire, nous avons utilisé ce modèle pour identifier les phen péricyteschangements otypic au cours du temps de la réponse angiogénique 10 et d'évaluer le potentiel angiogénique dans des conditions pathologiques, telles que l'hypertension 12. La réponse angiogénique et les changements phénotypiques cellulaires associés à ce modèle peut également être observé dans d'autres modèles mésentériques de rat angiogéniques y compris l'exposition hypoxie chronique 10, 11.
Une limitation du modèle extériorisation, c'est que les mécanismes exacts de déclenchement de l'angiogenèse ne sont pas connus. Extériorisation du mésentère a été liée à la dégranulation des mastocytes et une augmentation des taux d'histamine 6, mais une enquête plus approfondie est nécessaire pour gagner plus de perspicacité. Le stimulus angiogénique est sans doute multifactorielle, produisant une réponse robuste remodelage dans la hiérarchie d'un réseau microvasculaire. Bien que les mécanismes inconnus restent une critique majeure de ce modèle, sa reproductibilité et la simplicité le rendre attrayant pour identifier la dynamique cellulaire impliqués dans le processus intrinsèquement complexe germination capillaire. La reproductibilité du modèle est soutenu par comparables métriques angiogéniques au cours du temps de la croissance du réseau microvasculaire dans plusieurs souches de rats (mâles Wistar et Sprague-Dawley femelles) dans des études publiées antérieurement dans notre laboratoire 10, 12. Depuis, la majorité des adultes tissus mésentériques de rat sont vascularisés, le modèle permet aussi de multiples tissus à examiner par animal. Malheureusement, ce modèle n'est manifestement pas applicable à des modèles génétiques de souris que les fenêtres mésentériques de souris ont une vascularisation moins natale et, dans notre expérience, manquent souvent observables réseaux de branchement. Les applications futures comprennent l'étude de la fonctionnalité navire au cours de l'angiogenèse en utilisant la microscopie intra-vitale à des moments précis et l'enquête de la dynamique connexes cellulaires impliqués dans la lymphangiogenèse et la neurogenèse. Bien que la mesure de la vascularisation native par la fenêtre mésentérique semble être roughly proportionnelle avec l'âge, nous avons observé de branchement des réseaux microvasculaires chez les rats mâles Wistar aussi jeunes que 4-5 semaines. Ces observations suggèrent que le modèle extériorisation pourrait également être appliqué pour comparer les différences angiogéniques à travers les âges.
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Ce travail a été soutenu par le Board of Regents de l'État de la Louisiane LEQSF (2009-12)-RD-A-19 (PI: WL Murfee) et l'hypertension Tulane et du Centre rénale d'excellence financé par le NIH subvention P20RR017659-08 (PI : L. Gabriel Navar).
matériels
| Name | Company | Catalog Number | Comments |
| Nom | Entreprise | Numéro de catalogue | Commentaires additionnels |
| Draper | Cardinal Health | 4012 | 12 "x12" Bio-Shield stérilisation régulière Wraps |
| Noyes Micro ciseaux | Roboz instruments chirurgicaux | RS-5677 | Noyes Micro Ciseaux de dissection de printemps; Droites, Sharp-Blunt points; Cutting Edge 13mm; Largeur Astuce 0.25mm, 4 1/2 "Longueur hors tout |
| Graefe Pince | Roboz instruments chirurgicaux | RS-5135 | Micro Pinces à disséquer; dentelé; légère courbe; Largeur Astuce 0.8mm; 4 "Longueur |
| Graefe Pince | Roboz instruments chirurgicaux | RS-5130 | Micro Pince à dissection; en dents de scie, les droites; Largeur Astuce 0.8mm; 4 "Longueur |
| Suture 4-0 | ETHICON | 699g | (1,5 métrique) monofilament en nylon noir Ethilon Suture |
| 5-0 | ETHICON | 8556 | (1,0 métrique) PROLENE Polyprolene suture monofilament Bleu |
| 7-0 suture | ETHICON | 1647G | (0,5 métrique) monofilament en nylon noir Ethilon Suture |
| Titulaire Castroviejo aiguille Micro | Outils belle science | 12060-02 | Largeur Astuce: 0.6mm De serrage Longueur: 5mm Longueur: 9cm Pointe droite |
| Porte-aiguille Castroviejo | Outils belle science | 12565-14 | Forme de la pointe: Droit Largeur Astuce: 1.5mm Longueur de serrage: 10mm Ciseaux: Aucun Lock: Oui Longueur: 14cm Dentelé: Oui |
| Manche de bistouri | Roboz d'instruments chirurgicaux | RS-9843 | Scalpel Handle, n ° 3; solide; 4 "Longueur |
| Stérile Lame chirurgicale | Cincinnati chirurgicale | 0110 | En acier inoxydable; Taille 10 |
| Boîte de Pétri | Fisher Scientific | 08-757-13 | Ridge biseauté, Slippable |
Table des matières spécifiques chirurgicales et outils.
| Nom | Entreprise | Numéro de catalogue | Commentaires additionnels |
| Beuthanasia | Schering-Plough Animal Health Corp Union (Commandé par MWI alimentation vétérinaire) | MWI #: 011168 | Matière active: par 100 ml, 390 mg de sodium pentobarbital de sodium, 50 mg de phénytoïne |
| La kétamine | Fort Dodge Santé Animale (Commandé par MWI alimentation vétérinaire) | MWI #: 000680 | Kateset 100 mg / ml |
| La xylazine | LLOYD. Inc (Commandé par MWI alimentation vétérinaire) | MWI #: 009307 | Anased 100 mg / ml |
| Saline | Hospira Inc | 94-217-JT | |
| PBS | SIGMA | 011M8207 | |
| La saponine | Sigma | BCBB4080 | |
| PECAM (CD31) | BD Pharmingen | 553371 | |
| Streptavidine-Cy3 | Jackson ImmunoResearch | 016-160-084 | |
| BSA | Jackson ImmunoResearch | 096555 | |
| Vectastain Elite ABC | Vector Laboratories | PK-6100 | |
| Vecteur Nouvelle-Rouge | Vector Laboratories | SK-4800 | |
| VectaMount | Vector Laboratories | H-500 |
Table des réactifs spécifiques
Références
- Carmeliet, P., Jain, R. K. Angiogenesis in cancer and other diseases. Nature. 407, 249-257 (2000).
- le Noble, F. A., Stassen, F. R., Hacking, W. J., Struijker Boudier, H. A. Angiogenesis and hypertension. J. Hypertens. 16, 1563-1572 (1998).
- Peirce, S. M., Skalak, T. C. Microvascular remodeling: a complex continuum spanning angiogenesis to arteriogenesis. Microcirculation. 10, 99-111 (2003).
- Anderson, C. R., Ponce, A. M., Price, R. J. Immunohistochemical identification of an extracellular matrix scaffold that microguides capillary sprouting in vivo. J. Histochem. Cytochem. 52, 1063-1072 (2004).
- Ponce, A. M., Price, R. J. Angiogenic stimulus determines the positioning of pericytes within capillary sprouts in vivo. Microvasc. Res. 65, 45-48 (2003).
- Franzen, L., Ghassemifar, R., Malcherek, P. Experimental mast cell activation improves connective tissue repair in the perforated rat mesentery. Agents Actions. 33, 371-377 (1991).
- Anderson, C. R., Hastings, N. E., Blackman, B. R., Price, R. J. Capillary sprout endothelial cells exhibit a CD36 low phenotype: regulation by shear stress and vascular endothelial growth factor-induced mechanism for attenuating anti-proliferative thrombospondin-1 signaling. Am. J. Pathol. 173, 1220-1228 (2008).
- Norrby, K. In vivo models of angiogenesis. J. Cell. Mol. Med. 10, 588-612 (2006).
- Norrby, K. C. Rat Mesentery Angiogenesis Assay. J. Vis. Exp. (52), e3078 (2011).
- Murfee, W. L., Rehorn, M. R., Peirce, S. M., Skalak, T. C. Perivascular cells along venules upregulate NG2 expression during microvascular remodeling. Microcirculation. 13, 261-273 (2006).
- Stapor, C. P., Murfee, L. W. Identification of class III β-tubulin as a marker of angiogenic perivascular cells. Microvascular Research. , (2011).
- Yang, M., Aragon, M., Murfee, W. L. Angiogenesis in Mesenteric Microvascular Networks from Spontaneously Hypertensive Versus Normotensive Rats. Microcirculation. , (2011).
- Robichaux, J. L. Lymphatic/Blood endothelial cell connections at the capillary level in adult rat mesentery. Anat. Rec. (Hoboken). 293, 1629-1638 (2010).
- Amos, P. J. IFATS collection: The role of human adipose-derived stromal cells in inflammatory microvascular remodeling and evidence of a perivascular phenotype. Stem Cells. 26, 2682-2690 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon