Method Article
ワクチンには、マウスの応答における鼻咽頭関連リンパ網内系組織(NALT)の役割を調べる
要約
鼻腔内ワクチンマウスの鼻腔内および全身の免疫応答に鼻咽頭関連リンパ細網組織(NALT)の寄与を調べるためのメソッドが記述されています。我々はNALTに依存するマウスモデルを確立するために外科手術を発揮し、 ex vivoで文化。
要約
人間、齧歯類、および他の哺乳動物に見られる鼻咽頭関連リンパ細網組織(NALT)が、1月3日副鼻腔内免疫に貢献しています。 NALTは、硬口蓋、上記の鼻腔にある2つの平行な釣鐘型の構造であり、通常、粘膜関連リンパ系4-6の二次成分であると考えられている。 NALT内に位置し、抗原提示樹状細胞4,7,8が点在し、BおよびTリンパ球の離散的コンパートメントである。これらの細胞は、空気通路9,10の粘膜表面から抗原検索のための責任があるM細胞にインターカレートした上皮細胞層に囲まれています。 NALTを介して循環するナイーブリンパ球は、呼吸器病原体7で最初の出会いに対応するために態勢を整えています。 NALTは2歳で人間に消えている間、ワルダイヤー輪と同様に構造化されたリンパ器官は目を保持し続けるライフ6 roughout。人間とは対照的に、マウスは、このように副鼻腔11内に元の免疫応答の研究のための便利な動物モデルを提供し、生涯を通じてNALTを保持します。
NALTの単細胞懸濁液の培養は、単核細胞の収率が低いために実用的ではありません。しかし、NALT生物学は、無傷の器官のex vivoで培養することにより検討し、このメソッドは自然な組織構造を維持するための付加的な利点を持っていることができます。 in vivo試験では、NALTに限ら欠陥を提示する遺伝子ノックアウトモデルでは、発達経路の理解不足のため現在利用できません。リンホトキシン-αノックアウトマウスはNALTが萎縮している一方、例えば、パイエル板、末梢リンパ節、濾胞樹状細胞やその他のリンパ組織はまた、これらの遺伝子操作マウスを12,13に変更されています。遺伝子ノックアウトマウスの代わりに、外科的アブレーションのpとして常に承認、他の組織に影響を与えることなく、鼻腔からNALTを排除します。その結果マウスモデルは、ワクチン1,3にNALTと免疫応答の間の関係を確立するために使用されています。血清、唾液、鼻洗浄と膣分泌物のシリアルコレクションは、NALTから直接発信免疫応答は組織培養によって確認することができますが、予防接種へのホストの応答の基礎を確立するために必要である。次の手順では、鼻腔(IN)ワクチン接種局所および全身体液性免疫応答を検討するために必要な手術は、組織培養とサンプルコレクションの概要を説明します。
プロトコル
1。 NALTの収集と培養
- 承認されたIACUCガイダンスを使用してマウスを安楽死させる。 NALTに影響を与える可能性吸入麻酔薬の使用は避けてください。無菌スペースまたは生物学的安全性キャビネットにマウスを転送します。マウスの下顎を外して、アルコールとヨウ素ワイプと上部口蓋エリアを清掃してください。
- 慎重にマウス切歯と臼歯の内側の輪郭に従うことによって、上部口蓋を削減し、消費税にメスハンドルに11号手術ブレードを使用しています。
- 口蓋を引き裂くないように注意しながらピンセットでそっと背中の皮口蓋、。
- このステップでは、文化の汚染を低減する必要があると、複数の味覚を処理するために設計されています。 10%ウシ胎児血清を含むRPMI 1640、100μg/ mlのストレプトマイシン、100から成る完全培地(37℃)を250μLの滅菌48ウェルプレートにあらかじめ入力の最初の列の個々のウェルに配置する味覚UI / mLペニシリン、50μg/ mLのゲンタマイシン1μg/ mLのファンギゾン/アムホテリシン。メディアは、味覚を5%CO 2/95%湿度の高い空気インキュベーター(37℃)で培養し、あるいは非CO 2培養用の10 mM HEPES pH 7.4を使用している場合はバッファリングされ、炭酸でなければなりません。
- 味覚を洗浄するために、口蓋は8回の洗浄の合計を受けているまで、慎重に、洗浄の間に板をタップ、行の連続した各ウェルに味覚を移動するために鉗子を使用しています。
- ウェル内の新鮮な完全培地(37℃)の250μLを含む新しい滅菌48ウェルプレートに味覚を転送します。
- 研究の期間培養し、37℃のインキュベーターに味覚を含むプレートを配置します。
- 無菌的に新鮮な37°Cの培養液100μLで置き換え、エッペンドルフチューブ、24時間ごとに培養ウェルから培地100μLを転送することによって分析のためのサンプルを収集します。
- ペレットの破片〜10分、4℃、380 xgで培地サンプルを遠心します。
- 分析する準備ができるまで-20℃で新鮮なエッペンドルフチューブや店舗を遠心分離し、試料から上清を移します。
- 抗原特異的IgG、IgMおよびIgAの、または分泌されるサイトカインは、標準的な酵素結合免疫吸着アッセイ(ELISA)によって組織培養上清で測定されます。
2。 NALTの外科的アブレーション
- 雌性BALB / cマウス、年齢の7から9週では、適切な科目であるが、他の株も許容されます。ポスト操作投与される食料や水代わりにマウスを順応するのに三日、手術前にゲル状のウェットフードを提供しています。
- 手術前に口腔内にメタカムの疼痛緩和薬(1.5 mg / mlまたはは0.05 mg /ドロップ)1滴を管理します。
- 乾燥を防ぐために、ケタミン、アセプロマジン、およびキシラジンの混合物(KAX)とは、例えば、承認されたIACUCのガイダンスを使用してマウスを麻酔し、眼にPuralube獣医軟膏を適用します。 NALTに影響を与える可能性吸入麻酔薬の使用は避けてください。 Anesthesiaは、つま先の穏やかなピンチに反射反応の有無によって確認することができます。
- 皮下手術後のマウスの潜在的な脱水を防ぐために22から28ゲージの注射針とシリンジを用いて肩甲骨の間1 mLの生理食塩水(0.9%塩化ナトリウム注射USP)を管理することができます。また、手術中と後に健康な呼吸を促進するために22から28ゲージの注射針とシリンジを用いて肩甲骨の間に皮下Respiramの0.1 mLを管理することができます。
- 後続のすべての操作中にマウスに熱サポートを提供しています。
- 仰臥位で麻酔にマウスを置き、ゆっくりと口をこじ開けるように上限と下限歯の周囲に縫合糸の2つの別々のループを使用して、上部の口蓋を公開しています。
- NALTのサイトの上部口蓋の正中線の下の長さの切開が約3ミリメートルを作るために11番手術ブレードを使用しています。
- 切開に0.5 mmのmicrocuretteを差し込んで、静かに縁の下に落とすNALTを混乱させる。
- 熱焼灼装置のストレート細かいループを使って出血を止めるために切開を焼灼する。
- マウスが完全な意識と活動に復帰しながら熱のサポートを続行します。
- 3日後の手術のために一日に一回必要と経口鎮痛剤として脱水を防ぐために、皮下まで一日三回、肩甲骨の間の注入あたり1 mLの生理食塩水でマウスを提供しています。皮膚の膨圧をチェックするために皮膚テントテストを実行することにより脱水を決定します。それがつながったケースまでされるように、肩甲骨の間に皮膚や毛をつかみます。皮膚はすぐに正常、前の位置に返した場合、マウスは脱水ではありません。皮膚が上昇したまま、ゆっくりと移動した場合、マウスは脱水の状態であり、生理食塩水が必要になります。回復のための十分な時間を可能にするために、手術後少なくとも3日間ウェットフードを提供しています。
- すべての実験手順の前に、体重増加を追跡することによって、8月10日日間マウスを観察します。貧しい重量の回復通常不完全口蓋治癒を示し、これらのマウスは、さらなる研究から撤退しなければなりません。
3。組織学のためにNALTを準備し、NALT手術の成功を評価する
- 後述するようにNALT手術の成功は、組織によって確認する必要があります。すべての実験的研究を完了した後、承認されたIACUCガイダンスを使用して安楽死で、頭蓋のコレクションのためにマウスを準備します。 NALTに影響を与える可能性吸入麻酔薬の使用は避けてください。
- 安楽死させたマウスの首筋をつかみます。両側にハサミで下顎頭プロセスを経てsnippingによって頭蓋骨の残りの部分から下顎骨を削除します。
- うなじから始まり、徐々に剥離し、頭蓋骨の腹側に向かってカットして頭蓋骨から、皮膚や毛皮を削除します。
- 慎重に鼻の領域の周りの皮膚を除去し、完全に削除するには、鼻の先端から皮膚を切り取る。
- 脊椎ウィットから頭蓋を切り離すはさみのHAスニップ。
- 大後頭孔にハサミを挿入し、固定時の軟組織にホルマリンの浸透を可能にするために正中線に沿って頭蓋骨の下半分カット。
- 室温で24時間(NBF)緩衝ホルマリン、10%中性に頭蓋を固定します。
- 石灰を除去するためには、ギ酸混合物と瓶の中に、骨に触れてからRexynを防ぐためにガーゼに包まれた、サンプル、別のカセットを配置します。室温で12時間インキュベートし、その後約20分間、水道水の下に連続的に洗い流してください。
- かみそりの刃を持つ隔壁と過去の目の軌道にサンプルをトリミングします。
- サンプルおよびカセットを10%NBFの短期保存できます。
- 一晩処理のための組織·プロセッサにサンプルを置きます。これは、パラフィン包埋の準備のために、試料から水分を除去するために行われます。
- ダウン鼻のパラフィンブロックに埋め込む処理組織を削除し、それを冷却することができます。
- トリムR自動化されたミクロトームを持つブロックのウワーッ15μmの断面は、NALTのおおよその位置に近づくと、44.3℃の水浴中でガラススライド上にマウントするための5μmの切片に切断し続けています。
- ヘマトキシリンおよびエオシン(H&E)組織染色は、NALTアブレーションを評価するために使用されるべきである。
4。マウス由来の生体試料の収集
4.1血清
- 慎重にヒートランプで体温を上昇させると、血流が増加します。手術ブレードを横尾静脈をニッキングにより血液を収集します。血液がMicrotainer血清セパレータチューブに自由に滴下することができます。
- 血流を停止するには、そのようなガーゼやタオルなどの吸収性材料とのニックネームに穏やかな圧力を適用します。
- 30分間Microtainersで血液凝固を可能にし、少なくとも90秒間、6月15日×1,000 gの間遠心します。
- のためのクリーンなエッペンドルフチューブにMicrotainerからの血清に分離譲渡ストレージ-80℃
4.2唾液
- 頬と歯茎の線の間に緩衝生理食塩水(PBS)20から30μL滅菌リン酸をピペッティングしながら垂直に麻酔マウスを保持します。頬と歯茎の間にピペットチップを向けることによって、希釈唾液を収集します。
- -20℃で2倍のプロテアーゼ阻害剤とストアの10μLを含む新しいチューブに希釈した唾液を転送
4.3鼻汁
- 承認されたIACUCガイダンスを使用して、鼻の分泌物を収集する前に、マウスを安楽死させる。 NALTに影響を与える可能性吸入麻酔薬の使用は避けてください。
- 垂直方向にマウスを持って、慎重に鼻孔に滅菌したPBSの30μLをピペットで収集他の鼻孔からすすいでください。
- -20℃で2倍のプロテアーゼ阻害剤とストアの10μLを含む新しいチューブにリンス転送
4.4膣分泌物
- 番目の開口部に、マイクロピペットの先端を挿入します。安楽死させたマウスのe外陰部は、滅菌したPBSを50μLと膣を洗浄し、マイクロピペットですべての流体を収集します。
- -20℃で2倍のプロテアーゼ阻害剤とストアの10μLを含む新しいチューブにリンス転送
5。採取した試料中の抗原特異的抗体やサイトカインをELISA法または他の定量法によって測定することができる。
6。代表的な結果
図1は、ex vivoでの解析のための NALTを含む組織の処理に必要な手順の一般的な回路図を提供しています。 図2(A、B)では、口蓋のサイズは、点線で示され、アブレーション手術中に切開の場所()と同様に、表示されます。 NALTの場所は、並列組織を示す図2の切り出し、ヘマトキシリン染色口蓋(C)、上の小臼歯領域の矢印で示されています。
図3上部のNALTにアクセスするための口蓋(A、B)、アブレーション(C)と、切開の最終的な焼灼(D)の露出を示す、NALT混乱手術の手順を示します。直接手術後microcuretteによってNALT混乱のイメージは、 図3Fに表示されている間に手術前にNALTを囲む副鼻腔領域の典型的なH&E断面は、図3Eに示されています。手術から回復するための十分な時間ができるように、切開部を閉じる必要がありますし、NALT( 図3G)の鼻腔欠いている。
これらの技術を用いて得られた典型的な実験結果は、ブドウ球菌サブユニットワクチン(STEBVax)の研究から組織培養上清と生物学的試料を比較すると、 図4に示されています。マウスは鼻腔(IN)または腹腔内(IP)経路によりSTEBVax投与した。ワクチンは、Toll様受容体4の経路3,1を活性化するアジュバントで策定された 4、およびコントロールは、生理食塩水またはワクチンアジュバントなしで与えられた。実験群から得られた培養NALTには、ELISA法による測定だった培地中に抗原特異的免疫グロブリンを分泌する。この例では( 図4A)、結果はIgAの最大量は、アジュバントと組み合わせたサブユニットワクチンとではワクチン接種したマウスから得られたNALTによってリリースされたことを示しています。
コントロールやNALTフリーマウスから得られた生体試料(例えば、血清、唾液、鼻汁、膣分泌液など)は組織培養の結果との比較のために鼻の抗原に対する生体の免疫応答内のプロファイルに使用することができます。 図4Bに、予防接種INへのIgAおよびIgG応答が大幅に機能NALTずに減少した。抗原特異的IgAのレベルは、ワクチン接種したマウスの粘膜の分泌物(唾液、鼻洗浄)中のIgGよりも一般的に大きかった。
upload/3960/3960fig1.jpg "/>
図1。NALTの収集およびex vivoでの培養の模式図。
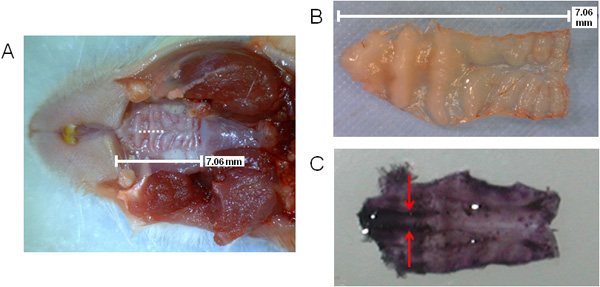
図2。NALTおよび手術切開の位置を示すマウス口蓋の可視化。点線()で表される手術切開と上部口蓋のサイズと位置、口蓋の前方側(口蓋の小臼歯領域で染色された濃い紫色を並列NALTを表示するには、上部の切り出し、口蓋(B)またはヘマトキシリンで染色し(C) 。) NALTは矢印で示された。
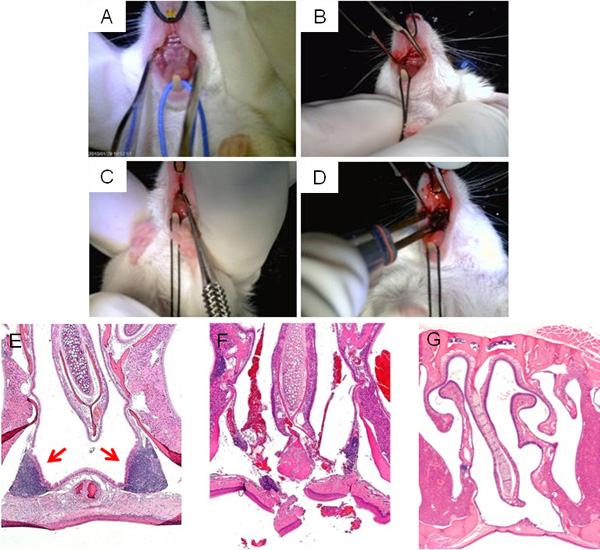
図3手術NALTの中断。 NALT混乱手術の主要な段階:手術前にマウスの上部口蓋の仰臥位ビュー(); NALT(B)にアクセスするために、上部口蓋に行わ正中切開。でNALT構造を破壊するために正中切開を通して挿入microcuretteプローブtegrity(C)、手術の終了時に切開の焼灼(D)。鼻腔の顕微鏡画像、H&E染色、手術(E)の前に、手術直後(F)の後、および首尾よく癒され、NALTフリーマウス(G)。
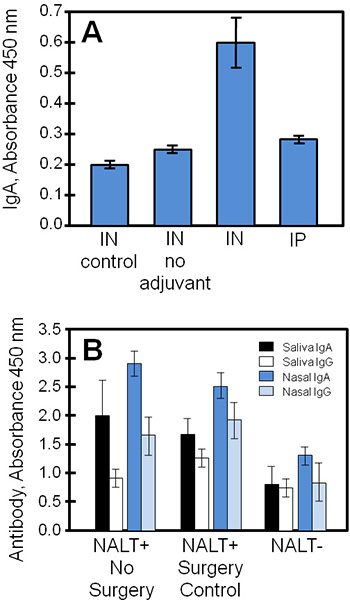
図4培養NALT、唾液、鼻汁からワクチン特異的抗体は、ワクチン接種したマウスから採取した。 NALTフリーまたは正常対照マウスは、INまたはSTEBVaxとIP予防接種を受けていたし、生体試料を採取した。トリプリケートサンプルの抗体レベルをELISAを用いて測定した。 (A)NALTは、コントロールマウス(外科的に操作しない)から削除され、抗体応答を調べるために培養した。ワクチンを接種したマウスでは培養のワクチン特異的IgA応答はコントロール(スチューデントのt検定、p≤0.01、無アジュバントなしのワクチンに比べて)から統計的に異なっていた。 (B)NALTの混乱は、実質的に特異的な抗体応答を減少させ予防接種をINに。特定の抗体レベルの間に有意差が認められたNALTとNALT唾液IgGの結果(スチューデントのt検定、p≤0.05)を除くすべての比較のために+グループ(非手術またはコントロール手術)。
ディスカッション
我々は、生物学的サンプル、NALTに関連した免疫応答の1-4を調べるためのアッセイを得て、動物モデルを開発するための集団的方法を提示している。これらのメソッドの実行中に考慮すべきその他の要因があります。手術や組織培養のための標準無菌テクニックに従うべきである。単離および培養と同様に、滅菌した器具、作業領域、および消毒味覚を維持する時に使用される抗菌剤および抗真菌剤の組み合わせは、汚染の危険性を減らすことができます。血清抗体は一般的に高い濃度で検出されたとして唾液、鼻洗浄と同じような粘膜分泌物のサンプルは、血液中の潜在的な汚染を検査する必要があります。抗体の低濃度は、血清に比べ、これらのサンプル中に存在するので、さらに、粘膜の分泌物は、ほんの少しだけ分析のために希釈する必要があります。
マウスは、事前に直接、手術後に保温する必要があります潜在的な麻酔誘発性低体温を発散。不規則な呼吸を最小限に抑えるために手術後の療養中に、その両側に別の安静時のマウス。手術を行う1、口を開けて、マウスは麻酔から回復するように手術後のケアを提供するための1つを保持して支援するためにいずれかの手術では、これらのタスクを完了するために一緒に仕事を3人の方が効率的です。
これは、各マウスの手術の成功したかどうかを確認するために、すべての実験手順や研究の終了時に頭蓋の断面のH&E染色を使用する必要があります。可能な限り手術の成果は、以下のとおりです。完全な二国間のNALTアブレーション、不完全切除、または無傷のNALT。すべての手術は、NALTの完全な損失になりますので、残留または無傷のNALTを持つ動物は、内部コントロールとして使用することができます。別の潜在的な結果は、口蓋、鼻と口腔をつなぐ開口部を残して、完全に治癒してしまうことである。不完全口蓋の治癒は、低体重と成長障害が発生し、これらの個人は、研究から削除する必要があります。
マウスモデルを持つ最初のワクチンの応答を調べると、意図した研究結果(抗体応答、生存率など)にNALTの役割を確立するのに役立つでしょう。外科的にNALTを削除すると、ローカルおよび全身性免疫に鼻の貢献の決定を容易にします。ここで説明した外科的アプローチは、NALTの欠けているマウスモデルを得るための最も直接的な方法です。選択したノックアウトマウスモデルが欠けてNALTに報告したが、これらの動物はまた、他の二次リンパ組織の発達に不可欠なサイトカインやケモカインの欠乏であり、追加の欠陥12,13を抱いていることがされています。さらに、ここで説明する方法は、鼻腔内に元の免疫応答のいくつかの側面を調べるために開発されました。我々の実験結果は、全体の上限palatを用いた研究に基づいています。組織培養のためのマウスからの電子、それはセクションが使用されている可能性がありますが。最後に、培養されたNALTモデルは、組織培養で完全に実験を行うのに便利です。
開示事項
利害の衝突が宣言されません。
謝辞
サポートは、ベクトン·ディッキンソンの技術によって提供されました。この申請において示された見解は著者のものであり、米国政府の公式方針を反映するように意図されません。研究は、動物福祉法と実験動物のケアと使用するためのガイド 、国家研究評議会、1996年に述べた原則に動物や付着を伴う動物実験に関連する他の連邦法および規制を遵守して実施されました。本研究が実施された施設は完全に実験動物ケア·インターナショナルの評価と認定協会の認定を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| ステンレススチール滅菌外科ブレード、第11号 | Miltex | 4から311 | |
| ナイフのハンドル、第3号 | Miltex | 4月7日 | |
| 48ウェル細胞培養プレート | 共演者 | 3548 | |
| RPMI 1640 | インビトロジェン | 11875-093 | |
| ウシ胎児血清、不活化熱 | GIBCO / Invitrogen社 | 16000-044 | 最終濃度:10%体積の培地に |
| 硫酸ストレプトマイシン | シグマ | S9137 | 最終濃度:100μg/ mLの |
| ペニシリン | シグマ | P7794 | 最終濃度:100 UI / mLの |
| ゲンタマイシン | Sigma-Aldrich社 | G1397-10ML | 最終濃度:50μg/ mLの |
| ファンギゾン | GIBCO / Invitrogen社 | 15290-018 | 最終濃度1μg/ mLの |
| HEPES | Sigma-Aldrich社 | H0887 | 最終濃度10 mMの |
| エッペンドルフ微量遠心チューブ | エッペンドルフ | 022364111 | |
| ニュートラゲルチェリー風味マウスウェットフード | バイオサーブ | S4798-TRAY | |
| メタカム | ベーリンガーインゲルハイム | 601531000 | 1.5 mg / mLの経口懸濁液の一滴 |
| ケタミン | ファイザー | 00856440301 | 最終的な共同NC:6.06 mg / mLの |
| アセプロマジン | Vedco | VEDC207 | 最終濃度:0.061 mg / mLの |
| キシラジン | ロイド | 4811 | 最終濃度:0.667 mg / mLの |
| Puralube獣医軟膏 | Pharmadermアニマルヘルス | 1621 | |
| 0.9%塩化ナトリウム注射液USP | バクスター | 2B1302 | |
| 0.5ミリメートルMicrocurette | Roboz | RS-6350 | |
| 熱焼灼装置 | ガイガー | 150-S/150A-S | |
| TCUの交換チップ、ストレートファインループ | ガイガー | 214 | |
| 外科はさみ | |||
| 10%中性緩衝化ホルマリン | シグマ | HT501128 | |
| ギ酸 | フィッシャー | A119P-4 | 1047 mLの水道水に426 mLのギ酸を混ぜて、その後45mLのRexyn 101(H)を追加する |
| Rexyn 101(H) | フィッシャー | R231-500 | |
| 組織テックVIP E150/E300 | 桜 | ||
| 回転式ミクロトーム | ライカ | RM2255 | |
| マイヤーのヘマトキシリン | シグマ | MHS16-500ML | |
| ギルNo.1のヘマトキシリン | シグマ | GHS116 | |
| エオシンB | シグマ | 2853 | |
| Microtainer血清セパレータ | BD Medical | 365956 | |
| リン酸緩衝生理食塩水 | 100mMののNaH 2 PO 4、140mMのNaCl、pH7.4の | ||
| プロテアーゼインヒビターカクテル、EDTA-フリー | サーモフィッシャーサイエンティフィック | 78415 |
参考文献
- Wiley, J. A., Tighe, M. P., Harmsen, A. G. Upper respiratory tract resistance to influenza infection is not prevented by the absence of either nasal-associated lymphoid tissue or cervical lymph nodes. J. Immunol. 175, 3186-3196 (2005).
- W, A. Intranasal immunisation with conjugate vaccine protects mice from systemic and respiratory tract infection with Pseudomonas aeruginosa. Vaccine. 24, 4333-4342 (2006).
- Fernandez, S., Cisney, E. D., Hall, S. I., Ulrich, R. G. Nasal immunity to staphylococcal toxic shock is controlled by the nasopharynx-associated lymphoid tissue. Clin. Vaccine Immunol. 18, 667-675 (2011).
- Asanuma, H. Isolation and characterization of mouse nasal-associated lymphoid tissue. J. Immunol. Methods. 202, 123-131 (1997).
- Casteleyn, C., Broos, A. M., Simoens, P., Van den Broeck, W. NALT (nasal cavity-associated lymphoid tissue) in the rabbit. Vet. Immunol. Immunopathol. 133, 212-218 (2010).
- Debertin, A. S. Nasal-associated lymphoid tissue (NALT): frequency and localization in young children. Clin. Exp. Immunol. 134, 503-507 (2003).
- Csencsits, K. L., Jutila, M. A., Pascual, D. W. Nasal-associated lymphoid tissue: phenotypic and functional evidence for the primary role of peripheral node addressin in naïve lymphocyte adhesion to high endothelial venules in a mucosal site. J. Immunol. 163, 1382-1389 (1999).
- Zuercher, A. W. Nasal-associated lymphoid tissue is a mucosal inductive site for virus-specific humoral and cellular immune responses. J. Immunol. 168, 1796-1803 (2002).
- Park, H. S., Francis, K. P., Yu, J., Cleary, P. P. Membranous cells in nasal-associated lymphoid tissue: a portal of entry for the respiratory mucosal pathogen group A streptococcus. J. Immunol. 171, 2532-2537 (2003).
- Tyrer, P., Foxwell, A. R., Cripps, A. W., Apicella, M. A., Kyd, J. M. Microbial pattern recognition receptors mediate M-cell uptake of a gram-negative bacterium. Infect. Immun. 74, 625-631 (2006).
- Wu, A. W., Russell, M. W. Nasal lymphoid tissue, intranasal immunization, and compartmentalization of the common mucosal immune system. Immunol. Res. 16, 187-201 (1997).
- Harmsen, A. Cutting edge: organogenesis of nasal-associated lymphoid tissue (NALT) occurs independently of lymphotoxin-alpha (LT alpha) and retinoic acid receptor-related orphan receptor-gamma, but the organization of NALT is LT alpha dependent. J. Immunol. 168, 986-990 (2002).
- Rangel-Moreno, J. Role of CXC chemokine ligand 13, CC chemokine ligand (CCL) 19, and CCL21 in the organization and function of nasal-associated lymphoid tissue. J. Immunol. 175, 4904-4913 (2005).
- Morefield, G. L., Hawkins, L. D., Ishizaka, S. T., Kissner, T. L., Ulrich, R. G. Synthetic Toll-like receptor 4 agonist enhances vaccine efficacy in an experimental model of toxic shock syndrome. Clin. Vaccine Immunol. 14, 1499-1504 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved