Method Article
糖尿病研究におけるβ細胞の質量分布のアセスメント用の赤外線光学投影断層近く
* これらの著者は同等に貢献しました
Erratum Notice
要約
我々は、光学投影断層撮影(OPT)の適応を述べる 1近赤外スペクトルにおけるイメージング、計算ツールの数の実装に。これらのプロトコルは、より大きな標本では、膵β細胞量(BCM)の評価を可能にする技術のマルチチャンネル容量を増やすとOPTデータの品質を高める。
要約
近赤外(NIR)スペクトルにおけるイメージングの機能を含むようにOPTを適応することによって、私たちはここでそのようなラット膵臓などの膵臓組織のイメージより大きい体に可能性を示しており、チャンネル数(細胞型)かもしれないを高めるために一つの標本で検討する。 、2 /改善されたアルゴリズムのポストのための回転軸(AR)の2の質量の試料の(私たちの例では膵臓)中心(COM)の1 /正確な位置決め:我々は、さらに提供する計算ツールの数の実装を記述するトモグラフィー再構成2と3 / OPTベースBCMの決定3で信号対雑音比を向上させる強度等化のためのプロトコルの間に幾何学的な歪みを防ぎアライメント調整。加えて、我々は、画像取得時の試料の意図していない動きのためにリスクを最小限に抑え、試料ホルダを記述します。一緒に、これらのプロトコルでは、BCMの分布とothの評価を可能にするえー機能、ランゲルハンス氏島の個々のレベルまでの分解能で、無傷の膵臓や他の臓器(膵島移植の研究でEG)の体積全体にダウンして実行される。
概要
β細胞をインスリン産生、血中グルコースの恒常性を制御するための体の能力のための鍵となります。したがって、膵臓のBCM分布の評価は、前臨床糖尿病研究の多くの分野に欠かせません。例えば、治療体制の評価では、疾患のげっ歯類モデルにおける内分泌細胞の分化や糖尿病病因の研究上の標的遺伝子アブレーションの影響は、しばしばこのような分析に依存しています。伝統的には、評価のこれらのタイプは、膵臓の大きさや複雑な解剖学的憲法によって履行をすることが困難で時間のかかる立体的なアプローチに頼ってきた。現時点で最も高解像度イメージングアプローチは(通常光)、げっ歯類で全体膵臓イメージングを可能にするのに十分な溶け込み深さを提供していません。逆に、彼らの侵入深さ(通常、核)によって制限されていないイメージングアプローチはフルBCMの分布を解決するために、貧しい人々の解像度に提供し、妨げられ4,5十分な造影剤の不足による。
光学投影断層撮影は、cmスケール6〜mmの医学標本の高解像度の評価を可能にする3Dイメージングモダリティである。これにより、空間的な位置とランゲルハンス島を表現する個々のインスリンの量に関する情報は、正常および糖尿病マウス3,7-10における膵臓の体積全体を抽出することができる。現在の研究の目的は、さらに膵β細胞の評価のために、この技術の能力を強化するためであり、他の組織、他の膵臓の成分(例えば、細胞型に浸潤など)との関係に、より大きなでグラフト化されたそれらの内因性分布、従来よりも膵臓の準備。
近赤外光学投影断層撮影法(NIR-OPT)をセットアップ
以下のプロトコルは、最大シャープによって記述された元のセットに基づいて、OPTのスキャナでら1は 、記載されて使用されます。マウスの膵臓の単一チャネルアセスメント(BCMの例 )については、SkyScan 3001(Bioptonics)スキャナを使用することができる。
650nmの波長で上記の水銀アークランプよりも高い励起エネルギーを提供メタルハライドランプは、励起光を供給します。光は液体ライトガイドを介して転送されます。蛍光色素と近赤外蛍光イメージングおよびチャネル分離のためのバンドパスフィルタの有用な組み合わせを図3に示します。放出された光は、NIRスペクトルで高い量子効率で、バック点灯CCDカメラで検出された。 OPTのスキャンはカメラとステッピングモータを制御LabVIEWプラットフォームを使用して自動化されています。無傷ラット膵臓の大きさのサンプルをサポートするために、保護された銀コートミラーと大きなキュベットが使用されます。最後に、不要な垂直movemenを排除試料ホルダースキャン中にサンプルのtsは設計されました。
プロトコル
1。サンプル調製およびスキャン
1.1試料の調製
以前に説明したように7以下の手順は基本的に行われます。
- 膵臓を収穫。タンパク質分解を避けるために、氷冷PBSを使用しています。
- 2〜3時間のために氷の上でPBS中4%PFAで組織を固定します。ローブが固定時に "広がって"いることを確認してください。これは、再建後の解剖学的ランドマークの識別を容易にするでしょう。
- 30分間過剰のPBSで洗浄します。
- メタノール中で段階的に膵臓(33、66%、100%)、15分/ステップを脱水する。これは、漂白時に気泡の形成を最小限に抑えます(ステップ5を参照)と、凍結融解時の細胞破壊を防ぎます(ステップ7を参照)。
- H 2 O 2:作りたてのMeOH中の組織をインキュベートDMSOは、内因性の組織の蛍光を消光するため、24時間、室温で2時01分03秒の割合でバッファを漂白。新しいbleachiに大きなサンプル、交換のための別の24時間ngのバッファとインキュベート。
- ON、過剰MeOHで洗浄します。
- -80に少なくとも5サイクルの凍結融解℃ - 室温抗体の浸透を容易にする。
- TBST(33、66%、100%)、15分/ステップに戻って段階的に水分補給を。
- 室温で12〜24時間の場合は10%血清(できれば二次抗体が生成された同じ種から)、5%DMSOおよび0.01%NAAZとTBST中ブロック
- RTで、48時間ブロッキングバッファーで一次抗体と共にインキュベートし、大きなサンプル(ここで使用される抗体は、試薬の表に記載されている)のための72時間に及ぶ。
- ON、過剰TBSTで洗浄します。
- 48時間蛍光標識二次抗体とインキュベートし、室温で、より大きなサンプルのための72時間に及ぶ。
- ON、過剰TBSTで洗浄します。
1.2
次の手順では、アガロースでサンプルをマウントして、カスタムメイドの試料ホルダー( 図7を参照にアタッチする方法を説明します)スキャンをオプトインする前に。
- Hörnblad ら 3に図3Aを参照するに従って、脾臓、十二指腸と胃のローブを分離します。ローブ間の関係はさらにHörnblad ら 11で明らかにされています。
- 1.5%(w / v)のdH 2 Oで、フィルター内の低融点アガロースを準備し、37まで冷まし℃、洗剤を洗い流し、氷の上にアガロース埋め込 む前に、気泡を除去するためのdH 2 O中の組織をすすいでください。
- あなたのサンプルを囲むアガロースブロックを切り出してサンプルとアガロースのベースとの間に約1cmのスペーサーを残す。光の散乱を低減するためにアガロースブロックのシャープなエッジを(≤90°)をトリムします。
- 時間は、各ステップ間で平衡化することができますし、MeOH(33、66%、100%)で段階的にサンプルを脱水。試料が沈むとき、それは平衡化であると考えられている。
- ベンジルベンツ:ベンジルアルコールの1:2溶液中の試料をクリアそれが透明になるまでオエート(Babbの)。さらに12時間のためのExchange Babbのソリューションとインキュベートする。
- サンプルホルダーにクリアサンプルを置き、ホルダーのフランジで開けた穴を介して、アガローススペーサを介して2本の針を挿入して固定します。
- Babbの決済ソリューションでいっぱいにキュベットに注入し、スキャナと沈めることでサンプルを置きます。膵臓のシリーズを比較する場合、同じ倍率はすべてのスキャンに使用されるべきです。倍率は、シリーズの最大のサンプルのために最適化されるべきである。
ARで試料の1.3ポジショニング
次のプロトコルは、正確に、COM-ARアルゴリズムを使用してサンプルを配置する手順について説明します。 ROIが全体の標本が含まれている場合、この手順にのみ適用されます。アルゴリズムの詳細については、Cheddad ら 2を参照してください。
- ボットのための2つの位置で試料の画像を取得解剖学と信号チャネルh。最大投影面積、および90°(Z軸に関連付けられている)の位置2を表示0°(X軸に関連付けられている)の位置1。我々は解剖学を視覚化するためにGFPのチャネルを使用しています。
- しきい値に解剖画像上にROIの期待値最大化(EM)アルゴリズムを適用します。
- 0°と90°の突起の両方に対して、ステップ2で得られた2値画像のCOM点(x座標)を計算します。
- 0°および信号チャネルの90°の画像にステップ3で計算識別されるCOM点を通る垂直線を重ね合わせる。
- 参照は、視野の中心線は、試料の発見のCOM点を通過するように、サンプルを移動するように手順4で取得した画像を使用してください。
1.4スキャニング
- 飽和することなく可能対雑音比が最も高い信号を達成するために露光時間を調整します投影画像の影はどの分野。スキャンされるすべてのチャネルに対して、この手順を繰り返します。
- スキャンされた最初の蛍光チャンネル用のフィルタセットを選択します。短いのλフルオロフォアからの発光はもはやλと蛍光体を励起し、それによって退色を引き起こす可能性があります。この可能性を最小限に抑えるには、まず一番長い励起λの蛍光体をスキャンしてください。
- 各チャンネルの垂直軸に沿って試料を回転、360°以上のサンプルを照らす、蛍光シグナルを収集するためにシャッターを開きます。 NIR-OPTのセットアップに使用するステップ角は0.9°とBioptonics 3001スキャナ0.45°用です。
- 次のチャネルに適したフィルタを選択し、上記のように進みます。
2。計算処理と復興
2.1ポスト買収ずれ検出および訂正(値のチューニング)
投影トモグラフィーでは、それは一般的に必要である前に復興への回転軸に沿って画像の位置を微調整するための投影にポストアラインメント値を割り当てることができます。しかし、光軸に向かってカメラの角度の小さな収差は、サンプルの長さに沿って不均一-値を引き起こす可能性がありますので、幾何学的な歪みを誘発する。このような歪みを避けるためには、標本全体にわたって正確かつ統一された後のアライメント値(値)を見つけるための計算方法は2を適用することができる。
- 8ピクセルの高さのブロックに0で特定の信号を投写°と180°に分割し、各ブロック間のx軸に沿ってシフト(A値)を計算するために、離散フーリエ変換を使用しています。
- 試験片の長さ方向に沿ってx軸シフトの傾きを説明角度θ 'を計算するために、回転中心点を見つけるために線形最小二乗回帰を適用します。
- すべてのプロジェクトは移行を回転させることにより、スキャン中にズレを補正するため回転中心点の周りctionsθ '/ 2。
2.2コントラスト限られた適応ヒストグラム均等化(CLAHE)
再建および/または定量的評価のためのセグメンテーション時に "アウトしきい値処理"される危険にさらされている非常に弱い信号を呈するオブジェクト(膵島)の検出とセグメンテーションを容易にするために、CLAHEアルゴリズムは投影画像にも適用することができる。 CLAHE操作は2つの主要な強度変換して実行されます:
- 局所的なコントラストが推定され、投影画像の非重複ブロック内で均一化される。
- 強度はその後バイリニア補間によるブロック間の境界領域で正規化されます。
名前コントラストは、画像に限られた飽和画素を避けるために設定されているクリップの制限を参照しています。このプロトコルでは、MATLABは、組み込み関数"adapthisteq"が使用され、デフォルトのcを使用して適用された 0.01のリップ制限と256のタイルサイズ。ノートでは、最適なタイルサイズは、経験的にテストする必要があると分析された試料に応じて変えることができる。アルゴリズムと例の詳細については、Hörnblad ら 3に記載されています。
注意!上記の計算処理手順の標準的なアルゴリズムに基づいて構築されていて、MATLAB(MathWorks社)で実行されます(COM-AR-ValueのチューニングとCLAHE含むが、1.3から2.2を参照)。
2.3断層復興と等値面の描画
- フィルタ補正逆投影アルゴリズムを使用して、修正し、正規化された画像は、すぐに統一されたずれ補正とダイナミックレンジを最適化するための最小限の要件を再構成することができる。このプロトコルでは、すべての再建はNReconソフトウェア(Skyscan)、バージョン1.6.8(で利用できるフィルタ補正逆投影法を用いて行われる= "_blank"> http://www.skyscan.be/products/downloads.htm)。平行ビーム形状を撮像セットアップで実装されていない限り、注意、画像化されたオブジェクトの倍率はレンズの焦点からの距離に依存します。したがって、NReconソフトウェアに投影データセットをインポートするとき、それは、添付のソースの距離(mm)とスキャナの回転方向(反時計回り入力 "CC"のため、時計回り入力 "CW"の場合)に正しいオブジェクトを含めることが重要です再建中にコーンビーム誘起アーチファクトを避けるために、ファイルをログに記録します。
- 得られた仮想セクションのスタックを可視化し、定量化するために、ImarisまたはVolocityなどの適当な画像処理ソフトを使って3Dの等値面を生成します。
マウス膵島の単離および移植手順がMIAM大学が見直され、承認されたプロトコルの下で糖尿病研究所の臨床細胞プロセッシングおよびトランスレーショナルモデル·コアで行われた私は施設内動物のケアと使用委員会。動物の研究のための倫理委員会、スウェーデン北部では、動物を含む他のすべての実験を承認した。
結果
現在のレポートでは、私たちは、NIR-OPT( 図1)を用いて 、げっ歯類の膵臓(および他の組織)におけるBCMのデータの抽出、計算処理のためのプロトコルを記述します。 図2に示すように、膵臓標本からの組織autofluorescenseは、著しくNIRスペクトルで減少が期待されている。ランゲルハンス島のインスリンというラベルの付いた評価のための比率:これは、ノイズ(N S)への平均信号の大幅な増加につながる。本明細書に記載のようにスペクトルのNIR一部のイメージングにOPTの適応によって、少なくとも3つの特定のチャンネルは十分なSを用いて可視化することができる:N比の異なる有するマウス膵臓の体積全体抗体標識細胞の種類の評価を可能にするためにチャンネルセパレーション( 図3と図4を参照)。糖尿病のプロセスおよび/または一般的にBCM評価のイメージングに適用され、技術はこうしての可視化と定量を可能に周囲および/ または細胞型を相互作用との関係でインスリン陽性領域( 図4を参照)。このような評価は、そのマウス対応します ( 図5を参照)よりも3-5倍大きいラット膵臓など、以前よりもはるかに大きい標本で行うことが可能とNIRの範囲で得られた増加組織浸透深さに感謝しています。かかわらず、可視または近赤外の波長が利用されているかどうかにかかわらず、CLAHEの実装が大幅に( 図6を参照)手法の検出感度を高めることによって、異なる遺伝的および生理的状態の間のBCMのOPTベースの評価を容易にすることができる。開発されたサンプルホルダーのための青写真を図7に示します。
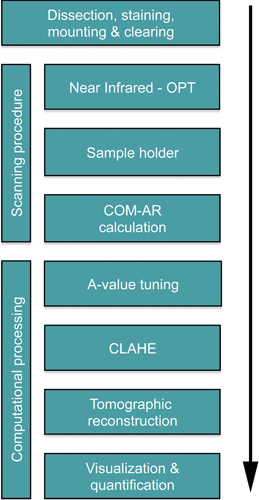
図1。 MURにおけるBCMのOPTベースの分析のための重要なステップを示すフローチャート伊根膵臓。典型的なマウスの膵臓を評価するために必要な時間は13から14日です。スキャンの長さが必要な露光時間(通常は約1時間)に依存しているのに対し、時間の大半は組織の処理と免疫組織化学的染色(10日)の間に消費され、組織のクリアは約2日を要する。その後の計算処理は、通常、一日以内に実行されます。ノートは、比較的長い染色プロトコルは、理想的には標本の大量のバッチ処理に適しています。
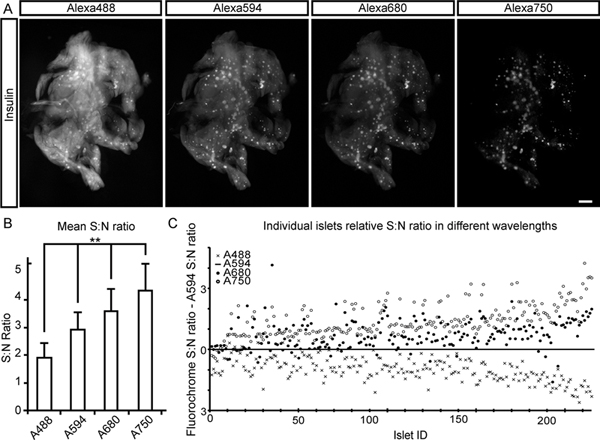
図2。 、マウス十二指腸膵臓ローブ。異なる波長でのBCMの評価のための信号対雑音比インスリンについて染色し、蛍光標識二次抗体(のカクテルでアレクサ488、594、680および異なる波長でN比:750)、Sを決定するために使用された。 、画像は、各信号チャネルのための第1の投影フレームを表示する。平均Sを示すA、B、グラフ:各信号チャネルに対するN。比率は、バックグラウンド強度で割った平均膵島強度(215小島に基づく)(外分泌組織からの内因性組織蛍光)として決定した。 C、Sを示すグラフ:Sに正規化し、各チャネルの個々の膵島用N比:アレクサ594チャネルに対して得られたN。一方向ANOVAは統計分析のために使用された。有意水準は**はp <0.01に対応して示されている。中のスケールバー()は1ミリメートルに対応しています。 拡大図を表示するには、ここをクリックしてください 。
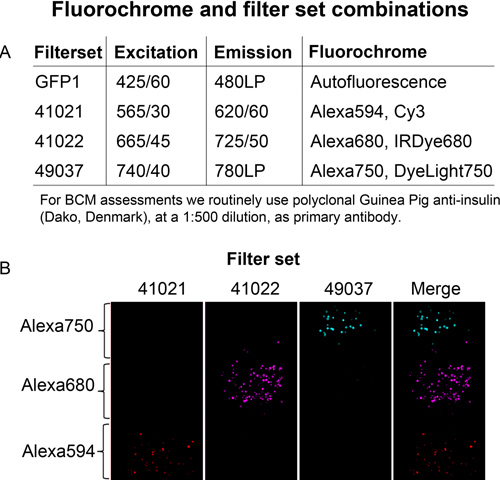
図3。チャンネルセパレーションは、表に記載されてAlexafluor染料を結合させた二次抗体をproteinG-セファロースビーズで別々に固定化された。 A、B、蛍光ビーズをアガロースファントムの異なるレベルで組み込まれており、指定されたフィルタを使用して撮像した。
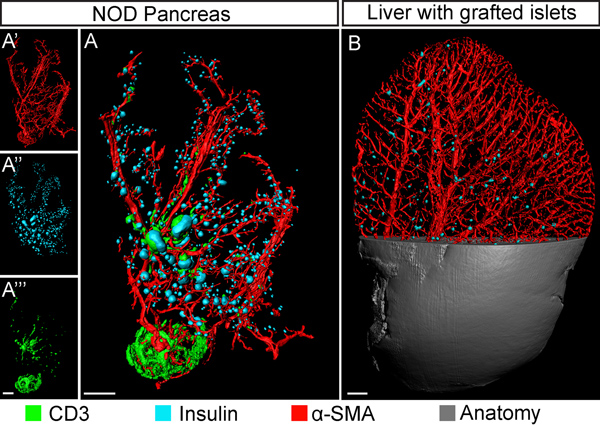
図4。糖尿病の研究に基づいたマルチチャンネル·イメージングを選ぶ。、OPTは非肥満糖尿病(NOD)1型糖尿病のモデルから膵臓(12週間、十二指腸ローブ)の等値面の復興に基づく。平滑筋α-アクチン(血管、赤)とCD3(Tリンパ球の浸潤、緑)、検体はインスリン(膵島β細胞、擬似青色)のために染色されています。使用される、対応する二次抗体はあった; Cy3に、IRDye-680とそれぞれDyeLight-750。ザインセット(はA'-A'' ')は、個々の信号チャネルを示しています。 A、B、同系膵島でグラフト化と移植後のNIR-OPT二週間で撮像し、マウスの肝葉(葉不吉外側)のOPT画像(ビューブローアップ)。インスリンを発現する小島は、青色でpseuodocoloredと平滑筋α-アクチン陽性血管は赤で表示されています。アプローチは、血管網内の膵島移植分布の評価が可能になります。スケールバーは1ミリメートルに対応しています。
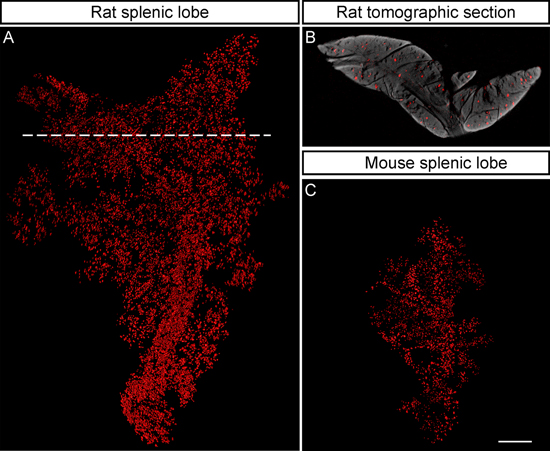
図5。 NIR-OPTは、大きい標本の撮影を容易にします。2型糖尿病(9ヶ月で脾臓の葉)のZucker肥満モデルからラット膵臓におけるBCMの分布の、ISO-表面レンダリング、ラット上の画像標本に可能性を例示NIR-OPTによって膵臓のスケール。決定されたこの手法によって表示ローブはそのマウス対応より〜6倍(v / v)であり、β細胞容積総葉量の1.32パーセントを占めているランゲルハンス島を表現10139インスリンを庇護する。 A、B、(A)は、組織のすべての深さからの膵島が検出されたことを示すの破線に相当する断層面。 Cのサイズを基準として表示するマウス膵臓(8週で脾ローブ)でBCM分布の等値面のレンダリング。表示された葉は、そのβ細胞容積が全小葉量の0.89パーセントを占めています。2490インスリンを発現する膵島を抱いて膵臓をAlexa594標識ヤギ抗GP(マウス)とそれぞれIRDye 680結合ロバ抗GP(ラット)抗体に続くGP抗インスリンで染色されています。で標本は交流(AC)(C)は2ミリメートルに相当のスケールとスケールバーに描かれている。
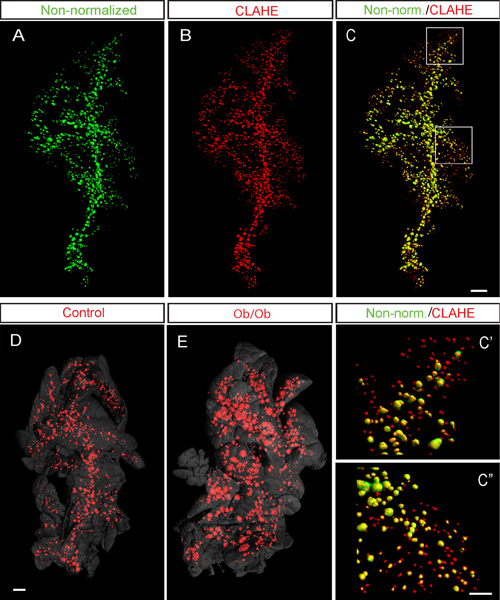
図6。 CLAHEは、OPTイメージングによるマウス膵ランゲルハンス島での検出を容易にする。交流、代表等値面は、インシュリンのために標識C57BL / 6マウスの膵臓(8週目に脾臓の葉)のOPTの画像をレンダリングしました。 OPTの画像の等値面の再構成は、前に行われた(疑似緑色)とCLAHEプロトコルの後に(A、B、疑似赤色)に適用した。 C言語では、非正規化されたデータ(A)と(B)でCLAHE処理されたデータのオーバーレイ。 C'-C "は、代表的な高倍率非正規化のオーバーレイ()とCLAHEは、処理された画像は。としての存在によって示される(B)は"赤のみ "小島CLAHEスクリプトは、小型で低信号の検出を容易に強度島は現在の例で示されている標本は(CLAHE処理後)は、対応する未処理の投影データに基づいて、数字は1057年のWi小島であった(1.74ミリメートル3の体積で2419小島を抱いて1.77ミリメートル3)の体積番目。 DとE、制御(D)およびCLAHEプロトコルを実装した6ヵ月の時点で2型糖尿病12(E)のob / obマウスモデルからのデータの例。のob / ob膵臓(E)の膵島のサイズが巨大な一般的な増加に注意してください。で(D)および(E)膵臓アウトライン(グレー)は組織の自己蛍光からの信号に基づいています。 Cの中のスケールバーは、ACで500μmである。 Cの中のスケールバーは"C"で200μmを相当とEのC''。スケールバーは1mmのに対応しています(D)及び(E)内の画像(AC)Hörnblad ら 3から適応されており、使用して生成されたBioptonics 3001スキャナ。

図7。 OPTの検体の結合のための試料ホルダは、試料は、フランジ内の穴を介して、アガローススペーサを介して針を挿入することによって保護されています。ホルダーは経由ステッパモータにヒンジ結合され強力な磁石は、そのベースにあります。このセットアップでは、不安定な接着剤の使用を省略し、スキャン中に試料の不要な動きを防ぐことができます。
ディスカッション
OPTイメージングのため記載されている技術は、マウス膵臓の体積全体の空間的および定量的なパラメータの抽出を可能にします。メゾスコピックイメージングそれのこのタイプのための達成可能な解像度の制限のために留意すべきで、そのほとんどの画像診断法のような、より大きな標本低い解像度(高解像度CCDの使用は、OPTスキャンの解像度を上げる必要がありますが) 。従って、無傷膵臓マウスローブの評価のために、現状では技術はあるが近く(約15から20μm)を7単一細胞の解像度を提供していません。それでも、マウスの膵臓におけるBCMの分布を抽出するためのプロトコルがうまく形態計測3,13を数えるなどポイントによって得られたものと一致している以上のことに留意する必要があることをデータを提供してきたそのCLAHEプロトコルの実装は、かなり多くの小島の検出が可能になるものの、 、これらの小島は、一般に小さく、貢献しないTEは、実質的に全体的なβ細胞のボリュームに。
関係する免疫組織化学プロトコル(最大2週間まで)比較的長いですが、試料作製のための時間上の実際の手は短いですので、テクニックはよく動物が9の大規模コホートの研究に適しています。異種遺伝子型の分布パターンの電位が調査の焦点である場合は、注意が固定に関して、膵臓組織が不利な方法で固定となり、フラット( "広がる"ことを避けるために、実装工程で取られるべきであることを強調すべきである組織の)マウントはそのような評価を容易にするために努力しなければならない。
OPTを実行する重要な問題は、サンプルのCOMは回転軸に固定されており、それがスキャン手順中に、垂直または水平に動かないことをされるということです。したがって、それはattachiのための安定した機械的なセットアップとうまく動作するシステムを構築することが不可欠であるngのサンプル。私たちは、新しいマウント( 図7)を構築することによってこの問題を解決しました。
パラレルジオメトリは背中と記録された投影画像内の周辺のオブジェクトの前の位置の間の垂直シフトとして検出された私たちのNIR-OPTまたはBioptonics 3001スキャナには当てはまりませんでした。 (2.3.1を参照)、それぞれのスキャナのログファイルにソースの距離にオブジェクトを調整することによって、私たちはかなり我々のデータの品質を向上させる可能性があり、特に重要である投影画像の遠端で幾何学的な歪みを補正するとき大きな標本を評価する。
現在のプロトコルでは、我々は3つの異なる特定のチャンネルと無傷膵臓製剤の評価に "解剖"チャネルの可視化を可能にするフィルタセットの提案を提供します。明らかに、これらの設定には、蛍光のすべての形態と同様に、より良いものの、与えられた研究のために利用蛍光色素に合うように変調されたかもしれないセント顕微鏡は、信号ブリードスルーの潜在的な危険性を慎重に評価する必要があります。 750 nm以上に興奮している蛍光色素で標識された膵島のインスリンの研究は、まだ我々のセットは、最大利用しているメタルハライドランプを使用しては不可能であった。それは代替光源( 例えば、ダイオードレーザー)との組合せで適切な波長でさえ高い量子効率を持つカメラはさらにNIR-OPTの潜在力を高め、より高い波長でのイメージングを可能にする可能性があります。
OPTイメージングは、mm-cmの規模で生物医学標本の空間的および定量的な評価のための汎用性の高いテクニックです。ここに提示されたプロトコルが膵臓/糖尿病の研究の主な目的のために開発されてきたが、彼らは他の種、試料の種類とマーカーの研究に翻訳することは可能であるべきです。 NIR-OPTイメージングF、無傷膵臓製剤中に、いくつかの異なるチャネルを可視化するための潜在的なバイurtherている限り、これらの造影剤はまた、OPTによって検出可能な蛍光色素分子を運ぶように設計することができるように、他の画像診断法により非侵襲的評価のために意図された造影剤の取り込みの特異性を評価するためのツールとしての可能性を秘めている。
開示事項
特別な利害関係は宣言されません。
謝辞
博士のP.リンドストロームは、ob / obマウスを提供するために承認されます。 J.レヒトネンは、ビデオ制作·編集のヘルプについては、J.ギルバートの支援については認められています。本研究では、糖尿病研究所財団(AP)は、若年性糖尿病研究財団(APとUA)は、欧州委員会からの補助金によって支えられない(FP-7、グラント契約:CP-228933から2 IP)(JSとUA)は、ケンペ財団、ウメオ大学とUAにスウェーデンの研究評議会
資料
| Name | Company | Catalog Number | Comments |
| 試薬/材料の名称 | 会社 | カタログ番号 | 注釈 |
| メタノール | Scharlau | ME03162500 | |
| 30%H 2 O 2 | Scharlau | HI01362500 | |
| ベンジルアルコール | Scharlau | AL01611000 | |
| 安息香酸ベンジル | Scharlau | BE01851000 | |
| 低meltingpointアガロース | LONZA | 50100 | |
| ホルムアルデヒド(PFA) | シグマアルドリッチ | 158127 | |
| DMSO | シグマアルドリッチ | D5879 | |
| トリトン-X100 | シグマアルドリッチ | T8787 | |
| マウス抗ASMA-Cy3を | シグマアルドリッチ | C6198 | 一次抗体 |
| ウサギ抗CD3 | シグマアルドリッチ | C7930 | 一次抗体 |
| モルモット抗イン | DAKO | A0564 | 一次抗体 |
| ロバ抗GP-IRDye680 | LI-COR Biosciences社 | 926から32421 | 二次抗体 |
| ヤギ抗のRb-DyeLight750 | サーモサイエンティフィック | 35570 | 二次抗体 |
| ヤギ抗GP-Alexa594 | 分子プローブ | - 11076 | 二次抗体 |
| ヤギ抗GP-Alexa488 | 分子プローブ | - 11008 | 二次抗体 |
| ヤギ抗GP-Alexa594 | 分子プローブ | - 11012 | 二次抗体 |
| ヤギ抗GP-Alexa680 | 分子プローブ | - 21076 | 二次抗体 |
| ヤギ抗GP-Alexa750 | 分子プローブ | - 21039 | 二次抗体 |
| OPT Skyscan 3001 | Bioptonics | OPT-スキャナー | |
| ライカMZ FLIII | ライカマイクロシステムズ | 実体顕微鏡 | |
| ライカのObjective 0.5倍 | ライカマイクロシステムズ | 10446157 | |
| ライカカメラアダプター1.0X | ライカマイクロシステムズ | 10445930 | |
| ハロゲンEL6000メタル | 11504115 | 光源 | |
| 液体ライトガイド | 11504116 | ||
| キュベット | Hellma分析 | 6030-OG | 55×55×52.5ミリメートル |
| ミラー | エドモンド·オプティクス | F68-334 | 50×50ミリメートル |
| アンドールイコン-M | アンドール·テクノロジー | DU934N-BV | 裏面照射型CCD |
| filtersetを | クロマ·テクノロジー | 41021-MZFLIII | TXRは、Alexa-594、Cy3の |
| filtersetを | クロマ·テクノロジー | 41022-MZFLIII | IRDye680、アレクサ-680 |
| filtersetを | クロマ·テクノロジー | 49037-MZFLIII | Dylight750、アレクサ-750 |
| ProteinG-セファロースビーズ | GEヘルスケア | 17-0618-01 | プロテインGセファロース4ファーストフロー |
| アジ化ナトリウム | シグマアルドリッチ | 08591 | アジ化ナトリウム0.1M溶液 |
参考文献
- Sharpe, J., et al. Optical projection tomography as a tool for 3D microscopy and gene expression studies. Science. 296, 541-545 (2002).
- Cheddad, A., Svensson, C., Sharpe, J., Georgsson, F., Ahlgren, U. Image Processing Assisted Algorithms for Optical Projection Tomography. IEEE Trans. Med. Imaging. , (2012).
- Hornblad, A., Cheddad, A., Ahlgren, U. An improved protocol for optical projection tomography imaging reveals lobular heterogeneities in pancreatic islet and beta-cell mass distribution. Islets. 3, 204-208 (2011).
- Holmberg, D., Ahlgren, U. Imaging the pancreas: from ex vivo to non-invasive technology. Diabetologia. 51, 2148-2154 (2008).
- Ahlgren, U., Gotthardt, M. Approaches for imaging islets: recent advances and future prospects. Adv. Exp. Med. Biol. 654, 39-57 (2010).
- Sharpe, J. Optical projection tomography. Annu. Rev. Biomed. Eng. 6, 209-228 (2004).
- Alanentalo, T., et al. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Methods. 4, 31-33 (2007).
- Alanentalo, T., et al. High-resolution three-dimensional imaging of islet-infiltrate interactions based on optical projection tomography assessments of the intact adult mouse pancreas. J. Biomed. Opt. 13, 054070(2008).
- Alanentalo, T., et al. Quantification and Three-Dimensional Imaging of the Insulitis-Induced Destruction of beta-Cells in Murine Type 1 Diabetes. Diabetes. 59, 1756-1764 (2010).
- Sun, G., et al. Ablation of AMP-activated protein kinase alpha1 and alpha2 from mouse pancreatic beta cells and RIP2.Cre neurons suppresses insulin release in vivo. Diabetologia. 53, 924-936 (2010).
- Hornblad, A., Eriksson, A. U., Sock, E., Hill, R. E., Ahlgren, U. Impaired spleen formation perturbs morphogenesis of the gastric lobe of the pancreas. PLoS One. 6, e21753(2011).
- Lindström, P. The physiology of the Obese-Hyperglycemic Mice (ob/ob Mice). The Scientific World JOURNAL. 7, 665-685 (2007).
- Bock, T., Pakkenberg, B., Buschard, K. Genetic background determines the size and structure of the endocrine pancreas. Diabetes. 54, 133-137 (2005).
Erratum
Formal Correction: Erratum: Near Infrared Optical Projection Tomography for Assessments of β-cell Mass Distribution in Diabetes Research
Posted by JoVE Editors on 11/05/2018. Citeable Link.
A correction was made to Near Infrared Optical Projection Tomography for Assessments of β-cell Mass Distribution in Diabetes Research. In Protocol section 1.1, the order of the listed chemicals MeOH:H2O2:DMSO has accidentally been switched and should instead be MeOH:DMSO:H2O2.
Protocol section 1.1 was changed from:
Incubate the tissue in freshly prepared MeOH:H2O2:DMSO bleaching buffer in a 2:1:3 ratio at RT for 24 hr to quench endogenous tissue fluorescence. For larger samples, exchange to new bleaching buffer and incubate for another 24 hr.
to:
Incubate the tissue in freshly prepared MeOH:DMSO:H2O2 bleaching buffer in a 2:1:3 ratio at RT for 24 hr to quench endogenous tissue fluorescence. For larger samples, exchange to new bleaching buffer and incubate for another 24 hr.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved