Method Article
Perto Tomografia Projeção óptico infravermelho para avaliações de β-célula distribuição em massa em Pesquisa do Diabetes
* Estes autores contribuíram igualmente
Neste Artigo
Erratum Notice
Resumo
Nós descrevemos a adaptação de tomografia projeção óptica (OPT) 1 Para imagens no espectro infravermelho próximo, e da implementação de uma série de ferramentas computacionais. Estes protocolos permitem avaliações de massa pancreática β-célula (BCM) em amostras maiores, aumentar a capacidade de multicanal da técnica e aumentar a qualidade dos dados OPT.
Resumo
Ao adaptar OPT para incluir a capacidade de formação de imagens de infravermelho próximo do espectro (NIR), que aqui ilustrar a possibilidade de corpos grandes de imagem de tecido pancreático, tais como o pâncreas de ratos, e para aumentar o número de canais (os tipos de células) que podem ser estudado em um único espécime. Iremos descrever a execução de um número de ferramentas computacionais que fornecem: posicionamento 1 / precisa do centro de um espécime (no nosso caso, o pâncreas) de massa (COM), o eixo de rotação (AR) 2; dois algoritmos / melhoradas para pós Alinhamento de ajuste que impede que as distorções geométricas durante a reconstrução tomográfica 2 e 3 / de um protocolo para aumentar a intensidade de equalização do sinal para relações de ruído nas determinações OPT baseados BCM 3. Além disso, descreve-se um suporte de amostras que minimiza o risco de movimentos involuntários do corpo de prova durante a aquisição de imagem. Juntos, estes protocolos permitem avaliações da distribuição BCM e othfuncionalidades er, a serem realizados em todo o volume do pâncreas ou de outros órgãos intactos (por exemplo, em estudos de transplante de ilhotas), com uma resolução até o nível de ilhotas de Langerhans individuais.
Introdução
Produtoras de insulina β células são a chave para a capacidade do corpo para controlar a homeostase da glicose do sangue. Portanto, a avaliação da distribuição BCM pâncreas são fundamentais para muitas áreas de pesquisa pré-clínica diabetes. Na avaliação dos regimes terapêuticos, por exemplo, o impacto de ablação do gene alvo na diferenciação de células endócrinas ou estudos de etiologia diabetes em modelos de roedores para a doença muitas vezes dependem de tais análises. Tradicionalmente, esses tipos de avaliações basearam-se em demoradas abordagens estereológicas que são difíceis de realizar, devido ao tamanho e constituição anatómica complexa do pâncreas. Abordagens de resolução mais alta de imagem no presente (normalmente óptico), não fornecem a profundidade de penetração suficiente para permitir imagens de pâncreas em roedores. Por outro lado, as abordagens de imagem que não são limitadas pela sua profundidade de penetração (tipicamente nuclear) para proporcionar baixa resolução para resolver a distribuição BCM completo e são dificultadoscom a falta de agentes de contraste adequados 4,5.
Tomografia projeção óptica é uma modalidade de imagem 3D que permite que as avaliações de alta resolução de amostras biomédicas na mm a escala de 6 centímetros. Por este meio, a informação sobre a posição espacial e volume do indivíduo expressar a insulina de ilhotas de Langerhans pode ser extraído todo o volume do pâncreas em ratos normais e diabéticos 3,7-10. O objectivo do estudo é o de melhorar ainda mais a capacidade desta técnica para a avaliação do pâncreas β células, a sua distribuição endógena, quando enxertado em outros tecidos, a sua relação com outros componentes do pâncreas (tal como os tipos de células infiltrantes) e em maior preparações de pâncreas do que era possível anteriormente.
A tomografia de projeção óptico infravermelho próximo (NIR-OPT) de instalação
No protocolos abaixo, um scanner de OPT com base no conjunto original se descrito por Sharpe et al 1, adaptado para imagiologia na gama do infravermelho próximo são descritos e utilizados. Para a avaliação de canal único, do pâncreas do rato (por exemplo, de BCM), a SkyScan 3001 scanner (Bioptonics) pode ser usado.
Uma lâmpada de halogeneto de metal, que fornece a energia de excitação mais elevada do que uma lâmpada de arco de mercúrio a comprimentos de onda superiores a 650 nm, fornece a luz de excitação. A luz é transferida através de um guia de luz líquido. Uma combinação útil de fluorocromos e filtros passa banda para NIR fluorescência de imagem e separação de canais são mostrados na Figura 3. A luz emitida é detectada com uma câmara CCD de iluminação traseira, com elevada eficiência quântica no espectro NIR. A digitalização OPT é automatizado utilizando uma plataforma LabView que controla a câmera e motor de passo. Para suportar as amostras no tamanho de pâncreas de ratos intactos, um espelho de prata revestido e protegido numa cuvete grande é usado. Finalmente, um porta-amostras que elimina indesejadas movemen verticaists da amostra durante a análise foi concebida.
Protocolo
1. Preparação de amostras e Digitalização
1,1 Preparação da amostra
O procedimento seguinte é realizado essencialmente como descrito anteriormente 7.
- Colher o pâncreas. Use PBS gelado para evitar a degradação proteolítica.
- Fixar o tecido em PFA a 4% em PBS em gelo durante 2-3 horas. Verifique se os lobos estão "se espalhar" durante a fixação. Isso irá facilitar a identificação de pontos anatômicos após a reconstrução.
- Lavar com PBS em excesso durante 30 min.
- Desidratar o pâncreas stepwise em metanol (33, 66%, 100%), 15 min / passo. Isto minimiza a formação de bolhas durante o branqueamento (ver passo 5) e impede a destruição das células durante a congelação-descongelação (ver passo 7).
- Incubar o tecido em MeOH recentemente preparada: H 2 O 2: DMSO branqueamento tampão numa proporção de 02:01:03, à RT durante 24 h, para extinguir a fluorescência tecido endógeno. Para maiores amostras de troca, a nova bleachitampão ng e incubar durante uma outra hora 24.
- Lavar com MeOH em excesso, ON.
- Congelamento-descongelamento durante pelo menos 5 ciclos de -80 ° C - temperatura ambiente para facilitar a penetração dos anticorpos.
- Reidratar stepwise volta para TBST (33, 66%, 100%), 15 min / passo.
- Bloco em TBST com soro a 10% (de preferência com a mesma espécie na qual o anticorpo secundário foi gerado), DMSO a 5% e 0,01% Naaz durante 12-24 horas à temperatura ambiente
- Incubar com anticorpo primário em tampão de bloqueio durante 48 h, à RT, estender a 72 horas para as amostras maiores (anticorpos usados aqui são listados na tabela de reagentes).
- Lavar em TBST excesso, ON.
- Incubar com anticorpos secundários conjugados com fluorescência durante 48 h, à RT, estender a 72 horas para as amostras maiores.
- Lavar em TBST excesso, ON.
1,2
O procedimento a seguir descreve como montar a amostra em agarose e anexá-lo ao suporte de amostras feitos (ver Figura 7) Antes de optar digitalização.
- Separa-se os lóbulos do baço, gástrica e duodenal, de acordo com a Figura 3A em Hörnblad et al 3. A relação entre os lóbulos é clarificado em Hörnblad et al 11.
- Prepare a 1,5% (w / v) de agarose de temperatura de fusão baixo em dH 2 O, filtro, deixar arrefecer até 37 ° C e lavar o tecido em dH 2 O, para lavar o detergente e remover as bolhas antes agarose-incorporação em gelo.
- Cortar um bloco de agarose encerrando a sua amostra e deixar um espaçador de 1 cm ~ entre a amostra e a base da agarose. Aparar arestas vivas (≤ 90 °) do bloco de agarose para reduzir a dispersão da luz.
- Desidratar a amostra por passos em MeOH (33, 66%, 100%), dando tempo para equilibrar entre cada passo. Quando a amostra se afunda é considerado para ser equilibrada.
- Limpar a amostra em uma solução 1:2 de álcool benzílico: Benzyl Benzoato de metila (BABB) até que se torne transparente. Troca BABB solução e incubar durante uma hora adicional 12.
- Posicionar a amostra limpa no suporte de amostras e fixá-lo através da inserção de 2 agulhas através do espaçador de agarose através dos orifícios perfurados na flange do suporte.
- Coloque a amostra no scanner e mergulhe-o em uma tina cheia de BABB solução de compensação. Quando se comparam uma série de pâncreas a mesma ampliação deve ser usada para todas as análises. A ampliação deve ser optimizado para o maior amostra na série.
1,3 Posicionamento da amostra no AR
O protocolo seguinte descreve o procedimento para posicionar com precisão uma amostra usando o algoritmo de COM-AR. Este procedimento só é aplicável quando o ROI inclui toda a amostra. Para descrições detalhadas dos algoritmos, consulte Cheddad et al 2.
- Aquisição de imagens da amostra em duas posições para both a anatomia e canais de sinalização. Posição 1 a 0 ° C (associado com o eixo X), apresentando a maior área de projecção, e a posição 2 a 90 ° (associadas com o eixo Z). Estamos usando o canal GFP para visualizar a anatomia.
- Aplicar o algoritmo de Maximização da Expectação (EM) nas imagens de limiar anatomia do ROI.
- Calcular os pontos de COM (coordenadas x) das imagens binárias obtidas no passo 2 para ambos os 0 ° e 90 ° projecções.
- Sobrepor uma linha vertical que passa pelo ponto COM identificado calculado no passo 3 no ° 0 e 90 ° imagens do canal de sinal.
- Utilizar as imagens obtidas no passo 4, como referências para mover a amostra de forma que a linha de centro do campo de visão passa pelos pontos COM encontrados da amostra.
1,4 Digitalização
- Ajuste o tempo de exposição para atingir o maior relação sinal-ruído possível sem saturaçãoting todas as áreas das imagens de projeção. Repita o procedimento para todos os canais a serem verificados.
- Selecione o conjunto de filtro para o primeiro canal de fluorescência a ser digitalizada. Emissão de fluoróforos mais curtos λ pode excitar fluoróforos com mais λ e, assim, causar foto branqueamento. Para minimizar esta possibilidade, a varredura do fluoróforo com λ maior excitação primeiro.
- Abrir o obturador para iluminar a amostra e recolher o sinal de fluorescência ao longo de 360 °, rotação da amostra ao longo do eixo vertical de cada canal. O ângulo de passo utilizado para a configuração de NIR-OPT é de 0,9 ° C e durante o digitalizador Bioptonics 3001 0,45 °.
- Selecione o filtro apropriado para o canal seguinte e proceda como acima.
2. Processamento Computacional e Reconstrução
2,1 detecção desalinhamento pós-aquisição e correção (Um valor-tuning)
Na tomografia de projecção, é, em geral, necessárioatribuir um valor pós-alinhamento com as projeções para afinar a imagens posição ao longo do eixo de rotação antes da reconstrução. No entanto, um pequeno desvio no ângulo da câmara na direcção do eixo óptico pode causar não-uniforme de valores ao longo do comprimento da amostra e, assim, induzir distorções geométricas. Para evitar estas distorções, um método computacional para determinar o exato valor e unificada pós-alinhamento (um valor) durante toda a amostra pode ser aplicada 2.
- Use uma transformada discreta de Fourier para dividir uma projecção do sinal específico a 0 ° e 180 ° em blocos de 8 pixels de altura e calcular o deslocamento ao longo do eixo x (o valor-A) entre cada bloco.
- Aplicar um mínimo de regressão linear quadrados para ajudar a calcular o ângulo θ ", que descreve a inclinação do eixo x-deslocamento ao longo do comprimento da amostra, e para encontrar um ponto central de rotação.
- Corrigir distorções durante a varredura, rodando tudo projeCÇÕES θ '/ 2 em torno do ponto central de rotação.
2,2 Contraste equalização de histograma limitado adaptativo (CLAHE)
Para facilitar a detecção e a segmentação de objectos (ilhéus) que exibem sinais muito fracos, os quais se encontram em risco de ser "limiarizadas para fora" durante a reconstrução e / ou a segmentação para avaliações quantitativas, de um algoritmo de CLAHE pode ser aplicado a imagens de projecção. A operação é realizada com CLAHE duas transformações intensidade principais:
- O contraste local é estimada e empatou dentro não sobrepostos blocos na imagem de projeção.
- As intensidades são normalizados nas regiões fronteiriças entre blocos através da interpolação bilinear.
O nome de contraste limitada refere-se ao limite de grampo, o qual é configurado para evitar saturação pixels na imagem. Neste protocolo, o MATLAB função interna "adapthisteq" foi usado e aplicado com o padrão c limite de lábio de 0,01 e um tamanho de telha 256. Note, o tamanho da telha óptima deve ser testada empiricamente e pode variar de acordo com a amostra analisada. Mais detalhes sobre o algoritmo e os exemplos podem ser encontrados em Hörnblad et al 3.
Nota: As etapas de processamento acima listados computacionais (incluindo-COM AR, ajustando um valor e CLAHE, consulte 1,3-2,2) são construídas sobre algoritmos padrão e são executadas no MATLAB (Mathworks).
2,3 reconstrução tomográfica e iso-superfície renderização
- Usando um algoritmo de filtrado de volta projeção, as imagens corrigidas e normalizados pode agora ser reconstruído com compensação de desalinhamento unificada e exigência mínima para a otimização de faixa dinâmica. Neste protocolo, todas as reconstruções são realizadas usando o método de projeção filtrada de volta disponível no software NRecon (SkyScan), versão 1.6.8 (= "_blank"> Http://www.skyscan.be/products/downloads.htm). Nota, a ampliação de um objecto com imagens depende da sua distância a partir do ponto focal da lente, a menos que a geometria de feixe paralelo é implementado na configuração de imagem. Portanto, quando a importação de um conjunto de dados de projeção para o software NRecon é importante incluir o objeto correto a distância da fonte (mm) e direção de rotação do scanner (para anti-horário de entrada "cc" e para a entrada no sentido horário "cw") no acompanhamento arquivo de log, para evitar artefatos de feixe cônico induzidas durante a reconstrução.
- Para visualizar e quantificar a pilha de seções virtuais obtidos, gerar 3D iso-superfícies utilizando software de processamento de imagem, como adequado ou Imaris Volocity.
Isolamento de ilhotas murina e procedimentos de transplante foram realizados em Processamento de Diabetes Research Institute celular pré-clínica e Core Modelo Translational sob protocolos analisados e aprovados pela Universidade de Miami Animal Care Institucional e Comitê de uso. O comitê de ética para pesquisas com animais, norte da Suécia, aprovou todos os outros experimentos envolvendo animais.
Resultados
No relatório atual nós descrevemos um protocolo para a extração e processamento computacional de dados BCM em pâncreas de roedores (e outros tecidos) usando NIR-OPT (Figura 1). Como ilustrado na Figura 2, a partir de tecido autofluorescense espécime pancreática é a esperada redução acentuada no espectro NIR. Isto leva a um aumento significativo no sinal de média ao ruído (S: N) razão para a avaliação dos ilhéus de Langerhans de insulina rotuladas. Pelas adaptações de OPT de imagiologia, na parte do espectro NIR, tal como aqui descrito, pelo menos, três canais específicos podem ser visualizados com suficiente S: relação N para permitir a avaliação de tipos de anticorpos rotulados de células ao longo do volume do pâncreas murino com distinto canal de separação (ver a Figura 3 e 4). Aplicado a imagiologia de processos diabetogênicos e / ou avaliações de BCM, em geral, a técnica permite, assim, para a visualização e quantificação deáreas-insulina em relação à envolvente e / ou interagindo tipos de células (ver Figura 4). Estas considerações são, graças ao aumento da profundidade de penetração do tecido obtido na gama NIR possível realizar em amostras muito maiores do que anteriormente, incluindo o pâncreas de rato, que é 3-5 vezes maior do que o seu homólogo de rato (ver Figura 5). Independentemente do facto de comprimentos de onda visíveis ou NIR são utilizadas, a implementação de CLAHE pode facilitar significativamente OPT avaliações baseadas de BCM durante as diferentes condições genéticas e fisiológicas ao aumentar a sensibilidade de detecção da técnica (ver Figura 6). Um modelo para o suporte de amostras desenvolvido é mostrado na Figura 7.
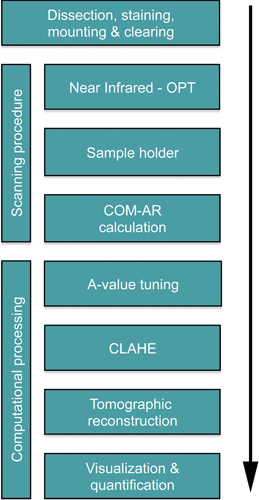
Figura 1. Fluxograma que descreve os passos críticos para OPT análises baseadas de BCM na murpâncreas ine. O tempo requerido para avaliar um pâncreas de rato normal é 13-14 dias. A maioria das vezes é consumida durante o processamento de tecidos e imunohistoquímica (10 dias), a limpeza de tecidos requer aproximadamente 2 dias enquanto que a duração do varrimento é dependente do tempo de exposição necessário (normalmente cerca de 1 hora). O processamento subsequente tipicamente computacional é realizada dentro de um dia. Note, o protocolo de coloração relativamente longo é idealmente adequada para o processamento em lotes de grandes quantidades de amostras.
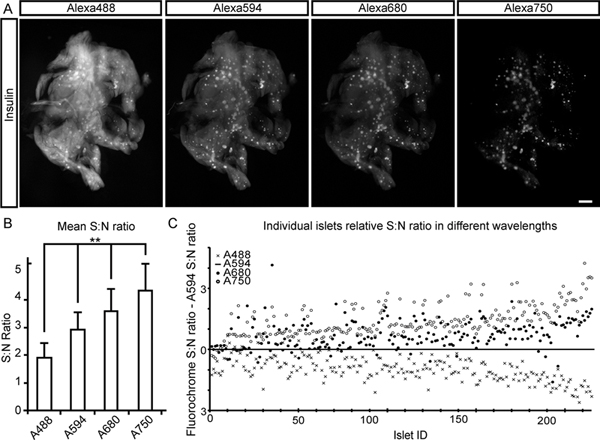
Figura 2. Sinal para relações de ruído para as avaliações de BCM em comprimentos de onda diferentes. Um rato do lobo duodenal do pâncreas, corado para a insulina e com um cocktail de fluorocromo-conjugados de anticorpos secundários (Alexa 488, 594, 680 e750), foi utilizada para determinar S: N proporções em comprimentos de onda diferentes. A Imagens, mostrar o quadro primeira projeção para cada canal de sinal. Gráfico B, que ilustra a média S: N, para cada canal de sinal. As proporções foram determinadas como a intensidade média da ilhota (com base em 215 ilhéus) dividida pela intensidade do fundo (a fluorescência tecido endógeno a partir do tecido exócrino). C, Gráfico mostrando S: proporções de N para os ilhéus individuais em cada um dos canais normalizados para o S: N obtidos para o canal 594 Alexa. Uma maneira ANOVA foi utilizado para análises estatísticas. Os níveis de significância indicados correspondem a ** p <0,01. Barra de escala em (A) corresponde a 1 mm. Clique aqui para ver maior figura .
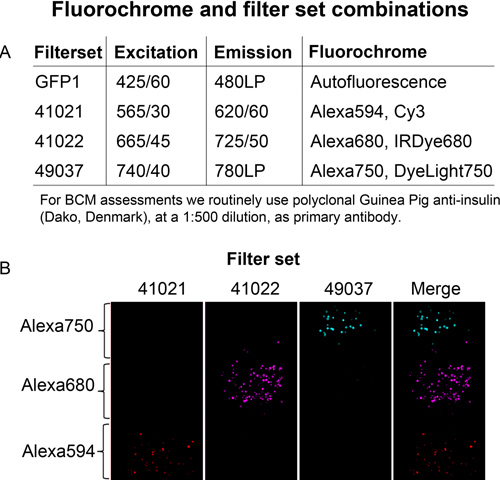
Figura3. Separação de canais. A, anticorpos secundários conjugados com corantes Alexafluor listados na tabela foram imobilizados separadamente em proteinG-sepharose grânulos. B, As contas fluorescentes foram então embebidas em diferentes níveis de um fantasma de agarose e visualizados utilizando filtros indicados.
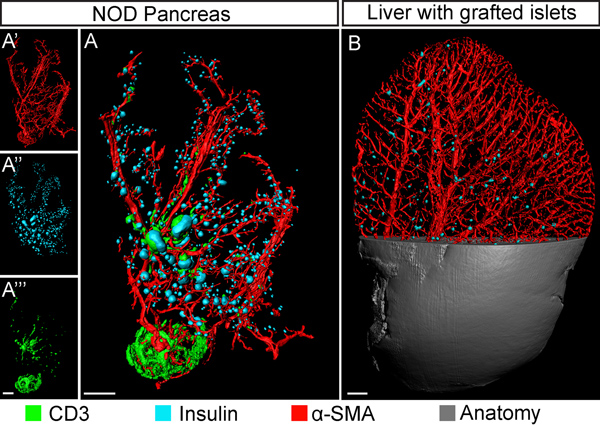
Figura 4. OPT imaging multicanal baseada na pesquisa da diabetes. A, OPT base iso-superfície de reconstrução de um pâncreas (12 semanas, lobo duodenal) do diabético não obeso (NOD) modelo de diabetes do tipo 1. O espécime é corado para a insulina (células islet β, pseudo cor azul); músculo liso α-actina (vasos sanguíneos, vermelho) e CD3 (linfócitos T infiltrantes, verde). Os anticorpos secundários utilizados foram correspondentes; Cy3, IRDye-680-750 e DyeLight respectivamente. Oinserções (A'-A'' ') mostram os canais de sinal individuais. B, OPT imagem (golpe de vista) de um lobo de fígado de rato (lateral lobus sinistros) enxertado com ilhotas singênicos e fotografada com duas semanas NIR-OPT após a transplantação. As ilhotas de insulina estão expressando pseuodocolored em azul e do músculo liso α-actina vasos positivos estão em vermelho. A abordagem permite avaliações da distribuição do enxerto ilhota dentro da rede vascular. Barras de escala correspondem a 1 mm.
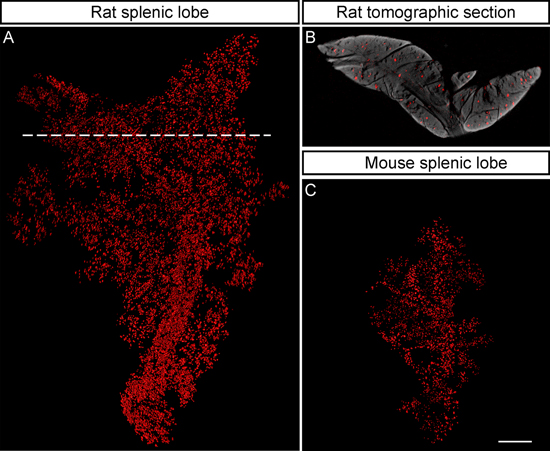
Figura 5. NIR-OPT facilita a criação de imagens de espécimes de maiores dimensões. A, render Iso-superfície da distribuição BCM em pâncreas de rato a partir do modelo Zucker Fatty para a diabetes do tipo 2 (lóbulo esplénica em 9 meses), exemplificando a possibilidade de espécime imagem no rato escala de pâncreas por NIR-OPT. Conforme determinadopor esta técnica é apresentada no lobo ~ 6 vezes maior (v / v) do que o seu homólogo de rato e abriga 10.139 expressando insulina das ilhotas de Langerhans, cuja célula-β volume faz-se 1,32% do volume total lobular. B, secção Tomographic correspondente à linha a tracejado em (A) ilustra que ilhotas de todas as profundidades do tecido são detectados. C, Iso-superfície de processamento da distribuição BCM em pâncreas de rato (lobo esplénica em 8 semanas) exibido como uma referência de tamanho. O lóbulo exibida abriga 2.490 ilhotas de insulina que expressam cujas células β volume faz-se 0,89% do volume total lobular. O pâncreas estão manchadas com o GP anti-insulina seguido de Alexa594 conjugado de cabra anti-GP (mouse) e Donkey IRDye 680 conjugado anti-GP (rato) anticorpos respectivamente. Os espécimes em (AC) são representadas à escala e a barra de escala em (C) corresponde a 2 mm.
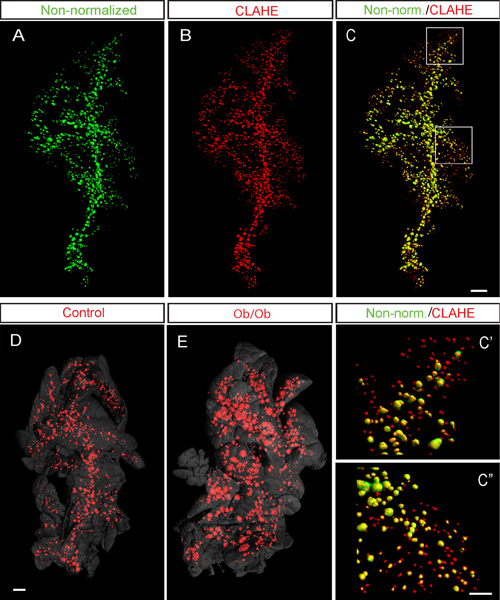
Figura 6. CLAHE facilita a detecção de ilhotas do pâncreas murino por imagem OPT. AC, representante iso-superfície imagens OPT prestados de uma pâncreas do rato C57Bl / 6 (lobo esplênica em 8 semanas) marcada para a insulina. Iso-superfície reconstruções de imagens de OPT foram realizadas antes (A, verde pseudo colorida) e após o protocolo CLAHE foi aplicado (B, pseudo cor vermelha). C, sobreposição dos dados não normalizadas, em (A) e os dados processados CLAHE em (B). C'-C ", sobreposição de ampliação elevada representativas dos não normalizados (A) e CLAHE processada (B) as imagens. Tal como mostrado pela presença de" vermelho "somente ilhotas, o script CLAHE facilita a detecção de sinal pequena e baixa ilhotas intensidade. No exemplo actual, o espécime descrito (após CLAHE processamento), continham 2.419 ilhotas com um volume de 1,74 mm 3 (Números com base nos dados correspondentes de projecção não transformados era 1.057 ilhotas with um volume de 1,77 mm 3). D e E, a partir de dados de exemplo de controlo (D) e o modelo de ratinho ob / ob para o diabetes tipo 2 12 (E), 6 meses de execução do protocolo CLAHE. Notar o aumento massivo no tamanho geral dos ilhéus pancreáticos ob / ob (E). Em (D) e (E) do esboço pâncreas (cinza) está baseado no sinal de autofluorescência de tecidos. Barra de escala em C é 500 mm em CA. Barra de escala em C "corresponde 200 um em C 'e C'' bar. Escala em E corresponde a 1 mm em (D) e (E). Imagens em (AC) são adaptados de Hörnblad et al 3 e foram gerados utilizando o Bioptonics scanner de 3001.

Figura 7. Porta-amostras para a fixação das amostras OPT. O espécime é assegurado pela inserção de agulhas através do espaçador de agarose através dos orifícios pré-perfurados na flange. O suporte encontra-se articulado para o motor passo a passo através de umíman forte localizada na sua base. Esta configuração omite o uso de colas instáveis e evita movimentos indesejados da amostra durante a análise.
Discussão
As técnicas descritas para a imagiologia OPT permite a extracção de parâmetros espaço-quantitativa em todo o volume do pâncreas murino. Devido às limitações na resolução alcançável para este tipo de mesoscópica imagiologia deve notar-se que, tal como para a maioria das modalidades de imagiologia, maior a amostra menor a resolução da (Embora a utilização de uma resolução mais alta CCD deve aumentar a resolução da digitalização OPT) . Assim, para a avaliação dos lóbulos intactos pancreáticas de rato, a técnica actualmente não fornece resolução única célula embora próximo (aproximadamente 15-20 mm) 7. Ainda assim, para a extracção de distribuição BCM no pâncreas de rato os protocolos proporcionam dados que corresponde bem mais do que as obtidas pelo ponto de contagem, por exemplo 3,13 a morfometria Deve notar-se que, embora a execução do protocolo CLAHE permite a detecção de um número significativamente maior ilhotas , estes ilhéus são geralmente menores e não contrite substancialmente para os totais de células β volumes.
Os protocolos de imuno-histoquímica envolvidos são relativamente longos (até duas semanas), mas as mãos reais no tempo de preparação da amostra é pequeno e, portanto, a técnica é bem adequado para o estudo de grandes grupos de animais 9. Se o potencial de padrões de distribuição heterogêneas é um foco para a investigação, deve sublinhar-se que os cuidados devem ser tomados nas etapas sobre fixação e montagem para evitar que o tecido pancreático torna-se fixado de maneira desfavorável e um apartamento ("se espalhar" ) montagem do tecido deve ser buscado para facilitar tais avaliações.
Uma questão importante no desempenho é que OPT COM a amostra é fixada no eixo de rotação e que não se move, na vertical ou na horizontal, durante o processo de digitalização. Portanto, é essencial ter uma configuração estável mecânico e um sistema que funcione bem para attaching a amostra. Resolvemos este problema através da construção de uma nova montagem (Figura 7).
Geometria paralela não era verdade para o nosso NIR-OPT ou scanner Bioptonics 3001, que foi detectado como um deslocamento vertical entre a parte traseira e as posições da frente de objetos periféricos nas imagens gravadas de projeção. Ao ajustar o objeto a distância da fonte no arquivo de log do scanner respectivo (ver 2.3.1) que pode melhorar significativamente a qualidade de nossos dados e corrigir distorções geométricas nas bordas longe das imagens de projeção, que é de particular importância quando avaliar os espécimes maiores.
No protocolo atual, nós fornecemos uma sugestão de conjuntos de filtros que permitem a visualização de três diferentes canais específicos e uma "anatomia" do canal nas avaliações de preparações pancreáticas intactos. Obviamente essas configurações pode ser modulada para melhor atender os fluorocromos utilizados para um determinado estudo, embora, como acontece com todas as formas de fluorescênciamicroscopia cento, o risco potencial de sinal de sangramento através deve ser cuidadosamente avaliada. O estudo das ilhotas de insulina marcados com fluorocromos que são excitados acima de 750 nm não foi ainda possível por nós usando a lâmpada de halogeneto de metal de que se utiliza o conjunto. É possível que a câmara com ainda maior eficiência quântica nos comprimentos de onda relevantes, em combinação com fontes de luz alternativas (por exemplo, lasers de diodo) pode aumentar o potencial de NIR-OPT adicional e permitir a imagiologia em comprimentos de onda mais elevados.
OPT de imagem é uma técnica altamente versátil para avaliações espaciais e quantitativos da amostra biomédica na escala de milímetros cm. Embora os protocolos aqui apresentados foram desenvolvidos com a finalidade principal do pâncreas / diabetes de pesquisa que deverá ser possível traduzir a pesquisa sobre as outras espécies, tipos de amostras e os marcadores. Pelo potencial de visualizar vários canais distintos em preparações pancreáticas intactas, NIR-OPT imagem fUTRAS tem potencial como uma ferramenta para avaliar a especificidade de absorção de agentes de contraste destinados a avaliação não-invasiva de outras modalidades de imagem, desde que estes agentes de contraste podem ser concebidas para transportar também um fluoróforo detectável por OPT.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Lindström Dr. P. é reconhecida por fornecer ob / ob. J. Lehtonen é reconhecido para a assistência com produção de vídeo e Gilbert J. ajuda com edição. Este estudo foi financiado por doações do Instituto de Pesquisa de Diabetes Foundation (AP), o Juvenile Diabetes Research Foundation (AP e UA), a Comissão Europeia (FP-7, Grant acordo não:. IP CP-228933-2) (JS e UA), as Fundações Kempe, Umeå University e do Conselho Sueco de Pesquisa para UA
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / Material | Companhia | Número de catálogo | Comentários |
| Metanol | Scharlau | ME03162500 | |
| 30% de H 2 O 2 | Scharlau | HI01362500 | |
| Álcool benzílico | Scharlau | AL01611000 | |
| Benzoato de benzilo | Scharlau | BE01851000 | |
| Agarose de baixo meltingpoint | LONZA | 50100 | |
| Paraformaldeído (PFA) | Sigma-Aldrich | 158127 | |
| DMSO | Sigma-Aldrich | D5879 | |
| Triton X100 | Sigma-Aldrich | T8787 | |
| Rato anti-Asma-Cy3 | Sigma-Aldrich | C6198 | O anticorpo primário |
| Coelho anti-CD3 | Sigma-Aldrich | C7930 | O anticorpo primário |
| Cobaia anti-Ins | DAKO | A0564 | O anticorpo primário |
| Donkey anti GP-IRDye680 | LI-COR Biosciences | 926-32421 | Anticorpo secundário |
| De cabra anti-Rb DyeLight750 | Thermo Scientific | 35570 | Anticorpo secundário |
| Cabra anti GP-Alexa594 | Molecular Probes | A-11076 | Anticorpo secundário |
| Anti-cabra GP Alexa488 | Molecular Probes | A-11008 | Anticorpo secundário |
| Anti cabraGP-Alexa594 | Molecular Probes | A-11012 | Anticorpo secundário |
| Cabra anti GP-Alexa680 | Molecular Probes | A-21076 | Anticorpo secundário |
| Cabra anti GP-Alexa750 | Molecular Probes | A-21039 | Anticorpo secundário |
| OPT SkyScan 3001 | Bioptonics | OPT-Scanner | |
| Leica MZ FLIII | Leica Microsystems | Estereomicroscópio | |
| Leica Objetivo 0.5x | Leica Microsystems | 10446157 | |
| Leica Camera adaptador 1.0x | Leica Microsystems | 10445930 | |
| EL6000 HQI | 11504115 | Lightsource | |
| Guia Liquid Light | 11504116 | ||
| Cuveta | Hellma Analytics | 6030-OG | 55 x 55 x 52,5 mm |
| Espelho | Edmund Optics | F68-334 | 50 x 50 mm |
| Andor Ikon-M | Andor Tecnologia | DU934N-BV | Retro-iluminado CCD |
| Filterset | Tecnologia Chroma | 41.021-MZFLIII | TXR, Alexa-594, Cy3 |
| Filterset | Tecnologia Chroma | 41.022-MZFLIII | IRDye680, Alexa-680 |
| Filterset | Tecnologia Chroma | 49.037-MZFLIII | Dylight750, Alexa-750 |
| ProteinG Sepharose-esferas | GE Healthcare | 17-0618-01 | Protein G Sepharose 4 Fast Flow |
| Azida de sódio | Sigma-Aldrich | 08591 | Azida de sódio a 0,1 M solução |
Referências
- Sharpe, J., et al. Optical projection tomography as a tool for 3D microscopy and gene expression studies. Science. 296, 541-545 (2002).
- Cheddad, A., Svensson, C., Sharpe, J., Georgsson, F., Ahlgren, U. Image Processing Assisted Algorithms for Optical Projection Tomography. IEEE Trans. Med. Imaging. , (2012).
- Hornblad, A., Cheddad, A., Ahlgren, U. An improved protocol for optical projection tomography imaging reveals lobular heterogeneities in pancreatic islet and beta-cell mass distribution. Islets. 3, 204-208 (2011).
- Holmberg, D., Ahlgren, U. Imaging the pancreas: from ex vivo to non-invasive technology. Diabetologia. 51, 2148-2154 (2008).
- Ahlgren, U., Gotthardt, M. Approaches for imaging islets: recent advances and future prospects. Adv. Exp. Med. Biol. 654, 39-57 (2010).
- Sharpe, J. Optical projection tomography. Annu. Rev. Biomed. Eng. 6, 209-228 (2004).
- Alanentalo, T., et al. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Methods. 4, 31-33 (2007).
- Alanentalo, T., et al. High-resolution three-dimensional imaging of islet-infiltrate interactions based on optical projection tomography assessments of the intact adult mouse pancreas. J. Biomed. Opt. 13, 054070(2008).
- Alanentalo, T., et al. Quantification and Three-Dimensional Imaging of the Insulitis-Induced Destruction of beta-Cells in Murine Type 1 Diabetes. Diabetes. 59, 1756-1764 (2010).
- Sun, G., et al. Ablation of AMP-activated protein kinase alpha1 and alpha2 from mouse pancreatic beta cells and RIP2.Cre neurons suppresses insulin release in vivo. Diabetologia. 53, 924-936 (2010).
- Hornblad, A., Eriksson, A. U., Sock, E., Hill, R. E., Ahlgren, U. Impaired spleen formation perturbs morphogenesis of the gastric lobe of the pancreas. PLoS One. 6, e21753(2011).
- Lindström, P. The physiology of the Obese-Hyperglycemic Mice (ob/ob Mice). The Scientific World JOURNAL. 7, 665-685 (2007).
- Bock, T., Pakkenberg, B., Buschard, K. Genetic background determines the size and structure of the endocrine pancreas. Diabetes. 54, 133-137 (2005).
Erratum
Formal Correction: Erratum: Near Infrared Optical Projection Tomography for Assessments of β-cell Mass Distribution in Diabetes Research
Posted by JoVE Editors on 11/05/2018. Citeable Link.
A correction was made to Near Infrared Optical Projection Tomography for Assessments of β-cell Mass Distribution in Diabetes Research. In Protocol section 1.1, the order of the listed chemicals MeOH:H2O2:DMSO has accidentally been switched and should instead be MeOH:DMSO:H2O2.
Protocol section 1.1 was changed from:
Incubate the tissue in freshly prepared MeOH:H2O2:DMSO bleaching buffer in a 2:1:3 ratio at RT for 24 hr to quench endogenous tissue fluorescence. For larger samples, exchange to new bleaching buffer and incubate for another 24 hr.
to:
Incubate the tissue in freshly prepared MeOH:DMSO:H2O2 bleaching buffer in a 2:1:3 ratio at RT for 24 hr to quench endogenous tissue fluorescence. For larger samples, exchange to new bleaching buffer and incubate for another 24 hr.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados